小鼠ECM的制备方法及得到的不同来源的小鼠ECM和小鼠卵巢体内再生的方法与流程
本发明涉及组织工程及医学再生领域,尤其是小鼠ECM的制备方法及得到不同来源的小鼠ECM和小鼠卵巢体内再生的方法。
背景技术:
卵巢疾病是目前困扰女性的一大难题,但目前的治疗都会对卵巢造成一定的损伤。2008年,心脏移植的成功再生开启了ECM支架的研究热潮。研究表明生物支架在物种间具有良好的保守性,并能很好的被异种宿主接受,在一定程度上降低了免疫排斥反应。此外,天然的三维支架也能够影响细胞的有丝分裂、细胞的分化,同时也含有利于细胞募集、增殖和分化的生长因子,促进组织结构的修复和重建。
技术实现要素:
本发明所要解决的技术问题是,提供一种小鼠ECM的制备方法及得到不同来源的小鼠ECM和小鼠卵巢体内再生的方法。
为了解决上述技术问题,本发明采用的技术方案是:一种小鼠ECM的制备方法,包括以下步骤:
(1)取出小鼠的不同组织,将其置于不同浓度的洗涤剂中,处理不同的时间,然后使用灭菌水和PBS清洗洗涤剂,保证ECM中不含有洗涤剂;
(2)对制备的ECM进行组织学分析和生化分析,优选出最好的小鼠ECM。
所述步骤(1)中洗涤剂为SDS和Triton中的一种或两种组合。
优选,所述组织为小鼠卵巢组织。
所述步骤(2)包括对ECM的组织切片进行H&E和DAPI染色,并对ECM的弹性蛋白、胶原和sGAG三种成分含量的测定以及残留DNA量对比分析。
上述的小鼠ECM的制备方法制得不同来源的小鼠ECM。
一种小鼠卵巢体内再生的方法,将获得的小鼠ECM,移植回小鼠卵巢原位,不同时间点取出ECM,观察其再生情况,并且对再生卵巢从再生效率、组织学分析、免疫组织化学分析、基因表达情况和生殖能力检测五方面进行分析鉴定。
所述小鼠ECM移植回小鼠卵巢原位的方法:腹腔注射麻醉受体小鼠,用手术剪刀在背中线中部开口,用镊子在背侧将肌肉层扎破并伸入到体腔内,夹出与卵巢相连的脂肪组织,撕破卵巢包膜,夹取出卵巢,将制备好的ECM重新放回到卵巢包膜中,将其放回到体内,缝合伤口,做好标记。
所述再生效率=回收再生卵巢数量/移植小鼠卵巢数量×100%,计算再生效率;所述的组织学分析使用常规H&E染色的方法。
所述免疫组织化学分析包括使用脱蜡、脱水、微波加热抗原修复、血清封闭、一抗孵育、二抗孵育、AP显色、复染、脱水、透明、封片、镜检。
所述基因表达情况采用PCR和qPCR两种实验方法验证不同基因的表达情况;所述生殖能力检测包括雌雄小鼠比例为2:1合笼,检查阴栓,观察其生仔情况。
本发明的有益效果是:首次成功的再生出小鼠卵巢,并且在移植四周后配对能够成功的产生后代,进一步为解决女性因卵巢功能停止造成的不孕症提供了新的方法,为人类生殖做出新的贡献。同时,脱细胞处理后的组织也在再生医学的领域中具有更广阔的应用前景。本发明的方法简便,成本低廉,实验条件要求低,可操作性强。
附图说明
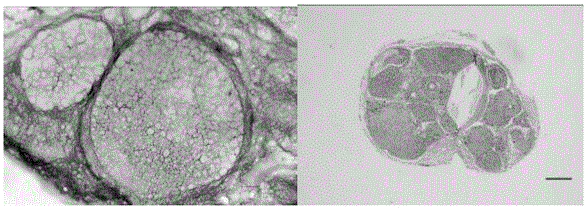
图1为本发明处理后的ECM与再生的卵巢形态学和组织学对比照片。
图2为不同基因的免疫组织化学表达情况照片。
图3为不同基因在移植后不同时间的表达情况图。
具体实施方式
以下是对本发明的实施例作详细说明:本实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方式和具体的操作过程,但本发明的保护范围不限于下述的实施例。
本发明是通过以下的技术方案实现的,
本发明提供小鼠ECM的制备方法,包括如下步骤:
步骤一:收集小鼠卵巢或其他组织器官,分别采用不同的洗涤剂,用不同的浓度处理不同的时间,制备小鼠ECM。
步骤二:使用无菌水和1xPBS清洗残留的洗涤剂,两种清洗液各洗八次,每两小时换一次液,最后在PBS中加入双抗,4℃备用。
步骤三:对制备的ECM进行组织学分析和生化分析确定最佳处理条件。
所述洗涤剂为SDS和Triton中的一种或两种组合。
所述不同的浓度洗涤剂和不同的处理时间是根据不同的组织来确定最佳的处理条件,例如卵巢组织的ECM使用的洗涤剂为(质量体积百分比,克每毫升)1%、0.5%、0.2%的SDS,处理时间分别为6h、12h、20h。
所述的ECM的组织学分析是固定不同浓度、不同时间处理的ECM,制作石蜡组织切片,分别用H&E和DAPI染色方法对组织切片进行染色,根据染色结果初步鉴定ECM内的细胞是否去除干净。
所述的ECM的生化分析包括测量ECM的弹性蛋白、胶原和sGAG三种成分在ECM中的含量以及残留DNA的量。
所述的SDS是购买于Sigma公司。
将上述步骤二得到的小鼠ECM采用背部开口移植卵巢的方法,把支架移植到小鼠体内,一个月后观察小鼠卵巢再生情况。
所述的背部开口移植卵巢的方法,包括如下步骤:腹腔注射麻醉剂,麻醉小鼠5分钟后,使用消毒后的手术剪刀在小鼠背部开口,扎破肌肉层,夹出与卵巢相连的脂肪组织。在卵巢包膜撕破一个小口,把卵巢剥离出来并取出来。最后挑取处理好的ECM,将其重新塞回到卵巢生长的原部位,将所有组织重新夹回到体腔内侧,缝合伤口、做好标记,观察其术后情况。
所述的麻醉剂是购买于Alfar的2.2.2-Tribromoethanol和Sigma的Tert-amylalcohol,储液具体配置方法为在5g包装的2.2.2-Tribromoethanol瓶中加入5ml Tert-amylalcohol,振摇至全部溶解。工作液为在35ml的生理盐水中加入0.625ml储液,充分混匀后用0.22um滤器过滤,贴好标签避光储存于4℃。
所述的实验所需的小鼠均来自北京维通利华有限公司。
所述的观察小鼠卵巢的再生情况包括,在移植手术5天、10天、15天、20天、25天、30天这六个时间点取出小鼠移植后的ECM,并且进一步用组织学、免疫组织化学、PCR等方法对再生卵巢组织进行了验证。
所述的再生效率分析采用的分析公式为:再生效率=回收再生卵巢数量/移植小鼠卵巢数量×100%。
所述的组织学分析取上述六个时间点移植后的小鼠再生的卵巢组织,固定之后制作石蜡组织切片,同样采用H&E染色方法,与正常的卵巢组织切片对比,观察不同时间点的卵巢组织形态学再生、发育情况。
所述的免疫组织化学分析是利用不同时间点制作好的石蜡组织切片,经过脱蜡复水、抗原热修复、血清封闭、一抗孵育、二抗孵育、AP显色、核固红复染、脱水透明、封片然后镜检,观察不同抗体的表达情况。
所述的不同抗体的表达情况,抗体为blimp-1、stella、inhibinα、dazl、vasa、scp3、zp3、gdf9。上述抗体都购买于santa公司。
所述的检测基因的表达情况是采用PCR技术检测回收的再生卵巢在不同时间点是否有blimp-1、stella、inhibinα、dazl、scp3、zp3、gdf9、oct4、ddx4等基因的表达,同时还采用qPCR技术检测上述基因的相对表达情况。
所述的产生后代的情况是成功产子两代,共16只F1代小鼠。
本发明通过制作小鼠ECM以及小鼠卵巢原位移植技术,成功回收到不同时间点的小鼠再生卵巢,并且配对后成功产生后代,证明移植后的小鼠ECM可以再生出卵巢。
具体实施例如下:
实施例一
1.小鼠卵巢支架的制备与分析
步骤一,小鼠卵巢支架的制备
将4周龄雌性小鼠颈椎处死后,在体式解剖镜下用75%的乙醇擦拭小鼠腹部,然后剪开腹部,沿双角子宫及输卵管找到卵巢。轻轻将卵巢包膜撕开,用镊子从脂肪与卵巢连接的根部轻轻取下卵巢,放置于无菌的PBS中清洗一下,然后在50ml无菌的离心管中预先配置好(质量体积百分比,克每毫升)1%、0.5%、0.2%的SDS,将取到的卵巢放于离心管中。在摇床中回旋转动清洗小鼠卵巢,清洗时间分别为6h、12h、20h。SDS清洗完毕后,在超净工作台内把离心管中的SDS倒掉,倒入无菌水,清洗残留在卵巢支架内的SDS。每隔两个小时换一次无菌水,总共换无菌水8次。为了使支架移植到体内后与体内的渗透压保持一致,接着使用无菌PBS以同样的方法也换8次液,结束时加入2000U/ml的双抗,4℃备用。
步骤二,小鼠卵巢支架的蜡块制备
将制备好的小鼠卵巢支架放置于10%的中性甲醛中固定24小时后,先用水冲洗组织12h,放到50%的酒精中过夜,然后使用自动脱水透明浸蜡机器,脱水、透明和浸蜡。其中脱水过程为75%乙醇1h——85%乙醇1h——95%乙醇40min——95%乙醇40min——100%乙醇40min——100%乙醇40min。透明过程为二甲苯Ⅰ(乙醇:二甲苯为1:1)40min——二甲苯Ⅱ40min——二甲苯Ⅲ40min。浸蜡过程为:石蜡Ⅰ(石蜡:二甲苯为1:1)1h——石蜡Ⅱ1h——石蜡Ⅲ1h。然后使用包埋机将支架包埋成蜡块。
步骤三,小鼠卵巢支架的切片分析
(1)将制作好的支架蜡块,使用石蜡切片机切成5mm的组织切片,52℃烘箱拷片过夜。进行H&E染色,具体操作步骤为:二甲苯Ⅰ5min——二甲苯Ⅱ5min——无水乙醇2min——无水乙醇2min——95%乙醇2min——85%乙醇2min——75%乙醇2min——苏木素染色液5min——蒸馏水水洗10min——伊红染色液1min30s——无水乙醇1min——二甲苯Ⅰ3min——二甲苯Ⅱ3min——封片——镜检。根据镜检结果判断是否有细胞残留在卵巢支架中。
(2)DAPI染色:二甲苯Ⅰ5min——二甲苯Ⅱ5min,无水乙醇2min——95%乙醇2min——85%乙醇2min——75%乙醇2min——PBS中浸泡3min——滴加DAPI染液100ul——暗室作用15min吸去多余染色液——PBS洗2次,每次5min——封片——镜检。
(3)弹性蛋白染色:二甲苯Ⅰ5min——二甲苯Ⅱ5min——无水乙醇2min——95%乙醇2min——85%乙醇2min——75%乙醇2min——70%乙醇2min——蒸馏水水洗3min——地衣红室温染色3h——70%酒精分化2min——85%、95%酒精各复水2min——二甲苯透明3min——封片——镜检。
(4)胶原染色:二甲苯Ⅰ5min——二甲苯Ⅱ5min——无水乙醇2min——无水乙醇2min——95%乙醇2min——95%乙醇2min——水流冲洗2min——Weigert氏苏木素染色10min——水流冲洗10min——Van Gieson染色液染色1min——弃染液,用95%酒精快速分化数秒钟——无水乙醇1min——二甲苯Ⅰ3min——二甲苯Ⅱ3min——封片——镜检。
(5)sGAG染色:二甲苯Ⅰ5min——二甲苯Ⅱ5min——无水乙醇2min——无水乙醇2min——95%乙醇2min——95%乙醇2min——水流冲洗1min——1%阿尔新蓝染液染10~30分钟——水流冲洗约10min至颜色分明为止——1%中性红水溶液染细胞核1分钟——水洗2min——95%乙醇1min——无水乙醇1min——二甲苯Ⅰ3min——二甲苯Ⅱ3min——封片——镜检。
(6)DNA含量测定:差量法称量组织,设PCR管重量设为A、PCR管重量+组织重量设为B、组织重量设为C,则C=B-A,两者之差即组织的重量。按照差量法称重分别称重大约10mg左右的组织,组织称重后将组织切碎,每管中加入1ml提前预冷的0.85%生理盐水,用匀浆仪将组织打碎成细胞悬液。简短离心后即可按照Tiangen DNA提取试剂盒的基本流程提取DNA,260nm下测定吸光值,按照计算公式:DNA的干重含量(ng/mg)=OD260x50x(10/0.52)x体积/组织重量,即每毫克组织中含有的DNA含量。接着使用3%LMP含有EB的凝胶对DNA进行电泳分析,紫外光下鉴定DNA片段的长度。
(7)sGAG的测定:同样采取差量法称取卵巢组织,称取约20mg的组织样品,每管中加入1ml配制好的木瓜蛋白酶于65℃水浴3h,10000g离心10min。试样—取出10ul上清液于一新离心管中,去离子水加至100ul;空白试剂加入100ul去离子水;标准曲线加入试管中分别加入1、2、3、4、5ug的标准试剂。以上每管加入1ml Blyscan染料试剂,倒置混匀,摇床震荡30min,12000rpm离心10min,倒出未结合的染料,加入250ul解离试剂,充分涡旋混合。12000rpm离心5min去除浮沫。吸取200ul试样于96孔板中,656nm下测定OD值。
(8)弹性蛋白测定:差量法定量称重10-20mg组织样品并标记好离心管,每管中加入750ul0.25M草酸置于95℃—100℃的水浴锅中1h,将离心管冷却至室温,10000rpm离心10min,收集部分上清液,向离心管剩余的组织中继续加入750ul 0.25M草酸再次加热1h,收集两次的上清液。检测试样加入500ulα-弹性蛋;空白试剂加入100ul去离子水;标准试剂加入12.5,25,50ul标准样品。以上每管中加入等同体积的弹性蛋白沉淀试剂,涡旋混合后静置15min,11000g离心10min后倒去上清液,加入1ml Sircol染料置于摇床中90min,11000g离心10min,倒出未结合染料后加入250ul解离试剂,涡旋混合。吸取200ul检测试样于96孔板中,513nm下测定OD值。
(9)胶原测定:按照以上的方法称取组织重量在10mg左右,每管中加入1.3ml冷酸-胃蛋白酶(0.5M乙酸中0.1mg/ml胃蛋白酶),4℃过夜。吸取1.0ml样品加入100ul酸中和溶液,每管中加入冷分离和浓缩试剂(200ul/管)。倒置混匀,离心管放入试管架置于半冰半水的容器中,0-4℃下过夜。轻轻的移出试管,避免剧烈摇晃。12000rpm,10min离心从每管中缓慢吸出1000ul上清液弃去。检测试样加入100ul溶液;空白对照加入100ul/去离子水/0.5M乙酸//提取液;标准胶原加入5,10,15ug标准胶原。用空白试剂栏中的溶液加至100u,以上每管中加入1.0ml sircol染料,倒置混匀,将离心管置于摇床中30min,12000rpm 10min,小心翻转并倒去未结合的染料溶液,小心将750ul冰-冷酸-盐冲洗试剂加到球形的胶原-染料表面,12000rpm 10min离心,倒出冲洗试剂,用棉签移出试管边缘中剩余的液体,分别加入250ul碱试剂。离心管盖上盖,5min后漩涡混合,每管中吸取200ul样品溶液加入96孔板中的每孔中,555nm测定吸光值。
根据上述实验结果分析得出0.2%SDS处理12h的DNA浓度为15.6731ug/ml,脱细胞程度为93.94%,不含有完整DNA片段,损失了2/3的sGAG,弹性蛋白还保持比较好的水平,胶原保留值为10%,综上所述此处理条件对支架损失最小,为最佳的处理条件。
2.小鼠卵巢支架原位移植与再生分析
步骤一小鼠卵巢原位取出
按腹腔注射0.015ml/g麻醉剂处理受体小鼠。用75%酒精棉球擦洗小鼠背部,使用消毒后的手术剪刀在在背中线中部开口,然后使用手术镊子在背侧肾脏偏下的位置将肌肉层扎破,将镊子伸入到体腔内,夹出与卵巢相连的脂肪组织、卵巢、输卵管和部分子宫角。在卵巢包膜的一侧轻轻的撕破一个小口,把卵巢剥离出来。接着用镊子夹取卵巢与脂肪连接的根部,将卵巢从其生长部位取出。
步骤二小鼠卵巢支架原位移植
挑取处理好的卵巢支架,找到卵巢包膜的破口处,使用碘酒浸泡的脱脂棉帮助去除卵巢的伤口处先止血,然后将处理的支架组织重新塞回到卵巢生长的原部位,接着把夹取出来的组织重新夹回到体腔内侧,缝合伤口、打完耳标后,将手术后的老鼠放回到鼠笼里,观察其术后情况。
步骤三小鼠卵巢再生分析
(1)再生效率的分析
小鼠卵巢原位移植支架一个月后回收再生的卵巢,记录回收的数量并计算再生效率。
(2)再生组织学的分析
小鼠卵巢原位移植后,在移植后5天、10天、15天、20天、25天、30天这六个时间点分别回收再生的卵巢组织,利用上面所述的蜡块制作方法,制作不同的蜡块。使用石蜡切片机,制作5mm的石蜡切片。在高于石蜡熔点两度的烘箱里,过夜烘片。第二天取出切片,
经过二甲苯Ⅰ10min——二甲苯Ⅱ10min——二甲苯Ⅲ10min——无水乙醇5min——无水乙醇5min——95%乙醇5min——95%乙醇5min——苏木素染色液5min——蒸馏水水洗2min——伊红染色液20s——95%乙醇5min——无水乙醇5min——二甲苯Ⅰ5min——二甲苯Ⅱ5min——二甲苯Ⅲ5min——封片——镜检。检查在移植不同时间后,再生卵巢的形态学变化。
(3)再生免疫组织化学分析
根据上述所制作的石蜡切片,30度过夜烘片,然后52度烘片两小时,进行免疫组织化学实验。主要检测blimp-1、stella、inhibinα、dazl、scp3、zp3、gdf9、vasa八个基因的蛋白表达情况。具体操作如下:二甲苯Ⅰ10min——二甲苯Ⅱ10min——二甲苯Ⅲ10min——无水乙醇5min——无水乙醇5min——95%乙醇5min——95%乙醇5min——流水冲洗2min——1×PBS冲洗5min——0.01M的柠檬酸缓冲液抗原修复(使用微波炉修复,大火修复6min,中火修复四次,每次90s,最后凉至室温)——10%的血清封闭两小时——一抗孵育4度过夜——1×PBS清洗3次,每次5min——37度二抗孵育2小时——1×PBS清洗3次,每次5min——AP显色2-5min——1×PBS清洗2次,每次5min——核固红复染1min-2min——流水冲洗3遍——95%乙醇5min——无水乙醇5min——二甲苯Ⅲ5min——二甲苯Ⅱ5min——二甲苯Ⅰ5min——封片——镜检。
(4)基因表达情况分析
取出不同时间回收的再生卵巢,单个再生卵巢提取RNA,反转录为cDNA。分别进行PCR和qPCR,检测blimp-1、stella、inhibinα、dazl、scp3、zp3、gdf9、oct4、ddx4各个基因在再生卵巢中的表达。
其中采用Trizol法提取RNA,先取到新鲜的或者冻于液氮中的再生卵巢组织,切碎组织,至于200ul—500ul的Trizol中,置于室温下消化组织5—10min之后再加入五分之一体积的氯仿,14000rpm离心5min,取上清,然后加入2.5倍体积无水乙醇-20℃沉淀2小时。取出后14000rpm离心10min,然后用75%乙醇清洗一遍,无酶水混匀后-20℃保存待用。下一步进行反转录,使用Takara RR047A反转录试剂盒,根据试剂盒说明书反转录得到cDNA。
PCR扩增上述9个基因。PCR引物(见SEQ ID NO.1-SEQ ID NO.20)与反应体系见表1.1、表1.2。PCR反应条件:预变性95℃,5min;变性95℃,30s,复性52℃,30s,延伸72℃,30s,30个循环;最后延伸72℃,7min。
实时定量qPCR是选择相对定量的方法。RT-qPCR反应条件:预变性95℃,5min;变性95℃,10s,复性55℃,20s,延伸72℃,30s,40个循环。
表1.1目标基因和管家基因的引物序列、PCR产物长度和退火温度
表1.2RT-PCR反应体系
表1.3RT-qPCR反应体系
(5)生殖能力的检测
原位移植一个月后的雌性小鼠与正常的雄性小鼠以2:1的比例合笼,最后成功繁育出两代小鼠,共16只F1代小鼠。
综上结果表明经过处理的天然的卵巢支架移植到卵巢原位,可以重新发育成正常的可以产生后代的卵巢。
实施例二
1.小鼠胸腺支架的制备与分析
步骤一,小鼠胸腺支架的制备
将4周龄雌性小鼠颈椎处死后,在体式解剖镜下用75%的乙醇擦拭小鼠胸部,然后剪开胸部及胸腔,找到呈乳白色的两叶胸腺。用镊子从胸腺根部轻轻取下胸腺,放置于无菌的PBS中清洗一下,然后在50ml无菌的离心管中预先配置好(体积百分比)1%、0.5%、0.2%的TritonX-100,将取到的胸腺放于离心管中。在摇床中回旋转动清洗小鼠胸腺,清洗时间分别为10h、15h、20h。清洗完毕后,在超净工作台内把离心管的中TritonX-100倒掉,倒入无菌水,清洗残留在胸腺支架内的TritonX-100。每隔一个小时换一次无菌水,总共换无菌水8次。为了使支架移植到体内后与体内的渗透压保持一致,接着使用无菌PBS以同样的方法也换8次液,结束时加入2000U/ml的双抗,4℃备用。
步骤二,小鼠胸腺支架的蜡块制备
同上述小鼠卵巢支架蜡块制备一致
步骤三,小鼠胸腺支架的切片分析
同上述小鼠卵巢支架切片的分析方法也一样,包括H&E染色、DAPI染色、sGAG染色、弹性蛋白染色、胶原染色。
步骤四,小鼠胸腺支架的生化成分测定及分析
同上述小鼠卵巢支架测定与分析方法一致,包括DNA含量及片段长度分析、sGAG、弹性蛋白和胶原的含量测定。
2.小鼠卵巢支架原位移植与再生分析
同上述小鼠卵巢支架原位移植方法移植。
再生分析只包含了形态学与组织学的分析,所用的方法都与小鼠卵巢支架形态学与组织学的分析方法一致。
实施例三
1.小鼠睾丸支架的制备与分析
步骤一,小鼠睾丸支架的制备
将4周龄雌性小鼠颈椎处死后,在体式解剖镜下用75%的乙醇擦拭小鼠腹部,然后剪开腹部,找到小鼠睾丸。用镊子从睾丸基部轻轻取下睾丸,放置于无菌的PBS中清洗一下,然后在50ml无菌的离心管中预先配置好(体积百分比)1%、0.5%的SDS,将取到的睾丸放于离心管中。在摇床中回旋转动清洗小鼠睾丸,清洗时间分别为20h、24h、30h。清洗完毕后,在超净工作台内把离心管的中SDS倒掉,倒入无菌水,清洗残留在睾丸支架内的SDS。每隔;两个小时换一次无菌水,总共换无菌水8次。为了使支架移植到体内后与体内的渗透压保持一致,接着使用无菌PBS以同样的方法也换8次液,结束时加入2000U/ml的双抗,4℃备用。
步骤二,小鼠睾丸支架的蜡块制备
同上述小鼠卵巢支架蜡块制备一致
步骤三,小鼠睾丸支架的切片分析
同上述小鼠卵巢支架切片的分析方法也一样,包括H&E染色、DAPI染色、sGAG染色、弹性蛋白染色、胶原染色。
步骤四,小鼠睾丸支架的生化成分测定及分析
同上述小鼠卵巢支架测定与分析方法一致,包括DNA含量及片段长度分析、sGAG、弹性蛋白和胶原的含量测定。
2.小鼠睾丸支架原位移植与再生分析
同上述小鼠卵巢支架原位移植方法移植。
再生分析只包含了形态学与组织学的分析,所用的方法都与小鼠卵巢支架形态学与组织学的分析方法一致。此外还包括了生殖能力的检测,合笼后能够得到后代。
综上结果表明经过处理的天然的卵巢、胸腺、睾丸支架移植到卵巢原位,可以重新发育成正常的可以产生后代的卵巢。
以上显示和描述了本发明的基本原理、主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护范围由所附的权利要求书及其等同物界定。
以上显示和描述了本发明的基本原理、主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护范围由所附的权利要求书及其等同物界定。
SEQUENCE LISTING
<110> 戴雁峰
<120> 小鼠ECM的制备方法及得到的不同来源的小鼠ECM和小鼠卵巢体内再生的方法
<130>
<160> 20
<170> PatentIn version 3.5
<210> 1
<211> 21
<212> DNA
<213> 小鼠(Mus musculus)
<400> 1
ggctgtattc ccctccatcg t 21
<210> 2
<211> 23
<212> DNA
<213> 小鼠(Mus musculus)
<400> 2
tggtgccaga tcttctccat gtc 23
<210> 3
<211> 20
<212> DNA
<213> 小鼠(Mus musculus)
<400> 3
cgtggtacaa cccaaagcta 20
<210> 4
<211> 18
<212> DNA
<213> 小鼠(Mus musculus)
<400> 4
ttggcacaga cattgcac 18
<210> 5
<211> 20
<212> DNA
<213> 小鼠(Mus musculus)
<400> 5
ctttcaaagc cagtaaccag 20
<210> 6
<211> 20
<212> DNA
<213> 小鼠(Mus musculus)
<400> 6
actgctgcaa cacattcata 20
<210> 7
<211> 22
<212> DNA
<213> 小鼠(Mus musculus)
<400> 7
atgatacaga cgtcctacaa cc 22
<210> 8
<211> 19
<212> DNA
<213> 小鼠(Mus musculus)
<400> 8
tctttcagca ccgacaaca 19
<210> 9
<211> 22
<212> DNA
<213> 小鼠(Mus musculus)
<400> 9
cttatgtatt ccggccatcc ca 22
<210> 10
<211> 20
<212> DNA
<213> 小鼠(Mus musculus)
<400> 10
ccccagatga tagcaccaga 20
<210> 11
<211> 21
<212> DNA
<213> 小鼠(Mus musculus)
<400> 11
ccgagctgtg caattcccag a 21
<210> 12
<211> 21
<212> DNA
<213> 小鼠(Mus musculus)
<400> 12
aaccctctga gccaagggtg a 21
<210> 13
<211> 20
<212> DNA
<213> 小鼠(Mus musculus)
<400> 13
agctgctgaa gcagaagagg 20
<210> 14
<211> 20
<212> DNA
<213> 小鼠(Mus musculus)
<400> 14
ggttctcatt gttgtcggct 20
<210> 15
<211> 20
<212> DNA
<213> 小鼠(Mus musculus)
<400> 15
ggaaaccagc agcaagtgat 20
<210> 16
<211> 19
<212> DNA
<213> 小鼠(Mus musculus)
<400> 16
tggagtcctc atcctctgg 19
<210> 17
<211> 21
<212> DNA
<213> 小鼠(Mus musculus)
<400> 17
ttatcatgtg cagccacgtc c 21
<210> 18
<211> 21
<212> DNA
<213> 小鼠(Mus musculus)
<400> 18
tgatgacctg aactggtgaa c 21
<210> 19
<211> 19
<212> DNA
<213> 小鼠(Mus musculus)
<400> 19
agcaccgtac tcattcacc 19
<210> 20
<211> 20
<212> DNA
<213> 小鼠(Mus musculus)
<400> 20
catgctaaac actccgtcct 20
- 还没有人留言评论。精彩留言会获得点赞!