一种药物球囊的制作方法
本实用新型涉及药物球囊技术领域,具体涉及一种药物球囊。
背景技术:
自1977年Gruntzig首次临床应用经皮冠状动脉腔内成形术(percutaneous transluminal coronary angioplasty,PTCA)以来,血管内再狭窄一直是PTCA治疗争论的主要焦点。早期在球囊扩张时期,血管内再狭窄与动脉壁的弹性回缩和过度重构密切相关。后来,支架的引进在减少了靶血管的弹性回缩和不良血管重构方面具有很大优势,但是支架的植入能刺激血管平滑肌细胞的迁移、增殖和新生内膜增生,同样引起支架内再狭窄的发生。药物洗脱支架(drug-eluting stent,DES)是项新技术突破,通过抑制新生内膜增生,而降低血管再狭窄的发生率。但是,与DES相关的支架内血栓以及一些复杂血管病变的再狭窄引起人们的关注,并且DES植入后需要长时间的双重抗血小板治疗。如何能既抑制血管内再狭窄又防止晚期血栓形成成为研究的热点。因此,药物洗脱球囊(drug-eluting balloon,DEB)在不依赖支架的基础上局部释放药物可能成为新的治疗策略,将成为PCI的新选择。
德国贝朗医疗率先将paccocath药物洗脱球囊技术商业化,商品名为sequent please的紫杉醇释放冠脉球囊导管,以紫杉醇为活性药物,碘普罗胺造影剂优维显为载体;美敦力公司以紫杉醇为活性药物,尿素为载体推出IN.Pact药物洗脱球囊导管;美国巴德公司以紫杉醇为活性药物,聚山梨醇酯为载体推出moxy药物洗脱球囊导管,这些已经上市的药物洗脱球囊导管说明该技术在临床上已经取得毋庸置疑的效果。国内研究机构对药物洗脱球囊技术也进行了很多研究,这些研究基本围绕着不同的载体技术,药物涂层工艺和球囊表面预处理展开技术展开。
申请号为CN201080007189.7的专利涉及一种具有水合溶剂化晶体形式的紫杉醇的药物涂层球囊导管,水合晶体形式的紫杉醇包含2~4范围内整数或小数的结晶水,所述溶剂化水合晶体形式紫杉醇通过在含水溶剂中溶解紫杉醇,并将该溶剂完全或部分润湿球囊获得。
申请号为CN201310732989.0的专利涉及一种载体为有机酸盐和多元醇的药物涂层球囊导管,有机酸盐和多元醇共同发挥作用,防止在球囊导管被置入到靶位点前药物过早释放,促进药物从球囊表面快速释放并被靶组织吸收。
申请号为CN201410426234.2的专利涉及一种药物洗脱球囊导管的载药方法,包括以下步骤:①先将球囊进行溶胀处理,溶胀处理的时间为0.5h-3h;②采用真空喷涂技术将由治疗性药物、添加剂和溶剂组成的混合液喷涂在溶胀后的球囊表面,自然风干10-30分钟。
申请号为CN201410066921.8的专利涉及一种新型双层药物球囊,包括内层球囊、外层微孔药物释放膜、导管体、显影环及连接件等球囊充盈时,外层微孔药物释放膜在内层球囊的压力下,微孔扩张,药物贮囊内的药物通过扩张的微孔快速而精确的释放。
药物球囊的特点是药物的输送和快速释放。药物球囊通过球囊成形术进入血管病变部位,药物需要经过血流冲刷和血管壁摩擦,尤其是药物球囊打开的瞬间,药物涂层松动,更容易随着血液循环损失,药物球囊中有80%以上的药物都损失在手术过程中。除了药物在手术过程中的损失,球囊在短期的扩张(60秒左右)中药物并不能完全释放,手术结束后仍然会有约5%~10%的药物留在球囊表面。据文献报道,药物球囊的药物利用率仅仅有10~15%左右。
由上可知,现有技术中药物球囊的药物利用率非常低。
技术实现要素:
为解决现有技术中的药物球囊在穿越过程中药物损失率高,并且药物球囊在到达病变组织时药物并不能完全释放,使得药物球囊的药物的利用率非常低的缺陷,本实用新型提供一种药物球囊,能够最大化避免药物在穿越过程中的损失,并最大化将药物输送到病变组织使药物被吸收,达到治疗目的。
为实现上述目的,本实用新型采用的技术方案为:
一种药物球囊,包括球囊本体和保护膜;其中,
所述保护膜上开有一条或多条密闭缝隙;
所述保护膜缠绕于所述球囊本体外,且所述保护膜两端分别固接于所述球囊本体两端。
本实用新型的药物球囊是在球囊本体表面缠绕一层带有密闭缝隙的保护膜,能够最大化避免药物在穿越过程中的损失,并最大化将药物输送到病变组织使药物被吸收。
优选的,所述保护膜两端分别通过激光焊接或胶水粘结于所述球囊本体两端。
优选的,所述保护膜的材料为高分子膜材料。
优选的,所述高分子膜材料为聚四氟乙烯膜,乳胶薄膜,硅胶薄膜,聚氨酯膜或聚亚安酯膜。
优选的,所述保护膜的厚度为0.01-0.1毫米。
本实用新型的有益效果为:本实用新型的药物球囊是在球囊本体表面缠绕一层带有密闭缝隙的保护膜,保护药物不被血流冲刷;在球囊本体充盈时,保护膜的密闭缝隙打开,使药物暴露在血管壁上,使药物大量转移到血管组织,使药物的利用率大大提升,进一步达到治疗目的。
附图说明
图1-1为本实用新型第一实施例的药物球囊(球囊本体折叠卷绕后缠绕上保护膜)的结构示意图;
图1-2本实用新型第一实施例的药物球囊(球囊本体扩张后)的结构示意图;
图2-1为本实用新型第二实施例的药物球囊(球囊本体折叠卷绕后缠绕上保护膜)的结构示意图;
图2-2本实用新型第二实施例的药物球囊(球囊本体扩张后)的结构示意图;
图3-1为本实用新型第三实施例的药物球囊(球囊本体折叠卷绕后缠绕上保护膜)的结构示意图;
图3-2本实用新型第三实施例的药物球囊(球囊本体扩张后)的结构示意图;
图4-1为本实用新型第四实施例的药物球囊(球囊本体折叠卷绕后缠绕上保护膜)的结构示意图;
图4-2本实用新型第四实施例的药物球囊(球囊本体扩张后)的结构示意图;
图5-1为本实用新型第五实施例的药物球囊(球囊本体折叠卷绕后缠绕上保护膜)的结构示意图;
图5-2本实用新型第五实施例的药物球囊(球囊本体扩张后)的结构示意图;
图6为本实用新型的体外模拟实验中的体外模型的结构示意图。
图中,
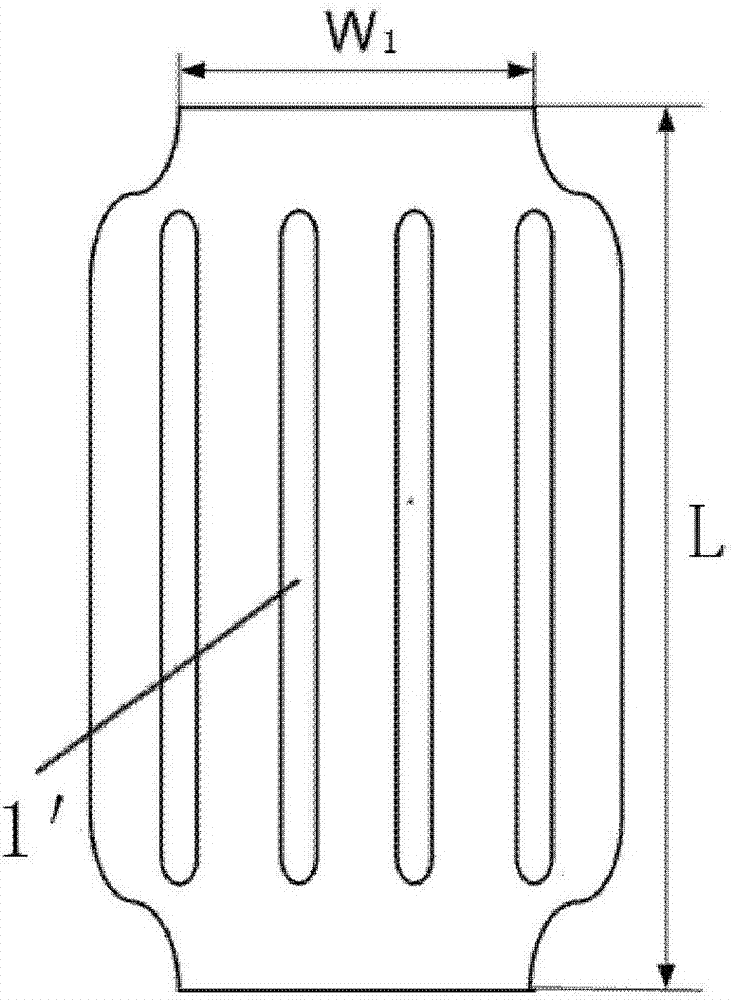
1-密闭缝隙;1'-打开后的缝隙。
具体实施方式
下面结合附图对本实用新型的结构进行详细解释说明。
如图1-1至图5-2所示,本实用新型第一实施例至第五实施例提供的药物球囊,包括球囊本体和保护膜;其中,所述保护膜上开有一条或多条密闭缝隙1;所述保护膜缠绕于所述球囊本体外,且所述保护膜两端分别通过激光焊接或胶水粘结于所述球囊本体两端。所述密闭缝隙1的形状可以根据实际需求设定。所述保护膜由一种具有良好生物相容性的超弹高分子膜材料制成,所述超弹高分子材料可以为聚四氟乙烯膜,乳胶薄膜,硅胶薄膜,聚氨酯膜或聚亚安酯膜等。
本实用新型第一实施例至第五实施例提供的药物球囊,所述保护膜的厚度为0.01~0.1毫米,所述保护膜上开有不同形状的切割口,在所述保护膜没有受力时,所述切割口紧密排列形成密闭缝隙1。所述球囊本体折叠卷绕完之后,将所述保护膜缠绕于所述球囊本体外表面,所述保护膜的宽度刚好可缠绕所述球囊本体一周,所述保护膜通过激光焊接或胶水粘结在所述球囊本体两端固定。当本实用新型的药物球囊进入血管后,所述保护膜可以保护药物不被血流冲刷而损失,当所述球囊本体扩张时,所述保护膜受力膨胀,密闭缝隙1部分打开(打开后的缝隙1'的形状如图1-2、2-2、3-2、4-2及5-2所示),药物裸露出来释放到血管。这样,大部分药物将被转移到血管组织,药物的利用率大大提升。
本实用新型实施例提供的药物球囊,不同直径的球囊本体在扩张时,所述保护膜材料的拉伸率和空隙面积也会不同。假设所述保护膜材料在拉伸变形时面积不发生变化,那么保护膜在扩张前的表面积S0可以表示为:
S0=πW0L,
其中π为圆周率,W0为保护膜扩张前直径,L为球囊本体长度。保护膜在扩张后的表面积S1可以表示为:
S1=πW1L,
其中W1为保护套扩张后直径,可以近似等于球囊本体直径;L为球囊本体长度。
那么球囊本体在扩张后裸露的表面积为:
ΔS=S1-S0=πL(W1-W0)。
裸露表面积占球囊本体扩张后总面积比例为:
R=ΔS/S1=πL(W1-W0)/(πL W1)=1-W0/W1
W0保护膜扩张前直径大约1毫米,对于直径为4毫米的球囊导管,其药物暴露面积为75%。直径越大,暴露面积占球囊本体总面积比例越高。实际上,保护膜在受到拉伸时面积会变小,暴露比例会更高。
在体外通过模拟使用验证本实用新型的药物球囊的药物的利用率得到了大大地提升。样品制作过程如下(需要说明:下述药物球囊指代现有技术中的药物球囊,等同于本实用新型的球囊本体):
取药物涂层PTCA球囊导管10根,药物球囊直径4mm,药物球囊长度30mm,载药量3μg/mm2,将药物球囊折叠卷绕成三翼。10跟药物球囊分成两组,一组对照品(5跟),一组缠绕保护膜的样品(5根)。取长度50mm,宽度4mm,厚度为0.03mm的乳胶薄膜5张,每张薄膜中间均开有4条长度为30mm的切割口。将药物球囊的两端涂一些医用胶水,将薄膜卷绕药物球囊一圈,两端粘结到药物球囊两端。
体外模拟使用测试方法如下:
如图6所示,使用由导引导管以及曲折通路(冠脉血管模型)组成的体外模型,模拟球囊导管输送的情况。图6中,a为模型框架,有机玻璃材质,尺寸为英寸;b为导引导管;c为聚乙烯导管(即冠脉血管模型)。右上方箭头表示球囊导管进入方向。下方箭头表示药物球囊穿出体外模型的位置。
导引导管的自由端连接一个止血阀。整个体外冠脉血管模型浸没在37℃水浴中,导引导丝从右上方箭头方向插入止血阀,进入导引导管b,并一直插入到冠脉血管模型c的末段。
在测试之前,使用37℃温热的蒸馏水冲洗整个体外模型。再从包装中取出球囊导管,使用压力泵排气。随后,取出保护管套和保护衬丝,将导引导丝的近端插入到球囊导管远端的导丝腔中。打开止血阀,手动推动球囊导管通过导引导管和冠脉血管模型前进,直到药物球囊(包括5跟对照品和5根缠绕保护膜的药物球囊样品)完全离开血管模型。现在,剪下药物球囊,将其存放在一个5ml的小瓶中密封。拉回剩余的导管,抛弃。在接下来的准备中,再次使用37℃温热的蒸馏水冲洗整个体外。对每个检测中的球囊导管均重复此步骤。
将剪下的药物球囊使用乙醇萃取,使用高效液相色谱法进行定量测试。穿越损失计算公式:
穿越损失%=100*(药物球囊原始载药量-药物球囊穿越后载药量)/药物球囊原始载药量%。
表1:药物球囊穿越实验对比结果
以上仅为本实用新型的较佳实施例而已,并不用以限制本实用新型,凡在本实用新型实质内容上所作的任何修改、等同替换和简单改进等,均应包含在本实用新型的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!