中子捕获治疗系统的制作方法
本实用新型涉及一种放射性射线辐照治疗系统,尤其涉及一种中子捕获治疗系统。
背景技术:
随着原子科学的发展,例如钴六十、直线加速器、电子射束等放射线治疗已成为癌症治疗的主要手段之一。然而传统光子或电子治疗受到放射线本身物理条件的限制,在杀死肿瘤细胞的同时,也会对射束途径上大量的正常组织造成伤害;另外由于肿瘤细胞对放射线敏感程度的不同,传统放射治疗对于较具抗辐射性的恶性肿瘤(如:多行性胶质母细胞瘤(glioblastoma multiforme)、黑色素细胞瘤(melanoma))的治疗成效往往不佳。
为了减少肿瘤周边正常组织的辐射伤害,化学治疗(chemotherapy)中的标靶治疗概念便被应用于放射线治疗中;而针对高抗辐射性的肿瘤细胞,目前也积极发展具有高相对生物效应(relative biological effectiveness,RBE)的辐射源,如质子治疗、重粒子治疗、中子捕获治疗等。其中,中子捕获治疗便是结合上述两种概念,如硼中子捕获治疗,借由含硼药物在肿瘤细胞的特异性集聚,配合精准的中子射束调控,提供比传统放射线更好的癌症治疗选择。
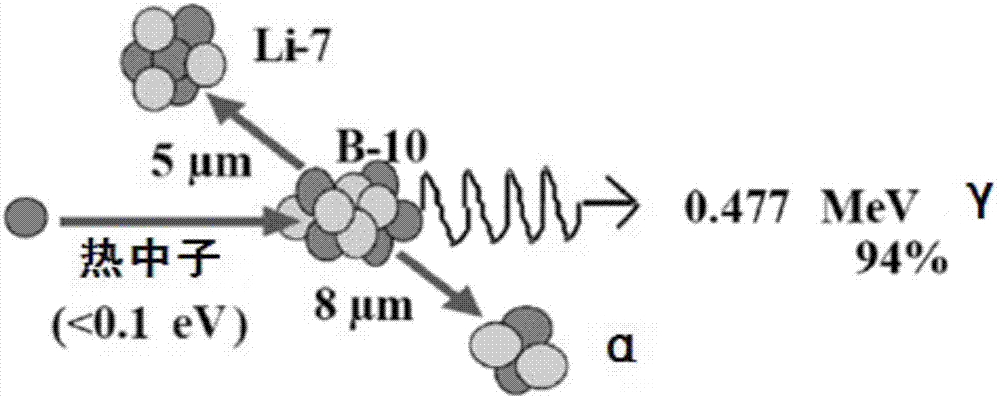
硼中子捕获治疗(Boron Neutron Capture Therapy,BNCT)是利用含硼(10B)药物对热中子具有高捕获截面的特性,借由10B(n,α)7Li中子捕获及核分裂反应产生4He和7Li两个重荷电粒子。参照图1,其示出了硼中子捕获反应的示意图,两荷电粒子的平均能量约为2.33MeV,具有高线性转移(Linear Energy Transfer,LET)、短射程特征,α粒子的线性能量转移与射程分别为150keV/μm、8μm,而7Li重荷粒子则为175keV/μm、5μm,两粒子的总射程约相当于一个细胞大小,因此对于生物体造成的辐射伤害能局限在细胞层级,当含硼药物选择性地聚集在肿瘤细胞中,搭配适当的中子射源,便能在不对正常组织造成太大伤害的前提下,达到局部杀死肿瘤细胞的目的。
因硼中子捕获治疗的成效取决于肿瘤细胞位置含硼药物浓度和热中子数量,故又被称为二元放射线癌症治疗(binary cancer therapy);由此可知,除了含硼药物的开发,中子射源品质在硼中子捕获治疗的研究中占有重要角色。
技术实现要素:
为了在中子捕获治疗过程中获得多种能量范围的中子射束以满足在实际治疗过程中需要的中子射束能谱,本实用新型的一个方面提供一种中子捕获治疗系统,包括用于产生带电粒子束的加速器、经带电粒子束照射后产生中子射束的中子产生部、射束整形体以及准直器,所述射束整形体包括缓速体及包覆于缓速体外周的反射体,所述中子产生部经带电离子束照射后产生中子,所述缓速体将自中子产生部产生的中子减速至预设能谱,所述反射体将偏离的中子导回以提高预设能谱内的中子强度,所述准直器将中子产生部产生的中子进行集中照射,在中子捕获治疗过程中,所述中子捕获治疗系统通过改变带电粒子束的能量使照射至中子产生部而产生的中子射束的能量发生改变。本申请主要是通过改变带电粒子束的能量间接改变中子射束的能量,进而改变中子捕获治疗系统的深度剂量分布。
进一步地,本申请中,通过能够产生不同脉冲的微波产生器对加速器中的离子源进行加速,从而使得加速器产生不同能量的带电粒子射。所述中子捕获治疗系统设有能够向加速器注入微波的微波产生器,所述加速器根据注入的不同频率的微波改变输出的带电粒子束的能量,当产生的带电粒子束的能量为第一值时,所述带电粒子与中子产生部反应产生第一中子射束能量值,当产生的带电粒子束的能量为第二值时,所述带电粒子与中子产生部反应产生第二中子射束能量值,其中所述第一值低于第二值,第一中子射束能量低于第二中子射束能量。
进一步地,所述中子捕获治疗系统产生的带电粒子束的能量通过加速器端电场强度的改变而改变。本申请中子捕获治疗系统中,所述带电粒子与中子产生部发生核反应之前的结构均应理解为加速器端。
进一步地,所述真空管或/和中子产生部外设有能够产生电场并且对真空管中传输的带电粒子束/照射至中子产生部前的带电粒子束加速或者减速的电场供应装置,所述电场供应装置是指能够在真空管外周或中子产生部的外周产生电场并且借助产生的电场使照射至中子产生部之前的带电粒子能够加速或者减速的外设装置,例如通电电极。
进一步地,所述中子捕获治疗系统还具有能够对所述带电粒子束的能量进行调节的射束能谱调节件,当所述射束能谱调节件位于真空管中并且位于所述中子产生部前方时,所述带电粒子束照射至射束能谱调节件进行能量调节后再照射至中子产生部而产生中子射束。
进一步地,所述真空管内设有容置部,所述射束能谱调节件收容于所述容置部并且连接有能够使射束能谱调节件运动的驱动机构,当所述驱动机构控制射束能谱调节件运动至中子产生部前方时,所述带电粒子照射至射束能谱调节件后进行能量调节后再照射至中子产生部;当所述驱动机构控制所述射束能谱调节件收容于容置部而不位于中子产生部前方时,所述带电粒子束直接照射于所述中子产生部。作为一种优选地,所述容置部位于所述中子产生部的下方,当所述驱动机构控制射束能谱调节件向上运动时,所述射束能谱调节件运动至中子产生部前方,所述带电粒子照射至射束能谱调节件后进行能量调节后再照射至中子产生部;当所述驱动机构控制所述射束能谱调节件向下运动时,所述射束能谱调节件收容于容置部,所述带电粒子束直接照射于所述中子产生部。
进一步地,所述射束能谱调节件具有多个,不同数量的射束能谱调节件对带电粒子束的能量调节作用不同,所述驱动机构能够驱动每个射束能谱调节件分别上下运动以对带电粒子束的能量进行调节。并且,所述中子能谱调节件可以采用能够产生中子的材料制造,比如铍、锂。
进一步地,所述每个射束能谱调节件采用不同的材料制造,不同材料的射束能谱调节件对带电粒子束的能量调节效果不同。
进一步地,所述中子产生部连接于一供电装置,通过所述供电装置对所述中子产生部通电,所述带电粒子束的射束能谱在带电粒子照射至通电的中子产生部后发生改变。
与现有技术相比,本申请中子捕获治疗系统通过对带电粒子束的能量进行调节,间接改变产生的中子射束的能量,以满足在不同治疗情况下不同对中子射束的能量的不同要求,结构简单,易于实现。
附图说明
图1是硼中子捕获反应示意图;
图2是本申请中子捕获治疗系统的示意图;
图3是设有微波产生器的中子捕获治疗系统的示意图;
图4是设有电场提供装置的中子捕获治疗系统的示意图;
图5是设有射束能谱调节件的中子捕获治疗系统的示意图;
图6是对中子产生部的镀层进行通电的示意图。
具体实施方式
中子捕获治疗作为一种有效的治疗癌症的手段近年来的应用逐渐增加,其中以硼中子捕获治疗最为常见,供应硼中子捕获治疗的中子可以由核反应堆或加速器供应。本申请的实施例以加速器硼中子捕获治疗为例,加速器硼中子捕获治疗的基本组件通常包括用于对带电粒子(如质子、氘核等)进行加速的加速器、中子产生部、热移除系统以及射束整形体,其中加速带电粒子与中子产生部作用产生中子,依据所需的中子产率与能量、可提供的加速带电粒子能量与电流大小、中子产生部的物化性等特性来挑选合适的核反应,常被讨论的核反应有7Li(p,n)7Be及9Be(p,n)9B,这两种反应皆为吸热反应。两种核反应的能量阀值分别为1.881MeV和2.055MeV,由于硼中子捕获治疗的理想中子源为keV能量等级的超热中子,理论上若使用能量仅稍高于阀值的质子轰击金属锂靶材,可产生相对低能的中子,不须太多的缓速处理便可用于临床,然而锂金属(Li)和铍金属(Be)两种材料的中子产生部与阀值能量的质子作用截面不高,为产生足够大的中子通量,通常选用较高能量的质子来引发核反应。
无论硼中子捕获治疗的中子源来自核反应堆或加速器带电粒子与靶材的核反应,产生的皆为混合辐射场,即射束包含了低能至高能的中子、光子;对于深部肿瘤的硼中子捕获治疗,除了超热中子外,其余的辐射线含量越多,造成正常组织非选择性剂量沉积的比例越大,因此这些会造成不必要剂量的辐射应尽量降低。除了空气射束品质因素,为更了解中子在人体中造成的剂量分布,本申请的实施例中使用人体头部组织假体进行剂量计算,并以假体射束品质因素来作为中子射束的设计参考,将在下文详细描述。
国际原子能机构(IAEA)针对临床硼中子捕获治疗用的中子源,给定了五项空气射束品质因素建议,此五项建议可用于比较不同中子源的优劣,并供以作为挑选中子产生途径、设计射束整形体时的参考依据。这五项建议分别如下:
超热中子射束通量Epithermal neutron flux>1x 109n/cm2s
快中子污染Fast neutron contamination<2x 10-13Gy-cm2/n
光子污染Photon contamination<2x 10-13Gy-cm2/n
热中子与超热中子通量比值thermal to epithermal neutron flux ratio<0.05
中子电流与通量比值epithermal neutron current to flux ratio>0.7
注:超热中子能区在0.5eV到40keV之间,热中子能区小于0.5eV,快中子能区大于40keV。
1、超热中子射束通量:
中子射束通量和肿瘤中含硼药物浓度共同决定了临床治疗时间。若肿瘤含硼药物浓度够高,对于中子射束通量的要求便可降低;反之,若肿瘤中含硼药物浓度低,则需高通量超热中子来给予肿瘤足够的剂量。IAEA对于超热中子射束通量的要求为每秒每平方厘米的超热中子个数大于109,此通量下的中子射束对于目前的含硼药物而言可大致控制治疗时间在一小时内,短治疗时间除了对病人定位和舒适度有优势外,也可较有效利用含硼药物在肿瘤内有限的滞留时间。
2、快中子污染:
由于快中子会造成不必要的正常组织剂量,因此视之为污染,此剂量大小和中子能量呈正相关,因此在中子射束设计上应尽量减少快中子的含量。快中子污染定义为单位超热中子通量伴随的快中子剂量,IAEA对快中子污染的建议为小于2x 10-13Gy-cm2/n。
3、光子污染(γ射线污染):
γ射线属于强穿辐射,会非选择性地造成射束路径上所有组织的剂量沉积,因此降低γ射线含量也是中子束设计的必要要求,γ射线污染定义为单位超热中子通量伴随的γ射线剂量,IAEA对γ射线污染的建议为小于2x 10-13Gy-cm2/n。
4、热中子与超热中子通量比值:
由于热中子衰减速度快、穿透能力差,进入人体后大部分能量沉积在皮肤组织,除黑色素细胞瘤等表皮肿瘤需用热中子作为硼中子捕获治疗的中子源外,针对脑瘤等深层肿瘤应降低热中子含量。IAEA对热中子与超热中子通量比值建议为小于0.05。
5、中子电流与通量比值:
中子电流与通量比值代表了射束的方向性,比值越大表示中子射束前向性佳,高前向性的中子束可减少因中子发散造成的周围正常组织剂量,另外也提高了可治疗深度及摆位姿势弹性。IAEA对中子电流与通量比值建议为大于0.7。
利用假体得到组织内的剂量分布,根据正常组织及肿瘤的剂量-深度曲线,推得假体射束品质因素。如下三个参数可用于进行不同中子射束治疗效益的比较。
1、有效治疗深度:
肿瘤剂量等于正常组织最大剂量的深度,在此深度之后的位置,肿瘤细胞得到的剂量小于正常组织最大剂量,即失去了硼中子捕获的优势。此参数代表中子射束的穿透能力,有效治疗深度越大表示可治疗的肿瘤深度越深,单位为cm。
2、有效治疗深度剂量率:
即有效治疗深度的肿瘤剂量率,亦等于正常组织的最大剂量率。因正常组织接收总剂量为影响可给予肿瘤总剂量大小的因素,因此参数影响治疗时间的长短,有效治疗深度剂量率越大表示给予肿瘤一定剂量所需的照射时间越短,单位为cGy/mA-min。
3、有效治疗剂量比:
从大脑表面到有效治疗深度,肿瘤和正常组织接收的平均剂量比值,称之为有效治疗剂量比;平均剂量的计算,可由剂量-深度曲线积分得到。有效治疗剂量比值越大,代表该中子射束的治疗效益越好。
为了使射束整形体在设计上有比较依据,除了五项IAEA建议的空气中射束品质因素和上述的三个参数,本申请实施例中也利用如下的用于评估中子射束剂量表现优劣的参数:
1、照射时间≤30min(加速器使用的质子电流为10mA)
2、30.0RBE-Gy可治疗深度≥7cm
3、肿瘤最大剂量≥60.0RBE-Gy
4、正常脑组织最大剂量≤12.5RBE-Gy
5、皮肤最大剂量≤11.0RBE-Gy
注:RBE(Relative Biological Effectiveness)为相对生物效应,由于光子、中子会造成的生物效应不同,所以如上的剂量项均分别乘上不同组织的相对生物效应以求得等效剂量。
在实际的中子捕获治疗过程中,不同情形下的病人及肿瘤情况往往需要采用不同能量的中子射束进行照射治疗,而如何根据具体情况得到所需能量的中子射束去进行治疗就成了需要解决的问题。本申请为了提供多种能量的中子射束,通过对照射至中子产生部之前的带电粒子束的能量进行改变,因为带电粒子束的能量改变了,而中子射束是由带电粒子照射至中子产生部后发生反应产生的,因此带电粒子束的能量改变会直接影响中子射束的能量。本申请所述中子捕获治疗系统通过改变带电粒子束的能量来改变中子射束的能量包括但是不限于硼中子捕获治疗过程中,以下具体介绍本申请中子捕获治疗系统。
如图2所示,本申请提供一种中子捕获治疗系统100,所述中子捕获治疗系统100包括用于产生带电粒子束P的加速器200、经带电粒子束P照射后产生中子射束的中子产生部10、射束整形体11以及准直器12。所述射束整形体11包括缓速体13及包覆于缓速体13外周的反射体14。所述中子产生部10经带电粒子束P照射后产生中子射束N,所述缓速体13将自中子产生部10产生的中子射束N减速至预设能谱,所述反射体14将偏离的中子导回以提高预设能谱内的中子强度,所述准直器12将中子产生部10产生的中子进行集中照射。所述带电粒子的能量能够改变,所述中子捕获治疗系统100通过改变带电粒子束的能量间接改变中子产生部产生的中子射束的能量,因为中子射束N是由经过带电粒子束P照射至中子产生部10后产生的,所以带电粒子束P的能量的改变会中子射束N的能量产生影响。即本申请通过带电粒子束P的能量变化间接改变中子射束N的能量,进而使得所述中子捕获治疗系统能够提供更好的中子深度剂量分布。
作为第一种实施方式,如图3所示,所述中子捕获治疗系统100还包括设置在加速器端的微波产生器300。所述微波产生器300能够产生不同频率的微波,所述加速器200根据注入的不同频率的微波对加速器中的离子源进行加速从而改变输出的带电粒子束的能量。当微波产生器300注入至加速器200中的频率较高时,所述加速器200对离子源的加速就越快,产生的带电粒子束P的能量也就越高,经所述带电粒子束P照射后中子产生部10产生的中子射束N的能量也就越高;当微波产生器300注入至加速器200中的频率较低时,所述加速器200对离子源的加速就较慢,产生的带电粒子束P的能量就较低,经所述带电粒子束P照射后的中子产生部10产生的中子射束N的能量就越低。当产生的带电粒子束的能量较低(为第一值)时,所述带电粒子与中子产生部反应产生的中子射束的能量较低(第一中子射束的能量值);当产生的带电粒子束的能量较高(为第二值)时,所述带电粒子与中子产生部反应产生的中子射束的能量较高(第二中子射束的能量值),其中所述第一值低于第二值,第一中子射束的能量值低于第二中子射束的能量值。
如图4所示,作为第二种实施方式,本申请还可以通过改变加速器端的电场强度来改变带电粒子束P的能量。因为加速器端的电场强度对带电粒子束P的加速速度有很大影响,而带电粒子束P的加速速度又直接影响带电粒子束P的能量,因此带电粒子束P照射至中子产生部10而产生的中子射束N的能量会受到影响。
作为改变加速器端电场强度的一个具体实施方式,本申请在真空管15外或者在中子产生部10外设置电场供应装置16以产生能够对照射至中子产生部10前的带电粒子束P进行加速或者减速的电场。作为一种优选地,所述电场供应装置16是指通电电极,通过控制通电电极两端的电压差对产生的电场强度差进行调整,从而对带电粒子束P进行加速或者减速,此处就不再作具体说明。
其实无论在真空管15外还是在中子产生部10外设置这样的电场供应装置16目的都是为了对经过加速器200加速后的带电粒子束P的能量进行二次调整,以利于带电粒子束P照射至中子产生部10时能够产生符合中子捕获治疗过程中需要的能量级中子射束N。即,通过控制加速器端的电场改变带电粒子束P的能量,间接改变中子射束N的能量。当然,也可以在真空管15外以及中子产生部10外分别设置这样的电场供应装置16,对带电粒子束P的能量进行多次调整,从而更易实现这样的能量调整,最后得到治疗过程中需要的能量级的中子射束N。
图5为本申请改变带电粒子束P的能量的第三种实施方式。本实施方式中,在真空管15中设置位于中子产生部10前方的射束能谱调节件17,所述带电粒子束P照射至射束能谱调节件17进行能量调节后再照射至中子产生部10进而产生中子射束N,最终实现对中子射束N的能量调节。
所述射束能谱调节件17设于真空管15内并位于中子产生部10下方,所述真空管15内设有位于中子产生部10下方的容置部151,所述射束能谱调节件17收容于所述容置部151中。因为不同数量的射束能谱调节件17对带电粒子束P的能量的调整效果会有所不同,因此,在真空管15中设置多个射束能谱调节件17,所述每个射束能谱调节件17分别连接于驱动机构18,所述驱动机构18控制每个射束能谱调节件17分别向上或者向下运动,即所述驱动机构18可以同时是一个或者多个射束能谱调节件17向上或者向下运动。在实际的中子捕获治疗过程中,根据对中子射束N的能量需求使驱动机构18工作,由驱动机构18控制每个射束能谱调节件17的运动情况。当所述驱动机构18控制射束能谱调节件17向上运动时,所述射束能谱调节件17运动至中子产生部10前方,所述带电粒子束P照射至所述射束能谱调节件17进行能量调节后再照射至中子产生部10;当所述驱动机构控制所述射束能谱调节件17向下运动时,所述射束能谱调节件17收容于容置部151,所述带电粒子束P直接照射于所述中子产生部10。通过射束能谱调节件17对带电粒子束P的能量进行调节,从而间接调整中子射束N的能谱。另外,所述射束能谱调节件除了设于中子产生部的下方外,也可以设置在真空管内的其他位置,只要能够在需要对带电粒子束的能量进行调节时位于中子产生部前方,在不需要对带电粒子束的能量进行调节时不位于中子产生部前方即可。
为了便于射束能谱调节件17的制造与安装,将所述每个射束能谱调节件17设计成相同的结构并且每个射束能谱调节件17有序排列在容置部15中,所述射束能谱调节件17和中子产生部10与带电粒子束P的照射方向垂直的截面均呈圆形,所述射束能谱调节件17的半径小于所述中子产生部10的半径。为了缓解射束能谱调节件17在经带电粒子束P照射后的发热情况,在射束能谱调节件17的外周设置冷却装置(未图示),所述射束能谱调节件17的冷却装置的设置可以参考现有技术中对中子产生部10的冷却方式,此处就不再具体介绍。当带电粒子束P照射至射束能谱调节件17时,所述射束能谱调节件17对带电粒子束P的能量进行调节,所述冷却装置对射束能谱调节件17进行冷却。
所述每个射束能谱调节件17的厚度可以相同也可以不同,另外,所述射束能谱调节件17的材料可以相同也可以不同。当所述射束能谱调节件17均采用相同的材料制造时,中子捕获治疗过程中对中子射束N能量的不同要求可以通过驱动机构控制不同数量的射束能谱调节件17向下运动至中子产生部10的前方来实现;当所述射束能谱调节件17采用不同材料制成时,中子捕获治疗过程中对中子射束N能量的不同要求既可以通过驱动机构控制不同数量的射束能谱调节件17向下运动实现,也可以通过驱动机构控制不同材料的射束能谱调节件17向下运动实现。另外,所述射束能谱调节件17也可以采用能够产生中子射束N的材料制成,比如锂或者铍。需要指出的是,当采用能够产生中子射束N的材料制造射束能谱调节件17时,应当将所述射束能谱调节件17设置的尽量靠近中子产生部10,如此以使带电粒子束P照射至射束能谱调节件17时产生的中子射束与中子产生部产生的中子射束得到有效利用。当然,如果射束能谱调节件17采用不产生中子射束的材料制成,只要射束能谱调节件17设于真空管15中并且在驱动机构的控制下能够向下运动而位于中子产生部10的前方,对照射至中子产生部10的带电粒子束P进行能量调节即可。
结合图6,作为第四种实施方式,所述中子捕获治疗系统100的中子产生部10连接于一通电装置20。通过所述供电装置20对所述中子产生部10通电使得中子产生部的内部产生电场,所述带电粒子束P的射束能谱因带电粒子束P照射至通电后的中子产生部10后发生改变。
当然,为了得到更好的中子射束N品质,也可以同时设置微波产生器、电场供应装置、射束能谱调节件以及连接于通电装置的中子产生部,以此对中子捕获治疗过程中产生的带电粒子束P进行多次能量的调整,从而更容易获得需要的能量级的中子射束,此处就不再具体说明。
本申请揭示的用于中子捕获治疗的射束整形体并不局限于以上实施例所述的内容以及附图所表示的结构。在本申请的基础上对其中构件的材料、形状及位置所做的显而易见地改变、替代或者修改,都在本申请要求保护的范围之内。
- 还没有人留言评论。精彩留言会获得点赞!