一种脱细胞肺支架及其制备方法与流程
本发明涉及组织工程人工肺领域,具体地说,是一种脱细胞肺支架及其制备的方法。
背景技术:
目前,由于环境因素、遗传因素、个人因素等原因,慢性阻塞性肺疾病(copd)、特发性肺纤维化(ipf)、ɑ-1抗胰蛋白酶缺乏,肺动脉高压等肺疾病越来越多,对于这些病人来说,肺移植是唯一效果肯定的治疗方法。但由于供体严重缺乏、免疫排斥反应、疾病传播、远期生存率低等原因制约了肺移植的开展。目前每年肺移植全球仅不足3700例,远远达不到需求。随着组织工程学和再生医学的发展,特别是组织工程皮肤、血管、膀胱、气管等在临床上已经成功应用,极大地鼓舞了组织工程人工肺的研究,为肺移植带来了新的方向。
构建组织工程人工肺的大致流程是首先获取理想的支架,然后通过种植宿主细胞,进行细胞培养,最后移植到宿主体内,形成一个具有气体交换功能的人工肺。获取理想的支架对于后面的细胞种植和体内移植至关重要。
目前,获取支架的来源有:脱细胞支架、天然支架、人工合成支架、3d打印支架等。其中,脱细胞支架已经广泛应用于临床,且不需要服用任何免疫抑制剂,最有前景。
制备脱细胞支架目前常用有震荡法和灌注法。震荡法过于剧烈,严重破坏了组织的三维结构,不适合结构组织疏松的肺脏。而灌注法是通过灌注去垢剂来制备脱细胞肺支架,最为合适,广泛应用于组织工程学。目前常用的去垢剂很难充分的去除肺内细胞,同时完美的保留肺脏的三维结构。细胞残留过多移植后会导致严重的免疫排斥反应。另一方面,构成脱细胞支架的内部成分是细胞外基质蛋白,细胞外基质蛋白丢失过多,也会使支架丧失了天然结构和功能,影响细胞化和血管化;呼吸膜破严重,气体交换能力难以维持;移植到体内,受体难以长期存活。
综上所述,可见对于寻求理想的去垢剂是制备脱细胞肺支架的关键之处。
技术实现要素:
为了克服上述技术问题,本发明提供了一种脱细胞肺支架。
本发明的另一目的在于提供一种脱细胞肺支架的制备方法。
为了制备出理想的脱细胞肺支架,本发明是通过以下技术方案来实现的:使用langendorff灌注系统灌注新型去垢剂:十二烷基醚硫酸钠(sodiumlaurylethersulfate,sles),同时联合灌注dnaseⅰ溶液。本发明首次利用去垢剂sles制备肺支架,同时对dnaseⅰ的应用方法做了改进。
为了实现上述目的,本发明所述一种脱细胞肺支架,其采用十二烷基醚硫酸钠(sodiumlaurylethersulfate,sles)联合dnaseⅰ溶液进行灌注处理而成。
其中,所述十二烷基醚硫酸钠(sodiumlaurylethersulfate,sles)的体积浓度为0.1-1%(ml/ml)。
所述dnaseⅰ溶液的浓度为20-30ug/ml。
十二烷基醚硫酸钠(sodiumlaurylethersulfate,sles)溶液与dnaseⅰ溶液的用量体积比约为10-20:1。
优选地,所述脱细胞肺支架采用先经0.1-1%sles的处理2-3小时;然后再在25℃下将20-30ug/mldnaseⅰ溶液以流速为1-2ml/min处理0.5-1h。
所述0.1%sles的用量为0.6-9ml,dnaseⅰ溶液的总用量约为0.6-3.6mg。
具体地说,本发明的脱细胞肺支架采用如下方法制成:
1)先将离体处理后的肺支架进行肝素化的pbs溶液灌洗;
2)然后采用0.1%-1%sles进行灌洗,并再用去离子水进行灌洗;
3)随后采用20-30ug/ml的dnaseⅰ溶液进行灌洗处理,并用去离子水进行灌洗;
4)最后用含抗生素的pbs溶液灌洗。
进一步,本发明的脱细胞肺支架,依次灌注以下溶液处理而成:
1)肝素化的pbs:pbs即磷酸缓冲盐溶液(phosphatebuffersaline),ph值为7.3-7.4;肝素浓度为10u/ml,即1mlpbs中加入普通肝素的量为10u,室温,流速为5ml/min,灌注15min。pbs用量100ml以内。
2)0.1%-1%sles:用去离子水稀释,即每100ml去离子水中加入0.1-1ml的sles,室温,流速为5ml/min,灌注2-3h,sles总用量约0.6-9ml。去离子水的用量约600-900ml。
3)去离子水:室温,流速为5ml/min,灌注15min。去离子水的用量100ml以内。
4)核酸酶应用液:dnase1液浓度为20-30ug/ml,用去离子水稀释,即每1ml去离子水中加入dnase120-30ug,控制灌注温度25℃,灌注流速为1-2ml/min,灌注0.5-1h,dnase1总用量约0.6-3.6mg。去离子水的用量约30-120ml。
5)去离子水:室温,流速为5ml/min,灌注15min。去离子水的用量100ml以内。
6)含抗生素的pbs:青霉素g500u/ml,链霉素500ug/ml,两性霉素b25ug/ml,即每1mlpbs中加入青霉素g500u,链霉素500ug和两性霉素b25ug。室温,流速为5ml/min,灌注2h。pbs用量约600ml,为了更好的冲洗细胞碎片,此步灌注时间可延长至3h,pbs用量可增加至1000ml。
sles是一种阴离子去垢剂,用来破坏细胞膜(裂解细胞)以释放细胞内的可溶性物质。sles含有乙氧基(c2h5o-),使得化学特性温和。此外,sles易溶于水,具有优良的去污能力、生物降解性和低温性能。肺脏结构疏松,温和的sles用于肺的脱细胞能最大程度的保留肺脏的三维结构。目前,sles应用于肺的脱细胞国内外还没有报道。本发明研究人员进过实验发现,灌注0.1%浓度的sles是使sd大鼠肺接近透明化的最小浓度,同时三维结构保持完整。
为了进一步去除细胞,本发明联合灌注dnaseⅰ溶液。dnaseⅰ即deoxyribonucleasei,中文名,脱氧核糖核酸酶i,是一种可以消化单链或双链dna的核酸内切酶,在25℃时酶的活性最大。这里,dnaseⅰ用来去除残留的dna,把免疫排斥的可能性降到最低。前期研究人员已通过dna定量实验证明,灌注sles后,对比不灌注dnaseⅰ,联合灌注dnaseⅰ可以使dna含量降至50ng/mg以内,达到组织工程学要求。
本发明提供脱细胞肺支架的制备方法,该方法采用先经0.1-1%sles的处理2-3小时;然后再在25℃下将20-30ug/mldnaseⅰ溶液以流速为1-2ml/min处理0.5-1h。
所述sles的用量为0.6-9ml,dnaseⅰ溶液的总用量约0.6-3.6mg。
具体地说,本发明的脱细胞肺支架的制备方法,包括如下方法:
1)先将离体处理后的肺支架进行肝素化的pbs溶液灌洗;
2)然后采用0.1-1%sles进行灌洗,并再用去离子水进行灌洗;
3)随后采用20-30ug/ml的dnaseⅰ溶液进行灌洗处理,并用去离子水进行灌洗;
4)最后用含抗生素的pbs溶液灌洗。
进一步,本发明的脱细胞肺支架的制备方法,采用依次灌注以下溶液处理:
1)肝素化的pbs:肝素10u/ml,室温,流速为5ml/min,灌注15min。
2)0.1-1%sles:用去离子水稀释,室温,流速为5ml/min,灌注2-3h,sles总用量约0.6-9ml。
3)去离子水:室温,流速为5ml/min,灌注15min。
4)核酸酶应用液:dnase1液20-30ug/ml,用去离子水稀释,25℃,流速为1-2ml/min,灌注0.5-1h,总用量约0.6-3.6mg。
5)去离子水:室温,流速为5ml/min,灌注15min。
6)含抗生素的pbs:青霉素g500u/ml,链霉素500ug/ml,两性霉素b25ug/ml,室温,流速为5ml/min,灌注2h。
langendorff灌注系统可以控制灌注压力、流速和温度,保证最佳的灌注效果,有利于量化生产。研究人员将此方案应用于sd大鼠,所制备的脱细胞肺支架能有效地去除细胞,同时完美的保留了肺脏三维形态结构,构建人工肺的细胞外基质蛋白也能完整的保存。肺支架体内移植后能与受体很好的融合,细胞化和血管化良好。
本发明采用了一种新型去垢剂十二烷基醚硫酸钠(sles),联合核酸酶(dnase1),解决人工肺三维结构破坏严重,细胞外基质蛋白丢失过多的问题。利用langendorff灌注系统,制备出来的脱细胞肺支架细胞去除干净,三维结构和细胞外基质蛋白保留完整,同种异体皮下移植6周后融合性、细胞化和血管化良好。本发明的制备方法统一、效率高,步骤简单,可以进行量化生产,在组织工程肺及疏松器官领域有良好的应用前景甚至可以应用于猪和猕猴等大型动物的脱细胞肺制备,为组织工程人工肺早日应用于临床提供了理论依据和技术支持。
附图说明
图1为不同灌注方式的大鼠肺部状态图;包含制备脱细胞肺支架不同时间点的状态图。
图2为正常大鼠肺组织与本发明制备的肺支架的he染色对比图;
图3为不同灌注状态下的大鼠肺的dna含量对照表;正常大鼠肺、仅灌注sles得到的脱细胞肺支架,和本发明联合灌注制备的脱细胞肺支架之间的dna含量差异。
图4为正常大鼠肺组织与本发明制备的肺支架的表面和内部扫描电镜对比图;
图5为正常大鼠肺与脱细胞肺支架针对5种主要细胞外基质蛋白的免疫荧光对照图;
图6为采用本发明制备的脱细胞肺支架进行体内移植处理的效果图。
具体实施方式
下面说明本发明的实施例。在本发明的一种实施方式中描述的元素和特征可以与一个或更多个其他实施方式中示出的元素和特征相结合。应当注意,为了清楚的目的,省略了与本发明无关的、本领域普通技术人员已知的部件或处理的表示和描述。
下面对本发明做进一步描述。
实施例1
一、大鼠取肺
选取健康雄性清洁级sd大鼠,体重250-350g,8-12周龄,术前12h禁食,4h禁饮水。腹腔内注射肝素,1000u/kg,15min后腹腔内注射3%戊巴比妥溶液,用量按150mg/kg麻醉。麻醉成功后将大鼠取仰卧位,四肢图钉固定于手术台上。胸部、腹部手术区备皮,常规消毒,胸腹部联合正中切口,长约5-8cm,剪开膈肌和肋骨,扒开胸腺,暴露心肺。棉签扒开腹部脏器,腹主动脉及腹主静脉切断放血。经右室注入生理盐水20-50ml,每1ml生理盐水含普通肝素50u防止心肺内血凝块形成,肺部稍微变白后,心肺支气管分离及整体切除,获得的新鲜正常肺直接储存在-80℃冰箱中备用。
二、langendorff灌注法制备脱细胞肺支架
之前储存的正常大鼠心肺从-80℃冰箱中取出,37℃水浴中融化。经主支气管注入20ml的pbs溶液,内含普通肝素100u,使双肺稍微膨胀。沿气管及升主动脉找到肺静脉和主肺动脉并分离,经主肺动脉根部离断心脏及升主动脉,并由主肺动脉插入16g灌注头,肝素化pbs溶液灌洗出肺脏残留血液。将灌注针头悬吊至langendorff操作台,调整与保温小室达到合适的距离,经肺动脉行离体肺脏灌流。在第1、2、3、5、6步中保持灌流压力为20cmh2o,室温,流速5ml/min。在第4步中保持灌注压力为20cmh2o,温度为25℃,流速为1-2ml/min。
依次灌注以下溶液:
1.肝素化的pbs:肝素10u/ml,室温,流速为5ml/min,灌注15min。
2.0.1%sles:用去离子水稀释,室温,流速为5ml/min,灌注2h,sles总用量约0.6ml。
3.去离子水:室温,流速为5ml/min,灌注15min。
4.核酸酶应用液:dnase1液30ug/ml,用去离子水稀释,25℃,流速为2ml/min,灌注1h,总用量约3.6mg。
而现有的方法大多是浸泡于30ug/ml的dnase1液中0.5-1h。本发明采用的dnase1灌注法可以更加有效的去除dna。但是如果dnase1用量过大会导致三维结构破坏严重,本发明优选采用流速为1-2ml/min。
5.去离子水:室温,流速为5ml/min,灌注15min。
6.含抗生素的pbs:青霉素g500u/ml,链霉素500ug/ml,两性霉素b25ug/ml,室温,流速为5ml/min,灌注2h。此步骤的目的是为了冲洗残留的细胞碎片和去垢剂。此步骤目前没有统一的灌注时间,本发明采用灌注2小时,体内移植后也没有出现排斥反应,细胞化和血管化良好。
实验例1
采用不同灌注方式观察大鼠肺部状态,如图1所示,a是从冰箱取出的正常大鼠肺与心脏分离后经主肺动脉插入16g灌注头,并悬吊至langendorff操作台上等待灌注。b是灌注0.1%sles溶液,流速5ml/min,2小时后肺基本透明,为了达到基本透明的效果,可以延长灌注时间至3小时。c是灌注浓度为30ug/ml的dnaseⅰ溶液1小时后,流速2ml/min,使肺更加晶莹剔透。d是灌注最终完成后,得到本发明制备的脱细胞肺支架。e研究人员采用本发明方法制备的支架灌注亚甲蓝染液后,可以看到蓝色的染液分布均匀,毛细血管床保留完整。通过图1可以得出结论,本发明能制备的脱细胞肺支架能完整的保留三维结构和微循环结构。
实验例2
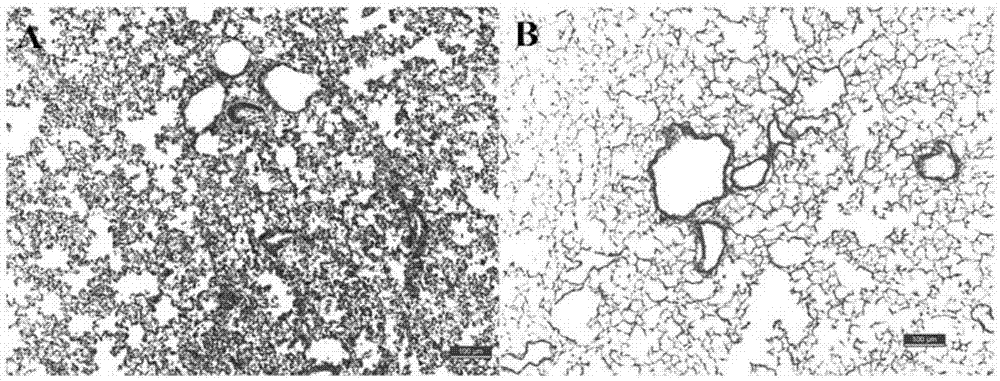
图2为正常大鼠肺组织与本发明制备的肺支架的he染色对比图;随机取正常肺叶和脱细胞肺支架肺叶按照he染色常规步骤,即固定、脱水、包埋、制备切片后常规he染色。如图2所示,a为正常大鼠肺组织he染色,组织内布满细胞;b为本发明制备的肺支架he染色,组织无明显细胞分布,放大100倍,比例尺100um。通过图2可以得出结论,本发明方法能完全的去除正常肺内细胞。
实验例3
图3为不同灌注状态下的大鼠肺的dna含量对照表为了评估联合应用dnaseⅰ的有效性。我们把18只大鼠随机分为3组,正常肺组6只,dnaseⅰ-组6只,dnaseⅰ+组6只。正常肺组为从冰箱取出的肺,不进行任何灌注。dnaseⅰ-组仅灌注sles,不灌注dnaseⅰ。dnaseⅰ+组采用本发明的联合灌注sles和dnaseⅰ方法。三组方法得到的肺组织,按照qiaampdnaminikit试剂盒说明书进行dna含量测定。数据采用spss软件进行单因素方差分析。结果如如图3所示,。正常肺组:1113.7±56.9(均值±标准差);dnaseⅰ-组:63.9±7.9;dnaseⅰ+组:33.9±3.1。单位:ng/mg(干重)。相对于正常肺组织,经过脱细胞,dna含量均明显下降(p<0.05),虽然dnaseⅰ-组和dnaseⅰ+组之间没有统计学差异(p>0.05),但是dnaseⅰ+组的dna含量均在50ng/mg以内,即每1mg脱细胞支架组织内的dna含量不超过50ng。通过图3可以得出结论,本发明能去除正常肺内97%的dna含量,达到组织工程学要求。
实验例4
图4为正常大鼠肺组织与本发明制备的肺支架的表面和内部扫描电镜对比图;扫描电镜的制作按照常规操作流程,结果如图4所示,采用扫描电镜:a正常大鼠肺表面超微结构。b是脱细胞肺支架表面超微结构,和正常肺基本相似,光滑完整。c是正常大鼠肺内部超微结构,布满细胞。d是脱细胞肺支架内部超微结构,未见细胞残留,三维结构基本接近正常肺。a、b扩大放大2000倍,比例尺50um。c、d扩大放大1000倍,比例尺100um。通过图4可以得出结论,本发明制备的脱细胞肺支架的超微结构也保留完整,接近正常肺组织。
实验例5
图5为正常大鼠肺与脱细胞支架针对5种细胞外基质蛋白的免疫荧光对照图;正常肺组织和本发明制备的脱细胞肺支架组织,按照常规免疫荧光流程,即组织制备成石蜡切片,经过抗原修复,山羊血清封闭,一抗孵育、加入相对应的荧光二抗,在荧光显微镜下观察。结果如图5所示,本发明所述的脱细胞肺支架能基本完好的保留了5种主要的细胞外基质蛋白:ⅳ型胶原蛋白、ⅰ型胶原蛋白、成纤维蛋白、层粘连蛋白、弹力蛋白,荧光表达量基本接近正常肺。放大200倍,比例尺75um。通过图5可以得出结论,构成细胞外基质的5种关键蛋白都能很好的保留,这为体内移植细胞化、血管化提供了很好的宿主环境。
实验例6
图6为采用本发明脱细胞支架进行体内移植处理的效果图;我们制备的脱细胞肺支架,取右肺上叶,大小约2cm×1.5cm。受体sd大鼠经过麻醉、消毒,切开腹部皮肤,把脱细胞肺支架右肺上叶移植到受体大鼠腹部皮下,缝合消毒,整个过程注意无菌操作,术后常规饲养。6周后取出植入的组织进行改良masson染色。结果如图6所示,a为脱细胞肺支架移植到另一sd大鼠皮下6周,可见支架与周围组织融合良好,没有出现坏死、脱落等排斥反应。b为改良masson三色染色,显示有新生血管形成(箭头所指),周围有细胞浸润(红色)。通过图6可以得出结论,本发明制备的脱细胞肺支架有很好的组织相容性,细胞化、血管化效果良好。这为最终的器官原位移植并长期存活提供了实验基础。
虽然已经详细说明了本发明及其优点,但是应当理解在不超出由所附的权利要求所限定的本发明的精神和范围的情况下可以进行各种改变、替代和变换。而且,本申请的范围不仅限于说明书所描述的过程、设备、手段、方法和步骤的具体实施例。本领域内的普通技术人员从本发明的公开内容将容易理解,根据本发明可以使用执行与在此所述的相应实施例基本相同的功能或者获得与其基本相同的结果的、现有和将来要被开发的过程、设备、手段、方法或者步骤。因此,所附的权利要求旨在在它们的范围内包括这样的过程、设备、手段、方法或者步骤。
- 还没有人留言评论。精彩留言会获得点赞!