一种使用载体组合的新型治疗性疫苗及使用方法与流程
本发明属于疫苗领域,尤其涉及一种使用载体组合的新型治疗性疫苗及使用方法。
背景技术:
慢性病毒感染疾病,如艾滋,乙肝,丙肝等,仍是人类健康面临的重大威胁。全球约有3400万人携带艾滋病毒(hiv),约有4亿人携带乙肝病毒(hbv),1.5亿人感染丙肝病毒(hcv)(1)。在中国,仅hbv携带者就超过9000万人,慢性活动性乙肝约3000万人,高居世界第一,hiv的感染率和发病率均呈上升趋势。因此,慢性病毒感染是我国公共健康面临的重大挑战,造成日益严重的社会和经济负担(每年约消耗我国gdp的2%)。疫苗接种是针对病毒感染最有效,最经济的一种免疫学手段。根据who估计,1美元的疫苗接种投入可节约5~10美元的健康保障费用。
现在常用的疫苗包括预防性疫苗(文献1)和治疗性疫苗两种,预防性疫苗主要通过作用于未曾抗原暴露过的淋巴细胞,产生免疫记忆以预防可能的相应感染。然而,在慢性病毒感染的特殊免疫环境下,病原特异性的淋巴细胞已抗原暴露,并受到长期慢性刺激而耗竭,丧失绝大部分功能,不能建立免疫记忆库(文献2、文献3)。可见感染性质的不同决定了预防性疫苗不适合直接用于治疗慢性病毒感染。
经过研究发现,针对慢性病毒感染,治疗性疫苗因其可逆转已耗竭的免疫细胞的功能,直接杀灭包含病毒的感染靶细胞,并可能最终清除感染而成为对抗慢性病毒感染新策略与技术。而慢性病毒感染除病毒抗原持续存在外,还同时伴随着抑制性免疫微环境的形成。治疗性疫苗免疫慢性病毒感染的机体后,相同的免疫微环境也会作用于新产生的效应性cd8+t细胞,从而导致新一轮的功能耗竭,造成疫苗的效力低下。在此背景下,由治疗性疫苗诱导而新形成的效应cd8+t细胞需具有在抑制性免疫微环境下抵抗耗竭的能力,从而使治疗性疫苗能在免疫后有效持久的发挥其抗病毒效力。然而,目前为止还没有很好的直接作用于cd8+t细胞本身而干预免疫耗竭的手段,而且已有研究提示,在慢性病毒感染环境下过度刺激病毒特异性cd8+t细胞反而易促使其凋亡(文献4、文献5)。
当前,国内外治疗性疫苗的研究大多依然遵循预防性疫苗研究的研究方式,采用不同类型的免疫原,如重组蛋白、合成肽,重组dna或病毒载体,抗原-抗体复合物等,配伍传统或新型佐剂,以期产生类似预防性疫苗引起的免疫反应而控制病毒的复制(文献6-文献9)。但此类研发尚未取得关键性的突破,仍然亟需研发新的策略及手段制备的高效持久的慢性病毒感染治疗性疫苗。
文献1:plotkin,s.a.complexcorrelatesofprotectionaftervaccination.clinicalinfectiousdiseases:anofficialpublicationoftheinfectiousdiseasessocietyofamerica(2013);
文献2:wherry,e.j.tcellexhaustion.natureimmunology12,492-499(2011);
文献3:wherry,e.j.etal.hiv-specificcd8tcellsexpresslowlevelsofil-7ralpha:implicationsforhiv-specifictcellmemory.virology353,366-373(2006);
文献4:west,e.e.etal.tightregulationofmemorycd8(+)tcellslimitstheireffectivenessduringsustainedhighviralload.immunity35,285-298(2011);
文献5:nolz,j.c.&harty,j.t.protectivecapacityofmemorycd8+tcellsisdictatedbyantigenexposurehistoryandnatureoftheinfection.immunity34,781-793(2011);
文献6:王萱怡,闻玉梅以临床-实验室-临床模式研究抗原-抗体复合物型治疗性乙型肝炎疫苗.传染病信息23,193-196(2010);
文献7:lan,p.,zhang,c.,han,q.,zhang,j.&tian,z.therapeuticrecoveryofhbv-inducedhepatocyte-intrinsicimmunedefectreversessystemicadaptiveimmunetolerance.hepatology(2013);
文献8:cobleigh,m.a.,wei,x.&robek,m.d.avesicularstomatitisvirus-basedtherapeuticvaccinegeneratesafunctionalcd8tcellresponsetohepatitisbvirusintransgenicmice.journalofvirology87,2969-2973(2013);
文献9:陈永红,陈小丽乙型肝炎疫苗的研究新进展.免疫学杂志28,266-271(2012)。
技术实现要素:
为了克服现有技术的上述不足,本发明提供了一种使用载体组合的新型治疗性疫苗及使用方法。
一种使用载体组合的新型治疗性疫苗,包括第一免疫物质和第二免疫物质,所述第一免疫物质由重组载体细菌组成,所述第二免疫物质由重组载体病毒组成;所述重组载体细菌为基因组中包含并表达了目标病毒或者目标肿瘤中主要cd4+t细胞抗原表位的脱氧核糖核酸序列的载体细菌,使得第一免疫物质能够特异性地刺激宿主cd4+t细胞,产生针对目标病毒或者目标肿瘤的特异性的细胞免疫应答;所述重组载体病毒为基因中包含并表达了与所述重组载体细菌所含相同的针对目标病毒或者目标肿瘤中主要cd4+t细胞抗原表位的脱氧核糖核酸序列的载体病毒,使得第二免疫物质能进一步地加强刺激宿主针对目标病毒或者目标肿瘤的cd4+t细胞免疫应答,并且增强的cd4+t细胞免疫应答能够辅助其它针对目标病毒或者目标肿瘤的细胞免疫应答;所述载体细菌为适用于人体的、安全的作为疫苗及基因治疗的细菌;所述载体病毒为适用于人体的、安全的作为疫苗及基因治疗的病毒;所述载体细菌和所述载体病毒都能够被人体免疫系统所清除。
优选的,获得重组载体细菌的方法如下:在载体细菌基因组中整合目标病毒或者目标肿瘤针对cd4+t细胞主要抗原表位的蛋白编码基因,得到重组载体细菌;获得重组载体病毒的方法如下:在载体病毒基因中插入目标病毒或者目标肿瘤针对cd4+t细胞主要抗原表位的蛋白编码基因,并通过细胞转染方式得到重组载体病毒。
优选的,所述目标病毒为造成人体慢性感染的病毒。
优选的,所述目标肿瘤为人体肿瘤。
优选的,所述重组载体细菌和重组载体病毒表达了相同的目标病毒或目标肿瘤的cd4+t细胞抗原表位或串联的抗原表位组合。
一种使用载体组合的新型治疗性疫苗的使用方法,包括下列步骤:
步骤a:在被感染机体进入被目标病毒感染的感染期后,对被感染机体注射含有重组载体细菌的第一免疫物质;
步骤b:在被感染机体注射第一免疫物质后的合适时间,对被感染机体注射含有重组载体病毒的第二免疫物质。
优选的,在步骤a中采用腹腔或肌肉注射的方法对被感染机体注射第一免疫物质;在步骤b中采用腹腔或肌肉注射的方法对被感染机体注射第二免疫物质。
一种使用载体组合的新型治疗性疫苗的使用方法,包括下列步骤:
步骤a:对荷瘤机体注射含有重组载体细菌的第一免疫物质;
步骤b:在荷瘤机体注射第一免疫物质后的合适时间,对荷瘤机体注射含有重组载体病毒的第二免疫物质。
优选的,在步骤a中采用腹腔、肌肉或瘤体内注射的方法对荷瘤机体注射第一免疫物质;在步骤b中采用腹腔、肌肉或瘤体内注射的方法对荷瘤机体注射第二免疫物质。
使用本发明所述的一种使用载体组合的新型治疗性疫苗,在载体细菌和载体病毒两种不同载体的基因中加入了目标病毒或者目标肿瘤针对cd4+t细胞主要抗原表位的蛋白编码基因,使得被感染机体或者荷瘤机体在使用所述疫苗的过程中通过依次注射第一免疫物质和第二免疫物质后产生效果加强的针对目标病毒或者目标肿瘤的cd4+t细胞的免疫应答,从而增强被感染机体或者荷瘤机体中的cd8+t细胞免疫应答,大大改善cd8+t细胞的耗竭状态,有效的提高治疗性疫苗控制病毒感染或者控制肿瘤的效果。
附图说明
图1:显示了实施例1中本发明所述的一种使用载体组合的新型治疗性疫苗降低慢性病毒感染小鼠体内病毒滴度;
图2:显示了实施例1中本发明所述的一种使用载体组合的新型治疗性疫苗加强cd8t细胞特异性抗病毒免疫反应的效果;
图3:显示了实施例1中本发明所述的一种使用载体组合的新型治疗性疫苗加强cd4t细胞特异性抗病毒免疫反应的效果;
图4:显示了实施例1中本发明所述的一种使用载体组合的新型治疗性疫苗加强抗病毒体液免疫的效果;
图5:显示了实施例1中本发明所述的一种使用载体组合的新型治疗性疫苗降低抑制性信号表达的效果;
图6:显示了实施例1中本发明所述的一种使用载体组合的新型治疗性疫苗降低treg细胞频率的效果;
图7:显示了实施例2中本发明所述的一种使用载体组合的新型治疗性疫苗抑制肿瘤生长的效果。
具体实施方式
一种使用载体组合的新型治疗性疫苗,包括第一免疫物质和第二免疫物质,用于治疗慢性病毒感染或肿瘤。第一免疫物质由重组载体细菌组成,第二免疫物质由重组载体病毒组成,完成制备并达到合格要求的第一免疫物质与第二免疫物质分别冷藏存储。其中重组载体细菌为基因组中包含并表达了目标病毒或者目标肿瘤中主要cd4+t细胞抗原表位或串联的抗原表位组合的脱氧核糖核酸序列的载体细菌,使得第一免疫物质能够特异性地刺激宿主cd4+t细胞,产生针对目标病毒或者目标肿瘤的特异性的细胞免疫应答;重组载体病毒为基因中包含并表达与所述重组载体细菌所含相同的针对目标病毒或者目标肿瘤的主要cd4+t细胞抗原表位或串联的抗原表位组合的脱氧核糖核酸序列的载体病毒,使得第二免疫物质能进一步地加强刺激宿主针对目标病毒或者目标肿瘤的cd4+t细胞免疫应答,并且增强的cd4+t细胞免疫应答能够辅助其它针对目标病毒或者目标肿瘤的细胞免疫应答。最终获得的重组载体细菌和重组病毒表达了相同的目标病毒或目标肿瘤的cd4+t细胞抗原表位或串联的抗原表位组合。
本发明所述的一种使用载体组合的新型治疗性疫苗所针对的目标病毒为造成人体慢性感染的病毒,所针对的目标肿瘤为人体肿瘤。其中目标病毒或者目标肿瘤的cd4+t细胞抗原表位的脱氧核糖核酸序列为30-105碱基对,编码10-35氨基酸序列。
制备本发明所述的一种使用载体组合的新型治疗性疫苗所使用的载体细菌为适用于人体的、安全的能作为疫苗及基因治疗的细菌,并且所使用的载体病毒也为适用于人体的、安全的能作为疫苗及基因治疗的病毒,确保进行基因重组前所选用的载体细菌和载体病毒都能够被人体免疫系统所消灭。本发明疫苗第一免疫物质和第二免疫物质的具体制备及使用方法将在具体实施例中详细说明。
实施例1
一、使用载体组合的新型治疗性疫苗的制备方法:
实施例1中本发明所述的一种使用载体组合的新型治疗性疫苗针对的目标病毒为淋巴细胞性脉络丛脑膜炎病毒(lcmv),为一种慢性感染病毒,其中淋巴细胞性脉络丛脑膜炎病毒(lcmv)中能引起cd4+t细胞免疫反应的主要抗原表位的蛋白编码基因为gp61-gp66基因;选择单核细胞增多性李斯特菌(lm)为载体细菌,选择甲型流感病毒(iav)为载体病毒,本实施例中被选作为载体细菌和载体病毒的细菌和病毒本身或者在减毒处理后对人体没有伤害,都能够被人体免疫系统所消灭。
实施例1疫苗制备包括步骤a和步骤b:
步骤a:制备第一免疫物质,包括步骤a1和步骤a2。
步骤a1:对单核细胞增多性李斯特菌(lm)进行减毒处理,然后利用同源重组的方法,将gp66蛋白编码基因定点整合于减毒后的单核细胞增多性李斯特菌(lm)基因组中的hly基因启动子和信号肽序列的下游,得到表达gp66(gp61)的重组载体细菌为rlm-gp66(lcmvgp61);
步骤a2:取lm-gp66(lcmvgp61)细菌储存液涂bhi平板,挑单菌落接种bhi肉汤培养基,在37℃环境下培养,每6至8小时测定细菌浓度a600的吸收值,调整细菌浓度为6×105/ml,并涂平板计数校正,最后将培养合格的rlm-gp66(lcmvgp61)细菌冰冻存储于-80℃冰箱中。
步骤b:制备第二免疫物质,包括步骤b1和步骤b2。
步骤b1:利用反向遗传技术将gp66蛋白编码基因插入到甲型流感病毒(iav)的na基因中,然后将嵌合的na基因插入phw2000中,并与phw-pb1、phw-pb2、phw-pa、phw-ha、phw-np、phw-m和phw-ns等基因转录/表达载体共转染293t细胞,最后将转染后含有甲型流感病毒(iav)的293t细胞培养上清接种spf鸡胚,获得有血凝价的重组载体病毒为iav-gp66。
步骤b2:iav-gp66病毒的培养参照国际通行的方法,采用原代鸡胚成纤维细胞(cef)在150平方厘米的培养瓶中培养,所述培养瓶中包括mem培养液,当鸡胚成纤维细胞(cef)长成单层后,接种iav-gp66病毒的病毒株,并使病毒moi=1;在37℃环境培养3天后,离心并弃上清,在干冰和37℃水浴冻融细胞3次,在冰上超声1分钟,然后将培养合格的iav-gp66病毒冰冻存储于-80℃冰箱中。其中iav-gp66病毒的浓度测定采用半数组织培养感染剂量测定方法简称tcid50进行测定,具体方法如下:将系列稀释的iav-gp66病毒液共计0.2ml与100μl1×105mlmdck细胞混合置于微量细胞培养板中,在37℃孵箱中培养18至22小时后,测定细胞半数感染剂量。
二、使用载体组合的新型治疗性疫苗的使用方法
在本实施例中,使用的小鼠为c57bl/6j(cd45.2),购自北京华阜康生物科技股份有限公司;所有小鼠均饲养于第三军医大学spf(specificpathogen-free)级动物房。所有实验中所用小鼠均为6-10周龄,且同一实验中使用的小鼠均为同一性别随机分组。本实施例所使用的重组后的rlm-gp66(lcmvgp61)细菌菌株从美国biourcesinc.公司购买得到,同时使用的重组后的iav-gp66病毒的病毒株来自中国人民解放军免疫学研究所。
关于在本实施例中所使用的重组载体病毒iav-gp66,及其构建方法在文献《qualitativelydifferentmemorycd8+tcellsaregeneratedafterlymphocyticchoriomeningitisvirusandinfluenzavirusinfections》中进行了描述,该文献于2010年发表在journalofimmunology杂志(august15,2010,185(4)2182-2190;doi:https://doi.org/10.4049/jimmunol.1001142)。文中说明了重组载体病毒iav-gp66是通过由八个质粒组成的质体逆向遗传学系统构建的;pcr引导的基因突变技术将lcmv病毒的gp(九个氨基酸长度)序列从流感病毒h1n1pr8株的神经氨酸酶(na)蛋白基因42位插入;为保证重组na蛋白的长度保持不变,qnhtgicnq序列从重组蛋白序列中被删除。
原文如下:
recombinantinfluenzaviruswasproducedusinganestablishedeight-plasmidinfluenzareverse-geneticssystem.theplasmidsusedintheconstructionoftherecombinantinfluenzavirusesweredescribedpreviously(18).thelcmvgpepitopewasinsertedintothenaofa/pr/8/34(h1n1)atresidue42usingapcrmutagenesisapproach.acorrespondingnumberofaminoacids(nine-qnhtgicnq)wasdeletedfromtherecombinantvirusestomaintaintheproteinlengthequaltothewild-typenaprotein.
步骤a:使用目标病毒lcmv-cl13感染小鼠,在小鼠进入lcmv-cl13慢性病毒感染期后的第21天,cd8+t细胞进入全面的耗竭状态,从此时开始使用组合治疗性疫苗,通过腹腔注射或者肌肉注射的方法对被感染小鼠注射1x106cfu含有lm-gp66(lcmvgp61)细菌的第一免疫物质,注射量为0.2ml,并且第一免疫物质采用rpmi培养基稀释。
步骤b:在小鼠注射第一免疫物质后的第7天,即小鼠进入lcmv-cl13慢性病毒感染期后的第28天,通过腹腔注射或者肌肉注射的方法对步骤a中被感染小鼠注射0.5tcid50含有iav-gp66病毒的第二免疫物质,用于boost高数量的病毒特异性cd4+t细胞,注射量为0.1ml,第二免疫物质采用rpmi培养基稀释。
三、使用载体组合的新型治疗性疫苗使用效果检测实验
在第二免疫物质注射后的第8天,分离各组织样品利用流式细胞仪分析cd8+t细胞的数量、功能和表型,同时也分析cd4+t细胞的数量和功能。最后,滴定小鼠脾脏、肺脏以及肝脏内的病毒滴度,确定治疗性疫苗的效力。在疫苗效果检测实验中,将未注射组合治疗性疫苗的lcmv-cl13感染小鼠作为对照。
1.病毒特异性的cd4+t细胞的数量和质量分析
1.1数量分析:将从脾脏分离的细胞先纪录细胞总数,再直接用含gp66短肽的四聚体染色,辅以cd3、cd4和cd44,用live/dead染料区分死细胞,进行流式细胞分析,以live/dead-tetramer+cd3+cd4+cd44+界定活的病毒特异性的cd4+t细胞,根据其在总细胞的频率和总细胞数量,确定病毒特异性的cd4+t细胞的数量。
1.2质量分析:通过上述的流式细胞分析,首先确定病毒特异性的cd4+t细胞,然后再进一步从分化方向、细胞因子分泌等方面界定病毒特异性的cd4+t细胞的质量。相关方法如下:用gp66短肽刺激细胞混合液5小时,再采用相应抗体进行细胞表面和胞内染色。
2.病毒特异性的cd8+t细胞耗竭分析
cd8+t细胞的耗竭程度从以下6个方面进行分析:
2.1细胞数量,将从脾脏分离的细胞先纪录细胞总数,再直接用含gp33+短肽的四聚体染色,辅以cd3、cd4和cd44,用live/dead染料区分死细胞,进行流式细胞分析,以live/dead-tetramer+cd3+cd4+cd44+界定活的病毒特异性的cd8+t细胞,根据其在总细胞的频率和总细胞数量,确定病毒特异性的cd8+t细胞的数量
2.2细胞表面抑制性受体的表达,包括pd-1,2b4,lag3,tim3等,这些受体均可以使用流式细胞仪进行定量分析;
2.3细胞因子的分泌,主要包括il-2,ifn-,tnf,分泌水平的定量可以采用特异性的gp33短肽刺激5小时,再采用胞内染色的方法,使用流式细胞仪进行分析;
2.4杀伤功能,细胞的杀伤功能可以用细胞仪及相应抗体检测cd107a/b的表达进行显示;
2.5增殖能力,细胞的增殖可以通过用流式细胞仪及相应抗体检测ki-67的表达进行显示;
3.组织病毒清除分析
3.1将免疫及未免疫的感染小鼠不同的组织取样,称重,匀浆,离心,取上清,使用tianampvirusrnakit(dp315-r)组织病毒rna提取试剂盒提取组织内的病毒rna;
3.2用nanodrop对所提取的病毒rna定量后,将其逆转录为cdna,逆转录过程中使用病毒特异性引物(gp-r:gcaactgctgtgttcccgaaac);
3.3qrt-pcr的方法检测病毒拷贝数:检测未知样本的时,需用已经过噬斑法金标准滴定的已知浓度的病毒十倍倍比稀释,建立标准曲线。所用引物序列为:gp-fcattcacctggactttgtcagactc及gp-rgcaactgctgtgttcccgaaac;
3.4根据标准曲线得出所提取的病毒rna拷贝数,再根据记录的组织重量计算每克组织中的病毒滴度。
4.抗体滴度检测
分离出小鼠血清使用elisa法测定lcmv特异性igg滴度。用pbs缓冲液将bhk-lcmvlysate稀释至浓度为3μg/ml。每孔中加100ul,在4℃环境过夜,并于第二天弃去孔内溶液,用pbst洗3次。每孔加入200ul封闭液(pbs+0.2%tween-20+10%fcs),室温放置1小时。在第一排孔中,加入一定稀释的待测血清,后排依次梯度稀释,室温孵育九十分钟,并同时做空白孔、阴性对照孔和阳性对照孔,然后用pbst洗三次。在封闭液中配置goatanti-mouseigg-hrp(1∶5000)酶标二抗。室温孵育九十分钟,用pbst洗三次。将4mgopd(sigma,p8787)溶解于10ml柠檬酸缓冲液中,再加入33ul3%的h2o2(fisher,h324500)。每孔加入100ul。待底物与酶反应完全后,于各反应孔中加入100ul1mhcl。使用酶标仪读取每孔在490nm处od值。
5.使用载体组合的新型治疗性疫苗与pd-l1抗体联用的效果检测
已感染lcmv-cl13的小鼠自感染后第26天起每三天接受一次pd-l1抗体(ratanti-mousepd-l1antibody;10f.9g2;bioxcell)注射,共三次,每次注射剂量为200μg,采用腹腔注射的方式。与此同时,在小鼠感染后第21天起接受使用载体组合的新型治疗性疫苗的免疫,即在小鼠感染后第21天注射lm-gp61,在小鼠感染后28天注射iav-gp61。
四、使用载体组合的新型治疗性疫苗的有益效果
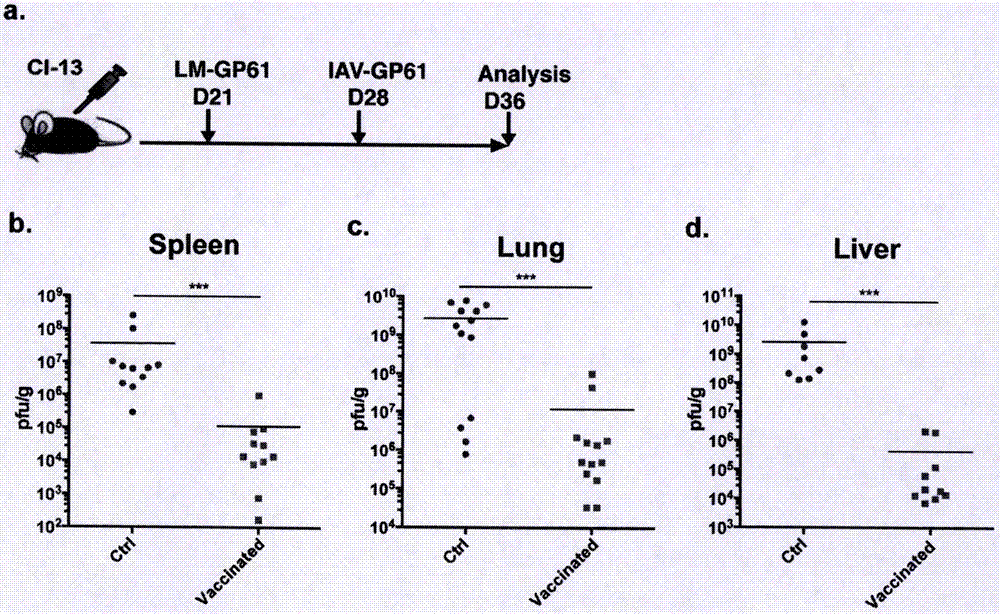
如图1-图6所示,实施例1中使用的本发明所述的使用载体组合的新型治疗性疫苗通过依次组合使用重组载体细菌及重组载体病毒两种不同载体,加强病毒特异性cd4+t细胞的免疫应答,从而增强慢性病毒感染中cd8+t细胞的应答,改善cd8+t细胞的耗竭状态。本发明所述的使用载体组合的新型治疗性疫苗免疫被慢性病毒感染的小鼠后,小鼠体内脾脏、肺脏及肝脏组织中病毒滴度显著下降100-1000倍。
经过本发明所述的使用载体组合的新型治疗性疫苗的免疫,慢性病毒感染的小鼠体内病毒特异性cd8+t细胞数目提高两倍左右,同时功能性cd8+t细胞数目的提高约三到四倍;因此可见,病毒特异性cd8+t细胞的免疫反应得到显著提升,cd8+t细胞的功能耗竭状态得到显著改善,并且cd8+t细胞恢复较强的抗病毒效应功能。
本发明所述的使用载体组合的新型治疗性疫苗在改善cd8+t细胞功能的同时,有效提升了病毒特异性cd4+t细胞的数目及功能,病毒特异性cd4+t细胞的数目增加约四倍,从而可为cd8+t细胞提供更多的帮助,增强cd8+t细胞抵抗耗竭的能力。并且,本疫苗在增强细胞免疫的同时还能增强慢病毒感染中的体液免疫。在免疫小鼠体内,滤泡辅助性t细胞tfh细胞数目提高两倍,生发中心b细胞比例升高两倍,并且在血清中病毒特异性抗体igg滴度显著提高,约为1.5倍。最后,本疫苗还能改善机体体内免疫抑制环境,经疫苗免疫的小鼠巨噬细胞及树突状细胞表面抑制性配体分子表达下降,调节性t细胞频率也有所下降,大约下降百分之五。
图1中a部分显示了小鼠使用载体组合的新型治疗性疫苗的方法流程;b-d部分显示了使用疫苗免疫小鼠与对照小鼠脾脏(b部分)、肺脏(c部分)和肝脏(d部分)内病毒滴度值,可见小鼠使用载体组合的新型治疗性疫苗后有效的降低脾脏、肺脏和肝脏等内脏组织内的病毒滴度。
图2中a部分显示对照组小鼠和疫苗组小鼠病毒激活的cd44hicd8t细胞的频率和数目的比较;b部分显示对照组小鼠和疫苗组小鼠病毒特异性cd8t细胞的频率和数目的比较;c部分显示对照组小鼠和疫苗组小鼠病毒特异性cd8t细胞表面表达抑制性分子水平的比较;d部分显示对照组小鼠和疫苗组小鼠cd8t细胞表达增殖标志物ki-67水平的比较;e-f部分显示对照组小鼠和疫苗组小鼠cd8t细胞体外经病毒特异性肽gp33刺激后效应功能的比较;g-h部分显示对照组小鼠和疫苗组小鼠组cd8t细胞体外经病毒特异性肽gp276刺激后效应功能的比较。
图3中a-c部分显示对照组小鼠和疫苗组小鼠病毒激活的cd44hicd4t细胞以及病毒特异性gp66+cd4t细胞的频率和数目的比较;d-e部分显示对照组小鼠和疫苗组小鼠cd4t细胞体外经特异性肽gp66刺激后分泌细胞因子的比较。
图4中a部分显示对照组小鼠和疫苗组小鼠病毒特异性tfh数目的比较;b部分显示对照组小鼠和疫苗组小鼠生发中心b细胞(gcb)频率的比较;c部分显示对照组小鼠和疫苗组小鼠血清中lcmv特异性igg的比较。
图5显示使用载体组合的新型治疗性疫苗可以降低巨噬细胞(macrophage)及树突状细胞(dc)表面抑制性信号分子pd-l1的表达。
图6显示使用载体组合的新型治疗性疫苗可以降低调节性t细胞(treg)的频率。
可见将本发明所述的使用载体组合的新型治疗性疫苗用于慢性病毒感染时,能通过刺激cd4+t细胞的免疫应答进而有效的增强cd8+t细胞抗病毒能力以及抵抗耗竭的能力,具有良好的抗病毒效果。
实施例2
一、使用载体组合的新型治疗性疫苗的制备方法:
实施例2中本发明所述的一种使用载体组合的新型治疗性疫苗针对的目标肿瘤为表达lcmv病毒糖蛋白的黑色素瘤细胞(b16-gp),为一种实体瘤,其中黑色素瘤细胞(b16-gp)能引起cd4+t细胞免疫反应的主要抗原表位的蛋白编码基因也为gp61-gp66基因;同样选择单核细胞增多性李斯特菌(lm)为载体细菌,选择甲型流感病毒(iav)为载体病毒,本实施例中被选作为载体细菌和载体病毒的细菌和病毒本身或者在减毒处理后对人体没有伤害,都能够被人体免疫系统所消灭。
实施例2疫苗制备步骤同实施例1相同。
二、使用载体组合的新型治疗性疫苗的使用方法
在本实施例中,使用的小鼠为c57bl/6j(cd45.2),购自北京华阜康生物科技股份有限公司;所有小鼠均饲养于第三军医大学spf(specificpathogen-free)级动物房。所有实验中所用小鼠均为6-10周龄,且同一实验中使用的小鼠均为同一性别随机分组。本实施例所使用的重组后的rlm-gp66(lcmvgp61)细菌菌株从美国biourcesinc.公司购买得到,同时使用的重组后的iav-gp66病毒的病毒株来自中国人民解放军免疫学研究所。
步骤a:将目标肿瘤细胞表达lcmv病毒糖蛋白的黑色素瘤细胞(b16-gp)通过皮下注射的方式在小鼠皮肤表层移植种植黑色素瘤细胞(b16-gp)。待移植黑色素瘤细胞(b16-gp)成瘤后开始使用组合治疗性疫苗,通过腹腔注射、肌肉注射或者瘤体内注射的方法对荷瘤小鼠注射1x106cfu含有lm-gp66(lcmvgp61)细菌的第一免疫物质,注射量为0.2ml,并且第一免疫物质采用rpmi培养基稀释。
步骤b:在小鼠注射第一免疫物质后的5-7天内,通过腹腔注射、肌肉注射或者瘤体内注射的方法对步骤a中荷瘤小鼠注射0.5tcid50含有iav-gp66病毒的第二免疫物质,用于boost高数量的病毒特异性cd4+t细胞,注射量为0.1ml,第二免疫物质采用rpmi培养基稀释。
三、使用载体组合的新型治疗性疫苗使用效果的检测实验
在本发明所述的使用载体组合的新型治疗性疫苗注射前、注射过程中以及注射后的,多次测量荷瘤小鼠表皮黑色素瘤体积大小的变化,确定本发明疫苗的效力。同时在本发明疫苗的效果检测实验中,将未注射本发明所述的使用载体组合的新型治疗性疫苗的荷瘤小鼠作为对照。
如图7所示,将本发明所述的使用载体组合的新型治疗性疫苗用于肿瘤模型,通过cd4+t细胞途径可以有效的增强机体抗肿瘤能力,具有良好的减缓肿瘤生长的效果,是一种具有良好潜在应用前景的新型疫苗。
本发明的上述实施例仅仅是为说明本发明所作的举例,而并非是对本发明的实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其他不同形式的变化和变动。这里无法所有的实施方式予以穷举。凡是属于本发明的技术方案所引申出的显而易见的变化或变动仍处于本发明的保护范围之列。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种在无血清全悬浮培养的mdck细胞生长的禽流感病毒的制备方法及获得的禽流感病毒的制作方法
- 腺相关病毒载体的高效生产的制作方法
- 一种靶向Mesothelin的复制缺陷性重组慢病毒CAR-T转基因载体及其构建方法和应用
- Cyp3a5蛋白、编码基因、重组载体及其在制备抗肿瘤复发或转移药物中的应用
- 一种靶向cd30的复制缺陷性重组慢病毒car-t转基因载体及其构建方法和应用
- 一种靶向cd22的复制缺陷性重组慢病毒car-t转基因载体及其构建方法和应用
- 一种特异性抑制平滑肌细胞增殖和迁移的腺病毒载体及其应用
- 一种提高AdEasy腺病毒载体系统重组效率的方法
- 用于转导脂肪组织的腺相关病毒载体的制作方法
- 肿瘤靶向腺病毒复合载体及其制备方法和用图