一种杀伤癌细胞的纳米颗粒及其制备方法与流程
本发明涉及纳米生物医学领域,具体为一种杀伤癌细胞的纳米颗粒及其制备方法。
背景技术:
目前治疗恶性肿瘤的多数化疗药物不是通过诱导肿瘤细胞凋亡来杀死癌细胞,而是通过竞争性抑制作用抑制各种核苷酸的合成或直接细胞毒性作用,因此有很大的副作用,破坏了机体的免疫平衡。细胞的增殖、凋亡、分化、衰老均是细胞周期依赖性的,因此,选择能破坏细胞周期并引起凋亡的药物,以调节细胞周期为策略将是今后抗肿瘤治疗的新途径。许多研究已经显示,中药在诱导肿瘤细胞凋亡、抵抗肿瘤细胞的侵袭及转移、诱导肿瘤细胞分化、抑制癌基因的表达、促进抑制癌基因的表达等多个环节抑制肿瘤的发生、发展与转移,而且许多中药可以同时作用于上述多个环节;但传统中药成分复杂,作用机制不够明确,因此寻找天然、有效、副作用小的抗肿瘤药物是肿瘤治疗中的关键所在。紫草提取物作为植物来源的天然药物,能有效诱导肿瘤细胞凋亡,是一种潜在的、有效的抗肿瘤药物。紫草主要的抗癌有效成分为萘醌类色素化合物,即紫草素及其衍生物,尤其以乙酰紫草素(acetylshikonin,as)和β,βʹ-二甲基丙烯酰紫草素为主要抗癌成分。目前,利用现代工艺提取紫草的有效成分用于肿瘤的治疗已经取得了很大的进展,可以提高有效成分的含量,降低其毒性。然而,当前紫草提取物仍缺乏对肿瘤的特异性,容易导致疾病区域剂量不足,并对正常组织造成意想不到的副作用。
技术实现要素:
本发明针对以上不足之处,提供了一种杀伤癌细胞的纳米颗粒及其制备方法,本发明将乙酰紫草素载入到石墨烯/介孔硅纳米复合材料中,并用透明质酸进行堵孔,透明质酸可以靶向癌细胞,载药纳米粒子通过内吞作用进入癌细胞后,癌细胞内过量表达的透明质酸酶可以降解透明质酸,释放紫草素杀死癌细胞。同时,在近红外光的照射下可实现癌症的化疗/光热协同治疗。
本发明解决其技术问题所采用的技术方案是:
本发明的有益效果是:
将纳米技术用于其有效成分的输送,利用肿瘤部位过量表达的酶来操控药物释放,可以很好地解决当前紫草提取物缺乏对肿瘤的特异性,容易导致疾病区域剂量不足,对正常组织造成意想不到的副作用的问题。
类三明治结构的石墨烯/介孔硅纳米片层(gs)成为一种新型的药物载体,它具有优异的生物兼容性、亲水性及分散性,能将石墨烯的光热功能与介孔硅的大孔径结合起来。gs的介孔中可以装载药物,并且可用响应靶向位点微环境的可降解分子进行封装堵孔。利用这种方式,可以构建一种“按需”的药物递送平台。透明质酸(ha)是一种生物可降解且无毒的细胞外基质的组分,已被广泛应用于癌症治疗的靶向和包裹试剂。它能特异性的与cd44受体结合,并且可被透明质酸酶降解,而cd44和透明质酸酶在各种癌细胞中均过量表达。
附图说明
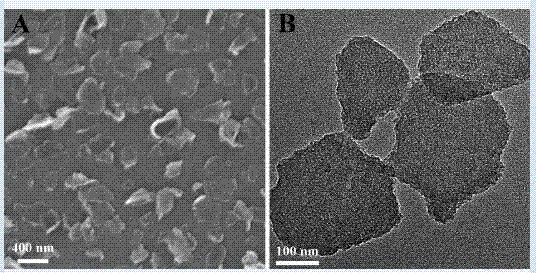
图1是石墨烯/介孔硅纳米复合材料典型扫描电子显微镜(a)和透射电子显微镜(b)图像;
图2是hela细胞在用gs@ha(a)、gs@ha-as(b)、gs@ha+nir(c)及gs@ha-as+nir(d)处理后的荧光显微镜图片,活细胞用calceinam染色,呈现绿色,死细胞用pi染色,呈现红色;
图3是hela细胞用不同方式处理后细胞活力图。
具体实施方式
实施例1
(1)石墨烯/介孔硅纳米复合材料的制备:先50mg氧化石墨烯加入到50ml含有0.5克ctab及20mg氢氧化钠的水溶液中,超声分散1小时;然后将上述溶液在40℃下搅拌2小时;接着加入500μlteos继续反应12小时。所得产物离心收集并用20ml热无水乙醇清洗三遍;然后将产物分散于50ml丙酮中,在40℃下搅拌24小时脱去ctab模板;得到的产物分别用乙醇和去离子水清洗,分散于10ml去离子水中备用,此即为石墨烯/介孔硅纳米粒子。
(2)将上步得到的20mg石墨烯/介孔硅纳米粒子和20mg乙酰紫草素(本课题组用高速逆流色谱纯化制备,相关论文已经发表)溶解于pbs缓冲液中(10mm,ph7.4),搅拌24小时;然后在12000rpm下离心收集沉淀物,重复以上步骤三次,收集到的沉淀物即为载入乙酰紫草素的石墨烯/介孔硅纳米粒子。
(3)将100mgha中加入50mgedc和30mgnhs,在mes缓冲液(ph5.5)中活化2小时,然后将载入乙酰紫草素的石墨烯/介孔硅纳米粒子与之混合,继续搅拌6小时;然后将得到的产物用pbs洗涤3次,即得到本发明的最终产物一种杀伤癌细胞的纳米颗粒。
癌细胞死亡成像,如图2所示
将hela细胞置于含10%的胎牛血清、100μg/ml青霉素和链霉素的dmem细胞培养基中,在含有5%co2的细胞培养箱中于37°c下培养;然后用共染色荧光指示剂来区分活细胞和死细胞,可视化细胞死亡。将hela细胞在100μl的rpmi细胞培养基中以每孔1×104个细胞的密度在24孔板中培养24小时。细胞洗涤后,将纳米粒子包裹透明质酸的石墨烯/介孔硅(gs@ha)和载入乙酰紫草素的石墨烯/介孔硅纳米粒子(gs@ha-as)(gs浓度为200μg/ml)加入孔中共孵育2小时。对于光热组,用808nm激光器以6w/cm2的强度照射5分钟。更换新鲜的dmem细胞培养基后继续培养12小时。最后,细胞用活-死细胞染色,活细胞用calceinam染色,呈现绿色,死细胞用碘化丙啶(pi)染色,呈现红色,得到的结果如图2所示,从图中我们可以看出:载入乙酰紫草素的纳米粒子或近红外光照都有一定的杀死癌细胞的能力,而当两者共同作用时具有最高的细胞死亡率。
体外癌细胞杀伤实验(如图3所示)
用mtt法来测定不同处理方式下癌细胞的存活率。将密度为1×105细胞/孔的hela细胞置于96孔细胞培养板中培养24小时后,将纳米粒子gs@ha和gs@ha-as(gs浓度为200μg/ml)加入孔中共孵育2小时。光热实验组用808nm激光器以6w/cm2强度照射5分钟。将上层培养基移除并用pbs溶液洗涤3次,加入新鲜的dmem培养基,然后继续培养24小时。加入10μlmtt(5mg/ml),继续孵育4小时。最后,小心吸去上清液,每孔加入100μldmso在摇床上轻轻摇动。通过记录在570nm处的光吸收值计算细胞的活力。细胞生长的相对活性计算公式为:%=(1-[od]test/[od]control)×100,结果如图3所示。从图中我们可以看到,纳米粒子本身对癌细胞的毒性很小,纳米粒子浓度为400μg/ml时,hela细胞仍保持了94%的存活率。该载药体系可以实现化疗/光热协同治疗,100μg/mlgs@ha-as细胞存活率为80.6%,nir光照100μg/mlgs@ha时细胞存活率为30.6%,而nir光照100μg/mlgs@ha-as纳米粒子时,只有25.6%细胞可以存活。
当然,上述说明并非是对本发明的限制,本发明也并不仅限于上述举例,本技术领域的技术人员在本发明的实质范围内所做出的变化、改型、添加或替换,也应属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!