山奈苷在制备预防和治疗新陈代谢综合征药物方面的应用的制作方法
本发明属于医药和/或保健品技术领域,具体涉及一种山奈苷在制备预防和治疗新陈代谢综合征药物方面的新应用。
背景技术:
山奈苷,是一种已知的天然化合物,具有降血糖、抗疲劳、清热解毒、消肿止痛的作用,多从植物中提取分离获得。如:中国专利cn201210382447.0公开了一种从紫叶李树叶中提取山奈苷的方法。
肥胖症是遗传、环境等多种因素引起的体内脂肪堆积过多、体重增加的慢性代谢性疾病。与2型糖尿病、血脂异常密切相关。摄入的能量超过消耗的能量会导致脂肪的堆积。脂肪组织的增大是由脂肪细胞数量的增多和体积增大引起的。脂肪组织的增殖、分化失常会引起脂肪组织的堆积。体内脂肪组织过多堆积会分泌一系列的激素和脂肪细胞因子干扰胰岛素在细胞内信号传导,引发胰岛素抵抗,胰岛素抵抗是指体内外周组织(肌肉、脂肪)对胰岛素的敏感性降低,使得外周组织对葡萄糖的摄取减少,导致血糖升高,进而诱发2型糖尿病。并且,胰岛素抵抗贯穿2型糖尿病的整个过程。脂肪组织的主要结构是脂滴,脂滴中甘油三酯的含量占95%。甘油三酯在脂肪酶的作用下分解为游离脂肪酸和甘油,脂质分解最主要的作用是供能。脂滴又被称之为“能量转换器”,是与肥胖相关的亚细胞结构,胞内脂滴增大可导致脂肪细胞体积增大。肥胖的生物学基础是:细胞内脂滴增大导致细胞体积增大和新生脂肪细胞数量增多。因此,研究脂滴的形成及甘油三酯的代谢可能成为解决肥胖问题的手段之一。脂肪细胞起源于中胚层干细胞,其分化发育经历几个阶段:多功能干细胞、间充质前体细胞、前脂肪细胞、成熟脂肪细胞。3t3-l1前脂肪细胞来源于小鼠胚胎成纤维细胞,经克隆扩增而成为前脂肪细胞系,能定向分化为成熟脂肪细胞,充分显示在体细胞的特点,包括形态学的改变,多种脂肪代谢酶的表达,广泛脂质积聚等,是体外研究脂肪细胞的理想模型。肥胖症和2型糖尿病的发病率不断上升,已成为全球性的健康问题。开发预防治疗肥胖症和2型糖尿病的天然产物意义尤为深远。
技术实现要素:
本发明目的在于克服现有技术缺陷,提供一种山奈苷在制备预防和治疗新陈代谢综合征药物方面的新应用。
为实现上述目的,本发明采用如下技术方案:
山奈苷在制备预防和治疗新陈代谢综合征药物方面的新应用。
上述的应用,具体的可以是:山奈苷在制备预防和治疗糖尿病药物方面的应用,尤其是在促进脂肪细胞糖吸收的药物和/或保健品方面的应用。
上述的应用,具体的还可以是:山奈苷在制备预防和改善肥胖症药物方面的应用,即具有潜在的减肥功效,尤其是在制备抑制前脂肪细胞分化的药物和/或保健品方面的应用。
和现有技术相比,本发明通过试验发现了山奈苷可以抑制前脂肪细胞分化、以及促进脂肪细胞糖吸收和改善胰岛素抵抗,可能成为治疗2型糖尿病、肥胖的一种新型化合物,即其具有潜在的降血糖、改善胰岛素抵抗的作用。因此,可被用作制备制备预防和治疗新陈代谢综合征药物和/或保健品,尤其是预防和改善糖尿病药物、肥胖症药物。
附图说明
图1为油红o染色试验结果,图中,上部为对照组油红分化形态图,下部为山奈苷油红分化染色图;
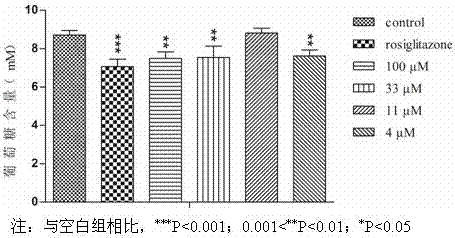
图2为化合物山奈苷对3t3-l1成熟脂肪细胞糖吸收作用。
具体实施方式
以下结合实施例对本发明的技术方案作进一步地详细介绍,但本发明的保护范围并不局限于此。
山奈苷是一种已知的天然化合物,多从植物中提取分离获得。本发明中山奈苷从植物女贞花(于2015年6月采集于贵州省贵阳市花溪区湿地公园,由贵州大学张前军教授鉴定为女贞(ligustrumlucidumait.)的花)中提取获得。具体提取分离步骤如下:
1)取475g干燥女贞花,添加石油醚至浸没女贞花,然后加热回流提取2次,每次回流提取2h,回流提取结束后,过滤,所得残渣挥干石油醚,用70%乙醇室温下浸渍提取3次(70%乙醇添加量以浸没残渣为宜),每次浸渍提取3天,合并提取液并浓缩,得到女贞花总浸膏;
2)女贞花总浸膏用50%乙醇溶解后,用d101型大孔树脂吸附分离,依次用水、20%乙醇、40%乙醇、60%乙醇、95%乙醇梯度洗脱,每个梯度洗脱五个柱体积,每个柱体积2000ml,洗脱液浓缩后,分别得到水部位浸膏、20%乙醇部位浸膏7g、40%乙醇部位浸膏60g、60%乙醇部位浸膏24g、95%乙醇部位16g;
3)40%乙醇部位浸膏(50g),经200-300目硅胶柱色谱进行分离,二氯甲烷/甲醇(v/v,100:0、50:1、25:1、20:1、15:1、5:1、2:1)进行洗脱,分离得到2个组分。其中的第1组分(10g)经过硅胶h减压柱色谱,二氯甲烷/甲醇(v/v,10:1、7:1、5:1、3:1、2:1、1:1)洗脱,然后经过sephadexlh-20凝胶柱色谱纯化,甲醇洗脱,分离得到化合物1(54mg),剩下的组分继续用反相半制备高效液相色谱纯化,用甲醇-水(0-40min,40%甲醇-100%甲醇;40-60min,100%甲醇,tr=46min)洗脱,分离得到化合物2(71mg)。其中的第2组分(5.6g)经过硅胶h减压柱色谱和sephadexlh-20凝胶柱色谱分离纯化得到化合物3(547mg)。化合物1、化合物2、化合物3经鉴定分别为山奈苷、10-羟基橄榄苦苷、过山蕨素,具体结构鉴定数据如下。
化合物1:黄色针晶(甲醇),分子量:578,分子式:c27h30o14,1h-nmr(dmso-d6,400mhz)δ:7.79(2h,d,j=8hz,h-2′,6′),6.92(2h,d,j=8hz,h-3′,5′),6.79(1h,d,j=4hz,h-8),6.46(1h,d,j=4hz,h-6),5.55(1h,d,7-o-rha,h-1),5.30(1h,d,j=4hz,3-o-rha,h-1),1.13(3h,d,j=4hz,7-o-rha,h-6),0.80(3h,d,j=8hz,3-o-rha,h-6).13c-nmr(dmso-d6,100mhz)δ:177.97(c-4),161.73(c-7),160.96(c-5),160.26(c-4′),157.84(c-9),156.14(c-2),134.56(c-3),130.76(c-2′,6′),120.38(c-1′),115.47(c-3′,5′),105.82(c-10),101.90(7-o-rha,c-1),99.51(3-o-rha,c-1),98.43(c-6),94.63(c-8),71.62(7-o-rha,c-4),71.13(3-o-rha,c-4),70.73(7-o-rha,c-3),70.34(3-o-rha,c-3),70.26(7-o-rha,c-2),70.11(3-o-rha,c-2),70.11(7-o-rha,c-5),69.85(3-o-rha,c-5),17.97(7-o-rha,c-6),17.52(3-o-rha,c-6)。以上数据和文献(陈艳,邓虹珠,梁磊.细梗胡枝子黄酮类成分的研究[j].南方医科大学学报,2008,28(05):858-860.)中化合物ⅳ比对,数据基本一致,故鉴定化合物1为山奈苷。
化合物2:白色固体,分子量:556,分子式:c25h32o14。1h-nmr(dmso-d6,400mhz)δ:6.64(1h,d,j=8hz),6.60(1h,s),6.47(1h,d,j=8hz)为苯环上的质子,7.53(1h,s),6.00(1h,t)为两个烯氢质子,4.66(1h,d,j=8hz)为葡萄糖端基质子,3.64(1h,s,c-11-och3)。13c-nmr(dmso-d6,100mhz)δ:170.70(c-7),166.15(c-11),153.42(c-3),145.15(c-3′),143.82(c-4′),129.24(c-1′),128.36(c-8),128.26(c-9),119.54(c-6′),116.22(c-2′),115.59(c-5′),107.61(c-4),99.14(glc-1″),92.66(c-1),77.42(glc-3″),76.63(glc-5″),73.32(glc-2″),69.95(glc-4″),65.16(c-β),61.13(glc-6″),57.28(c-10),51.34(c-11-och3),39.90(c-6),33.71(c-α),30.69(c-5)。以上数据与文献(冯雪松,许磊,高慧媛,吴立军.关东丁香化学成分的分离与鉴定[j].沈阳药科大学学报,2009,26(09):697-700)中化合物5比对,数据基本一致,故鉴定化合物2为10-羟基橄榄苦苷。
化合物3:黄色粉末(甲醇),分子量:594,分子式:c27h30o15,mp243~246℃,1h-nmr(dmso-d6,400mhz)δ:8.09(2h,d,j=8hz,h-2′,6′),6.89(2h,d,j=8hz,h-3′,5′),6.83(1h,s,h-8),6.44(1h,d,j=4hz,h-6),5.55(1h,s,3-o-glu,h-1),5.49(1h,d,j=8hz,7-o-rha,h-1),1.12(3h,d,j=4hz,7-o-rha,h-6).13c-nmr(dmso-d6,100mhz)δ:177.70(c-4),161.62(c-7),160.92(c-5),160.17(c-4′),156.80(c-9),156.03(c-2),133.51(c-3),130.07(c-2′,6′),120.82(c-1′),115.20(c-3′,5′),105.71(c-10),100.77(3-o-glu,c-1),99.44(7-o-rha,c-1),98.41(c-6),94.54(c-8),77.62(3-o-glu,c-5),76.45(3-o-glu,c-3),74.26(3-o-glu,c-2),71.64(7-o-rha,c-4),70.28(3-o-glu,c-4),70.12(7-o-rha,c-3),69.95(7-o-rha,c-2),69.87(7-o-rha,c-5),60.89(3-o-glu,c-6),17.98(7-o-rha,c-6)。以上数据和文献(袁琳,黄文忠,梁德强,马银海,杜芝芝.合柄铁线莲中黄酮苷类化学成分研究[j].中国药学杂志,2015,50(06):497-501.)中化合物3比对,数据基本一致,故鉴定化合物3为过山蕨素(山萘酚-3-o-β-d-吡喃葡萄糖基-7-o-α-l-鼠李糖苷)。
应用试验1、山奈苷对3t3-l1前脂肪细胞活性的影响
仪器材料:仪器:制备型高效液相色谱仪(waters2535q);旋转蒸发仪(eyela,东京理化器械株式会社);lc-3000高效液相制备柱色谱(北京创新通恒科技有限公司);am-400超导核磁共振仪(bruker);电子天平(美国mettler-toledo公司);tgl-16gr高速台式冷冻离心机(上海安亭科学仪器厂);双人单面净化工作台(型号:sw-cj-2fd型厂家:苏州净化设备有限公司);二氧化碳培养箱(型号:3111型,厂家:thermoscientific);倒置显微镜(ckx31型,olympus);全温振荡培养箱(hzp型上海精宏实验设备有限公司);离心沉淀器(800型上海手术器械厂);各种规格移液枪(transferpette);数码相机(canoneos450d)倒置显微镜(nikoneclipsets100);gf254硅胶薄层板(烟台汇友硅胶开发有限公司);40~80目硅胶、200~300目硅胶和硅胶h(烟台汇友硅胶开发有限公司);sephadexlh-20(瑞典pharmacia公司);d101型大孔树脂(天津海光化工有限公司);c-18(德国merk公司);其余试剂均为分析纯;葡萄糖测定试剂盒(上海荣盛生物药业有限公司,20161105147);葡萄糖标准品(上海荣盛生物药业有限公司,批号:20161001);小鼠游离脂肪酸测定试剂盒(南京森贝伽生物科技有限公司,批号:201609);胎牛血清(浙江天航生物科技股份有限公司,批号:20160923);dmem高糖培养基(北京索莱宝科技公司,批号:f08hv090);青霉素链霉素混合液(solarbio,批号:20161029);胰酶细胞消化液(碧云天,编号:c0210);二甲基亚砜(sigmashbc3313v);insulin(sigma);噻唑蓝(上海华蓝科技有限公司);油红o(sigmaslbp5248v);ibmx(sigma,bcbh1214v);dex(sigmabcbm4557v)。罗格列酮片(成都恒瑞制药有限公司);洛伐他汀胶囊(扬子江药业集团有限公司,20160109);细胞株:3t3-l1小鼠胚胎成纤维细胞购于中科院细胞库。
实验方法:
细胞培养与冻存:
3t3-l1前脂肪细胞,用含15%胎牛血清的dmem高糖培养基(青霉素:10u/ml、链霉素10μg/ml)在37℃、5%co2饱和湿度的二氧化碳培养箱中培养,2d换液一次,当细胞融合至80%后,弃培养瓶中培养液,加入0.25%胰蛋白酶液1ml,作用1min左右,加入2倍体积培养液终止消化,用吹打管将贴壁细胞吹打入培养液。将细胞悬液移入无菌离心管,1000rpm离心5min,弃上清。细胞传代:1个培养瓶收集的细胞沉淀用1ml新培养液吹散,按1:2比例传代。细胞冻存:2个培养瓶收集的细胞沉淀用1.2ml冻存液(含10%dmso的胎牛血清)吹散转入冻存管放入程序降温盒,然后放入-80℃冰箱过夜,取出冻存管放入液氮罐中保存。
细胞毒活性检测:
收集对数生长期的3t3-l1前脂肪细胞,调整细胞悬液浓度,以每孔2×105的密度接种于96孔培养板,每孔加入100μl细胞悬液。将细胞置于37℃、5%co2及饱和湿度的二氧化碳培养箱中培养24h,待细胞融合至60%-70%,加入浓度梯度的药物,每个板设正常对照组、溶媒对照组(0.1%dmso)、给药组,设6个复孔,继续培养48h后,每孔加入10μlmtt溶液(5g/l),继续培养4h。小心吸去孔内培养液,每孔加入100μldmso置震荡培养箱(100r/min)中震荡10min,使结晶物充分溶解。在酶标仪570nm波长处测量各孔的吸光度值(od值)。
表1:山奈苷对3t3-l1前脂肪细胞细胞毒活性的影响(n=6)
由表1可知,正常对照组与溶媒对照组吸光度值相比,差异没有统计学意义,说明溶剂对细胞活力不产生影响。山奈苷300μm剂量组吸光度值低于正常对照组,差异具有统计学意义(p<0.05)。山奈苷100、33和11μm剂量组与正常对照组吸光度值相比,差异没有统计学意义,说明山奈苷在300μm剂量时具有细胞毒作用。即:山奈苷在100μm剂量范围以下可设为给药剂量。
应用试验2、山奈苷对3t3-l1前脂肪细胞分化的影响
以3t3-l1前脂肪细胞为细胞模型,在诱导分化过程中加入山奈苷,油红o染色鉴定3t3-l1前脂肪细胞分化程度。
取对数生长期的3t3-l1前脂肪细胞传代培养,按1.5×105的密度接种到96孔板中,细胞完全融合后,接触抑制48h,然后更换含分化诱导剂a(0.5mmibmx、1μmdex、10μg/mlinsulin)的dmem高糖培养液(含15%胎牛血清),同时加药(分为空白组,模型组、洛伐他汀组(50μm),给药组)。3d后换成诱导分化剂b(含有10μg/mlinsulin)的dmem高糖培养液(含15%胎牛血清),2d后换常规培养液,此后隔天换液,培养至12d,小心吸除培养液,冰冷pbs洗2次,晾干,每孔加入50μl4%多聚甲醛固定40min,pbs再洗2遍,晾干,加入油红o染色30min,pbs洗2次,超纯水洗2次,倒置显微镜下数码相机拍照(100×)。每孔加入100μl异丙醇,40min后使用酶标仪在495nm波长下测定吸光度。结果如下。
数据处理:结果采用均值±sd值表示,数据统计采用spss19.0软件单因素方差分析法(one-wayanova)比较其显著性差异。
表2:山奈苷对3t3-l1前脂肪细胞分化的影响(n=6)
由图1、表2可知,与模型组相比,洛伐他汀组和山奈苷100μm剂量组油红染色水平显著降低(p<0.05),说明100μm的山萘苷能够抑制3t3-l1前脂肪细胞分化,说明山奈苷具有用于预防和改善肥胖症的潜质。
应用试验3、山奈苷对3t3-l1成熟脂肪细胞糖吸收的影响
取对数生长期的3t3-l1前脂肪细胞传代培养,按1.5×105的密度接种到96孔板中,细胞完全融合后,接触抑制48h,然后更换含分化诱导剂a(0.5mmibmx、1μmdex、10μg/mlinsulin)的dmem高糖培养液(含15%胎牛血清),3d后换成诱导分化剂b(10μg/mlinsulin)的dmem高糖培养液(含15%胎牛血清),2d后换含15%胎牛血清的dmem高糖培养液,此后隔天换液,培养至12d,诱导分化为成熟脂肪细胞。成熟脂肪细胞分组、加药(分为空白组、罗格列酮组(9.52μm)、给药组),继续培养48h,取培养液上清按葡萄糖测定试剂盒检测培养液中葡萄糖含量。
图2为化合物山萘苷对3t3-l1成熟脂肪细胞糖吸收作用。由图2可知,罗格列酮组的葡萄糖含量低于空白组,差异具有统计学意义(p<0.001)。100、33、4μm山萘苷组的葡萄糖含量低于空白组,差异具有统计学意义(p<0.01)。说明罗格列酮、100、33和4μm山萘苷均能促进脂肪细胞对外周葡萄糖的摄取,导致培养基中葡萄糖含量降低程度大于空白组葡萄糖含量降低程度,说明其具有预防和治疗糖尿病的潜质。
结论:山奈苷能够抑制3t3-l1前脂肪细胞的分化,说明其具有用于预防和改善肥胖症的潜质;山奈苷还能促进脂肪细胞对外周葡萄糖的摄取和吸收,导致培养基中葡萄糖含量降低程度大于空白组葡萄糖含量降低程度,说明其具有预防和治疗糖尿病的潜质。综合来讲,山奈苷可用于制备预防和治疗新陈代谢综合征药物。
- 还没有人留言评论。精彩留言会获得点赞!