一种包裹载药纳米材料的高分子水凝胶栓塞微球及其制备方法和应用与流程
本发明涉及一种包裹载药纳米材料的高分子水凝胶栓塞微球及其制备方法和应用,属于微球技术领域。
背景技术:
纳米药物在体外研究中具有较好的动物实验结果,但进入人体后仍然达不到预期的效果,主要原因是纳米药物在进入人体循环后被人体免疫系统干扰,难以发挥纳米药物的优异性能。纳米药物在静脉注射进入人体后需要经过血液循环、穿越血管壁、渗透进入肿瘤组织等多个步骤,而在血液循环过程中就被大量消耗,实际被肿瘤组织利用的药物比例极低。
公布号cn101953845a的发明描述了一种以超液态碘化油为载体,抗癌药物为顺铂并加入自噬抑制剂的方法。中国专利028179676与018236316描述了一种使用紫杉醇油性组合物提高药物在碘油中溶解性的方法,其问题在于碘油难以在机体中降解,无法进行二次栓塞。本发明使用可逐渐降解控释的水凝胶微球,与有一定水溶性的纳米药物(化疗药物)相容性好,负载率较高,可达到药物的缓释与二次栓塞的效果。中国专利2012100122870使用反相悬浮聚合法制备了可用于肿瘤栓塞化疗的微球,但不涉及纳米药物的输运。公布号04780912a、cn104994841a与cn106659688a的发明均采用可生物降解的白蛋白与阴离子性高分子(葡聚糖硫酸酯、硫酸皮肤素、硫酸角质素、硫酸软骨素、硫酸乙酰肝素、肝素等)作为微球基质,使用微流控方法或微胶囊造粒仪、乳化法等方法制备微球,利用阴离子性高分子的静电引力负载水溶液中化疗药物,可以用于肝癌等实体肿瘤的栓塞化疗。中国专利2012102579240中使用复乳化的方法形成w/o/w型的多囊脂质体,粒径为5-100μm,包裹有水溶性造影剂和抗肿瘤药物,在制备栓塞微球的过程中可同时包裹药物及水溶性造影剂(如碘海醇等)。但上述这些专利申请或公开都不涉及纳米药物,尤其是以纳米颗粒为载体负载化疗药物的纳米药物体系在体内的输运。
因此,现有技术中的纳米药物进入人体后,存在损耗高,利用率差,预期效果不够理想的缺陷。
技术实现要素:
发明目的:本发明的目的是在于提供一种包裹载药纳米材料的高分子水凝胶栓塞微球及其制备方法和应用,所得高分子水凝胶栓塞微球能够避免纳米药物在血管内输运过程中的损失,利用粒径可控的栓塞微球通过介入的方法将纳米药物定点于肿瘤组织处释放,以大大提高纳米药物的利用率,起到纳米药物化疗与栓塞阻断肿瘤供血的双重作用。
技术方案:为了实现上述目的,本发明公开了一种包裹载药纳米材料的高分子水凝胶栓塞微球,所述水凝胶栓塞微球以高分子材料为微球基体,其中包裹有负载药物的纳米材料。该水凝胶栓塞微球具有一定的力学强度和对血管壁的黏附力,可用于血管的特定位置的栓塞。
所述水凝胶栓塞微球的粒径分布在30-1500微米之间。
所述高分子材料为聚合物类,选自白蛋白、明胶、白芨胶、褐藻胶、海藻酸钠、葡聚糖、壳聚糖及其衍生物等中的一种。
所述纳米材料为碳纳米材料、无机纳米材料或高分子纳米颗粒等,选自化学修饰的氧化石墨烯或者介孔二氧化硅颗粒等。
所述药物为肿瘤化疗药物,选自阿霉素、伊立替康、紫杉醇或顺铂等。
所述高分子材料的质量占整个微球质量的1-30%;所述纳米材料中药物与纳米材料的重量比是0.1-0.9(药物与纳米材料重量比,就是通常说的载药量为10-90%)。
所述包裹载药纳米材料的高分子水凝胶栓塞微球的制备方法,包括以下步骤:
将已有文献报道的负载药物的纳米材料加入到含有高分子材料的溶液中,混合均匀作为水相,然后选取油相,利用微流控方法形成微液滴;
若高分子材料为明胶类物质,则先将上述微液滴凝固,然后提取至水相,之后在水中加入交联因子进行交联,即得所述水凝胶栓塞微球;
若高分子材料为非明胶类物质,则在生成上述微液滴的同时加入交联因子进行交联,然后提取至水相,即得所述水凝胶栓塞微球;
所述交联因子为化学交联,热交联或者光固化交联。
所述微流控方法中,水相的流速是0.05-1ml/h;油相的流速是2-10ml/h。
所述包裹载药纳米材料的高分子水凝胶栓塞微球在制备治疗肿瘤药物中的应用。
本发明可以使用微流控方法、乳化交联法、微胶囊造粒仪等方法制备载纳米药栓塞微球;
微流控方法中使用的芯片不仅可以是t型芯片,也可以是共流聚焦型等任何可生成微液滴类型的芯片;生成微液滴的微流控芯片中,一个流道其中为水相(分散相),另外一个流道其中为油相(连续相);连续相(油相)的成分可以是任何的难与水互溶且较稳定的液体,如液态的烷烃、液体石蜡、硅油、中链甘油三酯等中的一种或多种的混合物;连续相(油相)中所使用的表面活性剂为hlb值在3-6的有助于生成油包水液滴型乳化剂,如司盘80、丙二醇单硬脂酸酯等等;分散相(水相)为明胶或白蛋白、白芨胶、褐藻胶、海藻酸钠、葡聚糖、壳聚糖及其衍生物等的单一成分或混合成分的水溶液,且其中均匀分散有负载有药物的纳米材料;经过微流控系统后得到分散在油相中的水相微球,分散比例是1:40至1:10;
如果分散相材料为明胶类物质,其交联过程为:选取明胶溶液浓度为5%-20%,其中均匀分散有1-50mg/ml的氧化石墨烯纳米药物,在35℃-55℃下生成油相中的微液滴后,在低于25℃以下的温度下凝固,形成未交联的明胶微球,提取该明胶微球至水相,之后在水中加入1-10%京尼平或醛类交联剂进行交联,即可得到在水中分散的载纳米药水凝胶栓塞微球;
如果分散相材料为非明胶类物质,其交联过程为:生成油相的微液滴的同时在体系中加入交联因子成球,之后提取油相微球至水相即为载纳米药物的高分子水凝胶微球;所述交联因子为化学交联(如京尼平、戊二醛等)、热交联、光固化交联等;
微球从油相至水相的转移过程中,可使用互溶性介于水与油相之间且较稳定不发生反应的溶剂,如使用短链烷烃和50%异丙醇(但不限于此类溶液)水溶液先后浸洗,提取油相微球至水相中,最终得到分散在水中的载纳米药物高分子水凝胶微球;
本发明所得微球可以降解,在胰酶等的作用下可以逐渐崩解释放出其中的纳米药物;这种微球可以通过介入导管输运到动物体内,并聚集在血管局部,实现血管的栓塞,阻断局部血流,切断肿瘤组织供血,从而达到减少肿瘤组织局部营养供应,降低肿瘤组织生长速度的目的;在栓塞血管的同时,通过微球崩解释放出纳米药物,利用纳米药物对肿瘤细胞的作用杀灭肿瘤细胞,从而达到消除肿瘤组织的目的;崩解后的微球逐渐被代谢、排泄,从而使血管复通,通过调节微球崩解速度和肿瘤组织杀灭的速度,可以消除肿瘤组织,同时避免永久栓塞对正常组织的影响;此外,崩解复通后的血管可以进行第二次栓塞(第一次栓塞以后,血管如果重新通畅,可以进行第二次栓塞,就是所谓的二次栓塞),从而实现多次反复治疗,最终彻底消除肿瘤组织;特别是用于有明确血供的实体肿瘤的治疗,如原发性肝癌、转移性肝癌、子宫肌瘤等。
本发明着眼于克服纳米药物在血管内输运过程中的损失,利用微球作为载体负载纳米药物,并利用微创介入的方法定点施放在肝癌供血血管,一方面栓塞血管,另一方面通过微球的崩解逐渐释放出纳米药物,实现肝癌的栓塞化疗。
技术效果:相对于现有技术,本发明通过微流控方法制备交联的高分子水凝胶微球,可以有效控制微球的粒径和粒径分布,从而适应不同血管的栓塞需求。微球作为载体可以避免纳米药物在血管内输运过程中的影响,如被内皮网状系统吸收、经肝/肾代谢、在血管中层积团聚等,从而提高纳米药物的利用率和治疗效果。微球实现血管栓塞可以提高局部药物浓度并通过微球的崩解和纳米药物的药物缓释特征提供肿瘤组织局部的高浓度持续给药,起到更好的肿瘤治疗效果。
附图说明
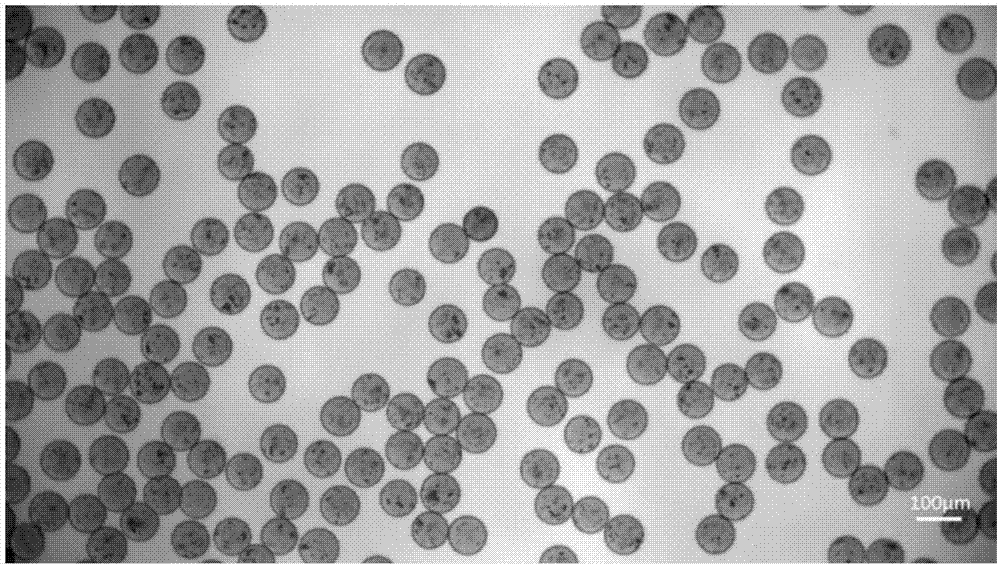
图1:交联的高分子水凝胶微球在显微镜下的照片;
图2:含有纳米药物(dox@go)的微球照片;
图3:微球经导管输运到动物体内栓塞血管的造影效果。
具体实施方式
下面结合实施例对本发明作进一步的说明,但本发明要求保护的范围并不局限于实施例所描述的范围。
实施例1:
交联高分子水凝胶微球的制备方法:
第一步,微流控微液滴发生装置的搭建:选用t型内壁疏水的微流控芯片,双通道注射泵,加热装置,搭建一组微流控系统;
第二步,配制连续相与分散相:
连续相(油相):含4%的司盘80的液体石蜡;
分散相(水相):含10%明胶的水溶液,使用微流控的温度控制装置加热至45℃;
第三步,调试连续相的流速为所搭建微流控系统允许的最大值2.5ml/h,以达到最大的微球产出速度。控制水相流速为0.056ml/h,即可微流道中形成单分散液滴,微球流出微通道后为室温条件,温度为20℃,明胶微球呈固态;
第四步,提取油相明胶微球至水相中,使用正辛烷和50%异丙醇水溶液先后提取交联之前的明胶微球,将其转移至水中;
第五步,在水中加入3%京尼平溶液于常温下聚合,48h后交联完成,如图1所示。微球的粒径约为60μm,呈完整的球形,粒径分布非常均匀,呈单分散,且互相之间没有粘连。将微球提取至存储液(如pbs或生理盐水等)中冷藏备用,即为分散于水中的高分子水凝胶微球。
实施例2:
含有石墨烯纳米药物的高分子水凝胶微球的制备方法:
第一步,微流控微液滴发生装置的搭建:选用t型内壁疏水的微流控芯片,双通道注射泵,加热装置,搭建一组微流控系统;
第二步,配制连续相与分散相:
连续相(油相):含4%的司盘80的液体石蜡;
分散相(水相):含10%明胶的水溶液,其中加入2mg/ml的纳米药物(dox@go)(参照yang,x.y.,etal.,high-efficiencyloadingandcontrolledreleaseofdoxorubicinhydrochlorideongrapheneoxide.journalofphysicalchemistryc,2008.112(45):p.17554-17558.),使用微流控的温度控制装置加热至45℃;
第三步,调试连续相的流速为所搭建微流控系统允许的最大值2.5ml/h,以达到最大的微球产出速度。控制水相流速为0.056ml/h,即可微流道中形成单分散液滴,微球流出微通道后为室温条件,温度为20℃,明胶微球呈固态;
第四步,提取油相明胶微球至水相中,使用正辛烷和50%异丙醇水溶液先后提取交联之前的明胶微球,将其转移至水中;
第五步,在水中加入4.5%京尼平溶液于常温下聚合,24h后交联完成,如图2所示。提取至存储液(如pbs或生理盐水等)中冷藏备用,即为分散于水中的载纳米药物的高分子水凝胶微球。
图2中的载纳米药高分子水凝胶微球,尺寸均一,对纳米药物的包裹率几乎达到了100%,没有造成药物的浪费,且其中包裹的纳米药物(dox@go)在各个微球中分散较为均匀。
含有石墨烯纳米药物的高分子水凝胶微球的体内介入:
动物模型为vx2肝癌模型。模型种植2-3周后,实验兔术前禁食36h,禁水12h术前半小时肌肉注射青霉素80万单位,地塞米松2mg,用戊巴比妥钠(100mg/kg体重)静脉注射麻醉。之后清理实验兔右腿股处毛发,注射2%利多卡因3ml,按照无菌手术的原则于右腿股动脉处切开一约3cm的切口,2支丝线分别置于右股动脉近端和远端的下方,结扎远端丝线,使用18g穿刺针穿刺股动脉,待穿刺针的外鞘管进入血管腔,退出针芯,使用少量肝素抗凝后将外鞘管留作鞘,其尾部用三通帽封住。结扎近端丝线,固定外套管鞘。移除三通帽,用2.7f微导管进行穿刺到达肿瘤供血主动脉。将分散于生理盐水中的载纳米药物的高分子水凝胶微球经过导管灌注到目标血管。同时灌注水溶性造影剂碘海醇进行栓塞造影,栓塞终点为造影时未见明显肿瘤血管。
使用股动脉穿刺方法将分散在生理盐水中载纳米药水凝胶微球经过导管输送到目标血管后,栓塞血管的造影结果如图3。图中左图栓塞前可见大量细小血管(深灰色阴影线),右图栓塞后只有较大的血管可见,在较大血管末端的小血管已经被闭塞实现了栓塞。
实施例3:
与实施例2类似,但是其中使用的为负载伊立替康的纳米药物,得到包裹纳米药物的水凝胶微球;
实施例4:
与实施例2类似,但是其中使用的纳米药物为负载阿霉素的介孔二氧化硅颗粒,得到包裹纳米药物的水凝胶微球;
实施例5:
与实施例2类似,但是其中使用的高分子为壳聚糖,得到包裹纳米药物的水凝胶微球;
实施例6:
与实施例2类似,但是微流控芯片换为流动聚焦型芯片,得到包裹纳米药物的水凝胶微球。
实施例7:
与实施例2类似,但是其中使用的油相(连续相)为植物油,得到包裹纳米药物的水凝胶微球;
实施例8:
与实施例2类似,但是将油相中司盘80换为丙二醇单硬脂酸酯,得到包裹纳米药物的水凝胶微球;
实施例9:
与实施例2类似,但是交联剂换为0.25%戊二醛溶液,得到包裹纳米药物的水凝胶微球。
- 还没有人留言评论。精彩留言会获得点赞!
- 酸敏感可控释放单线态氧纳米材料及其制备方法与应用与流程
- 一种层状复合纳米材料M‑LDHs@Si02微球的制备方法与流程
- 复合纳米材料和微米材料、它们的膜和其制备方法及用途与流程
- 复合纳米材料和微米材料、它们的膜和其制备方法及用途与流程
- 包括离散氧化铝纳米材料的正电极以及形成氧化铝纳米材料的方法与流程
- 一种基于TiO2介晶纳米材料的双响应夹心型免疫传感器的制备方法及应用与流程
- 一种基于核酸和铂纳米材料的自组装体系检测核酸浓度的方法与流程
- 一种高容量蜂窝结构的ZnCo2S4纳米材料及其制备和应用的制作方法与工艺
- 一种银纳米棒/聚合物/银纳米片核壳纳米材料及其制备方法和应用与流程
- 一种WC‑SiO2‑Mn‑Fe纳米材料及其制备方法与流程