桐花树叶石油醚提取物及其制备和治疗前列腺癌的应用的制作方法
本发明属于桐花树技术领域,尤其涉及一种桐花树叶石油醚提取物(pacl)及其制备和治疗前列腺癌的应用。
背景技术:
桐花树(aegicerascorniculatum)为紫金牛科蜡烛果属植物,是红树植物中分布很广的一种植物,生长于海边潮涨潮落的污泥滩上。目前研究显示其化学成分主要含有萜类、甾体、黄酮、多酚等,药理作用主要有细胞毒性,抗真菌、止泻、抗氧化等。由于植物化学成分的多样性与复杂性,即使是同一种植物,其不同药用部位的功效及其所含化学成分也会存在很大差异,如麻黄和麻黄根,麻黄主要含麻黄碱和伪麻黄碱,而麻黄根则主要为大环精胺类生物碱。而对于桐花树的研究,多见于桐花树茎、枝和皮,且多关注于其乙醇、水提部位,对桐花树叶石油醚部位抗癌的研究尚未见有报道。
随着发病率以及死亡率的上升,肿瘤目前已成为我国死亡率最高的疾病,也是最大的公共医疗问题。根据国家癌症中心2017年发布的我国最新癌症数据显示,全国每天约有1万人确诊为癌症,新发病例占到全球的百分之四十。前列腺癌是西方发达国家老年男性最常见的恶性肿瘤,近年来随着我国人口步入老龄化加快,饮食结构的改变以及诊断水平的提高,前列腺癌发病率在我国呈快速上升趋势。随着中医药治疗肿瘤标准化的不断发展,中药治疗前列腺癌已受到广泛关注。研究发现,中药治疗前列腺癌具有一定的优势,主要体现在提高患者生存质量,减轻临床症状,延长生存期等方面。因此,从中医药中寻求新型、安全有效的的治疗药物是目前治疗前列腺癌的重要研究方向。
技术实现要素:
本发明解决的技术问题是提供一种桐花树叶石油醚提取物及其制备和治疗前列腺癌的应用,以扩大桐花树的使用范围,为癌症治疗开辟新途径。
为解决上述技术问题,本发明采用以下技术方案:
桐花树叶石油醚提取物在制备治疗前列腺癌药物方面的应用。
药物为胶囊剂、片剂、丸剂、颗粒剂、膏剂、合剂、混悬剂,该药物以桐花树叶石油醚部位为活性成分,加入常规辅料按照常规工艺制成。
前列腺癌源于人前列腺癌细胞pc3、du145。
桐花树叶石油醚提取物的制备方法,将桐花树叶加入乙醇浸泡得到桐花树叶乙醇总提物,将乙醇总提物中乙醇挥发后,加入石油醚进行萃取获取上层石油醚部位提取物,再经水浴干燥,即得。
上述桐花树叶石油醚提取物的制备方法,按以下操作进行:将桐花树叶晒干打成粗粉,加入25倍量95%乙醇浸泡7天;通过减压浓缩得到桐花树叶乙醇总提物,将乙醇总提物加纯水溶解成混悬液,挥发至无乙醇味后,加入石油醚进行萃取,获取上层石油醚部位提取物,将上层石油醚部位提取物水浴干燥,即得桐花树叶石油醚提取物。
上述制备方法得到的桐花树叶石油醚提取物。
为充分开发桐花树资源,发明人建立了一种桐花树叶石油醚提取物的制备方法,将桐花树叶加入乙醇浸泡得到桐花树叶乙醇总提物,将乙醇总提物中乙醇挥发后,加入石油醚进行萃取获取上层石油醚部位提取物,再经水浴干燥,即得。体外分子生物学实验研究表明,桐花树叶石油醚提取物对人前列腺癌细胞pc3、du145具有增殖抑制作用,并可明显抑制人前列腺癌细胞pc3、du145的克隆形成。因此,桐花树叶石油醚提取物在制备治疗前列腺癌药物方面具有潜在应用前景,可用于制备抗前列腺癌药物。深入开发桐花树叶石油醚提取物可以扩大桐花树的使用范围,为癌症治疗开辟新途径。
附图说明
图1是本发明桐花树叶石油醚提取物对前列腺癌细胞增殖抑制作用的结果图。
图2是本发明桐花树叶石油醚提取物对前列腺癌细胞活性影响的平板克隆形成实验结果图。
图3是本发明桐花树叶石油醚提取物对前列腺癌细胞活性影响的结果柱状图。
具体实施方式
一、桐花树叶石油醚部位提取物(pacl)的制备
1.药材:桐花树叶采于广西防城港,经广西北部湾海洋研究中心许铭本鉴定为金牛科蜡烛果属植物桐花树的叶子。
2.提取与分离:将桐花树叶晒干打成粗粉(2500g),加入25倍量(62.5l)95%乙醇浸泡7天;通过减压浓缩得到桐花树叶乙醇总提物,将乙醇总提物加纯水溶解成混悬液,加热挥发至无乙醇味后,加入石油醚进行萃取,获取上层石油醚部位提取物,将上层石油醚部位提取物水浴干燥,即得桐花树叶石油醚提取物。
二、桐花树叶石油醚部位提取物对多种癌细胞的增殖抑制作用研究
1.实验材料
细胞株——人前列腺癌细胞pc3、du145,由广西医科大学转化医学研究中心提供。药材——桐花树叶
主要试剂和耗材——
主要试剂——
细胞增殖检测试剂盒(mts):美国promega公司;
结晶紫染色液:中国碧云天公司;
1640培养液:维森特公司
胎牛血清:美国gibco公司
氯仿、异丙醇、无水乙醇、水合氯醛等为国产分析纯试剂。
主要耗材——
25cm2细胞培养瓶:美国bd公司;
10cm细胞培养皿:美国bd公司;
96孔板:美国bd公司;
15毫升离心管、50毫升离心管:美国bd公司;
冻存管:美国bd公司;
移液管:美国corning公司;
枪头盒、ep管、pcr管:美国axygen公司;
主要仪器——
电动移液器、可调式移液器、低温高速离心机:德国eppendorf公司生产;
细胞培养孵箱、生物安全柜、液氮罐:美国thermo科学公司;
-80℃生物超低温冰箱:美国thermo科学公司;
超净工作台:苏州金净公司;
37℃细菌培养箱、烤箱:中国精宏公司;
倒置荧光显微镜:日本olympus公司;
掌上离心机:美国thermofisherscientific公司;
高压灭菌锅、-20℃生物冰箱、4℃生物冰箱:中国海尔公司;
碎冰制冰机:日本sanyo公司;
计算机:中国联想公司;
nanodrop2000分光光度计:美国thermoscientific公司;
电磁搅拌器、酶联免疫检测仪:美国thermoscientific公司。
2.实验方法
2.1细胞增殖实验(mts)
(1)取对数生长期细胞,加入dpbs清洗细胞,弃掉dpbs后加入0.25%胰酶进行消化,当细胞欲脱离瓶壁时加入含10%胎牛血清的完全培养基终止消化,用移液枪吸取培养液将细胞从培养瓶壁上吹打下来,转移至15ml离心管中,放入离心机中离心,1000转/分钟,离心3分钟,弃去上清,加入完全培养基重悬、混匀,进行细胞计数,将细胞重悬后调整密度为2×104个/ml,接种于96孔板,每孔加入100μl细胞悬液,即每个孔2000个细胞,每组设置3个复孔,共设5个给药梯度组(37.5,50,75,100,150μg/m1),以及培养液对照组、dmso对照组。置于37℃,5%co2恒温孵箱中进行常规培养。
(2)配置待测药物母液:用分析天平称取待测药物溶于dmso中配成100mg/ml的母液,设置超声仪水浴温度60℃,超声溶解,并用0.22μm尼龙过滤筛过滤后分装于ep管,保存于-20℃。
(3)细胞培养过夜后,每组细胞分别加入不同浓度梯度的桐花树叶石油醚部位提取物(37.5,50,75,100,150μg/ml),对照组加入等体积的含对应浓度dmso的完全培养基,以及单独只含完全培养基的对照组。继续培养24、48、72h。
(4)分别在培养24、48、72h后,用排枪于每孔加入20μl完全融化后的celltiter96aqueousonesolutionreagent,然后将细胞放回培养箱中继续培养2h,于酶标仪上在490nm波光处处读取吸光度值。将无细胞仅含培养基的孔作为空白孔扣除由于药物颜色产生的误差。并用软件计算细胞生长抑制率,其公式为:
(5)以上实验重复3次,用spss21检验统计分析,与空白组相比,p<0.01,差异有显著性;并用graphpadprism5作线性图,求出ic50。
2.2单细胞克隆形成实验
(1)将对数生长期的细胞常规消化,加入含10%胎牛血清的完全培养基终止,转移细胞到15ml离心管,置于离心机离心。弃掉上清液,加入新鲜完全培养基重悬细胞,吹打均匀,尽量使细胞充分分散,使分散度达到95%以上。进行细胞计数,调整细胞浓度为400个/ml,每孔接种1ml于6孔板中,培养过夜。
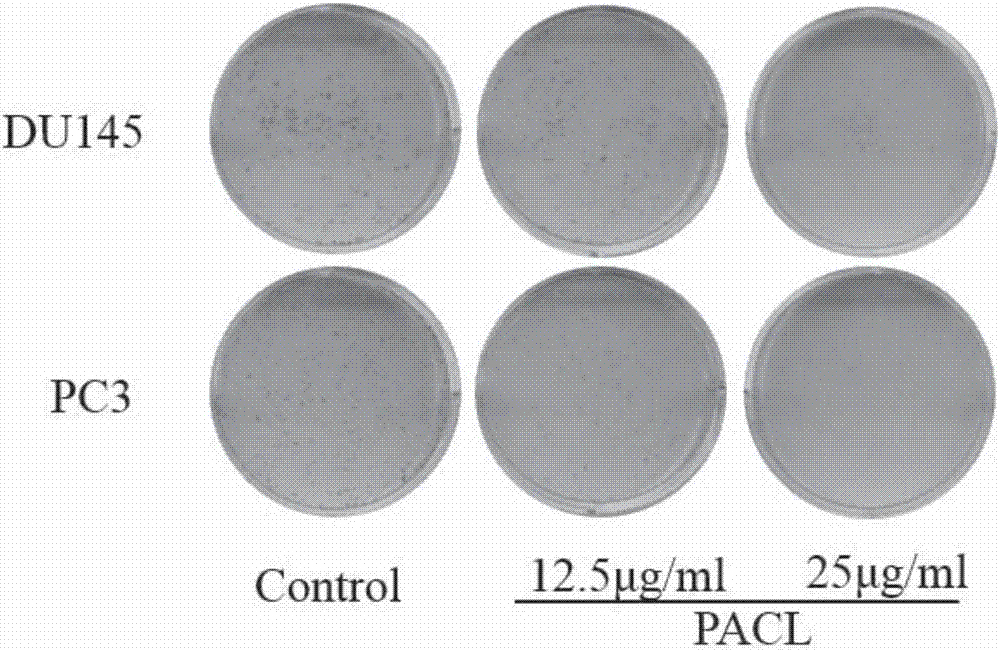
(2)第二天加入桐花树叶石油醚部位提取物进行处理,设两个药物浓度,分别为12.5,25μg/ml,另设一个空白组(完全培养液)。
(3)细胞经药物作用4天后,弃掉培养液,重新给予同样的药物。
(4)当有细胞团交合时,弃掉培养液,加dpbs缓冲液清洗两次,然后用4%的多聚甲醛固定15min。
(5)吸弃多聚甲醛,用结晶紫染色液染色35min。
(6)回收结晶紫,用dpbs缓冲液清洗细胞两次,弃掉dpbs缓冲液,待孔板晾干后,用扫描仪扫描六孔板。
(7)用spss21检验统计分析本实验重复三次的结果,与空白组相比,p<0.01,差异有显著性,并用graphpadprism5作柱状图;
统计学分析
应用spss统计软件处理分析数据,进行组间比较,*,p<0.05,差异具有统计学意义,**,p<0.01差异具有显著性统计学意义。
3.实验结果
3.1细胞增殖实验结果
桐花树叶石油醚部位提取物对人前列腺癌细胞pc3,du145的增殖具有抑制作用,其ic50如表1所示,细胞活性曲线如图1所示。
表1桐花树叶石油醚部位提取物作用于癌细胞的ic50(μg/ml)
3.2单细胞克隆形成实验结果
桐花树叶石油醚部位提取物可明显抑制人前列腺癌细胞pc3,du145的克隆形成,并与给药浓度呈浓度依赖性。du145细胞的对照组克隆形成率为22.75%,高、低浓度给药组克隆形成率分别为6.25%、22.25%;pc3细胞的对照组克隆形成率为30.25%,高、低浓度给药组克隆形成率分别为4.42%、11.00%。细胞克隆形成数如图2和图3所示。
- 还没有人留言评论。精彩留言会获得点赞!