碳纳米管复合薄膜电极和仿生型心肌组织及其培育方法与流程
本发明涉及一种碳纳米管复合薄膜电极、本发明还涉及一种仿生型心肌组织、本发明还涉及仿生型心肌组织的培育方法,属于组织工程领域。
背景技术:
心肌梗死又叫心肌梗塞,是由于冠状动脉闭塞,血流中断,导致分心肌因严重的持续性缺血而发生局部坏死。坏死的心肌逐渐被纤维瘢痕组织替代,引发心室重构,最终导致心力衰竭甚至猝死。目前临床所采用的治疗方法包括药物治疗、介入治疗、溶栓治疗、冠状动脉旁路手术,尽管能够延缓心室重构,改善心功能,但无法从根本上修复受损心肌、阻断病程进展。心脏移植则由于供体来源有限及免疫排异反应,无法满足临床需求。为解决上述难题,研究人员提出组织工程心脏补片概念。即在实验室培育多功能心脏组织,在患者出现心力衰竭之前替换受损组织,从而修复心脏的结构和功能。心肌组织工程研究包括3个方面:种子细胞、支架材料和组织构建与移植,经过多年研究已获得许多技术突破。各类天然及化学合成高分子材料显示出较好的生物相容性,且对细胞活动有一定程度的调节作用。然而,多功能心脏补片从实验室真正走向临床应用,还有诸多问题亟待解决。特别是心肌组织具有独特的电生理特性,而且心肌细胞在心脏的浅、中、深三层呈不同方向取向延伸,电信号在其中快速有序传导引起心脏同步收缩。传统的心肌补片培育方案难以充分模拟心肌的取向性结构及电信号传导功能。
技术实现要素:
本发明的目的在于提供一种碳纳米管复合薄膜电极和仿生型心肌组织及其培育方法,以解决上述问题。
本发明采用了如下技术方案:
本发明提供一种碳纳米管复合薄膜电极,其特征在于,包括:相互贴合的碳纳米管薄膜和基底层,所述碳纳米管薄膜中的碳纳米管具有高取向性。
进一步,本发明的碳纳米管复合薄膜电极,还可以具有这样的特征:其中,所述基底层为柔性的不导电高分子薄膜,材料为硅橡胶,聚四氟乙烯、聚乙烯和聚氯乙烯的其中一种。
进一步,本发明的碳纳米管复合薄膜电极,还可以具有这样的特征:其中,所述碳纳米管薄膜中,包括3~10层的单层碳纳米管。
进一步,本发明的碳纳米管复合薄膜电极,还可以具有这样的特征:其中,所述碳纳米管薄膜和所述基底层的厚度之和的范围是≥50μm,≤200μm。
本发明还提供一种仿生型心肌组织,包括如上述任意一项所述的碳纳米管复合薄膜电极,其特征在于,包括:从上到下依次排列的心肌细胞层,碳纳米管薄膜,以及基底层,其中,心肌细胞层中的心肌细胞的生长方向与取向碳纳米管薄膜的方向一致。
进一步,本发明的仿生型心肌组织,还可以具有这样的特征:其中,所述基底层使用玻璃片代替柔性的不导电高分子薄膜。
本发明还提供一种仿生型心肌组织的培育方法,其特征在于,包括如下步骤:
步骤一,制备高度取向碳纳米管薄膜,作为体外培育心肌细胞的基底;
步骤二,将碳纳米管薄膜贴附在玻璃片或不导电高分子薄膜上;
步骤三,分离心肌细胞、将心肌细胞接种到碳纳米管薄膜上。
进一步,本发明的仿生型心肌组织的培育方法,还可以具有这样的特征,还包括:步骤四、向心肌细胞实施模拟心脏的电脉冲刺激。
进一步,本发明的仿生型心肌组织的培育方法,还可以具有这样的特征:其中,电脉冲刺激的电压为2~6v/cm,脉冲宽度为2ms;脉冲频率为60~150bmp。
进一步,本发明的仿生型心肌组织的培育方法,还可以具有这样的特征:其中,电脉冲刺激通过碳纳米管薄膜向心肌细胞施加。
发明的有益效果
本发明的碳纳米管复合薄膜电极和仿生型心肌组织及其培育方法,由于采用了高度取向性的碳纳米管作为心肌细胞培育支架材料,使得心肌细胞在碳纳米管上形成了类似心肌组织的取向性生长。因此本发明所提供的仿生型心肌组织可充分模仿心肌细胞取向性的微观结构。进一步,由于碳纳米管具有良好的导电性,因此能够为细胞间电信号的传递提供有效的联接通路,使得本发明的仿生型心肌组织具有替代传统高分子细胞培育支架材料,构建多功能仿生心脏补片的应用潜力。
附图说明
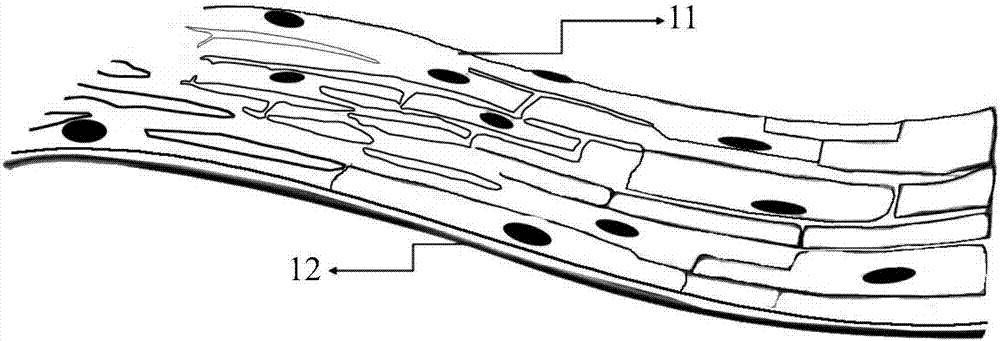
图1为仿生型心肌组织的结构示意图;
图2为制备出的取向碳纳米管的电镜图;
图3a为取向碳纳米管引导心肌细胞取向生长的荧光显微镜照片,培育第3天时的荧光显微镜照片;
图3b为培育第7天时的荧光显微镜照片;
图3c为培育第7天时,荧光显微镜下同时打开白光的照片,可见细胞伸展方向与碳纳米管取向方向一致。
图4a为显微镜下观察到的依附于取向碳纳米管薄膜上的三簇细胞,标尺:500μm;
图4b为这三簇细胞的自发搏动曲线;
图4c通过碳纳米管薄膜对这些细胞施加起搏信号之后,这三簇细胞相应起搏频率(60bpm及100bpm)的搏动变化曲线;
图5是将柔性电极紧密贴附心脏的照片;
图6是通过柔性电极同时起搏三个心脏的照片。
具体实施方式
以下结合附图来说明本发明的具体实施方式。
1.碳纳米管复合薄膜电极
1.1碳纳米管薄膜的制备方法:
根据已有技术方法制备高度取向碳纳米管膜,即通过化学气相沉积法制备碳纳米管阵列,再通过干法纺丝制备得相应的纤维和膜。制备方法是:先在一个石英管式炉中,以镀有fe(1.2nm)/al2o3(3nm)的硅片作为催化剂,以乙烯气体作为碳源,以高纯氩气和高纯氢气混合气作为载气,升温至740摄氏度,碳纳米管开始生长。生长时间控制在10-20分钟,冷却至室温。得到可纺碳纳米管阵列后,用一个刀片从碳纳米管阵列的边缘拉出单层的与阵列同宽的碳纳米管膜。直接拉出的碳纳米管薄膜显示高度取向性,显微镜下观测有显著的取向性结构。使用这种方法制备出这样的碳纳米管膜,称为super-alignedcarbonnanotubesheet,即高度取向性碳纳米管。制备好的高度取向性碳纳米管如图2所示。本发明的研究发现,干法纺丝技术制备的具有高度取向性的碳纳米管薄膜,具有极轻的质量、良好的柔韧性及自支撑性、多孔粗糙的表面、优异的导电性及纳米尺度上的可调控性。
1.2碳纳米管薄膜与基底复合形成碳纳米管复合薄膜电极
干法纺丝直接拉出的取向碳纳米管薄膜直接置于基底上。
基底分为非柔性基底和柔性基底。非柔性基底可采用细胞培养的盖玻片或玻璃片。柔性基底采用不导电高分子薄膜,包括硅橡胶,聚四氟乙烯、聚乙烯、聚氯乙烯等。
基底厚度在10-1000μm之间,小于200μm最佳;基底尺寸根据培养皿尺寸,或需要起搏的哺乳动物心脏大小调控,在0.2*0.2cm2及2*2cm2间可无比例约束随意变化。
由于静电吸引及范得华力作用,取向碳纳米管薄膜对上述基底均有很好的帖附性质。也可滴加少量无水乙醇,自然挥干起到更好的固定作用。基底上的碳纳米管薄膜可多层叠加。一般叠加层数在3-10层之间。单层的薄膜相当于单根碳纳米管组成的纳米栅,薄膜厚度仅为10纳米左右。碳纳米管之间会有很多缝隙。而且也比较脆弱,弯折的时候容易碎裂。多层可以有效改善这个问题。更重要的是,单层薄膜电阻较大,通过多层叠加来提高薄膜的电导率。也同时提高可操控性。
柔性基底上的取向碳纳米管薄膜可90度弯折而不会脱落或破碎。先取向碳纳米管所在一侧内向弯折500次,薄膜导电率几乎不发生变化。外向弯折时,第一次弯折会造成20%的电导率降低,随后继续外向弯折到500次,电导率不再产生显著降低。内向弯曲和外向弯曲的区别如下:碳纳米管薄膜帖附在柔性的基底上,向着碳纳米管薄膜这面弯曲,叫内向弯曲,向着基底那面弯曲,叫外向弯曲。更形象的,当碳纳米管在上,柔性基底在下,u形就是内向弯曲,n形就是外向弯曲。
取向碳纳米管薄膜帖附在柔性不导电高分子上制成碳纳米管复合薄膜,可应用于起搏器的电极。根据所需要起搏的器官大小将碳纳米管复合薄膜剪裁成合式的大小。碳纳米管复合薄膜显示出良好的柔性,可多角度弯曲而结构不发生明显变化。碳纳米管复合薄膜厚度控制在10-1000μm之间,碳纳米管层厚度小于1μm,可忽略不计。主要调控不导电高分子层厚度。高分子薄膜可直接购买厚度定制的商业生产的硅橡胶,聚四氟乙烯、聚乙烯、聚氯乙烯等薄膜。也可购买商业配制的前驱体溶液及引发剂,在实验室按产品说明书比例自行混合后倒入底部平滑的容器成膜。碳纳米管复合薄膜厚度小于200μm最佳,此时可紧密贴合柔软的组织器官表面。但是薄膜厚度太薄将增加转移操作难度,所以厚度一般大于50μm。
所制备取向碳纳米管复合薄膜电极,可同步起搏多个离体心脏。一个典型的例子如附图6所示:3个1-3天的乳鼠心脏被取出并经过台式液灌洗,放置在不导电平台上。使取向碳纳米管复合膜柔性电极同时覆盖三个心脏,显示出良好的贴合性。连接起搏器,三个心脏在2ms,5-10v,1-3hz条件下均可同步起搏。起搏情况可通过心室肌单项动作电位实时监测。另一方面,在麻醉条件下对试验小鼠进行显微镜下开胸手术,将柔性电极直接贴附在心脏表面,复合电极也可成功起搏心脏。上述实验结果显示出,本发明制备的柔性取向碳纳米管复合膜电极,在心脏同步起搏中具有进一步应用开发的潜力。
2.仿生型心肌组织
结构如图1所示,仿生型心肌组织包括:心肌细胞层11和碳纳米管复合薄膜电极12。心肌细胞层11覆盖在碳纳米管复合薄膜电极12上。
3.仿生型心肌组织的培育方法
根据本领域常规方法获得分离的哺乳动物心肌细胞,或通过市售途径及保藏机构获得。以典型的sd大鼠乳鼠心肌细胞培养体系为例。心肌细胞分散在对应的常规细胞培养液中,接种于底部铺有取向碳纳米管薄膜的细胞培养皿或培养瓶中。典型的方法中使用细胞培养六孔板,每个孔底部放置一片铺有取向碳纳米管薄膜的1.5*1.5cm2盖玻片。细胞种植量为1×106个细胞/孔。细胞的种植浓度可以调整,培养皿放置在常规的如37℃/5%二氧化碳培养箱中。心肌细胞自主沉降帖附在取向碳纳米管薄膜表面,自动感知取向碳纳米管薄膜表面拓扑结构并依附其取向性生长。细胞在培育第3天即显示出明显的沿碳纳米管取向方向伸长的形貌特征,如图3a、图3b和图3c所示。细胞生长情况通过免疫荧光染色后荧光显微镜图像观测。可见心肌细胞均显现取向性生长的形态。
取向碳纳米管薄膜对心肌细胞取向性生长具有显著的引导作用。细胞培育第7天,细胞体积增大,出现明显的肌节横纹,说明细胞结构趋于成熟。但是细胞的取向性形貌依然良好保持。可通过常规免疫荧光染色检测到明显的细胞间连接蛋白cx43表达。cx43对相邻细胞间信号的传递具有重要作用。取向性生长的心肌细胞表达的cx43也呈侧壁化分布,沿着细胞边缘显示出取向性的排列方式。
取向碳纳米管具体有良好的导电性。本发明中在细胞培养过程中,即细胞贴壁完全,第三天的时候,通过将取向碳纳米管薄膜基底连接外部信号发射器,对细胞进行持续的脉冲电刺激。电刺激范围:起搏电压2-6v/cm;脉宽,2ms;频率,60-150bpm。为了防止漏电,外电路与取向碳纳米管薄膜的连接部分使用不导电高分子,如硅橡胶,进行保护。确保电信号通过取向碳纳米管基底传入培育中的心肌细胞。通过热成像仪观察到,对细胞培养体系持续通电不会造成额外的发热现象。和无电刺激相比,电刺激培养也未带来明显的细胞凋亡数量的增加。另一方面,电刺激辅助培养提升了cx43的表达量(比未刺激高30-50%)。电刺激对取向碳纳米管上细胞的形貌没有显著影响。
无论是否通电,通过取向碳纳米管培育的心肌细胞,均能够显示出明显的同步自发搏动现象,sd大鼠乳鼠心肌细胞在培育第3天同步自发搏动频率约为80~200bpm,如图3a,b所示。在培养后3-4天,通过膜片钳技术针对培养的心肌细胞进行原位的电生理学评估,显示出取向碳纳米管薄膜可以促进乳鼠心肌细胞的电生理特性的成熟。电生理特性的成熟的标准是:静息电位-70~-80mv,动作电位幅度90~110mv,动作电位复极90%时程(apd90)130~160ms);同时取向碳纳米管薄膜还可以降低不同心肌细胞之间、同一心肌细胞连续多次搏动之间的电生理异质性(apd30和apd90异质性较盖玻片降低60~80%)。通过取向碳纳米管薄膜基底,可对所有细胞进行同步起搏,如图4c所示。图4a为显微镜下观察到的依附于取向碳纳米管薄膜上的三簇细胞,标尺:500μm;图4b为这三簇细胞的自发搏动曲线;图4c通过碳纳米管薄膜对这些细胞施加起搏信号之后,这三簇细胞相应起搏频率(60bpm及100bpm)的搏动变化曲线。
如图5所示,按照本发明的方法提供的仿生型心肌组织,能够很好的贴附在心肌上,实现体内起搏的效果。
综上所述,本发明首次提出利用碳纳米管复合膜可以引导心肌细胞取向生长,模拟天然心脏的微观心肌结构,增加心肌细胞间的连接蛋白表达和侧壁化,并为心肌细胞间电信号的快速传导提供物理通道。同时,碳纳米管复合膜促进乳鼠心肌细胞电生理特性的成熟,降低心肌细胞复极离散度,有助于碳纳米管复合膜上的所有心肌细胞产生自发、规律的搏动,避免心律失常的发生。电刺激协同碳纳米管复合膜可以促进乳鼠心肌细胞的成熟。体内外起搏试验还显示,轻薄、弹性极佳的单片式碳纳米管复合膜电极还具有优良的组织附着和起搏功能。因此,该碳纳米管复合膜在心梗后心脏修复治疗和伴有传导阻滞的心梗后心衰的心脏再同步化治疗中有着广泛的应用前景。
- 还没有人留言评论。精彩留言会获得点赞!