短梗五加果多酚的应用的制作方法
本发明涉及短梗五加果多酚的应用。
背景技术:
细胞黏附分子(celladhesionmolecules,cam)是介导细胞与细胞或细胞外基质间的黏附和相互作用的跨膜蛋白,在高脂血症、高血压和糖尿病等病理情况下,cam刺激白细胞募集进入血管内皮是动脉粥样硬化发病机制中的重要一步。目前市面上缺乏选择性抑制cam表达和活化的药物。现有药物如他汀类、抗血小板、抗炎或免疫抑制药物、抗氧化剂和天然植物中的一些化合物能够抑制炎症引起的cams的表达,但抗cam的作用机制尚不清楚。短梗五加果中含有咖啡酸、金丝桃苷、槲皮素没食子酸、对羟基苯乙醇等多种多酚成分,多酚类成分的功能研究主要集中在抗氧化、抗炎、抗疲劳、抗血栓和抗血小板凝集等方面。
技术实现要素:
本发明的目的是提供短梗五加果多酚的一种药物新用途。
本发明所提供的短梗五加果多酚的药物新用途是其在制备产品中的应用;所述产品的功能为如下(a1)和/或(a2)和/或(a3)和/或(a4)和/或(a5):
(a1)降低炎症因子水平;
(a2)降低细胞黏附分子水平;
(a3)降低炎症因子诱导的细胞黏附分子的分泌水平;
(a4)降低炎症因子诱导的细胞黏附分子蛋白表达;
(a5)抑制p38mapk信号通路下调黏附分子的表达。
上述应用中,所述产品可为功能性食品、保健品或药品。
所述功能性食品具体可为功能性饮料、功能性糕点等。
所述短梗五加果多酚可按照包括下述步骤的方法制备得到:
(1)将短梗五加果粉碎,分别用短梗五加果质量10倍、8倍50%的乙醇(体积分数)回流提取(即先用10倍的50%的乙醇提取,再用8倍的50%的乙醇提取),合并提取液,抽滤,滤液减压回收乙醇后冻干,得到短梗五加果粗多酚粗品;
(2)采用d101大孔树脂柱对所述短梗五加果粗多酚粗品进行纯化,依次用蒸馏水、30%(体积分数)、50%、70%和95%的乙醇洗脱,收集50%乙醇洗脱下的洗脱液,回收乙醇,减压浓缩后冻干,即得短梗五加果多酚(asfp)。
上述方法步骤(1)中,所述短梗五加果为干燥的短梗五加果。
所述回流提取的温度为80℃,时间为1h。
上述方法步骤(2)中,采用d101大孔树脂柱对所述短梗五加果粗多酚粗品进行纯化时,最大上样量即物料(即短梗五加果粗多酚溶液的质量)与大孔树脂质量比为7:10;最佳上样液浓度为3.5mg/ml;最佳上样速率为2.5mg/min;最佳洗脱剂为体积分数为50%的乙醇;最佳洗脱剂流速为2.5ml/min;最佳洗脱剂用量为5bv。
本发明还保护一种产品,其含有短梗五加果多酚;所述产品的功能为如下(a1)和/或(a2)和/或(a3)和/或(a4)和/或(a5)中的至少一种:
(a1)降低炎症因子水平;
(a2)降低细胞黏附分子水平;
(a3)降低炎症因子诱导的细胞黏附分子的分泌水平;
(a4)降低炎症因子诱导的细胞黏附分子蛋白表达;
(a5)抑制p38mapk信号通路下调黏附分子的表达。
所述产品可为功能性食品、保健品或药品。
所述功能性食品具体可为功能性饮料、功能性糕点等。
本发明的短梗五加果多酚是从短梗五加果成熟果实中提取获得,其具有抑制细胞黏附分子表达的作用,可广泛用于食品、保健食品和医药健康领域。
附图说明
图1为短梗五加果多酚样品和绿原酸标准品的吸收光谱。
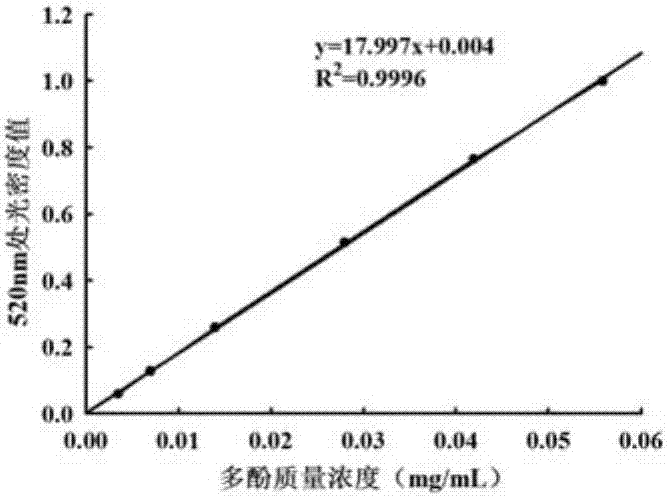
图2为短梗五加果多酚质量浓度测定标准曲线。
图3为不同型号的大孔吸附树脂静态吸附率和解吸率。
图4为上样量对树脂吸附多酚效果的影响。
图5为上样液浓度对树脂吸附多酚效果的影响。
图6为上样速率对树脂吸附多酚效果的影响。
图7为洗脱剂浓度对多酚解吸效果的影响。
图8为洗脱剂流速对多酚解吸效果的影响。
图9为洗脱剂用量对多酚解吸效果的影响。
图10为不同浓度的tnf-α对细胞存活率的影响。
图11为不同浓度的短梗五加果多酚对细胞存活率的影响。
图12为短梗五加果多酚对tnf-α诱导的人脐静脉内皮细胞中vcam-1、icam-1分泌水平的影响,图中“-”表示未加入;“+”表示加入。
图13为短梗五加果多酚对tnf-α诱导人脐静脉内皮细胞中vcam-1和icam-1蛋白表达的影响,图中“-”表示未加入;“+”表示加入。
图14为短梗五加果多酚对tnf-α诱导的人脐静脉内皮细胞中p-p38、p38、p-erk1/2和erk1/2蛋白表达的影响,图中“-”表示未加入;“+”表示加入。
图15为短梗五加果多酚对tnf-α诱导的人脐静脉内皮细胞中nf-κbp65、p-nf-κbp65和iκb蛋白表达的影响,图中“-”表示未加入;“+”表示加入。
具体实施方式
下面通过具体实施例对本发明进行说明,但本发明并不局限于此。
下述实施例中所使用的实验方法如无特殊说明,均为常规方法;下述实施例中所用的试剂、生物材料等,如无特殊说明,均可从商业途径得到。
下述实施例中所采用的短梗五加果购自丹东五加高新农业科技开发有限公司,为短梗五加(acanthopanaxsessiliflorus(ruqr.etmaxim)seem.)的干燥成熟果实;人脐静脉内皮细胞,美国sciencell公司。
用于提取肠组织蛋白的ripa裂解液(货号:wb-0071)和bca蛋白定量试剂盒(货号:bca02),购自北京鼎国昌盛生物技术有限公司;
tnf-α抗体(货号:t6674)购自sigma公司
vcam-1(货号:bpe10104)、icam-1(货号:bpe10163)elisa检测试剂盒购自上海朗顿生物技术公司;
下述实施例中所采用的绿原酸标准品购自中国食品药品检定研究院;d101大孔吸附树脂购自天津精细化工研究所。
实施例1、短梗五加果多酚的提取与纯化
一、短梗五加果多酚的提取及含量测定
称取100g干燥的短梗五加果粉粹后分别用10倍、8倍50%乙醇(体积分数)80℃回流提取2次,每次1h,合并提取液,抽滤,滤液减压回收乙醇后冻干,得到短梗五加果粗多酚粗品。
硝酸铝络合法测定短梗五加果中多酚的含量,具体步骤如下:
(1)对照品溶液的制备及检测:
精确称取绿原酸标准品约5.0mg,置于小烧杯中加适量蒸馏水超声溶解,加蒸馏水定容至25ml,作为测定总酚的对照品溶液。
分别取绿原酸对照品溶液0、0.5、1.0、2.0、4.0、6.0、8.0ml,,加入5%(质量分数)亚硝酸钠溶液1ml,充分混匀,静置6min;加入10%(质量分数)硝酸铝溶液10ml混匀后静置6min;再加入4%(质量分数)氢氧化钠溶液8ml,静置15min;加入蒸馏水定容至25ml,充分混匀,配制成不同质量浓度的对照品溶液。
(2)供试品溶液的制备及检测:
精密称取短梗五加果提取物2.5mg、5.0mg,置于小烧杯中加适量蒸馏水超声溶解,定容至25ml。量取5ml溶液,加入5%(质量分数)亚硝酸钠1ml,充分混匀,静置6min;加入10%硝酸铝溶液10ml充分混匀,静置6min;加入4%(质量分数)氢氧化钠溶液8ml,充分混匀,静置15min;最后蒸馏水定容至25ml容量瓶中,充分混匀,配制成短梗五加果提取物供试品溶液。
(3)检测波长的选择:
将上述经硝酸铝显色的绿原酸对照品溶液和短梗五加果提取物供试品溶液用紫外-可见分光光度计进行波长扫描(波长范围:200~800nm),确定最佳检测波长。
(4)样品含量的测定:
最佳检测波长下检测各对照品溶液和供试品溶液,绘制标准曲线法,计算各供试品中多酚的含量。
图1样品和绿原酸标准品的吸收光谱
短梗五加果多酚样品和绿原酸标准品经硝酸铝络合处理后在200~800nm处的波长扫描图谱如图1所示,绿原酸标准品在520nm处有一个比较明显的吸收峰,此处样品的峰型较为平缓,故选择520nm作为测定短梗五加果多酚含量的检测波长。
图2多酚质量浓度测定标准曲线
短梗五加果多酚的标准曲线方程为:y=17.99x+0.004,r2=0.9996。其中x表示样品多酚质量浓度(mg/ml),y表示样品在520nm下的吸光度值。结果表明,绿原酸浓度在4.08~65.28ug/ml内线性关系良好。根据短梗五加果多酚溶液光密度值(520nm处)和标准曲线计算可得:短梗五加果粗多酚冻干粉中多酚质量分数为8.4%,大孔树脂纯化后的短梗五加果多酚的质量分数为46.3%。
二、短梗五加果多酚的纯化
1.大孔树脂型号的筛选
选取ab-8、d101、xda-6、hpd100c、d1400、dm-21六种大孔吸附树脂,用乙醇浸泡过夜,再用蒸馏水洗至无醇味;用5%(体积分数)盐酸浸泡4h,蒸馏水洗至中性;用4%(m/v)氢氧化钠浸泡4h,水洗至中性,蒸馏水浸泡,备用。
2.大孔吸附树脂的静态吸附-解吸试验
分别称取已处理好的6种树脂1.0g,置于50ml锥形瓶中,加入40%(质量分数)的粗多酚水溶液20ml,密封后在25℃下振荡吸附24h,抽滤,分别测定经6种树脂吸附后的溶液中多酚的含量并计算大孔吸附树脂的静态吸附率.
将吸附后的大孔树脂置于50ml锥形瓶中,加入50%(体积分数)乙醇溶液20ml,密封后在25℃下振荡解吸24h,抽滤,分别测定6种树脂解吸液中多酚的含量并计算大孔吸附树脂的静态解吸率。选取吸附率与解吸率均较高的大孔吸附树脂进行纯化工艺研究。
图3不同型号的大孔吸附树脂静态吸附率和解吸率
如图3所示,d101和hpd100c对短梗五加果多酚的吸附率较高,分别达到75.8%和71.1%,说明这2种树脂对短梗五加果多酚的吸附性能均较好;而d101、xda-6和dm-21对大孔吸附树脂的解吸附能力较强,分别达到82.6%、79.8%和85.2%。大孔吸附树脂的选择既要求有良好的吸附性能以提高目标成分的富集,又要求有较强的解吸性能以减少树脂中目标成分的残留引起的损失和树脂吸附性能的下降。综合考虑吸附率和解吸率,选取d101大孔吸附树脂用于纯化短梗五加果多酚的大量制备和纯化工艺的研究。
3.大孔吸附树脂的动态吸附-解吸试验
3.1大孔吸附树脂最大上样量的确定
称取20g预处理好的大孔吸附树脂,湿法装柱(φ2cm×50cm),配置足量的一定质量浓度的短梗五加果粗多酚溶液,以1.0ml/min的流速通过大孔吸附树脂柱,自动收集器收集洗脱液,每5ml一管,检测每管洗脱液中多酚浓度,当流出液中多酚浓度为吸附前溶液中粗多酚浓度的十分之一(即达到泄漏点)时,此时通过大孔吸附树脂柱的粗多酚溶液的质量即为最大上样量。
图4上样量对树脂吸附多酚效果的影响
由图4可知,随着上样量的增加,洗脱液中多酚浓度逐渐增加,当物料与大孔吸附树脂质量之比为7:10时,洗脱液的浓度恰好为初始上样液浓度的10%(即达到泄漏点),即为最大上样量。增加上样量会因大孔吸附树脂吸附多酚量已达饱和而造成样品的浪费或大孔吸附树脂再生困难。故最大上样量为物料与大孔树脂质量比为7:10。
3.2上样液浓度对大孔吸附树脂吸附率的影响
称取20g预处理好的大孔吸附树脂,湿法装柱(φ2cm×50cm),分别加入浓度为0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0mg/ml的粗多酚溶液100ml,以1.0ml/min的流速让样品溶液全部通过大孔吸附树脂柱,测定吸附后溶液中的多酚含量并计算大孔吸附树脂的吸附率,选出最佳上样液浓度。
图5上样液浓度对树脂吸附多酚效果的影响
由图5可知,起始时,随着短梗五加果粗多酚上样液浓度的增加,多酚的吸附率逐渐升高,在上样液的浓度为3.5mg/ml时,短梗五加果多酚的吸附率达到最大值75.7%;增加上样液浓度,大孔吸附树脂对短梗五加果多酚的吸附率逐渐下降,可能是由于浓度较大的多酚与大孔吸附树脂上羟基等基团的吸附趋于饱和状态,或是多酚溶液中杂质与大孔吸附树脂的竞争吸附所致。综合考虑选取3.5mg/ml作为最佳上样液浓度。
3.3上样速率对大孔吸附树脂吸附率的影响
称取20g预处理好的大孔吸附树脂,湿法装柱(φ2cm×50cm),在上述确定的工艺条件下,上样100ml粗多酚溶液,分别以0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0ml/min的流速上样,待样品溶液全部通过大孔吸附树脂后,测定洗脱液中的多酚含量并计算大孔吸附树脂的吸附率,选出最佳上样速率。
图6上样速率对树脂吸附多酚效果的影响
由图6可知,随着短梗五加果粗多酚上样速率的增加,大孔树脂对多酚的吸附率呈逐渐下降趋势,上样速率在0.5~2.5ml/min时,短梗五加果多酚的吸附率下降较为平缓;上样速率在2.5~4.0ml/min时,短梗五加果多酚的吸附率快速下降。综合考虑时间、成本等因素,选取2.5mg/min作为最佳上样液浓度。
3.4乙醇浓度对大孔吸附树脂解吸率的影响
称取20g预处理好的大孔吸附树脂,湿法装柱(φ2cm×50cm),在上述确定的工艺条件下,上样100ml粗多酚溶液,待样品溶液全部通过大孔吸附树脂后,分别用蒸馏水、10%(体积分数)乙醇、30%乙醇、50%乙醇、70%乙醇、90%乙醇洗脱,并测定解吸液中的多酚含量,计算解吸率,选出最佳乙醇浓度。
图7洗脱剂浓度对多酚解吸效果的影响
由图7可知,随着乙醇体积分数的增加,短梗五加果多酚的解吸率表现出逐渐上升的趋势:乙醇体积分数在0~50%(体积分数)时,短梗五加果多酚的解吸率快速升高,可能是由于短梗五加果多酚与具有一定极性的乙醇溶液结合,大量的置换大孔吸附树脂中的多酚;继续增加乙醇体积分数,短梗五加果多酚的解吸率持续上升,但上升较缓慢。高效性及成本的角度综合考虑,选取体积分数为50%(体积分数)的乙醇作为最佳洗脱剂浓度。
3.5洗脱剂流速对大孔吸附树脂解吸率的影响
称取20g预处理好的大孔吸附树脂,湿法装柱(φ2cm×50cm),在上述确定的工艺条件下,上样100ml粗多酚溶液,待样品溶液全部通过大孔吸附树脂后,分别用500ml50%(体积分数)乙醇溶液以0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0ml/min的速度洗脱,测定解吸液中的多酚含量,计算解吸率,选出最佳洗脱剂流速。
图8洗脱剂流速对多酚解吸效果的影响
由图8可知,随着洗脱液流速的增加,短梗五加果多酚的解吸率表现出逐渐下降的趋势,洗脱液的流速在0.5~2.5(ml/min)时,短梗五加果多酚的解吸率缓慢下降,可能是由于较低流速时,洗脱液能充分与大孔吸附树脂中的多酚接触,从而快速的将多酚洗脱;增加洗脱液流速,短梗五加果多酚的解吸率迅速下降,可能是由于洗脱液的流速较快,不能充分的与大孔吸附树脂中的多酚接触,导致部分多酚残留在大孔吸附树脂中,但较低流速会导致处理周期的延长,不利于实际生产,故选取2.5ml/min作为最佳洗脱剂流速。
3.6洗脱剂用量对大孔吸附树脂解吸率的影响
称取20g预处理好的大孔吸附树脂,湿法装柱(φ2cm×50cm),在上述确定的工艺条件下,上样100ml粗多酚溶液,待样品溶液全部进入大孔吸附树脂后,用6倍树脂床体积(bedvolume,bv)的50%(体积分数)乙醇洗脱,每1bv收集一次解吸液,测定第1~6bv解吸液中的多酚含量并计算各bv解吸率,选出最佳洗脱剂用量。
图9洗脱剂用量对多酚解吸效果的影响
由图9可知,随着洗脱剂用量的增加,短梗五加果多酚的解吸率呈先上升后下降的变化趋势:洗脱剂的用量在1~4bv时,短梗五加果多酚的解吸率快速上升,当洗洗脱剂的用量为4bv时,洗脱后的溶液中多酚的解吸率达到最大值81.0%,增加洗脱剂的用量至5bv时,短梗五加果多酚的解吸率迅速下降至13.1%,继续增加洗脱剂的用量大孔吸附树脂对多酚的解吸率变化不大,考虑多份回收率、成本及操作时间,选取5bv作为最佳洗脱剂用量。
4.短梗五加果多酚的纯化方法
短梗五加果粗多酚粗品参照上述工艺选用d101大孔树脂柱进行纯化,依次用蒸馏水、30%(体积分数)、50%、70%和95%的乙醇洗脱,收集50%乙醇洗脱下的洗脱液,回收乙醇,减压浓缩后冻干即得短梗五加果多酚(acanthopanaxsessiliflorus(ruqr.etmaxim)seem.fruitpolyphenol,asfp)。
实施例2、短梗五加果多酚对tnf-α诱导人脐静脉内皮细胞中黏附分子的影响
人脐静脉内皮细胞(英humanumbilicalveinendothelialcells,huvec)
一、原代人脐静脉内皮细胞的培养
细胞复苏后接种于含5%(体积分数)热灭活的胎牛血清的内皮细胞培养液中,置于37℃、5%(体积分数)co2的细胞培养箱中进行培养。每16~24h更换一次培养液,待细胞融合度达到70~80%(细胞贴壁生长面积占培养瓶面积的70~80%)时用0.25%(m/v)的胰蛋白酶进行传代。倒置显微镜下观察细胞形态及生长状况,取生长状况良好的第3~8代细胞用于实验。
二、不同浓度的tnf-α或短梗五加果多酚对人脐静脉内皮细胞存活率的影响
取对数生长期的人脐静脉内皮细胞以5×104个/ml的密度接种于96孔板中,每孔200μl,待细胞贴壁后,用不同浓度的tnf-α或短梗五加果多酚处理24h后,加入20μl浓度为5mg/ml的wst-1置于37℃继续孵育4h后,酶标仪检测各孔在450nm下的吸光度值。每组设置6个平行孔,每个实验重复3次。具体步骤如下:
1.收集生长状况良好的对数生长期细胞,调整细胞浓度为1×105个/ml,接种于96孔板中,每孔200μl;
2.37℃、5%co2细胞培养箱中培养至细胞贴壁;
3.每孔加入不同浓度(0、1、5、10、20、50ng/ml)的tnf-α或(0、25、50、100、200、400μg/ml)的短梗五加果多酚,与细胞共孵育24h;
4.每孔加入20μl浓度为5mg/ml的wst-1溶液,继续孵育2h后,以加了相应量细胞培养液和wst-1溶液但没有加入细胞的孔作为空白对照,450nm波长下检测各孔的吸光度值,计算人脐静脉内皮细胞存活率。
图10为不同浓度的tnf-α对细胞存活率的影响。
人脐静脉内皮细胞与不同浓度的(0、1、5、10、20、50ng/ml)的tnf-α共孵育24h后,wst-1法检测各组人脐静脉内皮细胞的存活力。如图1所示,在较低浓度(0~10ng/ml)时,tnf-α对人脐静脉内皮细胞存活率的影响无显著性差异(p>0.05),随着tnf-α浓度的继续增大,tnf-α对人脐静脉内皮细胞存活率有显著性差异(p<0.05或p<0.01),故选择浓度为10ng/ml的tnf-α用于后续试验。
图11为不同浓度的短梗五加果多酚对细胞存活率的影响。
人脐静脉内皮细胞与不同浓度的(0、25、50、100、200、400μg/ml)的短梗五加果多酚共孵育24h后,wst-1法检测各组人脐静脉内皮细胞的存活力。如图2所示,与空白组(短梗五加果多酚浓度为0组)相比,低浓度(0~100μg/ml)的短梗五加果多酚对人脐静脉内皮细胞存活率的影响无显著性差异(p>0.05),继续增加短梗五加果多酚的浓度至200μg/ml,人脐静脉内皮细胞存活率的差异显著(p<0.05),短梗五加果多酚的浓度增加至400μg/ml时,细胞存活率的降低极显著(p<0.01)。结果表明,短梗五加果多酚在低浓度时无细胞毒性作用,超过一定浓度时对人脐静脉内皮细胞有一定的毒性作用,所以选择0~100μg/ml的浓度范围用于后续试验。
三、短梗五加果多酚对tnf-α诱导的人脐静脉内皮细胞中黏附分子vcam-1、icam-1分泌水平的影响
取对数生长期的人脐静脉内皮细胞,以2×104个/孔的密度接种于48孔板,待细胞贴壁后,用无血清培养基饥饿12h,分别加入不同浓度短梗五加果多酚预处理18h后,加入10ng/mltnf-α处理6h,收集细胞上清于离心管中,于4℃、3000r/min离心20min,收集上清,分装后置于-80℃保存备用。按照elisa试剂盒说明书的要求检测细胞上清中vcam-1、icam-1的水平。每个实验重复3次。具体操作如下:
标准品的稀释:按照试剂盒提供的原倍标准品和标准品稀释液在小试管中倍比稀释;
加样:1)空白孔只加显色剂a、b和终止液,其余各步骤操作相同;2)标准品孔加入标准品50μl和链霉素-hrp50μl;3)样品孔加入样本40μl,然后加入一抗10μl,链霉素-hrp50μl。盖上封板膜,轻轻震荡混匀,37℃孵育1h;
洗涤:每孔加入360μl的洗涤液,静置60s后弃去,重复数次,拍干;
显色:每孔分别加入显色剂a、b各50μl,轻轻震荡混匀,37℃避光显色10min;
终止:每孔加入终止液50μl,终止反应;
测定:以空白孔调零,酶标仪450nm波长下测定各孔的光密度值。
以标准物的浓度为横坐标,450nm处的光密度值为纵坐标,绘出标准曲线,根据样品的光密度值计算出相应的浓度。
图12为短梗五加果多酚对tnf-α诱导的人脐静脉内皮细胞中vcam-1、icam-1分泌水平的影响。
动脉粥样硬化是炎症的过程,黏附分子如vcam-1,icam-1等在动脉粥样硬化的形成中起关键作用。vcam-1主要在单核细胞黏附到内皮这一早期动脉粥样硬化的形成中起作用,而icam-1不仅能够促进单核细胞对内皮的黏附,还能促进淋巴细胞对内皮的黏附进一步加速动脉粥样硬化的形成。因此研究中我们检测了短梗五加果多酚对tnf-α诱导的人脐静脉内皮细胞的vcam-1、icam-1分泌水平的影响。tnf-α是一种重要的炎性诱导剂,能够诱导人脐静脉内皮细胞,增加细胞黏附分子vcam-1、icam-1等的表达。结果显示,无tnf-α存在时,人脐静脉内皮细胞细胞上清液中vcam-1和icam-1均呈现出低水平的表达;加入10ng/ml的tnf-α刺激人脐静脉内皮细胞6h后,细胞上清液中vcam-1和icam-1的含量均升高;加入不同浓度(0、25、50、100μg/ml)的短梗五加果多酚预处理组细胞上清液中vcam-1的表达均降低并呈现一定的剂量依赖性,而icam-1的表达没有明显的变化。结果表明,短梗五加果多酚可以显著减少tnf-α诱导的人脐静脉内皮细胞的vcam-1的分泌水平,但对icam-1分泌水平的影响无统计学意义。
四、短梗五加果多酚对tnf-α诱导的人脐静脉内皮细胞中黏附分子vcam-1、icam-1分泌蛋白表达的影响
取对数生长期的人脐静脉内皮细胞,接种到6cm2细胞培养皿中,待细胞长满后,无血清细胞培养液饥饿处理12h后,在有/无10ng/ml的tnf-α条件下处理6h,再加入不同浓度(0、25、50、100μg/ml)的asfp共孵育18h后,弃去培养基,pbs缓冲液(0.2m,ph=7.4)2次后,加入冷的pbs缓冲液1ml,用细胞刮刀将细胞轻轻刮下,1500r/min离心5min后,按照蛋白提取试剂盒说明书提取人脐静脉内皮细胞总蛋白,参照bca试剂盒说明书检测蛋白浓度。样品蛋白变性处理后,用10%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodiumdodecylsulfate-polyacrylamidegelelectrophoresis,sds-page)分离胶分离蛋白,并转移至硝酸纤维素膜上,用5%牛血清白蛋白封闭2h,在1:1000稀释的抗体中4℃条件下孵育过夜,0.1%(体积分数)tbst缓冲液(trisbufferedsalinewithtween-20,ph=8.0)洗膜3次,每次20min,再用1:2000稀释的辣根过氧化物酶标记的二抗室温孵育2h,0.1%tbst缓冲液洗膜3次,每次20min,加入western化学发光hrp底物,用化学发光成像系统观察结果并拍照。采用clinximageanalysis图像分析软件对硝酸纤维素膜上的条带进行灰度值比较分析,检测vcam-1、icam-1蛋白的表达。
图13为短梗五加果多酚对tnf-α诱导人脐静脉内皮细胞中vcam-1和icam-1蛋白表达的影响。
在研究了短梗五加果多酚对tnf-α诱导的人脐静脉内皮细胞的vcam-1、icam-1分泌水平的影响的基础上,又检测了短梗五加果多酚对tnf-α诱导的人脐静脉内皮细胞内黏附分子蛋白表达的影响。在有/无tnf-α的条件下,刺激人脐静脉内皮细胞6h后,加入不同浓度(0、25、50、100μg/ml)的短梗五加果多酚孵育18小时后,westernblotting检测不同浓度(0、25、50、100μg/ml)的短梗五加果多酚对tnf-α诱导的人脐静脉内皮细胞细胞内黏附分子蛋白表达的影响。结果表明,短梗五加果多酚能够减少tnf-α诱导的人脐静脉内皮细胞的vcam-1的转录后水平的表达,但对icam-1的转录后水平的表达无显著性影响
五、短梗五加果多酚对tnf-α诱导的人脐静脉内皮细胞的nf-κb和mapks信号通路关键蛋白表达的影响
取对数生长期的人脐静脉内皮细胞,接种到6cm2细胞培养皿中,待细胞长满后,无血清细胞培养液饥饿处理12h,加入10ng/ml的tnf-α处理6~12h,再加入不同浓度(0、25、50、100、100μg/ml)的短梗五加果多酚共孵育18h后,弃去培养基,pbs缓冲液冲洗2次后,加入1ml预冷的pbs缓冲液,用细胞刮刀将细胞轻轻刮下,转入离心管中低速离心后,按照蛋白提取试剂盒说明书的要求分别提取核蛋白、浆蛋白和总蛋白总蛋白,参照bca试剂盒说明书检测蛋白浓度。样品蛋白变性处理后,用10%(体积分数)的sds-page分离胶分离蛋白,并转移至硝酸纤维素膜上,用5%(体积分数)牛血清白蛋白封闭2h,在1:1000稀释的抗体中4℃条件下孵育过夜,0.1%tbst缓冲液(trisbufferedsalinewithtween-20,ph=8.0)洗膜3次,每次20min,再用1:2000稀释的辣根过氧化物酶标记的二抗室温孵育2h,0.1%(体积分数)tbst缓冲液洗膜3次,每次20min,加入western化学发光hrp底物,用化学发光成像系统观察结果并拍照。采用clinximageanalysis图像分析软件对硝酸纤维素膜上的条带进行灰度值比较分析,检测nf-κbp65、p-p65、iκb、p38、p-p38、erk1/2、p-erk1/2蛋白的表达。
图14为短梗五加果多酚对tnf-α诱导的人脐静脉内皮细胞中p-p38、p38、p-erk1/2和erk1/2蛋白表达的影响。
mapk是重要的炎症信号通路之一,炎症介质如tnf-α等可以激活此通路,引起黏附分子、趋化因子等相关炎症因子的表达增加。研究表明,mapks信号通路的活化在动脉粥样硬化的发生和发展中起着重要的作用,有研究报道mapks信号通路的的激活可以调节icam-1、vcam-1的表达。为进一步阐明短梗五加果多酚对tnf-α诱导人脐静脉内皮细胞引起的vcam-1的表达升高的抑制作用的机制,我们检测了短梗五加果多酚对mapks信号通路关键基因蛋白的表达的影响。人脐静脉内皮细胞在有/无不同浓度的(0、25、50、100、100μg/ml)短梗五加果多酚条件下培养24小时,然后加入10ng/ml的tnf-α培养30min,提取细胞总蛋白,westernblotting检测mapk的磷酸化水平。结果显示,短梗五加果多酚可以显著降低tnf-α诱导的p38的磷酸化,但并不能降低tnf-α诱导的erk1/2的磷酸化。提示在人脐静脉内皮细胞中短梗五加果多酚可能通过抑制p38mapk信号通路来下调黏附分子(如vcam-1)的表达,而不是通过erk1/2mapk信号通路来调控。
图15为短梗五加果多酚对tnf-α诱导的人脐静脉内皮细胞中nf-κbp65、p-nf-κbp65和iκb蛋白表达的影响。
nf-κb是炎症重要的信号通路,在调节细胞黏附和动脉粥样硬化的形成和进展中起着重要的作用,研究中我们检测了短梗五加果多酚对nf-κb信号通路关键蛋白的表达的影响。采用10ng/ml的tnf-α刺激人脐静脉内皮细胞1h,再加入不同浓度(0、25、50、100、100μg/ml)的短梗五加果多酚孵育23h后,westernblotting检测细胞中p65、p-p65、iκb的表达。结果显示,短梗五加果多酚对细胞中p-p65、iκb的表达量没有明显的调节作用。表明短梗五加果多酚可能不是通过nf-κb信号通路调控vcam-1的表达。
- 还没有人留言评论。精彩留言会获得点赞!