一种罗格列酮的新用途及含罗格列酮的抗肿瘤药物组合的制作方法
本发明涉及抗肿瘤药物技术领域,特别涉及一种罗格列酮的新用途及含罗格列酮的抗肿瘤药物组合。
背景技术:
恶性肿瘤是严重威胁人类健康与生命的疾病,化疗是恶性肿瘤最重要的治疗手段之一,但是目前化疗仍存在疗效瓶颈。肿瘤靶向给药系统因其对肿瘤靶组织的良好选择性成为了寻找高效低毒的抗肿瘤药物的突破口[1]。然而,最新的研究表明脂质体化疗药物相比传统化疗药物并未提高疗效[2]。聚乙二醇修饰的多柔比星脂质体(pegylatedliposomaldoxorubicin,pld)是fda批准的第一个长循环脂质体,它相比传统多柔比星可以明显减少毒性,但其疗效并不优于多柔比星,其批准的适应症范围也远不如传统多柔比星广[3,4]。近年来越来越多的研究关注到肿瘤特殊的微环境可能是导致化疗疗效不佳的重要原因之一[5,6]。
肿瘤微环境能够分泌大量的生长因子和细胞因子,如成纤维细胞、炎性细胞、血管内皮细胞等,其成分包括胶原蛋白、层粘连蛋白和蛋白多糖复合物[7]。其中,肿瘤相关成纤维细胞(cancerassociatedfibroblast,caf)作为主要的肿瘤基质细胞,对于肿瘤的发生、发展具有重要作用,是肿瘤治疗的潜在靶点[8,9]。caf细胞还具有强大的基质合成能力,可直接合成i型、iii型和iv型胶原,导致基质成分的过度沉积,致使肿瘤基质呈现“结缔组织化”现象[10]。而这种“结缔组织化”的现象不利于化疗药物由血管向肿瘤细胞渗透,可能是导致大分子脂质体靶向制剂疗效不佳的重要原因之一[11]。因此,如何促进pld由血管向基质的渗透是提升其疗效的关键。
罗格列酮(rsg)属噻唑烷二酮类抗糖尿病药,通过提高胰岛素的敏感性而有效地控制血糖。罗格列酮为过氧化物酶体增殖激活受体γ(ppar-γ)的高选择性、强效激动剂。人类的ppar受体存在于胰岛素的主要靶组织如肝脏、脂肪和肌肉组织中。罗格列酮激活ppar-γ核受体,可对参与葡萄糖生成、转运和利用的胰岛素反应基因的转录进行调控。
技术实现要素:
本发明的目的在于提供一种罗格列酮的新用途。
本发明还提供了一种含罗格列酮的抗肿瘤药物组合,能够提升pld的临床疗效为提高肿瘤患者的治疗获益,也为肿瘤靶向纳米递药体系的开发提供新思路;拓展了罗格列酮的用途。
本发明解决其技术问题所采用的技术方案是:
一种罗格列酮的新用途,罗格列酮作为提高聚乙二醇修饰的多柔比星脂质体抗肿瘤作用的增效剂的用途。
罗格列酮显著提高聚乙二醇修饰的多柔比星脂质体的肿瘤内浓度。
一种含罗格列酮的抗肿瘤药物组合,由罗格列酮与聚乙二醇修饰的多柔比星脂质体组成,罗格列酮:聚乙二醇修饰的多柔比星脂质体的质量比为1:1~1:4。
作为优选,其使用方法为:在聚乙二醇修饰的多柔比星脂质体的治疗期及治疗期前1-2周,每日给予口服罗格列酮,每日口服罗格列酮的用量为聚乙二醇修饰的多柔比星脂质体治疗有效量的25%-100%。
聚乙二醇修饰的多柔比星脂质体的治疗有效量为30-40mg/次,2-3周一次。
本发明的有益效果是:一、能够提升pld的临床疗效为提高肿瘤患者的治疗获益,也为肿瘤靶向纳米递药体系的开发提供新思路;二、拓展了罗格列酮的用途。
附图说明
图1是瘤内pld的分布及定量结果:(a)肿瘤组织的活体荧光成像图:经高剂量rsg(hd-rsg)预处理的肿瘤多柔比星荧光较单用组(pld)显著增强;(b)肿瘤组织内多柔比星含量:高剂量rsg合用组(橙色实心菱形)、低剂量rsg合用组(橙色空心菱形)、pld单用组(黑色方块)。
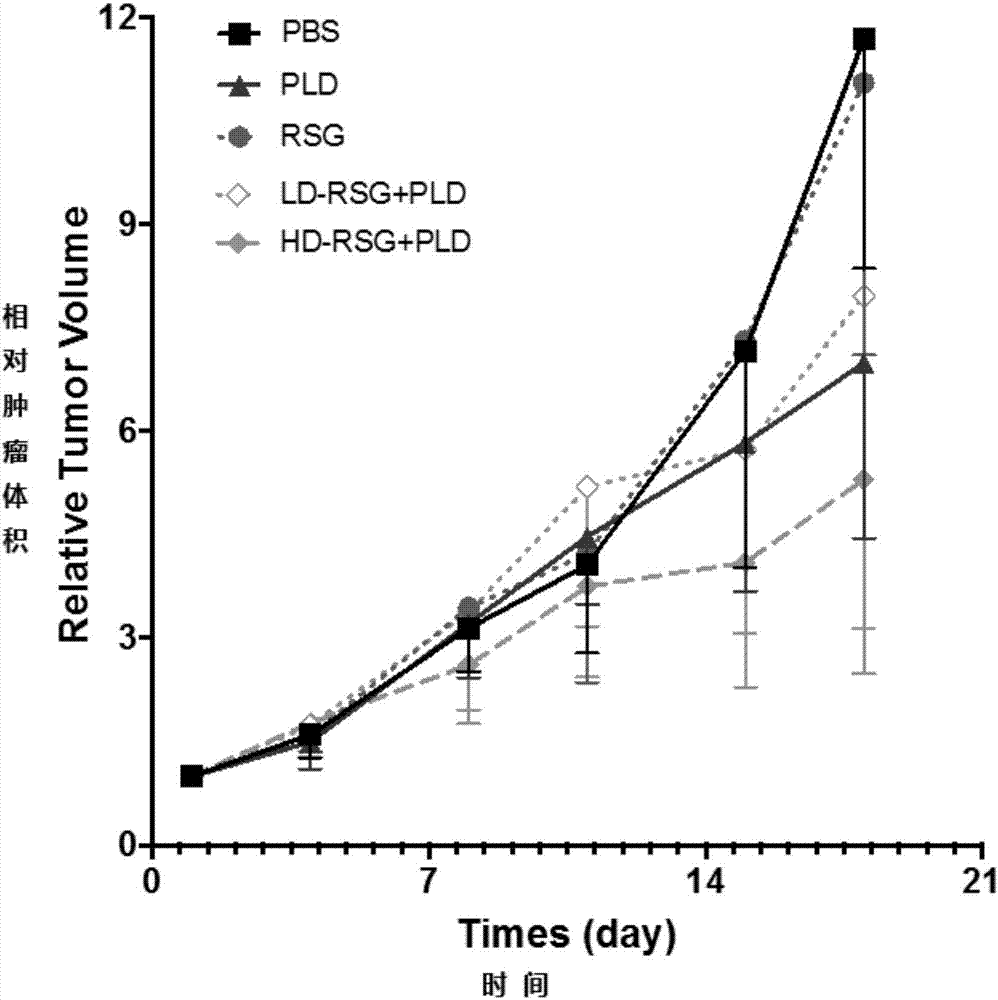
图2是罗格列酮与pld对裸鼠结肠癌移植瘤模型瘤体积的作用。
图3是罗格列酮与pld对裸鼠结肠癌移植瘤模型瘤重的作用。
具体实施方式
下面通过具体实施例,对本发明的技术方案作进一步的具体说明。
本发明中,若非特指,所采用的原料和设备等均可从市场购得或是本领域常用的。下述实施例中的方法,如无特别说明,均为本领域的常规方法。
实施例1:
一种含罗格列酮的抗肿瘤药物组合,由罗格列酮与聚乙二醇修饰的多柔比星脂质体组成,罗格列酮:聚乙二醇修饰的多柔比星脂质体的质量比为1:1。
实施例2:
一种含罗格列酮的抗肿瘤药物组合,由罗格列酮与聚乙二醇修饰的多柔比星脂质体组成,罗格列酮:聚乙二醇修饰的多柔比星脂质体的质量比为1:4。
实施例3:
一种含罗格列酮的抗肿瘤药物组合,由罗格列酮与聚乙二醇修饰的多柔比星脂质体组成,罗格列酮:聚乙二醇修饰的多柔比星脂质体的质量比为1:2。
含罗格列酮的抗肿瘤药物组合的使用方法为:
在聚乙二醇修饰的多柔比星脂质体的治疗期及治疗期前1-2周,每日给予患者口服罗格列酮,每日口服罗格列酮的用量为聚乙二醇修饰的多柔比星脂质体治疗有效量的25%-100%,聚乙二醇修饰的多柔比星脂质体的治疗有效量为30-40mg/次,治疗期间给予2-3周一次。比如聚乙二醇修饰的多柔比星脂质体的治疗有效量为40mg/次,每日口服罗格列酮的用量10-40mg/天。
试验部分:
1、结肠癌细胞株的培养:sw620细胞株采用含有10%小牛血清、100u/ml链霉素和青霉素的dmem:f12(1:1)培养基于37℃和5%co2条件下培养,用于体内移植瘤模型的构建。
2、结肠癌模型的构建:取雌性balb/c裸鼠(体重,16-22g)右腋窝皮下接种结肠癌sw620细胞株1×107个。当瘤体积长至约150mm3,剥取肿瘤组织,剪碎为1-2mm3颗粒大小接种与新裸鼠腋下,如此传代。取第3代荷瘤裸鼠,待瘤体增长至100mm3后用于研究。
分组与干预:取上述荷瘤裸鼠按照瘤体积均分为5组,干预如下:对照组(尾静脉注射生理盐水)、pld单独治疗组(分别于分组后第8,11,14和17天尾静脉注射pld,4mg/kg)、rsg单用组(于研究开始第1-17天灌胃给予rsg,4mg/kg每天一次)、低剂量rsg联用组(于研究开始第1-17天灌胃给予rsg,1mg/kg每天一次;同时于第8,11,14和17天尾静脉注射pld,1mg/kg)、高剂量rsg联用组(于研究开始第1-17天灌胃给予rsg,4mg/kg每天一次;同时于第8,11,14和17天尾静脉注射pld,4mg/kg)。研究过程中每周测量肿瘤体积2次,给药结束后次日,处死裸鼠,剥离肿瘤后称重。
3、合用罗格列酮(aa)可以显著提高pld的瘤内浓度
合用罗格列酮(1mg/kg和4mg/kg)可以显著提高肿瘤内多柔比星的浓度,显著提高瘤内多柔比星的荧光强度:尤其是在高剂量rsg的作用下,瘤内多柔比星的浓度由pld单用组的6.86±0.23μg/g提高至10.27±1.49μg/g,提升49.7%(p=0.0013);低剂量组提升至8.88±1.79μg/g,与单用组相比也具有显著性的提高趋势(p=0.0067)(见图1)。
4、合用罗格列酮可以显著提高pld的体内抗肿瘤作用
4.1裸鼠一般状态
在观察期间裸鼠的一般情况总体良好,在观察后期随着瘤体的增大,部分小鼠活动能力减弱,喜聚群,进食减少。无小鼠死亡。给药前后小鼠体重变化不大,略有减轻,18天体重平均下降5%,其余组裸鼠体重均无显著变化,详见表1,说明合用rsg并不增加治疗的毒性。
表1罗格列酮治疗期间药物对于裸鼠体重的变化(相对体重,%)
4.2罗格列酮对pld抑瘤作用的影响
pld单药(4mg/kg)对于结肠癌移植瘤的抑制率为48.5%,而单用罗格列酮(4mg/kg)对结肠癌移植瘤几乎没有抑制作用(抑瘤率为5.07%,与溶剂组相比p=0.794)。但是罗格列酮与pld合用后,抑瘤作用增强,对瘤重的抑制率分别为60.46%(合用罗格列酮:1mg/kg)和66.67%(合用罗格列酮:4mg/kg);单因素anova分析结果显示,合用罗格列酮对pld的抗肿瘤作用具有增效作用(p=0.000)。采用t检验进行组间对比,结果显示罗格列酮(4mg/kg)与pld合用组的瘤重显著低于pld单用组(p=0.031)。(详见表2,3,4,图2,3)。
表2罗格列酮与pld对裸鼠结肠癌移植瘤模型的抑瘤作用
表3合用罗格列酮对pld抑瘤作用的影响(组间差异,t-test,p值)
表4罗格列酮干预对pld抑瘤总的影响(单因素anova检验)
参考文献:
1.vanelk,m.,etal.,nanomedicinesforadvancedcancertreatments:transitioningtowardsresponsivesystems.intjpharm,2016.515(1-2):p.132-164.
2.petersen,g.h.,etal.,meta-analysisofclinicalandpreclinicalstudiescomparingtheanticancerefficacyofliposomalversusconventionalnon-liposomaldoxorubicin.jcontrolrelease,2016.232:p.255-64.
3.gabizon,a.,h.shmeeda,andt.grenader,pharmacologicalbasisofpegylatedliposomaldoxorubicin:impactoncancertherapy.eurjpharmsci,2012.45(4):p.388-98.
4.gabizon,a.a.,y.patil,andn.m.la-beck,newinsightsandevolvingroleofpegylatedliposomaldoxorubicinincancertherapy.drugresistupdat,2016.29:p.90-106.
5.hanahan,d.,rethinkingthewaroncancer.lancet,2014.383(9916):p.558-63.
6.straussman,r.,etal.,tumourmicro-environmentelicitsinnateresistancetorafinhibitorsthroughhgfsecretion.nature,2012.487(7408):p.500-4.
7.ishii,g.,a.ochiai,ands.neri,phenotypicandfunctionalheterogeneityofcancer-associatedfibroblastwithinthetumormicroenvironment.advdrugdelivrev,2016.99(ptb):p.186-96.
8.micke,p.anda.ostman,tumour-stromainteraction:cancer-associatedfibroblastsasnoveltargetsinanti-cancertherapy?lungcancer,2004.45suppl2:p.s163-75.
9.togo,s.,etal.,carcinoma-associatedfibroblastsareapromisingtherapeutictarget.cancers(basel),2013.5(1):p.149-69.
10.liu,m.,j.xu,andh.deng,tangledfibroblastsintumor-stromainteractions.intjcancer,2011.129(8):p.1795-805.
11.olive,k.p.,etal.,inhibitionofhedgehogsignalingenhancesdeliveryofchemotherapyinamousemodelofpancreaticcancer.science,2009.324(5933):p.1457-61。
以上所述的实施例只是本发明的一种较佳的方案,并非对本发明作任何形式上的限制,在不超出权利要求所记载的技术方案的前提下还有其它的变体及改型。
- 还没有人留言评论。精彩留言会获得点赞!