双氢青蒿素在治疗脓毒症诱导的急性肾损伤药物中的应用的制作方法
本发明属于药物制剂领域,具体涉及双氢青蒿素在治疗脓毒症诱导的急性肾损伤药物中的应用。
背景技术:
脓毒症(sepsis)是指由感染引起的全身炎症反应综合征,是由微生物(如细菌、真菌、病毒、寄生虫等)侵入人体而诱发的激烈全身炎症反应,并对组织具有损伤性的病理生理过程的一组临床表现,常常继发于严重疾病,如严重烧伤、多发伤、外科手术后等。严重脓毒症可以导致脓毒性休克和多器官功能障碍,是目前重症监护病房内非心脏病死亡的主要原因,约28.3%至41%的脓毒症患者因多器官功能衰竭而死亡,对人类健康和经济发展构成极大的威胁和挑战。
急性肾损伤(acutekidneyinjury,aki)是icu内,脓毒症患者中最为常见且严重的并发症。而且,脓毒症与脓毒症休克是危重病患者aki的最重要的病因,有研究表明,重症监护室中,脓毒症引起的急性肾损伤病人约占所有病人的50%,且急性肾损伤是icu病房内死亡的重要因素,即使在发达国家,脓毒症诱导的急性肾损伤占所有急性肾损伤病人的26%到50%,且尽管预防策略和支持疗法已经获得巨大进步的今天,脓毒症诱导的急性肾损伤的发病率和死亡率依然居高不下。此外,即使患有aki的患者度过危险期,仍有慢性化的趋势,一些高风险因素可加剧慢性肾病(chronickidneydisease,ckd)的发生,并加速变为终末期肾病(end-stagerenaldisease,esrd)。
青蒿素(artemisinin)是从蒿属植物青蒿(artemisiacarvifolia)中分离鉴定出的一种具有过氧基新倍半萜内酯类化合物,其分子式为c12h22o5,是我国首创的一类高效低毒的新型抗疟药,双氢青蒿素(dihydroartemisinin,dha)是从青蒿素中引入羟基的第一个衍生物,其抗疟疗效较青蒿素显著提高,近年来,又发现其具有抑制肿瘤细胞生长和治疗红斑狼疮等作用,但迄今尚未有研究报道其具有治疗脓毒症诱导的急性肾损伤的作用。
技术实现要素:
针对上述现有技术的不足,发明人经长期的技术与实践探索,意外发现双氢青蒿素能够明显抑制肿瘤坏死因子tnfα引起的肾小球内皮细胞(hrgecs)通透性过高,试验证明,肿瘤坏死因子tnfα能够降低紧密连接蛋白occludin在肾小球内皮细胞中的表达,而双氢青蒿素则具有上调occludin蛋白表达的作用。因此,我们的结果表明双氢青蒿素通过上调occludin蛋白的表达,降低了肾小球内皮通透性,从而表明双氢青蒿素对具有治疗脓毒症诱导的急性肾损伤的能力。
具体的,本发明涉及以下技术方案:
本发明的第一个方面,提供了双氢青蒿素在制备治疗脓毒症诱导的急性肾损伤药物中的应用;双氢青蒿素能够明显改善脓毒症诱导的急性肾损伤中出现的肾小球水肿、出血及炎性症状;
双氢青蒿素在制备抑制肿瘤坏死因子tnfα引起的肾小球内皮细胞(hrgecs)通透性过高药物中的应用;
双氢青蒿素在制备炎性条件下上调occludin蛋白表达以降低肾小球内皮细胞通透性过高药物中的应用;
其中,所述炎性条件促进因子包括肿瘤坏死因子tnfα;
所述药物用药有效浓度为25μm及以上,所述有效浓度为到达病灶的体内药物的浓度;
优选的,所述药物还包含一种或多种药学上或食品学上可接受的辅料。所用辅料可为固态或液态。固态形式的制剂包括粉剂、片剂、分散颗粒、胶囊、药丸及栓剂。粉剂及片剂可包含约0.1%至约99.9%的活性成分。适当的固体辅料可以是碳酸镁、硬脂酸镁、滑石粉、糖或者乳糖。片剂、粉剂、药丸及胶囊为适于口服用的固态剂型。液态形式的制剂包括溶液、悬浮液及乳液,其实施例为非经肠注射用水溶液或水-丙二醇溶液,或添加甜味剂及造影剂的口服溶液。此外,还可制成注射用小水针、注射用冻干粉针、大输液或小输液;
优选的,所述药物组合物为固体口服制剂、液体口服制剂或注射剂;
进一步优选的,所述药物组合物为片剂、分散片、肠溶片、咀嚼片、口崩片、胶囊、糖衣剂、颗粒剂、干粉剂、口服溶液剂、注射用小水针、注射用冻干粉针、大输液或小输液。
本发明有益效果:本发明提供了一种双氢青蒿素的新应用。我们的研究表明,双氢青蒿素能够明显改善脓毒症诱导的急性肾损伤出现的肾小球水肿、出血及炎性症状,具体的,低剂量的双氢青蒿素处理对肾小球内皮细胞的生长特性没有产生显著影响,但是却能显著地抑制肿瘤坏死因子tnf-α引起的肾小球内皮细胞通透性过高;进一步研究表明,肿瘤坏死因子tnf-α降低连接蛋白occludin在肾小球内皮细胞中的表达,而双氢青蒿素能上调其表达。因此,我们的结果表明双氢青蒿素通过上调occludin蛋白的表达,降低了肾小球内皮细胞的通透性。
我们的研究表明双氢青蒿素具有治疗脓毒症诱导的急性肾损伤的能力。我们的研究有助于更好地理解出现以上结果的机制,在脓毒症引起的组织损伤方面具有重要答的临床应用价值,同时为双氢青蒿素及其他临床上安全的青蒿素衍生物开辟了新的药物用途。
附图说明
图1a为不同处理组及对照组处理后的小鼠尿白蛋白/肌酐比值(n=6;**p<0.01);图1b为不同处理组及对照组处理后小鼠肾组织形态学图片;
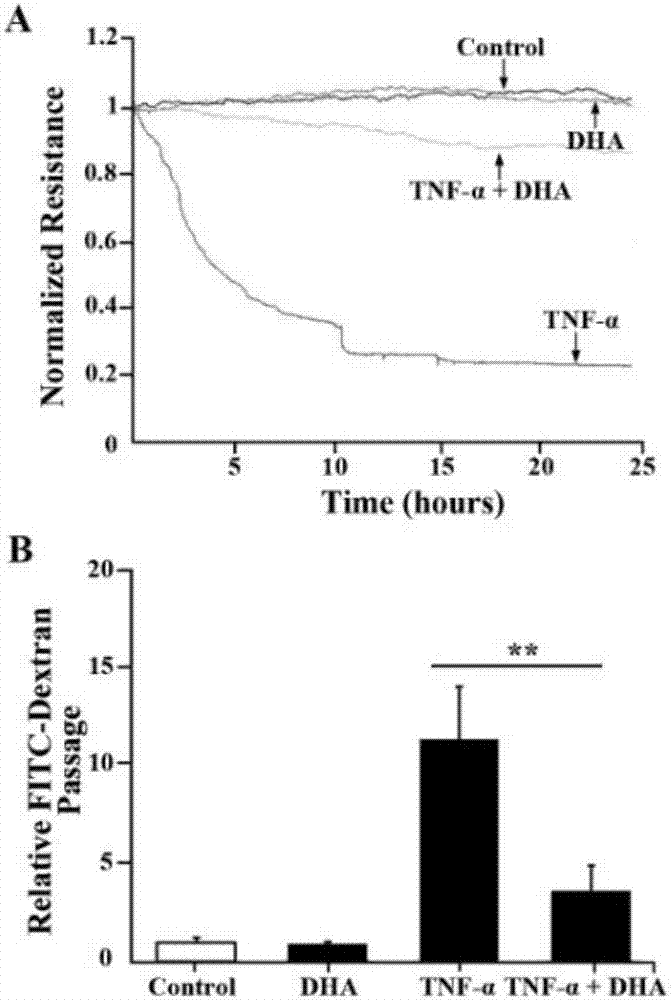
图2a为不同处理组及对照组处理后的小鼠肾小球内皮单层细胞的跨细胞电阻;图2b为不同处理组及对照组处理后的小鼠肾小球内皮单层细胞transwell通透性检测(n=6;**p<0.01);
图3a为annexinv/pi双染法检测dha处理后的小鼠肾小球内皮细胞流式细胞图;图3b为图3a的柱状结果图(n=4;n.s.non-significant);图3c为台盼蓝拒染法检测dha处理后小鼠肾小球内皮细胞活力(n=4,n.s.,non-significant);
图4a为不同处理组及对照组处理后的小鼠肾小球内皮细胞occludin蛋白免疫荧光图;图4b为不同处理组及对照组处理后的小鼠肾小球内皮细胞occludin蛋白免疫印迹图,其中gapdh作为内参蛋白;图4c为光密度法对不同处理组及对照组处理后的小鼠肾小球内皮细胞occludin蛋白表达量检测(n=4;n.s.,non-significant;**p<0.01)。
具体实施方式
应该指出,以下详细说明都是例示性的,旨在对本申请提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本申请所属技术领域的普通技术人员通常理解的相同含义。
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本申请的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
结合具体实例对本发明作进一步的说明,以下实例仅是为了解释本发明,并不对其内容进行限定。如果实施例中未注明的实验具体条件,通常按照常规条件,或按照试剂公司所推荐的条件;下述实施例中所用的试剂、耗材等,如无特殊说明,均可从商业途径得到。
如前所述,脓毒症诱导的急性肾损伤对人类健康和经济发展构成极大的威胁和挑战。
本发明的一种典型实施方式中,提供了双氢青蒿素在制备治疗脓毒症诱导的急性肾损伤药物中的应用;双氢青蒿素能够明显改善脓毒症诱导的急性肾损伤中出现的肾小球水肿、出血及炎性症状;
本发明的又一具体实施方式中,提供了双氢青蒿素在制备抑制肿瘤坏死因子tnfα引起的肾小球内皮细胞(hrgecs)通透性过高药物中的应用;
本发明的又一具体实施方式中,提供了双氢青蒿素在制备炎性条件下上调occludin蛋白表达以降低肾小球内皮细胞通透性过高药物中的应用;
其中,所述炎性条件促进因子包括肿瘤坏死因子tnfα;
本发明的又一具体实施方式中,所述药物用药有效浓度为25μm及以上,所述有效浓度为到达病灶的体内药物的浓度;
本发明的又一具体实施方式中,所述药物还包含一种或多种药学上或食品学上可接受的辅料。所用辅料可为固态或液态。固态形式的制剂包括粉剂、片剂、分散颗粒、胶囊、药丸及栓剂。粉剂及片剂可包含约0.1%至约99.9%的活性成分。适当的固体辅料可以是碳酸镁、硬脂酸镁、滑石粉、糖或者乳糖。片剂、粉剂、药丸及胶囊为适于口服用的固态剂型。液态形式的制剂包括溶液、悬浮液及乳液,其实施例为非经肠注射用水溶液或水-丙二醇溶液,或添加甜味剂及造影剂的口服溶液。此外,还可制成注射用小水针、注射用冻干粉针、大输液或小输液;
本发明的又一具体实施方式中,所述药物组合物为固体口服制剂、液体口服制剂或注射剂;
本发明的又一具体实施方式中,所述药物组合物为片剂、分散片、肠溶片、咀嚼片、口崩片、胶囊、糖衣剂、颗粒剂、干粉剂、口服溶液剂、注射用小水针、注射用冻干粉针、大输液或小输液。
下面通过实施例,对本发明的操作,作进一步具体的说明。
实施例
材料与方法
动物
6周龄c57bl/6j小鼠(重22-25g),购买自北京维通利华实验动物技术有限公司。lps(来源于escherichiacoli055:b5)和双氢青蒿素dha均购买自美国sigmaaldrich公司。小鼠腹腔内注射lps(20mg/kg),建立脓毒症模型。注射后1小时,每只小鼠灌胃给予dha(50mg/kg,dha溶于pbs中)。24小时后,收集这期间的尿液,杀死小鼠得到肾脏。所有程序均遵照山东大学动物实验伦理审查委员会的指南进行。
尿白蛋白/肌酐比值(uacr)
尿液标本2000g、4℃离心5分钟,取上清用于检测。利用商品化试剂盒基于免疫比浊法原理检测尿白蛋白。尿肌酐采用jaffe等报道的方法进行比色分析。
苏木精-伊红染色
小鼠肾用4%多聚甲醛固定,在干冰上包埋进美国樱花牌冷冻切片包埋剂。将组织切成5微米厚的切片,用1%苏木精染色5分钟。水洗后,将切片浸泡在1%的盐酸-乙醇溶液中,用蒸馏水洗后,再用0.5%伊红染色15秒。切片经过梯度乙醇脱水以及二甲苯透明后用中性树脂封片。在光学显微镜下观察肾组织的形态学改变,并利用bx-51纤维拍照系统(olympuscorporation,tokyo,japan)进行拍照。
细胞培养
肾小球内皮细胞(hrgecs)购自美国sciencellresearch实验室。培养在dmem培养液中,添加了10%胎牛血清,100iu/ml青霉素和100μg/ml链霉素。培养培养箱条件为37℃,5%co2。tnf-α购买自德国miltenyibiotec公司,作用在肾小球内皮细胞上的终浓度为20ng/ml。
异硫氰酸荧光素-右旋糖酐(fitc-dextran)transwell小室侵袭实验
transwell插在24孔transwell小室中,将肾小球内皮细胞(1×105cells)种在transwell顶端,培养24小时长至融合。用25μmdha处理后,接着用20ng/mltnf-α处理24小时,用hepes缓冲液冲洗,将1mg异硫氰酸荧光素-右旋糖(fitc-dextran)溶解在1mlpbs中,加在小室顶端。4小时后,从小室底部收集样品,使用荧光分光光度计检测,激发光波长485nm,发射光波长520nm。电子细胞-基质阻抗传感分析(ecis)
用ecis技术检测跨肾小球内皮细胞电阻。首先将用于ecis分析的8孔板铺被上一层纤维连接蛋白。然后直接在电极顶部种上一层hrgecs细胞,长至融合状态。在用dha或/和tnfα处理后,交流电流作用在电极上,电阻就被记录下来。
annexinv-fitc/pi分析和细胞存活率检测
利用annexinv-fitc和碘化丙啶(pi)双染试剂盒检测hrgecs凋亡。先将细胞离心,用pbs洗两遍。然后,用结合缓冲液(bindingbuffer)将细胞沉淀悬浮成单个细胞。取1×106个细胞在避光条件下,用annexinv-fitc(0.025%)染色3分钟,pi(20μg/ml)染色10分钟。染色阳性的细胞用facsariaii流式细胞仪检测(bdbiosciences,sanjose,ca,usa)。用facsdiva采集和分析软件分析数据。用台盼蓝拒染法检测96孔板中细胞活力。洗细胞后,在37℃用0.05%胰酶孵育2分钟。消化完成后,细胞悬液按1:1的比例加入0.4%台盼蓝(0.4g台盼蓝溶解在100ml0.9%nacl中),计算未被染色的细胞所占的比例。
westernblotting
提取hrgec总蛋白。用bca法测蛋白浓度。等量蛋白(40μg)进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳,聚丙烯酰胺浓度为10%,电泳结束后将蛋白转移到pvdf膜上。用2.5%bsa室温封闭2小时。然后过夜4度孵育抗-occludin的抗体(1:1000;abcam,cambridge,ma,usa)。用tbst溶液洗3次以后,用结合有辣根过氧化物酶的羊抗兔抗体(1:6000)孵育1小时。用ecl化学发光试剂盒显色。用imagej软件分析灰度值。
免疫荧光
将hrgecs种在包被纤连蛋白的玻璃载玻片上,用25μmdha处理24小时。吸去培养液,用pbs洗细胞后用4%多聚甲醛固定,用pbs继续洗3次,共15分钟。用抗人occludin的一抗4度过夜孵育细胞(1:500,abcam),用罗丹明标记的二抗(1:200)孵育30分钟。将载玻片在olympuslcx100成像系统下观察拍照,发射光波长为546nm。
实验结果
1.dha改善lps诱导的小鼠急性肾损伤
为了探讨dha对于脓毒症引起的急性肾损伤的影响,我们用lps处理小鼠建立脓毒症模型。uacr是尿白蛋白排泄率的评价标准,因此我们检测了lps注射小鼠用dha处理前后的uacr。结果表明,lps注射小鼠uacr显著高于对照组小鼠。dha处理后降低了由lps上调的uacr水平(p<0.01,图1a)。对小鼠肾组织进行h-e染色,结果表明,在dha单独处理组,肾小球正常。lps注射组出现严重的肾小球损伤伴出血、水肿和炎性细胞浸润。在dha处理后,维持了lps注射组的肾小球通透性,并且水肿得到部分改善(图1b)。以上结果表明,dha缓解了lps引起的小鼠肾小球损伤。
2.dha降低了tnf-α引起的hrgec通透性过高
为了进一步明确dha对于肾小球内皮细胞通透性的影响,我们使用电子细胞-基质阻抗传感分析系统检测了单层hrgecs的跨细胞电阻(teer)。我们发现,tnf-α处理后显著降低了hrgecs的teer,而dha则大幅逆转了这种变化(图2a)。接下来利用fitc-右旋糖酐进行transwell通透性检测也获得了相似的结果。dha显著地降低了由tnf-α引起的hrgecs通透性过高(p<0.01,图2b)。在以上两个试验中,dha单独处理均未改变hrgecs单层细胞的通透性(p=0.22,p=0.14,respectively)。总起来说,我们的结果表明,dha改善了由tnf-α引起的hrgecs通透性过高。
然后,我们采用annexinv/pi双染法检测dha处理后对小鼠肾小球内皮细胞凋亡影响,结果如图3a,b所示,与对照组相比,采用dha处理后的小鼠肾小球内皮细胞发生率与对照组相比无显著变化(p=0.11),在台盼蓝拒染实验中,如图3c所示,dha处理后小鼠肾小球内皮细胞活力与对照组几近相同(p=0.25);因此,dha能够有效降低因tnf-α诱导的小鼠肾小球内皮细胞通透性升高,同时并不会引发小鼠肾小球内皮细胞凋亡或者影响细胞活力。
3.在hrgecs中,dha维持了occludin蛋白的表达
occludin蛋白对于维持内皮细胞屏障的完整性以及血管通透性非常重要。因此,检测了dha对于hrgecsoccludin蛋白表达的影响。免疫荧光实验表明,tnf-α处理后降低了细胞质膜上occludin蛋白的荧光强度(图4a),而25μmdha预处理逆转了tnf-α诱导对occludin蛋白的作用(p<0.01),dha单独处理对hrgecs的occludin蛋白水平没有影响(图4b,c),这些结果表明,dha在炎性条件下维持着occludin的表达。
综上,我们可得到如下结论:1.dha在小鼠模型中缓解了lps诱导的急性肾损伤;2.dha降低了tnf-α诱导的hrgecs通透性过高;3.在hrgecs中,dha维持了occludin的表达。
众所周知,脓毒症诱导的急性肾损伤是icu危重病患者死亡的一个主要因素。我们利用lps处理小鼠来模拟脓毒症,结果发现,dha缓解了lps诱导的肾损伤。25μmdha处理对hrgecs的生长特性没有影响,但却显著地抑制tnf-α引起的通透性过高。我们的实验有助于更好地理解出现以上结果的机制,在脓毒症引起的组织损伤方面具有临床应用价值,dha及其他临床上安全的青蒿素衍生物可能成为治疗脓毒症损伤的药物。
以上所述仅为本申请的优选实施例而已,并不用于限制本申请,对于本领域的技术人员来说,本申请可以有各种更改和变化。凡在本申请的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本申请的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!