本发明属于材料技术领域,具体涉及一种3d聚吡咯壳聚糖明胶复合电导材料及其制备方法。
背景技术:
随着经济社会的发展,先天性心脏病(congenitalheartdiease,chd)患儿的出生率已经有明显的下降;然而有研究表明,包括中国在内的亚洲地区,chd出生率高达0.9%,是严重威胁儿童健康成长的疾病之一,给个人、家庭、社会带来沉重负担。近年来,心肌梗死引起大量心肌细胞纤维死亡形成瘢痕并纤维化,破坏了心脏原有的点活动传导通路,不仅引起心脏收缩舒张功能下降,还能引起心脏电活动异常,如传导延迟、各种类型的心率失常。重构瘢痕区传导能够让残存心肌同步化。先天性心脏病是婴幼儿死亡的主要原因之一。
心脏组织工程作为一种修复心脏缺损的手段引起了人们极大的关注。很多可降解的生物材料(例如海藻酸、胶原蛋白、明胶海绵和聚乙醇酸)可用于修复心脏的缺损或使心脏梗死区稳定和防止心脏扩张。前期研究发现,在动物心梗模型中,用明胶海绵负载心肌细胞进行贴片移植,证实能够支持细胞存活和促进局部血管生成;海藻酸多孔补片也用于心梗的实验研究;3d聚乙醇酸作为一种生物相容材料可以支持胚胎干细胞向心肌样细胞分裂和增殖。轻中度心室功能障碍的患者可能受益于细胞因子注射、细胞补片、水凝胶注射或心梗部位表面加固。然而,这些生物材料导电性差或是绝缘体,限制其应用,急需研究新材料来解决上述问题。
导电生物材料是一种特殊的导电聚合材料,具有金属离子导电性;很多导电聚合材料应用于生物组织工程中,ppy是研究最多的导电聚合,具有良好的导电性和生物相容性。有学者合成3dppy-plga导电复合材料,应用于心肌祖细胞和ips细胞研究,该材料具有良好的生物相容性和导电性,且能够支持心肌祖细胞和ips细胞向心肌增殖分化能力。
然而,很少有研究3d复合导电补片材料用于心脏组织工程的可行性,以通过其电化学特性提高心肌细胞电导率和心脏电脉冲传播。
技术实现要素:
为了解决现有技术存在的上述问题,本发明提供了一种3d聚吡咯壳聚糖明胶复合电导材料及其制备方法。本发明方法制备得到的3d聚吡咯壳聚糖明胶复合电导材料具有良好的生物相容性,较高的导电性能,较低的阻抗,能够加快心肌细胞间钙信号传递。
本发明所采用的技术方案为:
(1)配制醋酸溶液,向所述醋酸溶液中加入壳聚糖,并控制所述醋酸溶液中醋酸与壳聚糖的质量之比为0.4:1-0.6:1,搅拌条件下进行充分混合均匀,得到壳聚糖酸性溶液;
(2)向步骤(1)所述壳聚糖酸性溶液中加入吡咯,并控制所述壳聚糖酸性溶液中壳聚糖与吡咯的质量之比为1:0.03-1:0.4,搅拌条件下进行充分混合均匀,得到壳聚糖-吡咯混合溶液;
(3)配制三氯化铁溶液,在暗室中、搅拌条件下,将所述三氯化铁溶液缓慢滴加至所述壳聚糖-吡咯混合溶液中,控制三氯化铁溶液中三氯化铁与吡咯的质量之比为1:0.2-1:0.4;滴加完后,继续搅拌至充分反应,得到黑色的聚吡咯-壳聚糖聚合物溶液;
(4)将所述聚吡咯-壳聚糖聚合物溶液置于反渗式透析袋中,采用pbs缓冲液透析去掉多余的铁离子和吡咯,之后采用甘油磷酸二钠对所述聚吡咯-壳聚糖聚合物溶液调节ph为5.8-6.5,备用;
(5)向步骤(4)调节ph后的聚吡咯-壳聚糖聚合物溶液中加入明胶海绵片,充分混合均匀后,加入戊二醛,并控制所述戊二醛与所述聚吡咯-壳聚糖聚合物溶液的体积之比为1:250-1:1000,充分反应,依次进行脱水、冻干,即得所述的3d聚吡咯壳聚糖明胶复合电导材料。
步骤(1)中,所述醋酸溶液的浓度为0.17-0.18mol/l。
步骤(1)中,进行所述搅拌的速度为300-500rpm,进行所述搅拌的时间为2-4h。
步骤(2)中,进行所述搅拌的速度为300-500rpm,进行所述搅拌的时间为8-12h。
步骤(3)中,所述三氯化铁溶液的浓度为0.067-0.67mol/l。
步骤(3)中,所述三氯化铁溶液的滴加速度为0.3-0.6ml/h。
步骤(4)中,所述pbs缓冲液为0.05×pbs-0.2×pbs。
步骤(4)中,所述甘油磷酸二钠的质量浓度为45-55%。
步骤(5)中,所述明胶海绵片的规格为10mm*3mm*60mm,所述戊二醛的质量浓度为0.4-4%;
所述脱水为酒精梯度脱水(酒精梯度浓度依次为30%-50%-70%-80%-90%-100%,每次3min,共2次),所述冻干的时间为12-24h。
所述方法制备得到的3d聚吡咯壳聚糖明胶复合电导材料。
本发明的有益效果为:
本发明所述的3d聚吡咯壳聚糖明胶复合电导材料的制备方法,先利用壳聚糖和吡咯为原料,在单电子还原剂三氯化铁存在条件下,反应生成聚吡咯-壳聚糖聚合物;之后在交联剂戊二醛存在条件下,将聚吡咯-壳聚糖聚合物交联于明胶海绵片的孔隙中,形成具有多孔结构的3d聚吡咯壳聚糖明胶复合电导材料。本发明方法制备得到的3d聚吡咯壳聚糖明胶复合电导材料具有较好的机械强度,良好的生物相容性,较高的导电性能,较低的阻抗,电压损失小,能够加快心肌细胞间ca2+信号传递。在体外评估实验证明,所述3d聚吡咯壳聚糖明胶复合电导材料在大鼠心脏中作为修补材料来取代全层右心室流出道(rvot)缺陷具备可行性和有效性。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1是壳聚糖与吡咯反应生成聚吡咯壳聚糖的反应机理图;
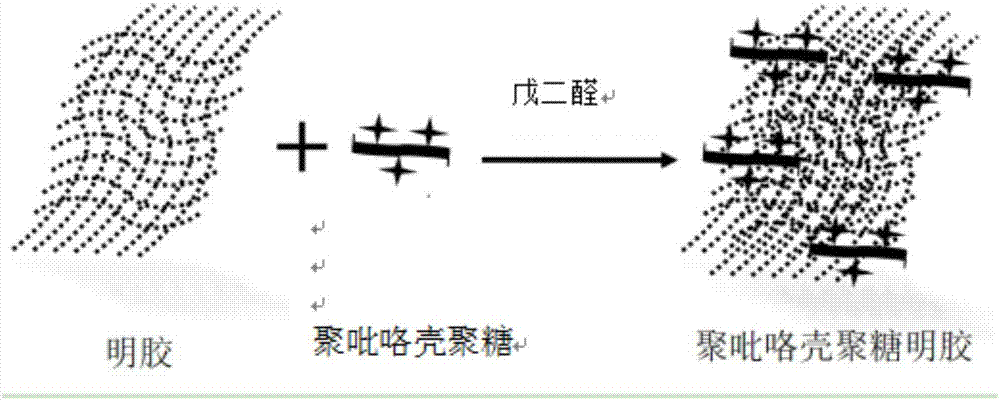
图2是聚吡咯壳聚糖交联于明胶孔隙中形成3d聚吡咯壳聚糖明胶复合电导材料的合成机理图;
图3a-3c分别为吡咯、壳聚糖、聚吡咯壳聚糖的红外图谱;
图4a-4c分别为明胶、壳聚糖明胶、聚吡咯壳聚糖明胶复合电导材料的sem图;
图5为明胶、壳聚糖明胶、聚吡咯壳聚糖明胶复合电导材料的应力变力对比图;
图6为明胶、壳聚糖明胶、聚吡咯壳聚糖明胶复合电导材料的断裂应力统计分析对比图;
图7为明胶(gel)、壳聚糖明胶(chi-gel)、聚吡咯壳聚糖明胶复合电导材料(ppy-chi-gel)的生物相容性对比分析图;
图8a为明胶(gel)、壳聚糖明胶(chi-gel)、聚吡咯壳聚糖明胶复合电导材料(ppy-chi-gel)的循环i-v图;
图8b为明胶(gel)、壳聚糖明胶(chi-gel)、聚吡咯壳聚糖明胶复合电导材料(ppy-chi-gel)的导电率对比图;
图9为明胶(gel)、壳聚糖明胶(chi-gel)、聚吡咯壳聚糖明胶复合电导材料(ppy-chi-gel)在电信号通过后记录到的电压统计结果对比图;
图10为gel、chi-gel、ppy-chi-gel三种材料上两个感兴趣区间(roi#1、roi#2)上nrvm间ca2+信号传递速度统计分析对比图;
图11为心脏超声观察到ppy-chi-gel补片后7天超声心动图;
图12a为gel、chi-gel、ppy-chi-gel移植7天后补片面积变化情况;
图12b为gel、chi-gel、ppy-chi-gel移植28天后补片面积变化情况;
图12c为gel、chi-gel、ppy-chi-gel移植28天后补片横断面厚度统计结果;
图13为gel、chi-gel、ppy-chi-gel在缺损心肌间电信号传导速度统计分析对比图。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚,下面将对本发明的技术方案进行详细的描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所得到的所有其它实施方式,都属于本发明所保护的范围。
实施例1
本实施例提供一种3d聚吡咯壳聚糖明胶复合电导材料的制备方法,包括如下步骤:
(1)配制浓度为0.172mol/l的醋酸溶液,向所述醋酸溶液中加入壳聚糖,并控制所述醋酸溶液中醋酸与壳聚糖的质量之比为0.525:1,400rpm搅拌条件下搅拌4h进行充分混合均匀,得到壳聚糖酸性溶液;
(2)向步骤(1)所述壳聚糖酸性溶液中加入吡咯,并控制所述壳聚糖酸性溶液中壳聚糖与吡咯的质量之比为1:0.294,400rpm搅拌条件下搅拌12h进行充分混合均匀,得到壳聚糖-吡咯混合溶液;
(3)配制浓度为0.67mol/l的三氯化铁溶液,在4℃的暗室中、搅拌条件下,将所述三氯化铁溶液以0.5ml/h的滴加速度缓慢滴加至所述壳聚糖-吡咯混合溶液中,控制三氯化铁溶液中三氯化铁与吡咯的质量之比为1:0.3;滴加完后,继续搅拌48h进行充分反应,得到黑色的聚吡咯-壳聚糖聚合物溶液(ppy-chi),反应机理图见图1;
(4)将所述聚吡咯-壳聚糖聚合物溶液置于12-14kd反渗式透析袋中,采用0.1×pbs(1l溶液中含na2hpo4为0.142g,kh2po4为0.027g,nacl为0.8g,kcl为0.02g)缓冲液透析去掉多余的铁离子和吡咯,之后采用质量浓度为50%的甘油磷酸二钠对所述聚吡咯-壳聚糖聚合物溶液调节ph为6,备用;
(5)向步骤(4)调节ph后的聚吡咯-壳聚糖聚合物溶液中加入规格为10mm*3mm*60mm的明胶海绵片,充分混合均匀后,加入质量浓度为4%的戊二醛,并控制所述戊二醛与所述聚吡咯-壳聚糖聚合物溶液的体积之比为1:250,充分反应,采用酒精梯度脱水后(酒精梯度浓度依次为30%-50%-70%-80%-90%-100%,每次洗脱3min,共洗脱2次),冻干24h,即得所述的3d聚吡咯壳聚糖明胶复合电导材料(ppy-chi-gel),合成机理图见图2。
实施例2
本实施例提供一种3d聚吡咯壳聚糖明胶复合电导材料的制备方法,包括如下步骤:
(1)配制浓度为0.17mol/l的醋酸溶液,向所述醋酸溶液中加入壳聚糖,并控制所述醋酸溶液中醋酸与壳聚糖的质量之比为0.4:1,300rpm搅拌条件下搅拌4h进行充分混合均匀,得到壳聚糖酸性溶液;
(2)向步骤(1)所述壳聚糖酸性溶液中加入吡咯,并控制所述壳聚糖酸性溶液中壳聚糖与吡咯的质量之比为1:0.03,300rpm搅拌条件下搅拌12h进行充分混合均匀,得到壳聚糖-吡咯混合溶液;
(3)配制浓度为0.067mol/l的三氯化铁溶液,在4℃的暗室中、搅拌条件下,将所述三氯化铁溶液以0.3ml/h的滴加速度缓慢滴加至所述壳聚糖-吡咯混合溶液中,控制三氯化铁溶液中三氯化铁与吡咯的质量之比为1:0.2;滴加完后,继续搅拌24h进行充分反应,得到黑色的聚吡咯-壳聚糖聚合物溶液(ppy-chi);
(4)将所述聚吡咯-壳聚糖聚合物溶液置于12-14kd反渗式透析袋中,采用0.05×pbs缓冲液透析去掉多余的铁离子和吡咯,之后采用质量浓度为45%的甘油磷酸二钠对所述聚吡咯-壳聚糖聚合物溶液调节ph为5.8,备用;
(5)向步骤(4)调节ph后的聚吡咯-壳聚糖聚合物溶液中加入规格为10mm*3mm*60mm的明胶海绵片,充分混合均匀后,加入质量浓度为0.4%的戊二醛,并控制所述戊二醛与所述聚吡咯-壳聚糖聚合物溶液的体积之比为1:250,充分反应,采用酒精梯度脱水后,冻干12h,即得所述的3d聚吡咯壳聚糖明胶复合电导材料(ppy-chi-gel)。
实施例3
本实施例提供一种3d聚吡咯壳聚糖明胶复合电导材料的制备方法,包括如下步骤:
(1)配制浓度为0.18mol/l的醋酸溶液,向所述醋酸溶液中加入壳聚糖,并控制所述醋酸溶液中醋酸与壳聚糖的质量之比为0.6:1,500rpm搅拌条件下搅拌2h进行充分混合均匀,得到壳聚糖酸性溶液;
(2)向步骤(1)所述壳聚糖酸性溶液中加入吡咯,并控制所述壳聚糖酸性溶液中壳聚糖与吡咯的质量之比为1:0.04,500rpm搅拌条件下搅拌8h进行充分混合均匀,得到壳聚糖-吡咯混合溶液;
(3)配制浓度为0.67mol/l的三氯化铁溶液,在4℃的暗室中、搅拌条件下,将所述三氯化铁溶液以0.3ml/h的滴加速度缓慢滴加至所述壳聚糖-吡咯混合溶液中,控制三氯化铁溶液中三氯化铁与吡咯的质量之比为1:0.4;滴加完后,继续搅拌48h进行充分反应,得到黑色的聚吡咯-壳聚糖聚合物溶液(ppy-chi);
(4)将所述聚吡咯-壳聚糖聚合物溶液置于12-14kd反渗式透析袋中,采用0.2×pbs缓冲液透析去掉多余的铁离子和吡咯,之后采用质量浓度为65%的甘油磷酸二钠对所述聚吡咯-壳聚糖聚合物溶液调节ph为6.5,备用;
(5)向步骤(4)调节ph后的聚吡咯-壳聚糖聚合物溶液中加入规格为10mm*3mm*60mm的明胶海绵片,充分混合均匀后,加入质量浓度为4%的戊二醛,并控制所述戊二醛与所述聚吡咯-壳聚糖聚合物溶液的体积之比为1:250,充分反应,采用酒精梯度脱水后,冻干24h,即得所述的3d聚吡咯壳聚糖明胶复合电导材料(ppy-chi-gel)。
对比例
本对比例提供一种壳聚糖明胶作为对照,该壳聚糖明胶采用如下方法制备:
实施例1中制得壳聚糖酸性溶液后,不加三氯化铁溶液,直接溶液透析后,调整ph为6,加入戊二醛,各物质用量同实施例1,其他步骤相同,合成壳聚糖明胶(chi-gel)作为对照。
实验例
1、聚吡咯壳聚糖聚合物的红外光谱分析
图3a为98%吡咯的红外图谱,在942cm-1和1014cm-1可以观察到n-c键的特征吸收波长;在1669cm-1处可观察到n-h键频率,由于其中含有水,在3389cm-1可以观察到o-h键频率;图3b为壳聚糖的红外图谱,在977cm-1和1088cm-1处有c-o和c-o-c特征吸收峰,这是chi主要的化学键组成,还可以观察到chi中n-h键和o-h键的特征吸收峰1638cm-1和3304cm-1;图3c为ppy-chi(聚吡咯壳聚糖聚合物)红外图谱,在950cm-1、1064cm-1可以观察到n-c、c-o-c二者的特征频率,在1654cm-1可以观察到n-h键的存在,由于官能团和化学键相互影响,相同的官能团和化学键在不同的材料中有一定平移,在本次试验中也得到了体现。
2、明胶(gel)、壳聚糖明胶(chi-gel)、聚吡咯壳聚糖明胶复合电导材料(ppy-chi-gel)的超微结构分析
将三种材料(gel、chi-gel、ppy-chi-gel)分别用梯度酒精脱水和液态co2临界点干燥后,金包被处理并进行扫描电镜检查,结果如图图4a-4c所示,发现从表面观察,gel、chi-gel、ppy-chi-gel三种材料表面孔径大小不一,chi-gel、ppy-chi-gel小于gel本身,在chi-gel、ppy-chi-gel材料表面有较多的颗粒状物质覆盖。
3、明胶(gel)、壳聚糖明胶(chi-gel)、聚吡咯壳聚糖明胶复合电导材料(ppy-chi-gel)的机械强度分析
如图5所示为gel、chi-gel、ppy-chi-gel的典型应力变力对比图,可见,gel,chi-gel、ppy-chi-gel断裂应力逐渐增高,分别为8.24±1.52kpa、12.37±2.76kpa、19.21±3.16kpa。
如图6所示为gel、chi-gel、ppy-chi-gel的断裂应力统计分析对比图。
4、明胶(gel)、壳聚糖明胶(chi-gel)、聚吡咯壳聚糖明胶复合电导材料(ppy-chi-gel)的生物相容性对比分析
应用细胞能否粘附于材料表面评价材料的生物相容性,将新分离的乳鼠心肌细胞(nrvm)按相同浓度接种于gel、chi-gel、ppy-chi-gel表面,df12分别培养1、3、5天,用dapi标记细胞核来检测细胞数量;在1、3、5天的观察点中,发现细胞数量在gel、chi-gel、ppy-chi-gel三种材料中没有明显差异(如图7所示)。
5、明胶(gel)、壳聚糖明胶(chi-gel)、聚吡咯壳聚糖明胶复合电导材料(ppy-chi-gel)的导电率测试
将三种材料gel、chi-gel、ppy-chi-gel剪成相同大小的长方体,循环伏安法测量三种材料的导电率。具体为:将材料置于半导体测试仪hp4155测试台上,两探针间距(d)为7mm,循环电压为-5-5v;测出斜率,应用公式1/[2πd(v/i)]计算出相应材料的导电率。
图8a为通过hp4155半导体测试仪得到的gel、chi-gel、ppy-chi-gel三种材料循环i-v图,随着电压变化,gel电流基本上处于0点附近,表现出绝缘体特性,chi-gel、ppy-chi-gel电流渐进性增加,表现出半导体特性,ppy-chi-gel电流峰值明显高于chi-gel和gel。
图8b可以看出gel、chi-gel、ppy-chi-gel三种材料导电率明显不同,gel导电率接近于零,chi-gel的导电率为(4.78±1.61)*10-5s/cm,ppy-chi-gel的导电率为(12.49±2.25)*10-5s/cm,约为chi-gel的3倍,证明新合成的ppy-chi-gel材料有较高的导电性能。
6、明胶(gel)、壳聚糖明胶(chi-gel)、聚吡咯壳聚糖明胶复合电导材料(ppy-chi-gel)的电压损失测试
在串联电路中,电流经过电阻越大,损失的电压就越多,测量的电压就越小,基于上述原理我们用相同强度的电信号(1mv,80次/分钟)刺激gel、chi-gel、ppy-chi-gel的一侧,在对侧用ecg记率电压值,比较记率到三种材料的电压值,间接反应它们的电阻不同,进而得出它们的导电性不同。
图9为电信号通过gel、chi-gel、ppy-chi-gel后记率到电压统计结果,在gel材料中,记率到的电信号趋近于0,在chi-gel材料中,记率到的电压值0.13±0.03mv,而在在ppy-chi-gel材料中,记率到的电压值0.34±0.13mv,明显高于前两种。
7、明胶(gel)、壳聚糖明胶(chi-gel)、聚吡咯壳聚糖明胶复合电导材料(ppy-chi-gel)在nrvm细胞间ca2+传导速度。
将新分离的nrvm细胞接种于gel、chi-gel、ppy-chi-gel材料上,df-12培养5天后,细胞间ca2+信号瞬时传递用ca2+敏感的示踪剂fluo-4am标记,488nm激光激发,在显微系统中用光学高速电子电荷耦合装置成像(emccd)系统记录,通过imagej软件计算出两个感兴趣区间ca2+瞬时传递速度。
图10所示为gel、chi-gel、ppy-chi-gel三种材料上两个感兴趣区间(roi#1、roi#2)上nrvm间ca2+信号传递速度统计分析,在gel和chi-gel,nrvm间ca2+信号传导速度平均为20毫米每秒,而在ppy-chi-gel上传导速度为70毫米每秒,差异有统计学意义(p<0.01,n=6)。
8、明胶(gel)、壳聚糖明胶(chi-gel)、聚吡咯壳聚糖明胶复合电导材料(ppy-chi-gel)在大鼠右心流出道缺损模型中的应用及评价
8.1sd大鼠rvot缺损模型及补片手术
应用液氮局部冷冻的方法可以引起rvot局部心肌组织透壁性死亡,再在外围荷包缝合的基础上,减掉中间坏死的心肌组织形成直径为3mm的缺损,再用外科手术缝合线将gel、chi-gel、ppy-chi-gel缝合在缺损表面,形成补片样结构。
如图11所示为心脏超声观察到ppy-chi-gel补片后7天超声心动图,超声心动图短轴层面可以清楚显示rvot局部心肌组织缺损和表面的移植材料,箭头示rvot缺损部位,线圈示ppy-chi-gel材料所在位置,lv左心室,rv右心室。
8.2gel、chi-gel、ppy-chi-gel在体内降解
在手术后7天、28天,分别将一定数量gel、chi-gel、ppy-chi-gel材料移植手术后sd大鼠麻醉状态下分离心脏,用心脏停跳液将心脏灌停处于舒张期,用佳能相机按原比例高清拍照,对材料的表面积通过imagej进行统计分析。
图12a所示为gel、chi-gel、ppy-chi-gel移植7天后材料表面积变化情况,三组没有统计学差异(p>0.05);图12b所示为gel、chi-gel、ppy-chi-gel移植28天后材料表面积变化情况,ppy-chi-gel组表面积明显大于其他两组(p<0.01)。图12b所示为gel、chi-gel、ppy-chi-gel移植28天后2mm厚的心脏标本环图,可以观察到在大鼠rvot缺损部分外表面有gel、chi-gel、ppy-chi-gel材料覆盖,观察局部gel、chi-gel、ppy-chi-gel材料厚度变化及材料厚度统计分析结果,ppy-chi-gel厚于其他两组。
9、明胶(gel)、壳聚糖明胶(chi-gel)、聚吡咯壳聚糖明胶复合电导材料(ppy-chi-gel)在缺损心肌间电信号传导速度研究
在体外,我们已经证明ppy-chi-gel能加快nrvm细胞间ca2+信号传递;用opticalmapping观察ppy-chi-gel材料能否加快缺损心肌间电信号传导速度。具体为:在rvot缺损模型即刻进行gel、chi-gel、ppy-chi-gel移植,28天后分离心脏并用电压敏感的染料灌注心脏,用eccd记录rvot信号变化情况,应用brainvision1508分析。正常心脏rvot、rvot-gel、rvot-chi-gel、rvot-ppy-chi-gel局部电信号传导随时间变化,速度分别为0.92±0.12m/s、0.58±0.04m/s、0.66±0.09m/s、0.82±0.04m/s。如图13所示,rvot-ppy-chi-gel局部电信号传导明显快于rvot-gel和rvot-chi-gel(p<0.05),而与正常rvot局部电信号传导速度没有明显差异。
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以所述权利要求的保护范围为准。