一种用于防治结核病的结核多肽疫苗及其制备方法、应用与流程
本发明涉及一种用于防治结核病的结核多肽疫苗及其制备方法、应用,属于生物制药工程技术领域。
背景技术:
结核病(Tuberculosis,TB)是由结核分枝杆菌复合群(Mycobacterium tuberculosis complex,MTC)引起的一种慢性消耗性传染病。结核分枝杆菌复合群主要包括结核分枝杆菌(Mycobacterium tuberculosis)、牛结核分枝杆菌(Mycobacterium bovis)、非洲分枝杆菌(Mycobacterium africanum)三种对人和动物有明显致病性的分枝杆菌。在世界范围内,结核病的发病率和死亡率都居各类传染病前列。我国属于结核病高负担国家之一,流行形势十分严峻,结核病患者数量约占全世界的1/4,是单一感染因素引起死亡人数最多的疾病之一。从上个世纪50年代开始全世界普遍接种卡介苗预防和使用链霉素等抗结核药物治疗,结核病的蔓延曾一度得到控制,发病率和死亡率显著下降。但近年来,随着人口流动增加,耐药结核出现和艾滋病感染等新因素,结核病在全球重新流行。非洲南部,东南亚和中国是结核病重疫区,中国被世界卫生组织(WHO)称为“最应引起警示的国家和地区”之一。
目前唯一用于临床预防结核病的疫苗是卡介苗(BCG,减毒牛结核分枝杆菌疫苗)。接种BCG对于减少小儿结核性脑膜炎和粟粒性肺结核的发生,有非常重要的价值和意义。遗憾的是,BCG对于预防成人结核病发病的作用十分有限。环境分枝杆菌致敏是影响BCG效力的一个重要因素。接触环境分枝杆菌可获得不同水平的抗MTC感染的保护作用,但不足以控制以后毒力更强的MTC的攻击,接触环境分枝杆菌后却会完全阻断由BCG正常提供的抗MTC攻击的保护作用。因此,幼年未接种过BCG在成年之后复种,成年后新接种的BCG基本无效。早在上个世纪,基于多个国家的研究数据表明,不同地区,不同年龄和不同人群接种BCG的预防有效率从0%—80%不等。此外,比较基因组学已证实BCG在长期传代中缺失了一些保护性免疫基因区域,菌种品质退化,以及MTC自身的进化适应性,致使BCG的免疫效果也不如以前。随着结核病疫情的再次攀升和新的流行特征的出现,在世界范围内使用约100年的BCG疫苗已经不能充分满足人们预防结核病的要求,迫切需要新型有效的结核病疫苗的出现。
世界范围内正在开发的结核病疫苗包括基因工程减毒或免疫增强活疫苗、全菌体灭活疫苗、亚单位疫苗、DNA疫苗、初免-加强疫苗等。多肽疫苗可以称之为一种特殊的亚单位疫苗。多肽疫苗按照特殊的病原体抗原基因中已知或预测的某段抗原表位的氨基酸序列,通过化学合成多肽制备疫苗。通过比较基因组学和蛋白质组学寻找BCG与MTC标准强菌株H37RV差异表达谱,人们获得了一些疑似MTC保护性抗原蛋白,如Ag85B和ESAT-6这些蛋白。但由于生命体内分子网络调节的复杂性和整体性,这些多肽片段是否在体内也起同等作用,从而用于制备结核疫苗目前仍然未知。此外,这些多肽片段是否适合体外合成生产,哪些多肽片段能在体内引起较好的体液免疫和细胞免疫水平,应该配合哪种佐剂(或载体)能达到实际较好的抗结核免疫效果仍然未知。
壳聚糖(chitosan,CS),又名脱乙酰甲壳素,是一种近年来备受关注的小分子载体,可装载核酸、蛋白质、激素和药物等。壳聚糖具有良好的组织相容性,无免疫原性,可提高全身和局部免疫反应。作为抗原载体,其可促使大分子顺利地通过上皮组织屏障,减少抗原降解,并促进抗原提呈。抗原与壳聚糖结合形成纳米粒后,可延长抗原在休内的停留时间,起到疫苗缓释的作用,加强免疫反应。壳聚糖本身除了具备普通高分子材料的物理化学、机械性能稳定以及可接受消毒等相应处理的特性外,还能够在生物体内酶解成易被吸收、无毒副作用的小分子物质,并且不会残留在活体内。除了壳聚糖自身,近年来出现了各种经过化学改良的壳聚糖衍生物,这些衍生物作为疫苗佐剂,已经运用到如乙型肝炎病毒、幽门螺杆菌、新城疫病毒等人用及兽用疫苗研制中。也有人将壳聚糖作为链霉素药物载体和编码T细胞抗原表位的DNA疫苗的佐剂用于结核病的防治研究。但目前尚未有壳聚糖及其衍生物作为佐剂结合结核病抗原多肽用于结核病的防治的相关研究及报道。
技术实现要素:
本发明的目的是提供一种用于防治结核病的结核多肽疫苗,可用于预防成人结核病。
本发明还提供了上述结核多肽疫苗的制备方法。
本发明还提供了上述结核多肽疫苗的应用。
为了实现上述目的,本发明所采用的技术方案是:
一种用于防治结核病的结核多肽疫苗,包括结核多肽和载体,所述结核多肽包括结核分枝杆菌Rv0180c蛋白81~100位氨基酸片段、Rv0227c蛋白261~280位氨基酸片段和Rv2004c蛋白281~300位氨基酸片段中的一种或多种。
本发明的多肽疫苗集中了一个或多个抗原蛋白主要保护性表位,由于多肽比完整的抗原蛋白分子量更小,且采用人工合成的方式,产量大,纯度高,可以进行质量控制和标化,制成“鸡尾酒”式的复合疫苗。
所述的结核多肽可采用化学方法合成。所述的化学方法是固相多肽合成法,即以氨基酸为主要原料,在全自动多肽合成仪中合成多肽。本发明中的所述结核多肽可以单独或与药学上可以接受的载体(如弗氏不完全佐剂)或者赋形剂混合制成结核多肽疫苗,制备方法同现有技术中的方法。
所述的Rv0180c蛋白分子量47.6kDa,由452氨基酸组成。Rv0180c是菌体跨膜蛋白,Rv0180c蛋白81~100位氨基酸这段多肽可以紧密吸附在U937(单核巨噬细胞)和A549(2型肺泡上皮细胞)细胞表面,并有效阻止MTB进入细胞内,其为MTB侵染细胞的关键性多肽,因此本发明选用Rv0180c蛋白81~100位氨基酸作为疫苗用结核多肽。
所述的Rv0227c蛋白分子量45.5kDa,由421氨基酸组成。Rv0227c是菌体表面蛋白,Rv0227c蛋白261~280位氨基酸这段多肽可以紧密吸附在U937和A549细胞表面,并能有效阻止MTB进入细胞,其为MTB侵染细胞的关键性多肽,因此本发明选用Rv0227c蛋白261~280位氨基酸作为疫苗用结核多肽。
所述的Rv2004c蛋白分子量约54.4kDa,由498氨基酸组成。Rv2004c是菌体表面蛋白,Rv2004c蛋白281~300位氨基酸这段多肽可以紧密吸附在U937和A549细胞表面,并能有效阻止MTB进入细胞,其为MTB侵染细胞的关键性多肽,因此本发明选用Rv2004c蛋白281~300位氨基酸作为疫苗用结核多肽。
本发明中使用的Rv0180c(如SEQ ID NO.1所示)、Rv2004c(如SEQ ID NO.2所示)和Rv0227c(如SEQ ID NO.3所示)蛋白是BCG丢失的抗原或致病性结核分枝杆菌复合群里的菌株共有的保护性抗原,在致病菌株侵入细胞并引起细胞免疫反应中起作用,这些保护性抗原蛋白中的一部分多肽片段能与易感细胞紧密结合,有效阻止结核分枝杆菌H37Rv侵入细胞内。
优选的,所述结核多肽由结核分枝杆菌Rv0180c蛋白81~100位氨基酸片段、Rv0227c蛋白261~280位氨基酸片段和Rv2004c蛋白281~300位氨基酸片段三种多肽组成。所述三种多肽的质量比为0.5-1.5:0.5-1.5:0.5-1.5。优选的,所述三种多肽的质量比为1:1:1。
本发明通过实验筛选,综合选取了三段多肽,这三段筛选的多肽片段,均为MTB重要保护性抗原中的关键性多肽片段,且集中了多个抗原的主要保护性表位,和单个抗原保护性表位相比,多个抗原保护性表位能使疫苗获得更强的保护力。此外,经过理化性质分析,这三段多肽的天然结构和亲水性较好,适合人工合成。
优选的,所述载体为壳聚糖-脱氧胆酸偶联物。由于多肽的分子量小,若单纯免疫效果可能较弱,本发明中找到了有效的结核分枝杆菌保护性抗原多肽和与之匹配的疫苗佐剂,选用脱乙酰的壳聚糖-脱氧胆酸偶联物作为多肽的载体(佐剂),能够激起机体有效的体液免疫和细胞免疫反应。
所述壳聚糖-脱氧胆酸偶联物中壳聚糖的分子量为58000~62000。所述壳聚糖-脱氧胆酸偶联物中壳聚糖的脱乙酰度≥90.0%。
所述壳聚糖-脱氧胆酸偶联物由包括如下步骤的方法制得:将壳聚糖溶于乙酸水溶液,然后用甲醇稀释,得稀释液;在所述稀释液中依次加入脱氧胆酸、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐,混合后室温下反应20-28h,得反应混合物;将反应混合物倒入甲醇/氨溶液中,混匀后分离沉淀,将所述沉淀洗涤、干燥,即得。具体的所述混匀后离心取沉淀;将所述沉淀依次用蒸馏水、甲醇和乙醚充分洗涤后,冷冻干燥36~48h,即得。
本发明中在真空冷冻干燥器中冷冻干燥36~48h后得到疏松干燥的固体,即为壳聚糖-脱氧胆酸偶联物。
所述壳聚糖、脱氧胆酸和1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐的质量比为15-25:80-90:60-65。优选的壳聚糖、脱氧胆酸和1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐的质量比为20:85:62。
所述乙酸水溶液中乙酸和水的体积比为1:99。
所述壳聚糖、乙酸水溶液、稀释用甲醇和甲醇/氨溶液的质量体积比为0.2g:20mL:20mL:60mL。所述甲醇/氨溶液中甲醇和氨水的体积比为7:3。
本发明中所述的壳聚糖-脱氧胆酸偶联物是经过化学方法改良的两亲性壳聚糖,可在一定物理化学条件下,与多肽一起,自组装聚集成壳聚糖-脱氧胆酸偶联物包裹着多肽的纳米颗粒,自组装的特性让多肽和载体结合形成纳米颗粒的制备方法更简便、可控。此外,多肽被包裹在壳聚糖-脱氧胆酸偶联物颗粒内部,在机体里能起到抗原缓慢释放的作用,增强疫苗免疫效果。
上述的结核多肽疫苗的制备方法,包括如下步骤:将所述壳聚糖-脱氧胆酸偶联物溶于PBS溶液中,制得偶联物溶液;将所述结核多肽的混合物溶于PBS溶液中,制得多肽溶液;将所述多肽溶液滴加到所述偶联物溶液中,混匀后于3-5℃静置2.5-3.5h,分离沉淀,即得。该步骤中采用超高速离心分离沉淀,所述超高速离心为于4℃在16000~20000×g条件下离心30~45min。该步骤中所述沉淀为壳聚糖-脱氧胆酸偶联物包裹的结核多肽纳米颗粒。所述的结核多肽纳米颗粒为类球形,直径在30~100nm之间。
本发明中将所述壳聚糖-脱氧胆酸偶联物溶于PBS溶液中,磁力搅拌3-5h,制得偶联物溶液。
所述的核多肽纳米颗粒单独或与药学上可以接受的载体或者赋形剂混合,即为以壳聚糖-脱氧胆酸偶联物为载体的结核多肽疫苗。
本发明的结核多肽疫苗的制备方法,将壳聚糖-脱氧胆酸偶联物和结核多肽混合后于低温自组装,能够聚集形成壳聚糖-脱氧胆酸偶联物包裹着多肽的纳米颗粒,自组装的特性让多肽和载体结合形成纳米颗粒的制备方法更简便、可控。
所述壳聚糖-脱氧胆酸偶联物与结核多肽的质量比为5.5-11:2.5-5。
所述偶联物溶液中壳聚糖-脱氧胆酸偶联物的终浓度为2.2~4.4mg/mL。所述多肽溶液中结核多肽的终浓度为5.0~10.0mg/mL。
所述PBS溶液的pH为7.2~7.4。
上述的结核多肽疫苗在制备预防或治疗结核病的药物中的应用。
本发明提供了用于防治结核病的结核多肽疫苗及其应用,以壳聚糖-脱氧胆酸偶联物为载体的结核多肽疫苗的制备方法。传统卡介苗对于成人的结核病的预防效果并不明显,而在结核分支杆菌变异、耐药性增加、与艾滋病毒混合感染等新流行形势下,传统卡介苗预防结核病的效率更是大大下降,本申请的这种以壳聚糖-脱氧胆酸偶联物为载体的结核多肽纳米疫苗,正是解决了这种问题,该疫苗可以激起有效的体液免疫,促使机体产生特异性IgG抗体;该疫苗还可以激起有效的细胞免疫,引起脾淋巴细胞显著增殖,刺激脾淋巴细胞产生IFN-γ,从而达到较好的免疫效果。
附图说明
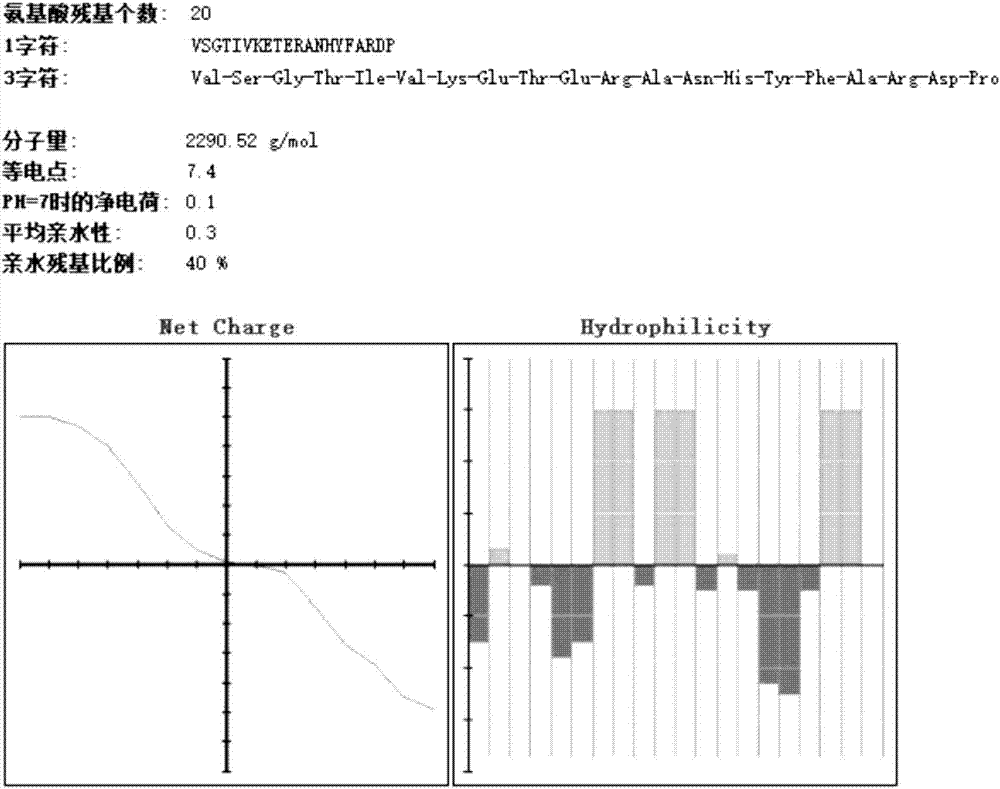
图1为Rv0180c蛋白81~100位氨基酸片段的基本理化性质预测图;
图2为Rv0227c蛋白261~280位氨基酸片段的基本理化性质预测图;
图3为Rv2004c蛋白281~300位氨基酸片段的基本理化性质预测图;
图4为实施例1中壳聚糖-脱氧胆酸偶联物紫外线检测图谱;
图5为实施例1中壳聚糖-脱氧胆酸偶联物核磁共振图谱;
图6为壳聚糖-脱氧胆酸偶联物包裹的结核多肽纳米颗粒电子显微镜观察图;
图7为各组免疫小鼠的脾淋巴细胞刺激指数(SI)和IFN-γ水平检测对比图。
具体实施方式
下面结合具体实施例对本发明做进一步的详细说明。以下实施例及试验例中实验动物为由河南省实验动物中心提供。以下实施例中采用的壳聚糖为的分子量为58000~62000,脱乙酰度≥90.0%。
实施例1
本实施例中以壳聚糖-脱氧胆酸偶联物为载体的结核多肽纳米疫苗,包括壳聚糖-脱氧胆酸偶联物与结核多肽;所述结核多肽由结核分枝杆菌Rv0180c蛋白81~100位氨基酸片段、Rv0227c蛋白261~280位氨基酸片段和Rv2004c蛋白281~300位氨基酸片段三种多肽组成。
上述的结核多肽纳米疫苗的制备包括如下步骤:
(1)合成三种结核多肽
合成结核分枝杆菌Rv0180c蛋白81~100位氨基酸片段、Rv0227c蛋白261~280位氨基酸片段和Rv2004c蛋白281~300位氨基酸片段。
Rv0180c蛋白81~100位氨基酸的基本理化性质如图1所示;Rv0227c蛋白261~280位氨基酸的基本理化性质如图2所示;Rv2004c蛋白281~300位氨基酸的基本理化性质如图3所示。其中“Net Charge”为在不同PH值条件下多肽的净电荷情况;等电点代表目标多肽所带净电荷为零时的pH值;根据等电点可判断多肽酸碱性。“Hydrophilicity”为多肽序列中各氨基酸残基的亲水性或疏水性;浅灰色代表多肽序列中的亲水性氨基酸,深灰色代表多肽序列中疏水性氨基酸;根据亲水性氨基酸的比例和分布可判断多肽在水的溶解性,0<平均亲水性值<2,表示亲水性良好,又不易吸潮。
从图中可以看出三种多肽的天然结构和亲水性较好,适合人工合成。
采用固相多肽合成法合成三种结核多肽,以各种氨基酸为主要原料,在全自动多肽合成仪中合成。本实施例中的三种多肽交由上海强耀生物科技有限公司代为合成。
(2)制备壳聚糖-脱氧胆酸偶联物
将0.2g壳聚糖溶于20mL的1%乙酸水溶液,然后用20ml甲醇稀释。在稀释液中依次加入0.85g脱氧胆酸,0.62g的1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC.HCL),搅拌后于室温下反应24h。将反应混合物倒入60mL甲醇/氨溶液(7/3,v/v)中,混匀。离心6000r/min,10min,取沉淀。将沉淀依次用蒸馏水、甲醇和乙醚充分洗涤,离心(6000r/min,10min),收集沉淀。将沉淀置于真空冷冻干燥器中,48h后得到疏松干燥的固体,即为壳聚糖-脱氧胆酸偶联物。
所得到的偶联物紫外线鉴定图谱如图4所示,从图中可以看出脱氧胆酸和壳聚糖对应的特征性紫外线吸收峰,以及两者形成的偶联物特征性紫外线吸收峰,表明脱氧胆酸和壳聚糖发生了偶联。核磁共振图谱如图5所示,从图中可以看出,0.6~2.5ppm之间的峰为脱氧胆酸核磁共振峰,3.0~6.0ppm之间的峰为壳聚糖主链的核磁共振峰,3.1ppm和3.7ppm处出现酰胺化学键的标志峰,表明脱氧胆酸和壳聚糖发生了偶联。
(3)组装壳聚糖-脱氧胆酸偶联物和结核多肽纳米颗粒
称取偶联物5.5mg,溶于2.5mL pH=7.2的PBS溶液,磁力搅拌4h,使偶联物溶解完全,得壳聚糖-脱氧胆酸偶联物溶液。取2.5mg上述三种结核多肽抗原(三种多肽的质量比为1:1:1)溶于0.5mL pH=7.2的PBS溶液,得多肽溶液。
将多肽溶液缓慢滴加到壳聚糖-脱氧胆酸偶联物溶液中,轻摇混匀,于4℃静置3h。然后超高速离心(160000×g,45min,4℃),取沉淀,获得壳聚糖-脱氧胆酸偶联物包裹的结核多肽抗原纳米疫苗。得到的壳聚糖-脱氧胆酸偶联物包裹的结核多肽抗原纳米疫苗为类球形。在电子显微镜下观察,其结构如图6所示,直径在30~100nm之间。
(4)以壳聚糖-脱氧胆酸偶联物为载体的结核多肽纳米疫苗
壳聚糖-脱氧胆酸偶联物包裹的结核多肽纳米颗粒自身可作为结核多肽纳米疫苗。
实施例2
本实施例中的以壳聚糖-脱氧胆酸偶联物为载体的结核多肽纳米疫苗,包括壳聚糖-脱氧胆酸偶联物与结核多肽;所述结核多肽由结核分枝杆菌Rv0180c蛋白81~100位氨基酸片段和Rv0227c蛋白261~280位氨基酸片段两种多肽组成。
上述的结核多肽纳米疫苗的制备包括如下步骤:
(1)合成两种结核多肽
合成方法同实施例1。
(2)制备壳聚糖-脱氧胆酸偶联物
将0.15g壳聚糖溶于20mL的1%乙酸水溶液,然后用20ml甲醇稀释。在稀释液中依次加入0.8g脱氧胆酸,0.6g的1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC.HCL),搅拌后于室温下反应20h。将反应混合物倒入60mL甲醇/氨溶液(7/3,v/v)中,混匀。离心6000r/min,10min,取沉淀。将沉淀依次用蒸馏水、甲醇和乙醚充分洗涤,离心(6000r/min,10min),收集沉淀。将沉淀置于真空冷冻干燥器中,36h后得到疏松干燥的固体,即为壳聚糖-脱氧胆酸偶联物。
(3)组装壳聚糖-脱氧胆酸偶联物和结核多肽纳米颗粒
称取偶联物11mg,溶于2.5mL pH=7.3的PBS溶液,磁力搅拌3h,使偶联物溶解完全,得壳聚糖-脱氧胆酸偶联物溶液。取5mg上述两种结核多肽抗原(两种多肽的质量比为1:1)溶于0.5mL pH=7.3的PBS溶液,得多肽溶液。
将多肽溶液缓慢滴加到壳聚糖-脱氧胆酸偶联物溶液中,轻摇混匀,于3℃静置2.5h。然后超高速离心(160000×g,45min,4℃),取沉淀,获得壳聚糖-脱氧胆酸偶联物包裹的结核多肽抗原纳米疫苗。得到的壳聚糖-脱氧胆酸偶联物包裹的结核多肽抗原纳米疫苗为类球形,直径在30~100nm之间。
(4)以壳聚糖-脱氧胆酸偶联物为载体的结核多肽纳米疫苗
壳聚糖-脱氧胆酸偶联物包裹的结核多肽纳米颗粒自身可作为结核多肽纳米疫苗。
壳聚糖-脱氧胆酸偶联物包裹的结核多肽纳米颗粒还可以与药学上可以接受的载体或者赋形剂混合,即为所述的以壳聚糖-脱氧胆酸偶联物为载体的结核多肽纳米疫苗。
实施例3
本实施例中的以壳聚糖-脱氧胆酸偶联物为载体的结核多肽纳米疫苗,包括壳聚糖-脱氧胆酸偶联物与结核多肽;所述结核多肽由结核分枝杆菌Rv0227c蛋白261~280位氨基酸片段和Rv2004c蛋白281~300位氨基酸片段两种多肽组成。
上述的结核多肽纳米疫苗的制备包括如下步骤:
(1)合成两种结核多肽
合成方法同实施例1。
(2)制备壳聚糖-脱氧胆酸偶联物
将0.25g壳聚糖溶于20mL的1%乙酸水溶液,然后用20ml甲醇稀释。在稀释液中依次加入0.9g脱氧胆酸,0.65g的1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC.HCL),搅拌后于室温下反应28h。将反应混合物倒入60mL甲醇/氨溶液(7/3,v/v)中,混匀。离心6000r/min,10min,取沉淀。将沉淀依次用蒸馏水、甲醇和乙醚充分洗涤,离心(6000r/min,10min),收集沉淀。将沉淀置于真空冷冻干燥器中,42h后得到疏松干燥的固体,即为壳聚糖-脱氧胆酸偶联物。
(3)组装壳聚糖-脱氧胆酸偶联物和结核多肽纳米颗粒
称取偶联物8mg,溶于2.5mL pH=7.4的PBS溶液,磁力搅拌5h,使偶联物溶解完全,得壳聚糖-脱氧胆酸偶联物溶液。取3.75mg上述两种结核多肽抗原(两种多肽的质量比为1:1)溶于0.5mL pH=7.4的PBS溶液,得多肽溶液。
将多肽溶液缓慢滴加到壳聚糖-脱氧胆酸偶联物溶液中,轻摇混匀,于5℃静置3.5h。然后超高速离心(160000×g,45min,4℃),取沉淀,获得壳聚糖-脱氧胆酸偶联物包裹的结核多肽抗原纳米疫苗。得到的壳聚糖-脱氧胆酸偶联物包裹的结核多肽抗原纳米疫苗为类球形,直径在30~100nm之间。
(4)以壳聚糖-脱氧胆酸偶联物为载体的结核多肽纳米疫苗
壳聚糖-脱氧胆酸偶联物包裹的结核多肽纳米颗粒自身可作为结核多肽纳米疫苗。
壳聚糖-脱氧胆酸偶联物包裹的结核多肽纳米颗粒还可以与药学上可以接受的载体或者赋形剂混合,即为所述的以壳聚糖-脱氧胆酸偶联物为载体的结核多肽纳米疫苗。
实施例4
本实施例中的以壳聚糖-脱氧胆酸偶联物为载体的结核多肽纳米疫苗,包括壳聚糖-脱氧胆酸偶联物与结核多肽;所述结核多肽由结核分枝杆菌Rv0180c蛋白81~100位氨基酸片段和Rv2004c蛋白281~300位氨基酸片段两种多肽组成,两种多肽的质量比为1:1。
上述的结核多肽纳米疫苗的制备方法同实施例1。
实施例5
本实施例中的以壳聚糖-脱氧胆酸偶联物为载体的结核多肽纳米疫苗,包括壳聚糖-脱氧胆酸偶联物与结核多肽;所述结核多肽为结核分枝杆菌Rv0180c蛋白81~100位氨基酸片段。
上述的结核多肽纳米疫苗的制备方法同实施例1。
实施例6
本实施例中的以壳聚糖-脱氧胆酸偶联物为载体的结核多肽纳米疫苗,包括壳聚糖-脱氧胆酸偶联物与结核多肽;所述结核多肽为结核分枝杆菌Rv0227c蛋白261~280位氨基酸片段。
上述的结核多肽纳米疫苗的制备方法同实施例1。
实施例7
本实施例中的以壳聚糖-脱氧胆酸偶联物为载体的结核多肽纳米疫苗,包括壳聚糖-脱氧胆酸偶联物与结核多肽;所述结核多肽为结核分枝杆菌Rv2004c蛋白281~300位氨基酸片段。
上述的结核多肽纳米疫苗的制备方法同实施例1。
实施例8
本实施例中的以弗氏不完全佐剂为载体的结核多肽疫苗,包括弗氏不完全佐剂和结核多肽。所述结核多肽由结核分枝杆菌Rv0180c蛋白81~100位氨基酸片段、Rv0227c蛋白261~280位氨基酸片段和Rv2004c蛋白281~300位氨基酸片段三种多肽组成。
上述结核多肽疫苗的制备方法为:将三种多肽与弗氏不完全佐剂混匀,进行充分搅拌乳化,即得。所述三种多肽的质量比为1:1:1。所述三种多肽与弗氏不完全佐剂的质量比为5.5:2.5。
对比例1
本对比例中的疫苗为市售卡介苗BCG。
对比例2
本对比例为pH为7.2的PBS缓冲液。
试验例1
实施例1中的结核多肽纳米疫苗免疫可诱导小鼠血液特异性抗体水平升高。
(1)实验动物免疫
取4周龄BALB/C雄性小鼠,分为4组,每组10只。这三组分别为:用本发明实施例1所述的方法制备的壳聚糖-脱氧胆酸偶联物为载体的结核多肽纳米疫苗免疫的免疫组(简称疫苗组),用实施例8中的弗氏不完全佐剂+多肽免疫的多肽组(简称多肽组),用对比例1的卡介苗(BCG)免疫的对照组(简称BCG组)和对比例2中磷酸盐缓冲液(PBS)对照组(简称PBS组)。另用实施例5、6和7的单个多肽片段和壳聚糖-脱氧胆酸偶联物载体组成的疫苗做参照组。
疫苗组免疫疫苗为:按本发明实施例1所述的方法制备的壳聚糖-脱氧胆酸偶联物为载体的结核多肽纳米颗粒,每只小鼠免疫100μL(3.0mg/mL)。
多肽组免疫疫苗为:按对比例1中所述的方法制备得到以弗氏不完全佐剂为载体的多肽疫苗,每只小鼠免疫100μL(6.0mg/mL)。
BCG组免疫疫苗为:商品化人用卡介苗,参照说明书,按体重换算后的剂量,进行小鼠免疫,每只免疫剂量为100μL。
PBS组免疫疫苗为:PH 7.2磷酸盐缓冲液,每只免疫剂量为100μL。
实施例5组:按本发明实施例5所述的方法制备的壳聚糖-脱氧胆酸偶联物为载体的结核多肽纳米颗粒,每只小鼠免疫100μL(1.0mg/mL)。
实施例6组:按本发明实施例6所述的方法制备的壳聚糖-脱氧胆酸偶联物为载体的结核多肽纳米颗粒,每只小鼠免疫100μL(1.0mg/mL)。
实施例7组:按本发明实施例7所述的方法制备的壳聚糖-脱氧胆酸偶联物为载体的结核多肽纳米颗粒,每只小鼠免疫100μL(1.0mg/mL)。
各组小鼠经皮下免疫,每两周免疫一次,连续免疫3次。
(2)抗体效价检测
末次免疫两周后,小鼠经尾静脉采血,分离血清。ELISA法检测免疫小鼠血清中抗上述三种多肽的IgG抗体效价。
ELISA法检测方法如下:将包被缓冲液稀释后的多肽(20μg/mL)加入到96孔酶标板上,每孔100μL,4℃孵育过夜。弃去孔中液体,加入洗涤液300μL,重复洗涤5次,每次5min,拍干。然后每孔加入BSA封闭液200μL,37℃孵育作用2h。洗涤5次,方法同上;每孔加入稀释的待检血清100μL,37℃水浴孵育1h,洗涤5次,方法同上;每孔加入100μL HRP标记的羊抗小鼠IgG,37℃孵育1h,洗涤5次,方法同上。每孔中加入TMB底物显色液(A和B各50μL),室温15min;再每孔加入终止液50μL。经酶标仪450nm处测定吸光度值。
间接ELISA法检测结果如表1所示,结果显示疫苗组小鼠血清Rv0180c、Rv0227c和Rv2004c特异性IgG抗体滴度随免疫次数的增加均有不同程度升高,而PBS组Rv0180c、Rv0227c、Rv2004c特异性抗体均为阴性。末次免疫两周,疫苗组的Rv0180c、Rv0227c和Rv2004c特异性IgG抗体滴度均显著高于BCG组(P<0.01)、多肽组(P<0.01)。而BCG组的Rv0180c和Rv0227c特异性IgG抗体滴度均显著高于多肽组(P<0.01)。
表1各组免疫小鼠血清的平均特异性抗体滴度(n=10)
注:经单因素方差分析(AVOVN),a:疫苗组vs BCG组,P<0.01;b:疫苗组vs多肽组,<0.01;c:BCG组vs多肽组,P<0.01。
结果表明本发明中的以壳聚糖-脱氧胆酸偶联物为载体的结核多肽疫苗可以激起有效的体液免疫,产生的特异性IgG抗体的效价高于卡介苗免疫或单纯多肽(添加弗氏不完全佐剂)免疫。以三种结核多肽为抗原的纳米疫苗免疫比单一多肽片段为抗原的纳米疫苗免疫产生的抗体种类更多,其特异性IgG抗体效价并没有因混合了多种多肽抗原而降低,能提供比单一多肽片段为抗原的纳米疫苗更全面的保护力。
试验例2
实施例1中的结核多肽纳米疫苗免疫可诱导小鼠抗原特异的脾淋巴细胞增殖。
(1)实验动物免疫
取4周龄BALB/C雄性小鼠,分为4组,每组10只。这三组分别为:用本发明实施例1所述的方法制备的壳聚糖-脱氧胆酸偶联物为载体的结核多肽纳米疫苗免疫的免疫组(简称疫苗组),用实施例8中的弗氏不完全佐剂+多肽免疫的多肽组(简称多肽组),用对比例1的卡介苗(BCG)免疫的对照组(简称BCG组)和磷酸盐缓冲液(PBS)对照组(简称PBS组)。
疫苗组免疫疫苗为:按本发明实施例1所述的方法制备的壳聚糖-脱氧胆酸偶联物为载体的结核多肽纳米颗粒,每只小鼠免疫100μL(3.0mg/mL)。
多肽组免疫疫苗为:按对比例1中所述的方法制备得到以弗氏不完全佐剂为载体的多肽疫苗,每只小鼠免疫100μL(6.0mg/mL)。
BCG组免疫疫苗为:商品化人用卡介苗,参照说明书,按体重换算后的剂量,进行小鼠免疫,每只免疫剂量为100μL。
PBS组免疫疫苗为:PH 7.2磷酸盐缓冲液,每只免疫剂量为100μL。
各组小鼠经皮下免疫,每两周免疫一次,连续免疫3次。
(2)脾细胞的制备
末次免疫小鼠2周后,眼眶采血,脱颈处死小鼠。无菌解剖小鼠,取脾脏置于PBS溶液中洗涤2次。然后用研磨棒碾碎脾脏,经200目无菌滤网滤去组织残片。收集滤过脾细胞,经1200rpm/min,离心10min。弃上清,沉淀加入5mL红细胞裂解液,裂解红细胞5min,重复3次,经1200rpm/min,离心10min。弃上清,用无菌PBS洗涤2次后,重悬于RPMI-1640培养液中。
(3)脾淋巴细胞增殖实验
调整脾细胞数为5×105/L,置于含10%小牛血清的RPMI-1640培养液的96孔细胞培养板中培养,每孔200μL。同时每孔加入50μL 0.5μg/mL上述三种多肽混合物(质量比1:1:1)刺激细胞,PBS对照孔不加多肽,调零孔不加脾细胞,37℃5%CO2孵箱培养72h后,每孔加入20μL MTT(5mg/mL,pH=7.2)继续培养4h后终止培养,离心弃尽上清,每孔加入DMSO 150μL,振荡10min。然后使用酶标仪于450nm波长处检测,读取各孔OD值,计算刺激指数(SI)。SI=(OD实验组)/(OD对照组)。
结果如图7-A所示,疫苗组、多肽组、BCG组、PBS组的SI值分别为2.77±0.23,1.43±0.27,2.59±0.26和0.82±0.18。疫苗组的的SI值显著高于PBS组(P=0.002<0.01)和多肽组(P=0.007<0.01),与BCG组无统计学差异(P=0.11>0.05)。
结果表明本发明中的以壳聚糖-脱氧胆酸偶联物为载体的结核多肽疫苗可以激起有效的细胞免疫,能引起脾淋巴细胞显著增殖,其效应高于单纯多肽(添加弗氏不完全佐剂)免疫,与卡介苗免疫无显著差异。
试验例3
实施例1中的结核多肽纳米疫苗免疫可诱导小鼠脾脏T细胞的IFN-γ分泌增加。
(1)实验动物免疫
取4周龄BALB/C雄性小鼠,分为4组,每组10只。这三组分别为:用本发明实施例1所述的方法制备的壳聚糖-脱氧胆酸偶联物为载体的结核多肽纳米疫苗免疫的免疫组(简称疫苗组),用实施例8中的弗氏不完全佐剂+多肽免疫的多肽组(简称多肽组),用对比例1的卡介苗(BCG)免疫的对照组(简称BCG组)和磷酸盐缓冲液(PBS)对照组(简称PBS组)。
疫苗组免疫疫苗为:按本发明实施例1所述的方法制备的壳聚糖-脱氧胆酸偶联物为载体的结核多肽纳米颗粒,每只小鼠免疫100μL(3.0mg/mL)。
多肽组免疫疫苗为:按对比例1中所述的方法制备得到以弗氏不完全佐剂为载体的多肽疫苗,每只小鼠免疫100μL(6.0mg/mL)。
BCG组免疫疫苗为:商品化人用卡介苗,参照说明书,按体重换算后的剂量,进行小鼠免疫,每只免疫剂量为100μL。
PBS组免疫疫苗为:PH 7.2磷酸盐缓冲液,每只免疫剂量为100μL。
各组小鼠经皮下免疫,每两周免疫一次,连续免疫3次。
(2)脾细胞的制备
末次免疫小鼠2周后,眼眶采血,脱颈处死小鼠。无菌解剖小鼠,取脾脏置于PBS溶液中洗涤2次。然后用研磨棒碾碎脾脏,经200目无菌滤网滤去组织残片。收集滤过脾细胞,经1200rpm/min,离心10min。弃上清,沉淀加入5mL红细胞裂解液,裂解红细胞5min,重复3次,经1200rpm/min,离心10min。弃上清,用无菌PBS洗涤2次后,重悬于RPMI-1640培养液中。
(3)小鼠脾细胞的IFN-γ水平检测
调整脾细胞数为5×105/L,置于含10%小牛血清的RPMI-1640培养液的96孔细胞培养板中,37℃5%CO2温箱培养,每孔200μL。同时每孔加入50μL 0.5μg/mL上述三种多肽混合物(质量比1:1:1)刺激共培养,PBS对照孔不加多肽,调零孔不加脾细胞。取48h、96h、144h培养上清1mL,用小鼠IFN-γELISA试剂盒检测脾脏T细胞分泌的IFN-γ水平。
ELISA法检测方法如下:将包被缓冲液稀释后大鼠抗小鼠IFN-γ抗体(4μg/L)加入到96孔酶标板上,每孔100μL,4℃孵育过夜。弃去孔中液体,加入洗涤液300μL,洗涤3次,每次3min,拍干。然后每孔加入BSA封闭液200μL,37℃孵育作用2h。洗涤3次(方法同前述洗涤操作),每孔加入稀释的待检血清100μL,37℃水浴孵育1h。再洗涤3次(方法同上),每孔加入100μL HRP标记的羊抗小鼠IFN-γ抗体,37℃孵育1h。又洗涤3次(方法同前述洗涤操作),每孔中加入TMB底物显色液(A和B各50μL),室温15min;再每孔加入终止液50μL。经酶标仪450nm处测定吸光度值。
结果如图7所示,经单因素方差分析(AVOVN),从图7-A中可以看出(SI)*,疫苗组vs多肽组,P<0.01;疫苗组vs PBS组,P<0.01;(SI)**,BCG组vs多肽组,P<0.01,BCG组vs PBS组,P<0.01;从图7-B中可以看出(IFN-γ)*,疫苗组vs多肽组,P<0.01;疫苗组vs PBS组,P<0.01;(IFN-γ)**,BCG组vs多肽组,P<0.01,BCG组vs PBS组,P<0.01。
结果表明,各组脾淋巴细胞产生的IFN-γ在共刺激培养48h达到最高值。疫苗组、多肽组、BCG组、PBS组的IFN-γ浓度分别为1895±107ng/L,1050±158ng/L,2307±136ng/L和354±53ng/L。疫苗组的IFN-γ浓度显著高于PBS组(P=0.004<0.01)和多肽组(P=0.009<0.01),略低于BCG组(0.01<P=0.024<0.05)。BCG组IFN-γ浓度显著高于PBS组(P=0.001<0.01)和多肽组(P=0.004<0.01)。以壳聚糖-脱氧胆酸偶联物为载体的结核多肽疫苗可以激起有效的细胞免疫,能刺激脾淋巴细胞产生的IFN-γ,产生的IFN-γ浓度高于单纯多肽(添加弗氏不完全佐剂)免疫,略低于卡介苗免疫。
由试验例1-3可知,本发明中的以壳聚糖-脱氧胆酸偶联物为载体的结核多肽疫苗能够激起机体有效的体液免疫和细胞免疫反应,具有较好的防治结核病的免疫效果,可以用于制备预防或治疗结核病的药物。
<110> 河南科技大学
<120> 一种用于防治结核病的结核多肽疫苗及其制备方法、应用
<160> 3
<170> SIPOSequenceListing 1.0
<211> 452
<212> PRT
<213> 结核分枝杆菌
<221> Rv0180c
<400> 1
MET Ser Gln Ala Gln Pro Arg Pro Ala Ala Pro Asn Pro Lys Arg
1 5 10 15
Asn Val Lys Ala Ile Arg Thr Val Arg Phe Trp MET Ala Pro Ile
20 25 30
Ala Thr Thr Leu Ala Leu MET Ser Ala Leu Ala Ala Leu Tyr Leu
35 40 45
Gly Gly Ile Leu Asn Pro MET Thr Asn Leu Arg His Phe Pro Ile
50 55 60
Ala Leu Val Asn Glu Asp Ala Gly Pro Ala Gly Gln Gln Ile Val
65 70 75
Asp Gly Leu Val Ser Gly Leu Asp Lys Asn Lys Phe Asp Ile Arg
80 85 90
Val Val Ser Pro Asp Glu Ala Arg Arg Leu Leu Asp Thr Ala Ala
95 100 105
Val Tyr Gly Ser Ala Leu Ile Pro Pro Thr Phe Ser Ser Gln Leu
110 115 120
Arg Asp Phe Gly Ala Ser Ala Val Thr Pro Thr Arg Thr Asp Arg
125 130 135
Pro Ala Ile Thr Ile Ser Thr Asn Pro Arg Ala Gly Thr Leu Ala
140 145 150
Ala Ser Ile Ala Gly Gln Thr Leu Thr Arg Ala Leu Thr Val Val
155 160 165
Asn Gly Lys Val Gly Glu Arg Leu Thr Ala Glu Val Ala Ala Gln
170 175 180
Thr Gly Gly Val Ala Leu Ala Gly Ala Ala Ala Ala Gly Leu Ala
185 190 195
Ser Pro Ile Asp Val Lys Ser Thr Ala Tyr Asn Pro Leu Pro Asn
200 205 210
Gly Thr Gly Asn Gly Leu Ser Ala Phe Tyr Tyr Ala Leu Leu Leu
215 220 225
Leu Leu Ala Gly Phe Thr Gly Ser Ile Val Val Ser Thr Leu Val
230 235 240
Asp Ser MET Leu Gly Tyr Val Pro Ala Glu Phe Gly Pro Val Tyr
245 250 255
Arg Phe Ala Glu Gln Val Asn Ile Ser Arg Phe Arg Thr Leu Leu
260 265 270
Val Lys Trp Ala Val MET Val Val Leu Ala Leu Leu Thr Ser Gly
275 280 285
Val Tyr Leu Ala Ile Ala His Gly Leu Gly MET Pro Ile Pro Leu
290 295 300
Gly Trp Gln Val Trp Leu Tyr Gly Val Phe Ala Ile Ile Ala Val
305 310 315
Gly Val Thr Ser Ser Ser Leu Ile Ala Val Leu Gly Ser MET Gly
320 325 330
Leu Leu Val Ser MET Leu Ile Phe Val Ile Leu Gly Leu Pro Ser
335 340 345
Ala Gly Ala Thr Val Pro Leu Glu Ala Val Pro Ala Phe Phe Arg
350 355 360
Trp Leu Ala Gln Phe Glu Pro MET His Gln Val Phe Leu Gly Val
365 370 375
Arg Ser Leu Leu Tyr Leu Asn Gly Asn Ala Asp Ala Gly Leu Ser
380 385 390
Gln Ala Leu Thr MET Thr Ser Ile Gly Leu Ile Ile Gly Leu Leu
395 400 405
Leu Gly Gly Phe Ile Thr His Leu Tyr Asp Arg Ser Ser Phe His
410 415 420
Arg Ile Pro Gly Ala Val Glu MET Ala Ile Ala Val Glu His Gln
425 430 435
Ala Gln Tyr Gln Ala Arg Gln Ser Ala Arg Glu Ser Ser Ser Glu
440 445 450
Gln Pro
452
<211> 421
<212> PRT
<213> 结核分枝杆菌
<221> Rv0227c
<400> 2
MET Leu Arg Phe Ala Ala Cys Gly Ala Ile Gly Leu Gly Ala Ala
1 5 10 15
Leu Leu Ile Ala Ala Leu Leu Leu Ser Thr Tyr Thr Thr Ser Arg
20 25 30
Ile Ala Glu Ile Pro Leu Asp Ile Asp Ala Thr Leu Ile Ser Asp
35 40 45
Gly Thr Gly Thr Ala Leu Asp Ser Ala Ser Leu Ala Thr Glu His
50 55 60
Ile Val Val Asn Gln Asp Val Pro Leu Val Ser Gln Gln Gln Val
65 70 75
Thr Val Glu Ser Pro Ala Asn Ala Asp Val Val Thr Leu Gln Val
80 85 90
Gly Ser Ser Leu Arg Arg Thr Asp Lys Gln Lys Asp Ser Gly Leu
95 100 105
Leu Leu Ala Ile Val Asp Thr Val Thr Leu Asn Arg Lys Thr Ala
110 115 120
MET Ala Val Ser Asp Asp Thr His Thr Gly Gly Ala Val Gln Lys
125 130 135
Pro Arg Gly Leu Asn Asp Glu Asn Pro Pro Thr Ala Ile Pro Leu
140 145 150
Arg His Asp Gly Leu Ser Tyr Arg Phe Pro Phe His Thr Glu Lys
155 160 165
Lys Thr Tyr Pro Tyr Phe Asp Pro Ile Ala Gln Lys Ala Phe Asp
170 175 180
Ala Asn Tyr Glu Gly Glu Glu Asp Val Asn Gly Leu Thr Thr Tyr
185 190 195
Arg Phe Thr Gln Asn Val Gly Tyr Thr Pro Glu Gly Lys Leu Val
200 205 210
Ala Pro Leu Lys Tyr Pro Ser Leu Tyr Ala Gly Asp Glu Asp Gly
215 220 225
Lys Val Thr Thr Ser Ala Ala MET Trp Gly Leu Pro Gly Asp Pro
230 235 240
Asn Glu Gln Ile Thr MET Thr Arg Tyr Tyr Ala Ala Gln Arg Thr
245 250 255
Phe Trp Val Asp Pro Val Ser Gly Thr Ile Val Lys Glu Thr Glu
260 265 270
Arg Ala Asn His Tyr Phe Ala Arg Asp Pro Leu Lys Pro Glu Val
275 280 285
Thr Phe Ala Asp Tyr Gln Val Thr Ser Thr Glu Glu Thr Val Glu
290 295 300
Ser Gln Val Asn Ala Ala Arg Asp Glu Arg Asp Arg Leu Ala Leu
305 310 315
Trp Ser Arg Val Leu Pro Ile Thr Phe Thr Ala Ala Gly Leu Val
320 325 330
Ala Leu Val Gly Gly Gly Leu Phe Ala Ser Phe Ser Leu Arg Thr
335 340 345
Glu Gly Ala Leu MET Ala Ala Ser Gly Asp Arg Asp Asp His Asp
350 355 360
Tyr Arg Arg Gly Gly Phe Glu Glu Pro Val Pro Gly Ala Glu Ala
365 370 375
Glu Thr Glu Lys Leu Pro Thr Gln Arg Pro Asp Phe Pro Arg Glu
380 385 390
Pro Ser Gly Ser Asp Pro Pro Arg Leu Gly Ser Ala Gln Pro Pro
395 400 405
Pro Pro Pro Asp Ala Gly His Pro Asp Pro Gly Pro Pro Glu Arg
410 415 420
Arg
421
<211> 498
<212> PRT
<213> 结核分枝杆菌
<221> Rv2004c
<400> 3
MET Asp Ser Pro Thr Asn Asp Gly Thr Cys Asp Ala His Pro Val
1 5 10 15
Thr Asp Glu Pro Phe Ile Asp Val Arg Glu Thr His Thr Ala Val
20 25 30
Val Val Leu Ala Gly Asp Arg Ala Phe Lys Ala Lys Lys Pro Val
35 40 45
Val Thr Asp Phe Cys Asp Phe Arg Thr Ala Glu Gln Arg Glu Arg
50 55 60
Ala Cys Ile Arg Glu Phe Glu Leu Asn Ser Arg Leu Ala Ala Gln
65 70 75
Ser Tyr Leu Gly Ile Ala His Leu Ser Asp Pro Ser Gly Gly His
80 85 90
Ala Glu Pro Val Val Val MET Arg Arg Tyr Arg Asp Lys Gln Arg
95 100 105
Leu Ala Ser MET Val Thr Ala Gly Leu Pro Val Glu Gly Ala Leu
110 115 120
Asp Ala Ile Ala Glu Val Leu Ala Arg Phe His Gln Arg Ala Gln
125 130 135
Arg Asn Arg Cys Ile Asp Thr Gln Gly Glu Val Gly Ala Val Ala
140 145 150
Arg Arg Trp His Glu Asn Leu Ala Glu Leu Arg His His Ala Asp
155 160 165
Lys Val Val Ser Gly Asp Val Ile Arg Arg Ile Glu His MET Val
170 175 180
Asp Glu Phe Val Ser Gly Arg Glu Val Leu Phe Ala Gly Arg Ile
185 190 195
Lys Glu Gly Cys Ile Val Asp Gly His Ala Asp Leu Leu Ala Asp
200 205 210
Asp Ile Phe Leu Val Asp Gly Glu Pro Ala Leu Leu Asp Cys Leu
215 220 225
Glu Phe Glu Asp Glu Leu Arg Tyr Leu Asp Arg Ile Asp Asp Ala
230 235 240
Ala Phe Leu Ala MET Asp Leu Glu Phe Leu Gly Arg Lys Asp Leu
245 250 255
Gly Asp Tyr Phe Leu Ala Gly Tyr Ala Val Arg Ser Gly Asp Thr
260 265 270
Ala Pro Ala Ser Leu Arg Asp Phe Tyr Ile Ala Tyr Arg Ala Val
275 280 285
Val Arg Ala Lys Val Glu Cys Val Arg Phe Ser Gln Gly Lys Pro
290 295 300
Glu Ala Ala Ala Asp Ala Val Arg His Leu Ile Ile Ala Thr Gln
305 310 315
His Leu Gln His Ala Thr Val Arg Leu Ala Leu Val Gly Gly Asn
320 325 330
Pro Gly Thr Gly Lys Ser Thr Leu Ala Arg Gly Val Ala Glu Leu
335 340 345
Val Gly Ala Gln Val Ile Ser Thr Asp Asp Val Arg Arg Arg Leu
350 355 360
Arg Asp Cys Gly Val Ile Thr Gly Glu Pro Gly Val Leu Asp Ser
365 370 375
Gly Leu Tyr Ser Arg Ala Asn Val Val Ala Val Tyr Gln Glu Ala
380 385 390
Leu Arg Lys Ala Arg Leu Leu Leu Gly Ser Gly His Ser Val Ile
395 400 405
Leu Asp Gly Thr Trp Gly Asp Pro Gln MET Arg Ala Cys Ala Arg
410 415 420
Arg Leu Ala Ala Asp Thr His Ser Ala Ile Val Glu Phe Arg Cys
425 430 435
Ser Ala Thr Val Asp Val MET Ala Asp Arg Ile Val Ala Arg Ala
440 445 450
Gly Gly Asn Ser Asp Ala Thr Ala Glu Ile Ala Ala Ala Leu Ala
455 460 465
Ala Arg Gln Ala Asp Trp Asp Thr Gly His Arg Ile Asp Thr Ala
470 475 480
Gly Pro Arg Glu Arg Ser Val Gly Gln Ala Tyr His Ile Trp Arg
485 490 495
Ser Ala Ile
498
- 还没有人留言评论。精彩留言会获得点赞!