阿莫地喹及其药学上可接受的盐在制备用于治疗阿尔茨海默病的药物中的应用的制作方法
本发明涉及药物应用领域,具体涉及阿莫地喹及其药物组合物在制备用于治疗阿尔茨海默病的药物中的应用,更具体地,本发明涉及阿莫地喹及其药学上可接受的盐或其药物组合物具有保护神经元及/或增加Aβ清除及/或抑制Tau蛋白磷酸化而用于制备治疗阿尔茨海默病等神经退行性疾病的药物中的应用。
背景技术:
阿尔茨海默病(Alzheimer's Disease,AD)是一种进行性神经退行性疾病,以Aβ聚集导致的神经外淀粉样蛋白沉淀,tau蛋白过度磷酸化导致的神经纤维缠结以及神经元细胞凋亡等为其主要标志。AD具有高度年龄依赖性,随着年龄增加,AD的发病率也会急剧提高,截止2011年全球已经有超过3000万人口患有痴呆,并且随着全球人口老龄化,每年AD患者人数在高速增长。目前我国已进入老年社会,AD也成为一个导致老年人生活质量下降并导致死亡的重要原因。目前,在临床上治疗AD的药物只能减缓患者的病症,并不能阻断AD的进程,因此对能够阻断AD病理进程的新型抗AD药物的发现有着迫切的需求。随着研究的进展,AD的发病机制已经初窥端倪,阿尔茨海默病患者尸检显示其脑组织出现明显的萎缩,脑细胞出现广泛死亡,在这些部位可见明显的老年斑、神经原纤维缠结等病变。因此,目前AD的发病机制主要提出了三种观点:神经元不可逆凋亡、β淀粉样蛋白(Aβ)假说和tau蛋白假说,目前的研究认为针对此三种观点的抗AD药物可能具有阻断AD病理进程的作用。
神经元广泛死亡是AD患者脑中最明显的病理特征,而神经元不可逆凋亡是造成神经元死亡的主要原因(Robert M.Friedlander,M.D.Apoptosis and Caspases in Neurodegenerative Diseases.N Engl J Med 2003;348:1365-1375)。AD患者脑中的Aβ过量表达及其毒性作用、神经纤维缠结、氧化物损伤、早老蛋白基因突变、钙离子稳态失衡等诸多因素最终都可导致神经元的不可逆凋亡(Carl W.Cotman Aileen J.Anderson.A potential role for apoptosis in neurodegeneration and Alzheimer's disease.Molecular Neurobiology,Volume 10,1995.),故认为可通过拮抗神经元凋亡以起抗AD的治疗效果。
β淀粉样蛋白(Aβ)推断认为,Aβ蛋白是老年斑的主要成分之一,由淀粉样前体蛋白(APP)经β-分泌酶和γ-分泌酶依次剪切生成,它在大脑组织中过度增加导致神经系统产生氧化应激,炎症反应等最终导致神经元凋亡及AD的发生。因此普遍认为通过抑制Aβ的生成或促进Aβ的清除来减少整体脑中Aβ的含量将可以有效的预防或治疗AD,而这也是目前抗AD新型药物的主要研发方向之一(Yamin G,Ono K,Inayathullah M,Teplow D B.Amyloid beta-protein assembly as a therapeutic target of Alzheimer’s disease.Current Pharmaceutical Design,2008,14:3231-3246;Kurz A,Perneczky R.Amyloid clearance as a treatment target against Alzheimer’s disease.Journal of Alzheimer's disease,2011,24[Suppl 2]:61-73.)。
Tau蛋白假说认为,由Tau蛋白高度磷酸化形成的神经纤维缠结最终同样会导致神经元递质传递损伤,神经元的凋亡等最终导致AD发生。Tau蛋白是一种微管相关蛋白,可以促进管蛋白组装成微管和维持微管的结构,在神经组织中广泛表达,并在AD患者脑组织中被异过度磷酸化(D.N.Drechsel,A.A.Hyman,M.H.Cobb,M.W.Kirschner.Modulation of the dynamic instability of tubulin assembly by the microtubule-associated protein tau.Molecular biology of the cell,1992,3,:1141)。正常情况下,Tau蛋白的磷酸化和去磷酸化处于动态平衡,但异常情况下,tau蛋白会过磷酸化,失去维持微管结构的功能,引发AD,帕金森氏综合征等疾病。
阿莫地喹,临床常用于疟疾的治疗,作用于红细胞内期。目前对于其保护神经元及/或抑制Aβ生成及/或抑制Tau蛋白磷酸化,从而起到抗阿尔茨海默病(Alzheimer’s disease,AD)的作用未见报道。本发明进一步发现阿莫地喹具有保护神经元及/或抑制Aβ生成及/或抑制Tau蛋白磷酸化的作用,因此本发明进一步发现它对新的适应症治疗的潜在应用。
技术实现要素:
本发明的一个目的是提供阿莫地喹及其药学上可接受的盐的新的医药应用,即其在制备用于治疗阿尔茨海默病的药物中的应用。
在所述应用中,阿莫地喹及其药学上可接受的盐可以保护神经元及/或抑制Tau蛋白的磷酸化和/或促抑制Aβ生成。所述药学上可接受的盐,包括无机酸盐、有机酸盐,例如苹果酸盐、琥珀酸盐、盐酸盐等。
本发明的另一个目的是提供阿莫地喹及其药学上可接受的盐在制备治疗与神经元损伤、Aβ生成及/或Tau蛋白磷酸化相关的神经退行性疾病的药物中的应用。
所述的神经元损伤及/或Aβ生成及/或Tau蛋白磷酸化相关的神经退行性疾病包括但不限于帕金森病等。
本发明的另一目的是提供包含阿莫地喹或其药学上可接受的盐的药物组合物在制备用于治疗阿尔茨海默病的药物中的应用,所述药物组合物包含阿莫地喹或其药学上可接受的盐及药学上可接受的各种辅料。
本发明还公开了该药物组合物在制备与神经元损伤及/或Aβ生成及/或Tau蛋白磷酸化相关的神经退行性疾病的药物中的应用。
本发明所述的阿莫地喹,其分子式:C20H22N3OCl,分子量:355.86,化学式为:
有益效果:
本发明通过大量实验筛选,发现了阿莫地喹的新的作用机制和药效,具有保护神经元功效,并且可或抑制Tau蛋白的磷酸化,同时可抑制Aβ生成的作用。因此,阿莫地喹可用于制备治疗阿尔茨海默病及与神经元受损及/或Aβ及/或Tau蛋白相关的疾病的药物。
附图说明
图1为阿莫地喹能够保护SH-SY5Y细胞及原代神经元免受链脲佐菌素(Streptozocin,STZ)的损伤作用的柱状图。***代表P<0.001。单因素方差分析。
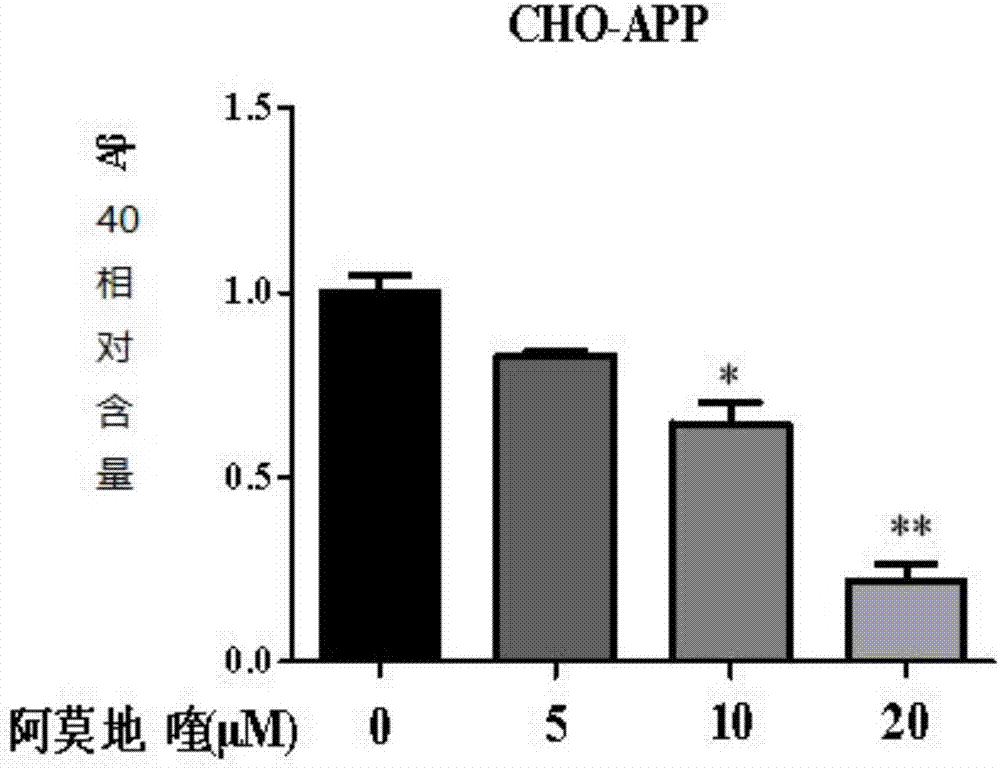
图2阿莫地喹能够抑制CHO-APP细胞中Aβ的生成作用的柱状图。**代表P<0.005。单因素方差分析。
图3阿莫地喹能够抑制原代神经元Tau蛋白磷酸化水平作用的柱状图。
具体实施方式
下面结合具体实施例对本发明作进一步阐述,但这些实施例不应解释为限制本发明。
试验实施例1:阿莫地喹(Amodiaquine)保护SH-SY5Y细胞及原代神经元的实验。
本发明在SH-SY5Y细胞及原代神经元中检测阿莫地喹对链脲佐菌素引起的细胞损伤的保护作用,实验表明阿莫地喹具有明显保护神经元的作用。
1、实验原理
本实验基于链脲霉素(Streptozocin,STZ)广泛用作体内及体外氧化应激介导的凋亡,故予以SH-SY5Y细胞及原代神经元STZ处理以在体外模拟AD状态下的神经元,本发明将STZ及不同浓度的阿莫地喹加入SH-SY5Y细胞及原代神经元培养液中共同孵育一定时间,然后通过MTT检测法测定细胞活力变化,以此评价阿莫地喹对SH-SY5Y细胞的保护作用(Tarek KASHOUR,Teralee BURTON,Alexander DIBROV,Francis M.AMARA.Late Simian virus 40transcription factor is a target of the phosphoinositide 3-kinase/Akt pathway in anti-apoptotic Alzheimer’s amyloid precursor protein signaling.Biochem.J.(2003)370,1063±1075)。
本实验通过MTT检测法评价阿莫地喹的神经保护作用,其原理是:活细胞线粒体中的琥珀酸脱氢酶能使外源性MTT还原为水不溶性的蓝紫色结晶甲瓒(Formazan)并沉积在细胞中,而死细胞无此功能。二甲基亚砜(DMSO)能溶解细胞中的甲瓒,用酶联免疫检测仪在490nm波长处测定其光吸收值,可间接反映活细胞数量。在一定细胞数范围内,MTT结晶形成的量与细胞数成正比。
2、实验材料与方法
1)用于诱导细胞损伤的STZ购于Sigma公司,细胞培养试剂均购于Gibco公司,SH-SY5Y细胞来源于ATCC。原代神经元取自C57BL6小鼠脑皮层。
2)MTT试验:SH-SY5Y细胞及原代神经元分别以以105个/孔及6*105的浓度以100ul接种于96孔板中,待细胞过夜贴壁后予以0.8mM STZ及不同浓度的阿莫地喹孵育24小时,后移去原有培养基每孔加入MTT于37℃孵育4小时,MTT终浓度为0.5mg/ml。最后移除孔内原有培养基后加入100ul DMSO,以溶解甲瓒并在酶标仪上在490nm波长处读吸光值。
3、实验结果
结果如图1中a所示,阿莫地喹能够浓度依赖性改善SH-SY5Y细胞中STZ引起的细胞活力下降且,如图1中b所示,阿莫地喹能够浓度依赖性改善原代神经元中STZ引起的细胞活力下降,结果表明阿莫地喹具有明显的浓度依赖性的神经保护作用。
试验实施例2:阿莫地喹(Amodiaquine)抑制Aβ生成。
本发明在CHO-APP细胞中以检测阿莫地喹对Aβ生成的影响,实验表明阿莫地喹具有明显的抑制Aβ生成的作用。
1、实验原理
本实验基于瑞典突变型人源APP的CHO细胞能够通过APP剪切途径生成内源性Aβ。本发明将不同浓度的阿莫地喹加入CHO-APP细胞培养液中共同孵育一定时间,然后取上层细胞培养液检测其中Aβ含量,同时洗净细胞并裂解测其蛋白浓度以消除细胞密度不同带来的影响,最终培养基中Aβ含量的降低,表明阿莫地喹可抑制Aβ生成。[CJ Phiel.GSK-3αregulates production of Alzheimer's disease amyloid-βpeptides,Nature,volume 423,pages 435–439(22May 2003)]。
本发明Aβ生成通过ELISA法检测,其原理是:CHO-APP细胞中生成的内源性Aβ通过胞吐分泌至培养基中,后将培养基移入与偶联有Aβ抗体的白色透明96孔板孵育,然后加入Aβ的另一位点抗体同时进行孵育,通过抗原抗体特异性识别结合原理,将Aβ及其抗体同时特异性的吸附于96孔板上;然后用偶联了辣根过氧化物酶的二抗及其显色底物(Tetramethylbenzidine,TMB)孵育,生成的产物颜色深浅与Aβ含量成正比,分别测定标准管和样本管的吸光度值(OD450),计算Aβ的含量。
2、实验材料与方法
1)Aβ40测定试剂盒购于invitrogen公司,细胞培养试剂均购于Gibco公司,CHO-APP细胞来源于ATCC。
2)CHO-APP细胞Aβ生成实验:CHO-APP细胞培养至70%密度后,加入不同浓度的阿莫地喹(20,10,5,0μM)共同孵育24小时,然后收集上层培养基,细胞用PBS清洗3遍,加入细胞裂解液(50mM Tris,1%SDS)于37℃裂解15分钟,然后12,000g离心15分钟,培养基中Aβ通过ELISA的方法测定。
3)将收集的细胞培养基按照试剂盒所提供方法进行检测。即在室温下将稀释后的细胞培养基、Aβ40抗体和偶联Aβ40另一种抗体的96孔板共同孵育3小时,然后用试剂盒中提供的漂洗液进行洗板4次,再加入偶联有辣根过氧化物酶的二抗室温下孵育30分钟,再用漂洗液洗板四次,然后加入显色液于室温孵育30分钟,最后加入反应中止液。以Tecan酶标仪在450nm处读取OD值。
3、实验结果
结果如图2所示,阿莫地喹能够浓度依赖性的减少CHO-APP细胞内的Aβ40的含量,表明阿莫地喹具有明显的浓度依赖性的抑制Aβ生成的作用。
试验实施例3:阿莫地喹(Amodiaquine)抑制Tau蛋白的磷酸化。
由于Tau蛋白过度磷酸化引起的神经纤维缠结是AD病理中重要的发病因素之一。因此本发明通过Western blot实验进一步研究化合物阿莫地喹对Tau蛋白磷酸化水平的调节作用。结果表明,在原代神经元细胞中,阿莫地喹能够显著地降低tau蛋白396位,231位及199位磷酸化水平。
1、实验原理
Western blot实验:Tau蛋白在神经系统中存在广泛表达,在原代神经元中同样具有表达,其磷酸化水平高低将直接影响到微管蛋白组装成微管和维持微管的结构的重要作用,因此利用Tau蛋白396位磷酸化抗体,231位抗体及199位抗体来直接检测细胞裂解后的tau蛋白的磷酸化水平,3-磷酸甘油醛脱氢酶(GAPDH)作为对照检测化合物对Tau的磷酸化的影响。
2、实验材料与方法
1)细胞培养试剂均购于Gbico公司,原代神经元取自C57BL/6小鼠脑皮质,Tau蛋白396位磷酸化抗体,Tau蛋白231位磷酸化抗体,Tau蛋白199位磷酸化抗体,GAPDH抗体均购于Cell signaling公司。
2)Western blot实验主要参数:一抗:p396-tau(1:1000,Cell signaling公司),p231-tau(1:1000,Cell signaling公司),p199-tau(1:1000,Cell signaling公司),Tau(1:1000,Cell signaling公司),GAPDH(1:10,000,Cell signaling);二抗:兔抗(anti-Rabbit)(1:5,000,Jackson公司),鼠抗(anti-mouse)(1:10,000,AbCam有限公司)。
3)实验方法:在细胞实验中,原代神经元以6*105的浓度培养于六孔板中,待培养至第九天后加入不同浓度的阿莫地喹(0,2,5,10μM),培养24小时,随后吸取培养液,并以PBS清洗3次,随后细胞用SDS-PAGE收样缓冲液(25%SDS,62.5mM Tris,25%甘油,0.1%溴芬蓝,pH6.8)收集于1.5mL的EP管中,于98℃加热处理15分钟,然后于4℃以10000转/分钟,离心10分钟。上清进行SDS-PAGE电泳,随后采用半干法电转转膜90分钟,接着将膜于TBST封闭液(TBS,0.5%吐温20,5%脱脂奶粉)中封闭30分钟。将封闭后的膜与相应于4℃孵育过夜。第二天用TBST缓冲液(TBS,0.5%吐温20)洗膜3次(每次15分钟),然后与二抗进行孵育2小时。随后同样采用TBST缓冲液洗膜3次(每次15分钟)。最后与辣根过氧化物酶(HRP)底物孵育5分钟,然后采用Tanon 4200发光成像系统收集信号。
3、实验结果:
结果如图3所示,与对照DMSO处理组相比,阿莫地喹可以浓度依赖性的抑制Tau蛋白的396位,231位及199位的磷酸化,表明阿莫地喹能够明显抑制Tau蛋白的磷酸化。
以上实施方式只为说明本发明的技术构思及特点,其目的在于让熟悉此项技术的人了解本发明内容并加以实施,并不能以此限制本发明的保护范围,凡根据本发明精神实质所做的等效变化或修饰,都应涵盖在本发明的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!