提供药理及临床效应的莫沙必利每日单次施用缓释制剂的制作方法
1.本发明领域
本发明总的涉及一种每日单次口服施用的缓释制剂,其含有总量为200mg或更低的莫沙必利。
2.相关领域描述
本领域熟知,4-氨基-5-氯-2-乙氧基-n-{[4-(4-氟苄基)-2-吗啉基]甲基}苯甲酰胺(莫沙必利)是具有以下化学式1结构的化合物。莫沙必利及其生理学可接受的盐为选择性血清素5-羟色胺4(在此及后文中,为“5-ht4”)受体激动剂,其可以选择性地仅促进存在于肌肉神经丛中的血清素5-ht4受体,以便有利于乙酰胆碱自神经末梢释放并通过所释放的乙酰胆碱使消化道平滑肌收缩从而促进消化道的运动,因此可作为治疗糖尿病性胃病、消化不良、胃炎和胃食管返流疾病的有效药物。莫沙必利是一安全的药物,其没有西沙比利中所出现的由于qt间期延长、多巴胺-2(d-2)受体阻滞效应、中枢神经系统(cns)副作用(锥体系外症状)以及高泌乳血症(泌乳,男性乳房发育症)造成的心律不齐和心源性猝死的风险。
[化学式1]
当口服给药时,莫沙必利在消化道的吸收超过93%。莫沙必利在肝脏、小肠、肾脏和肾上腺中分布的浓度比在血浆中高10倍,在肺、颌下腺、胰腺、脑垂体、甲状腺、脾脏等中以高浓度分布,而在眼球中的浓度较低,约为血中浓度的一半。在口服给药后的0.5小时至1.4小时之内,莫沙必利达到其最高血液浓度并由此表现出较快的药物效应。
由于莫沙必利的半衰期较短,在1.3-2小时的范围内,当其被身体吸收后,莫沙必利快速消失,由于药物作用时间较短,因此其必须经数次服用。现已开发并已市售可得莫沙必利的片剂。对于含有5mg莫沙必利的片剂,推荐每天服用3次。因此,需要通过减少所需服用次数以推荐应用来提高患者的依从性,同时也需要通过维持血液浓度来维持其药物效应。
传统缓释片剂的缺点在于,在初始阶段,它们需要用很长的时间来使药物达到有效的血液浓度。此外,在口服施用所给药物后,药理活性较快出现导致药物的有效药理活性难以维持24小时。
·本发明概述
因此,鉴于本领域中出现的上述问题作出本发明,本发明的一个目的就是提供一种每日单次口服施用的缓释制剂,其含有总的量为200mg或更低,优选150mg-160mg的莫沙必利,可以在其口服施用后表现出快速的药理活性同时维持24小时药理活性。
为了实现上述目的,本发明提供了一种含有莫沙必利或其盐作为活性成分的每日单次口服施用缓释制剂,
其中所述制剂包含:
快速释放层,含有所述活性成分、填充剂、崩解剂和添加剂;和
缓释层,含有所述活性成分、填充剂、崩解剂、控释基质和添加剂;
其中,所述制剂的胃肠保留时间为18-24小时,在其通过胃肠道运输过程中,在胃中释放20%-50%的莫沙必利或其盐,且在肠道中释放50%-80%的莫沙必利或其盐,
其中,当根据韩国药典溶出实验第二方法(桨法)、在37℃下ph为4.0、6.8、1.2的溶出介质以及水中测定溶出曲线时,所述制剂与下述的溶出曲线一致,
a)在ph为4.0、1.2的溶出介质和水中,所述制剂中所含的所述活性成分在1小时内的释放范围为25%-40%,8小时内为60%-80%,和在24小时内至少为85%;和
b)在ph为6.8的溶出介质中,所述制剂中所含的所述活性成分在16小时内释放了45%或更少;
其中,所述缓释层制备如下:将粘度在80000cps至120000cps内的高粘度羟丙基甲纤维素(hpmc)与粘度在2000cps至20000cps内的低粘度hpmc按10:1-1:1的质量比范围进行混合作为控释基质。
本发明在下文中进行进一步具体描述。
当通过胃肠道时,药物在剂型中释放,最终溶解并吸收。为了吸收药物,应当先释放至体液中,并溶解于吸收区域。例如,口服施用的片剂或胶囊剂型中的药物可只在药物分子释放并溶解于胃肠道后被吸收。此外,作为每日单次施用的药物,半衰期较短的莫沙必利或其盐优选在20小时或更长的时间释放、溶解并吸收,同时在胃肠道中保留超过20小时的时间。药物在胃肠道中的保留时间可借助待用的给定制剂的组分类型和/或组成比例来控制。
同时,胃的ph为1-3,十二指肠为5-7,升结肠为7-8,而空肠的ph为6.5。若所有药物组分在口服施用后的16小时内就在胃肠道内的各器官中释放,那么莫沙必利及其盐由于其只有1.3-2小时的较短半衰期会在吸收后很快消失,以及它们因较短的药物效应持续时间,而无法维持24小时的药物效应。
本发明含莫沙必利的口服施用制剂的例子包括含有莫沙必利或其盐(例如柠檬酸盐)、填充剂、崩解剂、添加剂(如粘结剂)的快速释放层和含有莫沙必利或其盐、填充剂、崩解剂、控释基质和添加剂(如粘结剂)的缓释层。本发明含莫沙必利的口服施用制剂可为双层片剂或多层片剂形式,并任选地含有润滑剂。
本发明制剂被制备成较小的尺寸,其总重为200mg或更低,优选为150mg至160mg的范围内,因此其较易吞咽以便于作为内服药物并提供依从性和高经济性。
同时,本发明含有莫沙必利或其盐的口服施用制剂的特征在于,在双层制剂的制造中,所述双层制剂由一快速释放药物的快速释放层以及一慢速释放的缓释层组成,以便同时满足药理活性的较快出现并能在24小时持续维持药理活性,在将高粘度hpmc和低粘度hpmc混合成缓释层内的控释基质时,对高粘度hpmc和低粘度hpmc的重量比进行控制,从而控制胃肠道不同ph值区域内的溶出度和/或胃肠道内的保留时间。
本发明的发明人通过对ph为4时的溶出度实验,发现只利用低粘度hpmc作为控释基质在运送的前6小时时完全(100%)释放莫沙必利或其盐,而只利用高粘度hpmc作为控释基质在,即使在运送的24小时后也无法100%释放莫沙必利或其盐。基于该结果,本发明人将高粘度hpmc和低粘度hpmc在特定比例下混合以便控制到达小肠后的保留时间和溶出度以及在到达小肠以前的保留时间和溶出度,因此莫沙必利或其盐可以在ph为6.8的小肠和/或大肠中释放,由此制备了能维持24小时有效药理学活性(图9和10)的每日单次口服施用缓释制剂。
具体地,由于莫沙必利或其盐在16小时(优选为24小时)的释放程度可以是45%或更低,因此使维持24小时有效药理学活性成为可能。
令人意外的是,本发明的发明人发现,当高粘度hpmc和低粘度hpmc一起作为缓释层中莫沙必利或其盐的控释基质使用时,ph为4时,24小时内的溶出度达到100%,而在ph为6.8时溶出度有大幅下降。因此,通过降低药物在通过胃后在十二指肠中或后续的消化道中时的溶出度,甚至在口服施用后的16小时药物仍在消化道内释放,由此可以表现出20-24小时的药理效应。
因此,本发明含莫沙必利的口服施用缓释制剂,通过(优选在其通过胃肠道期间)控制高粘度hpmc和低粘度hpmc的混合比例,能够在通过胃肠道时,使20%-50%的莫沙必利或其盐释放于胃,而50%-80%的莫沙必利或其盐释放于消化道。
高粘度hpmc的粘度范围为80000cps至120000cps,优选为100000cps。低粘度hpmc的粘度范围为2000cps至20000cps。在一实施方式中,所用的低粘度hpmc为4000cps。在本发明的一个实施方式中,高粘度hpmc和低粘度hpmc的重量比可为10:1至1:1,优选为2.6:1至1:1。
作为缓释基质,hpmc是一种控释聚合物,其相对于传统控释聚合物,例如甲基纤维素和聚醋酸乙烯酯而言具有相对更长的释放时间,以使溶出度得到相对恒定的控制。hpmc的粘度较易控制,但当使用低粘度hpmc时,其比使用高粘度hpmc而言,所需hpmc使用量更大,因此需要的片剂尺寸更大,从而提高了其生产成本,也由于其较大的片剂尺寸,使其作为内服药物的片剂服用便利性下降。然而,粘度为120000cps或更高的高粘度hpmc相对于低粘度hpmc来说,难于和柠檬酸莫沙必利(一种药学上的活性成分)均匀混合。控释聚合物和药学上的活性成分的不均匀混合物会造成溶出度不规则,因此,在现有技术中,即使会增加片剂重量,主要应用的还是低粘度的hpmc。
为了解决上述问题,本发明的一个实施方式中,将高粘度和低粘度hpmc按10:1至1:1的重量比混合,然后加入一定比例的聚维酮作为粘结剂,微晶纤维素作为赋形剂,乳糖、低取代羟丙基纤维素(在此及下文中为l-hpc)作为崩解剂,从而克服了高粘度hpmc的缺陷并获得了均匀的混合物。此外,通过减少片剂生产放大过程中可能出现的可变因素,基本消除了颗粒尺寸和压片压力导致的溶出度变化,并解决了聚(甲基丙烯酸甲酯)-基
同时,采用比低粘度hpmc用量更多的大量高粘度hpmc(基于重量)进行混合,则能够解决低粘度hpmc用量超过高粘度hpmc用量时的快速溶出问题,从而使制造一种每日单次口服的缓释制剂成为可能。
优选地,对同一粘度而已,hpmc的物理形态具有优异的分散性和恒定的颗粒易磨性。
相对于给定制剂的总重,hpmc的加入量为5wt%-20wt%,优选为8wt%-16wt%。当所添加的hpmc低于5wt%,则会导致快速溶出,而当所添加的hpmc高于20wt%,则给定制剂无法显示恒定的溶出。
莫沙必利,本发明的活性成分,为血清素受体激动剂,其能够通过选择性作用于消化道内胆碱能神经元上的血清素(5-ht)受体而促进乙酰胆碱自神经末梢释放,通过所释放的乙酰胆碱促进消化道平滑肌的运动,从而调整消化道的有力运动以及胃排空。柠檬酸莫沙必利是莫沙必利的一种,此二者在药理学上相同。柠檬酸莫沙必利比莫沙必利水溶性更高、熔点更高,因此更便于制备和纯化。
本发明含有柠檬酸莫沙必利的缓释片剂是一种特别设计的制剂,其利用一缓释基质控制所给药物的溶出度来缓慢释放制剂中所含的活性成分,与现有技术中其它制剂相比仍具有相同的生物学活性。本发明含有柠檬酸莫沙必利的缓释制剂能使患有常见胃肠蠕动障碍的患者每日口服服用一次莫沙必利而不是每日三次口服服用,快速达到有效血液治疗浓度,并持续维持血液中的有效治疗浓度,由此改善了治疗效果,也通过简化剂量治疗提高了需要服用药物的患者的便利性和依从性。
相对于给定制剂的总重,作为药学活性成分的莫沙必利或其盐的含量优选为10wt%至20wt%。当莫沙必利或其盐的含量低于10wt%,则导致药学效应的降低,而当其含量高于20wt%,其可导致副作用产生,例如排软便、腹泻、口渴等。当制成缓释片剂,每日单次口服施用的每片片剂中的活性成分量优选约为10mg-20mg。
崩解剂通过吸收水分并促进制剂的崩解来改善莫沙必利或其盐的溶出度。本发明快速释放层和缓释层中所用崩解剂的非限制性例子包括交联羧甲基纤维素钠、淀粉羧乙酸钠、微晶纤维素、交聚维酮(交联聚维酮)和其它商业上有用的聚乙烯吡咯烷酮(pvp,聚维酮)、l-hpc、海藻酸、粉状纤维素、淀粉,海藻酸钠,及其混合物。优选地,所述崩解剂为l-hpc或交聚维酮。所述崩解剂还可经药学上可接受的方法,通过加入口服固体制剂而进一步添加,还可采用第二崩解剂用于制剂的快速溶解。优选地,相对于制剂的总重量,崩解剂的用量为10wt%至30wt%,优选地,为20wt%至30wt%。
本发明快速释放层和缓释层中所用赋形剂的非限制性的例子各自包括乳糖、甘露醇、葡萄糖、山梨醇、葡聚糖、蔗糖,及其组合。乳糖用于改善片剂服用的方便性,当其与hpmc在溶出介质中共存时为水溶性通道提供便利,并维持片剂的形状。此外,当将乳糖与高粘度hpmc混合时,有助于在柠檬酸莫沙必利和hpmc之间形成均质混合物。优选地,相对于给定制剂的总重量,乳糖的加入量为15wt%至30wt%。当乳糖的用量低于15wt%,则难以在高粘度hpmc和其盐之间形成均质混合物,当混合物加入到制片冲压机时还会产生粘结的现象。相反,当乳糖用量多于30wt%时,则存在增加所述制剂总重量的问题。可选地,还可采用其它赋形剂来代替乳糖,例如,相对于制剂的总重量10wt%至30wt%的甘露醇,相对于制剂的总重量10wt%至30wt%的山梨醇,相对于制剂的总重量20wt%至40wt%的葡萄糖,相对于制剂的总重量20wt%至30wt%的糊精,或相对于制剂的总重量20wt%至40wt%的蔗糖。
在本发明的一实施方式中,作为可在有机溶剂中溶解并改善给定制剂结合力的水溶性聚合物,粘结剂可用于快速释放层和缓释层。所述粘结剂的非限制性例子可包括聚乙烯吡咯烷酮(采用了通用名为聚维酮的聚维酮k30,分子量为30)。优选地,粘结剂的加入量为3wt%至10wt%。当加入的粘结剂少于3wt%,制剂的粘结力减弱并造成制粒过程困难,而当加入的粘结剂多于10wt%时,则难以控制所给药物的溶出度。
本发明快速释放层和缓释层中所用润滑剂的非限制性的例子各自包括无水硅酸、二氧化硅、滑石粉、硬脂酸、硬脂酸镁或其混合物。所述润滑剂改善了粉末/颗粒材料的流动性从而提高模具内(制片机的较低部位)的制片机满斗率,同时降低了粉末/颗粒材料本身以及与冲压部,压片机上部与模具之间的摩擦力,从而更便于压片和分散。
优选地,润滑剂的用量为0.5wt%至5wt%。当所加的润滑剂少于0.5wt%,会造成制片过程困难,而当所加的润滑剂大于5wt%时,会由于润滑剂颗粒的包膜现象而影响片剂的溶解特性。
本发明含有莫沙必利的制剂组合物相对于制剂总重,可含有10wt%至15wt%的莫沙必利或其盐作为药学上的活性成分,5wt%至10wt%的高粘度hpmc,5wt%至10wt%的低粘度hpmc,15wt%至30wt%的乳糖,3wt%至10wt%的聚维酮,以及0.5wt%至5wt%的润滑剂。本发明含有莫沙必利的制剂组合物是一种由快速释放层和缓释层组成的双层缓释片剂。
在一实施方式中,本发明含有莫沙必利的口服施用制剂可分别通过对快速释放层和缓释层进行混合、揉捏、粒化,然后进行制片而制成。首先,在缓释层中,相对于缓释层的总重量,混合13wt%至15wt%的莫沙必利或其盐作为药学上的活性成分、15wt%至30wt%的乳糖、25wt%至30wt%的hpmc,以及15wt%至30wt%的l-hpc,揉捏并加入预先溶于足够量乙醇中的3wt%至10wt%的聚维酮作为粘结剂来造粒,然后在50℃至60℃的干燥箱内干燥至干燥减重(lod)为2%或更低,控制颗粒大小。随后将所得物与足够量的润滑剂混合从而制备缓释层。此外,快速释放层中,相对于快速释放层的总重量,混有6wt%至8wt%的莫沙必利或其盐、15wt%至30wt%的乳糖、以及15wt%至40wt%的l-hpc,揉捏并加入预先溶于足够量乙醇中的3wt%至10wt%的聚维酮作为粘结剂来造粒,然后在50℃至60℃的干燥箱内干燥至干燥减重(lod)为2%或更低,控制颗粒大小。随后将所得物与足够量的润滑剂混合从而制备快速释放层。可在上述制备的混合物中进行缓释层的初步压片,然后通过填充快速释放层在该缓释层的顶部进行次级压片来制备多层片剂。在此,快速释放层的制片并非必需在缓释层的制片之后进行。即,所述快速释放层的制片可先进行,然后将缓释层颗粒填入所制片剂之内。此外,可按此顺序或以相反顺序顺次填充快速释放层和缓释层,并可一次制片。
本发明含有莫沙必利的口服施用制剂可以是经混合快速释放层和缓释层而制备的球状片剂或多层片剂。
因此,对于本发明含有莫沙必利的口服制剂,通过对健康对象进行体内实验,血液中柠檬酸莫沙必利的最大浓度(c最大ng/ml)可以在40-50ng/ml的范围内,血液浓度-时间曲线下面积(aucth*ng/ml)的范围为200-240h*ng/ml,到达血液最高浓度的所需时间(t最大,h)可为1.0-4.0小时。
本发明双层片剂由含有相同活性成份的快速释放层和缓释层组成,根据每分钟50转的桨法,利用900ml、ph为4的溶出介质进行溶出实验(韩国药典,第十版,溶出实验第二方法),本发明双层片剂显示溶出实验开始1小时、8小时和40小时的相应溶出率为25%-45%、60%-80%,以及大于等于85%。当在水中、ph1.2、ph4.0以及ph6.8的溶出介质中进行溶出实验时,本发明含有柠檬酸莫沙必利缓释制剂以及传统技术的那些均根据ph情况显示出不同的溶出特性。
为了通过比较溶出特性以及药代动力学而预测所述制剂在人类体内的药物特性,利用具有实施例中所示组成的制剂,在比格犬体内对药理学活性进行了确认。结果确认柠檬酸莫沙必利的药代动力学特征随着体外溶出特征而改变,体外试验中合适的溶出特性在体内试验中获得所需的药理学活性。
此外,在人体内使用所述制剂检测柠檬酸莫沙必利药代动力学特征(其中上述药代动力学已经测定)后,确认出现本发明所期望的快速药理学活性,而高于柠檬酸莫沙必利血液最低有效浓度的柠檬酸莫沙必利血液浓度也被确认可维持24小时。
【有益效果】
根据本发明制备的由快速释放层和缓释层构成的双层口服片剂可通过药学上可接受的缓释基质而控制药物的溶出度,可在施用后快速达到血液中的有效治疗浓度,因此尽管与传统技术制剂的那些制剂的生物学活性相同,但同样能表现出对胃肠动力紊乱的更佳效果,也能在相当长的一段时间内将血液中的活性成分和有效活性代谢物维持在恒定的浓度。因此,与传统制剂相比,本发明片剂所需剂量数更少、体积更小,在施用方面可为患者提供更佳的便利性,从而提高药物适应性和患者依从性。
附图简要说明
本发明上述及其他它目的、特征及其余优点将通过以下详述结合附图得以更清晰的理解:
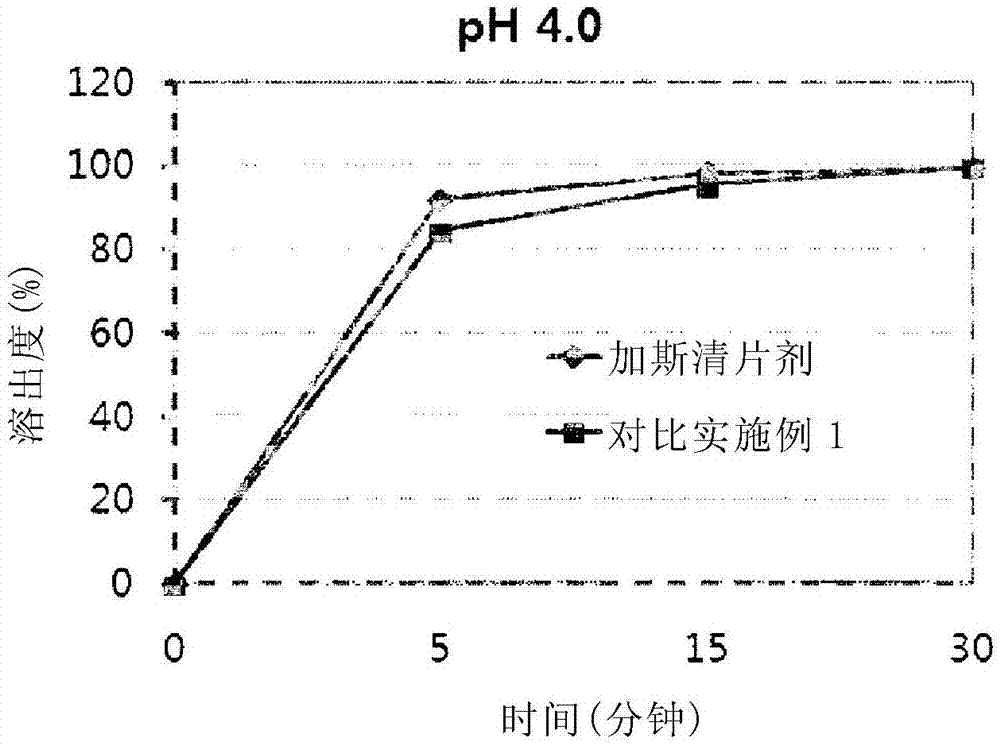
图1显示加斯清(gasmotin)5mg片剂和对比实施例1制备的对照药物在ph为4.0的溶出介质中的溶出度;
图2显示对比实施例2-4中制备的制剂在ph为4.0的溶出介质中的溶出度;
图3显示对比实施例5-6中制备的制剂在ph为4.0的溶出介质中的溶出度;
图4显示实施例1-7中制备的制剂在ph为4.0的溶出介质中的溶出度;
图5显示实施例3中制备的制剂在ph为4.0的溶出介质中的溶出度;
图6显示实施例3中制备的制剂在水作为溶出介质时的溶出度;
图7显示实施例3中制备的制剂在ph为1.2的溶出介质中的溶出度;
图8显示实施例3中制备的制剂在ph为6.8的溶出介质中的溶出度;
图9显示了在实验实施例3中进行的临床预试验的结果;和
图10显示了在实验实施例4中进行的临床试验的结果。
·优选实施方式描述
通过以下实施例可对本发明进行更好地理解,但其并非是本发明范围的限制。
<实施例1-7以及对比实施例1-6>
快速释放层的制备:根据表1和2中所述的组分,将柠檬酸莫沙必利、微晶纤维素、乳糖水合物以及l-hpc进行混合,并加入预先溶解在乙醇中的聚维酮k-30溶液,然后进行揉捏、制粒并在50℃-60℃的干燥箱中干燥30-40分钟(至lod2%或更低)。所得物控制颗粒大小,并混入剩下的润滑剂。
缓释层的制备:根据表1和2中的组分,将柠檬酸莫沙必利、微晶纤维素、乳糖水合物、低粘度hpmc(4000cps,hpmc2910)、高粘度hpmc(100000cps,hpmc2208)以及l-hpc进行混合,并加入预先溶解在乙醇中的聚维酮k-30溶液,然后进行揉捏、制粒并在50℃-60℃的干燥箱中干燥30-40分钟(至lod2%或更低)。所得物控制颗粒大小,并混入剩下的润滑剂。
双层片剂的制备:片剂的制片采用以上制备的快速释放层和缓释层的混合物,并通过常规方法采用opadryoy-c-7000a(由卡乐康(colorcone)有限公司制生产的膜基质商品名)进行膜包衣,从而制备含有每片中含有15mg柠檬酸莫沙必利作为莫沙必利的缓释片剂。
【表1】
【表2】
<实验实施例1>
利用ph为4.0的溶出介质,对市售可得的加斯清片剂5mg(莫沙必利5mg,太雄有限公司)和对比实施例1中制备的仅由快速释放层构成的片剂的溶出特征进行了比对。在此,体外溶出试验根据通用实验第二方法进行,桨转速50rpm/分子(韩国药典),结果如图1所示。在对比实施例1中仅由快速释放层组成的片剂中,30分钟内释放了100%的药物,与加斯清片剂的溶出度相似。
同时,为了检测缓释层中加入或不加入高粘度或低粘度控释基质(缓释基质)及其量(wt%)造成的制剂溶出特征变化,根据表2中的组分制备了对比实施例2-6的柠檬酸盐片剂。在此,片剂重量由微晶纤维素赋形剂(如填充剂)进行调整。在ph为4.0时,观察对比实施例2-6片剂的溶出特征,其结果如图2和3所示。
思考
对于溶出度,对比实施2-4中仅采用低粘度缓释基质制备的片剂在6小时内显示出了100%的药物释放,因此无法表现出缓释作用(图2)。同时,对比实施例5-6中仅采用高粘度(hpmc2208)缓释基质制备的片剂在24小时后,也未有100%的药物释放,因此其表现出了长时间的缓释作用(图3)。
图4显示了实施例1-7中,将低粘度缓释基质和高粘度缓释基质以特定比例混合后制备的片剂的溶出度。实施例5-7中制备的片剂在初始阶段,随着低粘度缓释基质的量的上升,显现出较快的释放,而达到100%药物释放所需的时间缩短。因此,该片剂并不能达到每日单次施用的效果。
实施例1-4显示,高粘度缓释基质含量高于低粘度缓释基质的片剂,片剂中药物在4小时后释放了60%或更少。在实施例3中的片剂中,在溶出早期,药物释放了约30%,与快速释放层的药物含量相似,而在开始后的20小时左右表现出恒定释放,在开始后20-24小时之间药物完全释放。因此,实施例3的片剂有望于在血液中具有所需的最低及最高效应浓度,并因此成为合适的每日单次施用缓释制剂。
<实验实施例2>
选取实施例3中的缓释制剂作为进行临床试验的最终制剂,实施例3缓释制剂的原料含量和重量比如下表3所示。
【表3】
实施例3显示了由快速释放层和缓释层构成的双层片剂,其中缓释层含有合适量的高粘度hpmc和低粘度hpmc作为缓释基质。因此,片剂中的大部分药物直到抵达ph为4的十二指肠后才释放,大量药物可在ph为6.8的小肠和/或大肠内释放,因此其被作为最具潜质的24小时缓释所给药物的候选组。此外,将表现出相对恒定和稳定溶出度的ph4.0环境作为标准溶出条件,建立的试验标准和方法为开始后1小时溶出度为25%-45%、开始后8小时为60%-80%,以及开始后24小时为85%或更高。
-不同ph条件下溶出介质的不同溶出度实验
对象:实施例4中制备的含有柠檬酸莫沙必利的缓释制剂
溶出实验溶液:韩国药典的崩解试验(ph1.2、4.0、6.8和水)900ml,
实验温度:37±5℃
溶出方法:韩国药典通用实验中溶出实验第二方法(桨法),50rpm/分钟。
对含有柠檬酸莫沙必利的缓释制剂根据ph变化的溶出特征采用体外试验进行检测,结果如表4和图5-8所示。
【表4】
结果显示,ph为1.2和在水环境下时溶出度是恒定且持续的,因此活性成分柠檬酸莫沙必利的生物利用度可维持24小时。此外,由于柠檬酸莫沙必利的理化特性以及其内所含缓释基质和赋形剂的影响,ph6.8的环境表现出的溶出度较低。
<实验实施例3>
采用实施例3中缓释制剂进行的临床预实验对柠檬酸莫沙必利的药代动力学特征进行了测试,其中实施例3缓释制剂的溶出特征经体外ph环境下进行确认。
测试方法包括向比格犬(雄性,n=6)口服给药施用测试材料(含有柠檬酸莫沙必利的缓释片剂)和市场上的加斯清5mg各一片,在预定时间采集血样,自所采集的血液中分离血清,并测定比格犬血清中莫沙必利及其盐的浓度。
作为药代动力学参数,测定血液中最终浓度的自施用开始到时间点t之间的血液浓度-时间曲线下面积(auct)、自施用开始到无穷大时间的血液浓度-时间曲线下面积(auc∞)、血液最大浓度(c最大)、到达血液最高浓度的所需时间(t最大)以及血液损失半衰期(t1/2)经bacalc2007程序进行计算。对于auc∞和c最大,分别利用除以剂量得到的商值,表示为auci/剂量和c最大/剂量,auct和auci之间的平均比例被表示为auct/auci。材料的显著性由学生t-检验(student’st-test)以95%可信区间进行确认,其结果如下表5和图9所示。
【表5】
利用一片加斯清5mg作为对照药物以及实施例3中制备的柠檬酸莫沙必利缓释片剂在比格犬中测得莫沙必利的pk特征后,可确定的是,c最大在初始阶段有所上升,达到血液中莫沙必利最高浓度的所需时间由于缓释基质而得以延长,由此具有与体外溶出特征相似的特征。上述结果有望达到解决本发明提出技术问题的目标,在此基础上,经临床试验确认的最佳效果揭示了本发明的最终目的。
<实验实施例4>
为了评估本发明制剂的药学等效性,针对健康男性对象进行了随机分配、开放标签、单剂量、3处理组的3周期威廉姆斯设计研究(williamsdesignstudy)第一阶段临床试验,对口服施用实施例3组成的柠檬酸莫沙必利缓释制剂和莫沙必利快速释放制剂(加斯清5mg,太雄有限公司)期间的药代动力学特征、以及食物影响进行了对比评估。根据临床试验过程的入选及排除标准,选取48位年龄在20-55岁之间的健康男性志愿者对象。具体实验条件如下表6所示,结果如表7和图10所示。
【表6】
在上表6中所述条件下进行的实施例3柠檬酸莫沙必利缓释制剂和加斯清5mg片剂的药学等效性测试结果显示了这两种制剂在90%可信区间内具药学等效性,如表7和图10所示。
【表7】
- 还没有人留言评论。精彩留言会获得点赞!