一种聚吡咯-聚乙烯吡咯烷酮纳米颗粒及其制备方法和用途与流程
本发明属于材料学领域,涉及一种生物纳米材料,具体来说是一种聚吡咯-聚乙烯吡咯烷酮纳米颗粒及其制备方法和用途。
背景技术
肿瘤的光热治疗,即光热消融治疗技术,因其微创而高效的特点受到了人们的广泛关注。光热治疗的基本原理是通过联合运用近红外光吸收剂和对于人体组织穿透力较强的近红外光,利用光热转换机制产生的高热量,使肿瘤组织局部升温,选择性地杀死肿瘤细胞。相对于传统的治疗方法而言,光热治疗是一种绿色治疗方法,表现出很多优势。比如,nir激光具有良好的生物组织穿透性,在穿透组织的过程中,光吸收衰减小且对正常组织细胞损伤较小;其次,在肿瘤治疗的精准性及可控性方面,光热治疗体现了极大的应用潜力。nir激光发挥诊疗作用的前提是需要能够吸收nir激光并将其转换成热量的纳米材料,即所谓的光热转换材料。在光热治疗中,光热转换材料通过主动或者被动靶向(即肿瘤部位血管的高通透性和滞留性,enhancedpermeabilityandretention,epr)效应富集在肿瘤组织处。在nir激光的辐射下,富集在肿瘤组织处的光热转换材料吸收nir激光并将其转换成热量,导致肿瘤细胞位置温度升高,进而达到消融并杀死肿瘤细胞的目的。由此可见,光热治疗的两大基本关键条件是nir激光及光热转换材料。
理论上,凡在近红外区域具有光吸收能力且生物相容性较好的纳米材料均可以作为光热转换材料用于光热治疗研究。近年来,在肿瘤光热治疗领域,一大部分在红外光区域具有强吸收的纳米生物材料(包括无机材料和有机材料)被广泛研究。无机材料主要为以金、银、钯等为基础的金属纳米颗粒(如金纳米材料,钯纳米片等)或以铜为基础的半导体纳米材料(如硫化铜纳米颗粒、硒化铜等);此外,以碳为基础(如石墨烯、碳管)的无机材料也是的一大类光热材料。这些材料通常需要较为复杂的制备过程,而且存在一些功能缺陷。例如,金纳米棒在光照条件下会发生形貌变化而导致吸收偏移,硫化铜纳米粒子在生物体内不易代谢,碳材料的光吸收系数较低、光热转化效率低等,限制了其进一步应用。有机光热转换材料,如聚苯胺、聚(3,4-亚乙基)聚(苯乙烯磺酸)(pedot:pss)和聚吡咯(ppy)等因拥有良好的生物相容性、光学稳定性及优异的光热转化性能成为创新型的光热转换材料。在这些创新性光热转换材料中,尺寸均匀的聚吡咯纳米颗粒显得尤其重要。
聚吡咯(ppy)是一种由五元杂环聚合而成的导电性高分子,这种材料因其优良的导电性能和出色的环境稳定性而备受关注。吡咯单体的α位和β位聚合能力相当,所以聚合时表现为三维生长,因此ppy的微观形貌往往呈菜花状或瘤状。要得到形貌较规则的ppy,就必须有能够控制和限定吡咯聚合生长的空间因素,使其能沿着某一特定方向或区域内进行有序的聚合生长。
研究表明,掺杂剂的加入能够提供吡咯有序生长所需的空间因素,从而得到具有特殊微观形貌的聚吡咯。
聚吡咯合成中的掺杂剂主要有质子酸、表面活性剂等。其中,表面活性剂具有特殊的分子结构和工作机理,引入到聚吡咯的合成过程中能够限制吡咯的三维生长,得到一系列具有特殊微型貌的ppy。随着科技的发展,ppy性能的提升成为ppy研究的重点,而ppy的性能直接受其微观形貌的影响,因此寻求最佳优化工艺条件来实现对特定形貌ppy的可控性制备变成重中之重。
技术实现要素:
针对现有技术中的上述技术问题,本发明提供了一种聚吡咯-聚乙烯吡咯烷酮纳米颗粒及其制备方法和用途,所述的这种聚吡咯-聚乙烯吡咯烷酮纳米颗粒及其制备方法和用途要解决现有技术中的聚吡咯纳米颗粒的微观形貌影响肿瘤热疗效果的技术问题。
本发明提供了一种聚吡咯-聚乙烯吡咯烷酮纳米颗粒,在所述的聚吡咯纳米颗粒表面修饰有聚乙烯吡咯烷酮。
进一步的,所述的聚乙烯吡咯烷酮的分子量为40kda-1300kda,浓度为1-25mg/ml。
进一步的,所述的聚乙烯吡咯烷酮的分子量为40kda,浓度为25mg/ml;纳米颗粒的直径为74.15nm。
进一步的,所述的聚乙烯吡咯烷酮的分子量为360kda,浓度为25mg/ml;纳米颗粒的粒径为74.55nm。
进一步的,所述的聚乙烯吡咯烷酮的分子量为1300kda,浓度为25mg/ml;纳米颗粒的粒径为68.98nm。
进一步的,所述的聚乙烯吡咯烷酮的分子量为360kda,浓度为5mg/ml;纳米颗粒的粒径为83.79nm。
本发明还提供了一种聚吡咯-聚乙烯吡咯烷酮纳米颗粒的制备方法,包括如下步骤:
1)将聚乙烯吡咯烷酮(pvp)加入蒸馏水中,所述的聚乙烯吡咯烷酮的分子量为40kda-1300kda,使得所述的聚乙烯吡咯烷酮的浓度为1-25mg/ml,搅拌溶解后加入引发剂,所述的引发剂为fecl3·6h2o、过硫酸铵或者高锰酸钾中的任意一种,加入后所述的引发剂的浓度为10-100mg/ml;
2)再加入吡咯,所述的吡咯与蒸馏水的体积比为1:100-1:200,在0-4℃的温度下,搅拌至聚合完成,将所得溶液离心洗涤,获得聚吡咯-聚乙烯吡咯烷酮纳米颗粒。
进一步的,步骤2)中,所述的聚吡咯-聚乙烯吡咯烷酮纳米颗粒的直径为74.15,74.55,68.98或者83.79nm。
进一步的,步骤1)或者2),所述的搅拌时间均为10-60分钟,反应时间均为1-8小时。
进一步的,步骤1)或者2)中,用蒸馏水洗涤2~5次。
本发明还提供了上述的聚吡咯-聚乙烯吡咯烷酮纳米颗粒作为药物载体的用途。
本发明还提供了上述的述的聚吡咯-聚乙烯吡咯烷酮纳米颗粒作为肿瘤治疗材料中的用途。
本发明通过在聚吡咯合成过程中同时加入掺杂剂的方法改善聚吡咯纳米颗粒的形貌、同步表面修饰及其应用性能的调控。经发明人研究发现,通过在化学氧化聚合的过程中加入pvp,可以制得ppy-pvp纳米颗粒;通过改变pvp的链长以及浓度,可以实现对ppy-pvp纳米颗粒形貌、光热转化效率、光热治疗、药物负载及释放能力等一系列性能的调控。
本发明通过选择不同的引发剂,在ppy合成过程中同时加入掺杂剂pvp的方法控制ppy纳米颗粒的形貌、同步表面修饰并调控其应用性能。
本发明工艺简单,产品易得,通过改变pvp的链长、浓度可以调控ppy-pvp纳米颗粒的形貌、光热转化效率、光热治疗、药物负载及释放能力等一系列性能的调控。注射至肿瘤后,ppy-pvp纳米颗粒可以吸收近红外光并将之转化为热能而使肿瘤组织局部升温,杀死肿瘤细胞;在纳米颗粒表面嫁接pvp可以增强纳米材料的胶体稳定性,使其具有良好的血液相容性和生物相容性,降低机体网状内皮系统对纳米材料的非特异性吞噬,使纳米材料更多地富集在肿瘤区域,提高对肿瘤的治疗效果。
将制备的ppy-pvp40kda、ppy-pvp360kda、ppy-pvp1300kda(pvp浓度为25mg/ml)、ppy-pvp360kda(pvp浓度为5mg/ml)四种材料分散于0.9%的nacl注射液中,将200ul所得的溶液通过尾静脉注入到荷有4t1乳腺癌肿瘤的balb/c裸鼠体内,24小时后通过功率密度为1w/cm2、波长为808nm的近红外激光照射肿瘤5分钟。实验结果发现,进行激光照射后,注射ppy-pvp360kdada-5mg/ml材料组小鼠肿瘤体积的增长受到明显抑制,而同等条件下注射ppy-pvp40kda、ppy-pvp360kda、ppy-pvp1300kda(pvp浓度为25mg/ml)三种材料、以及仅注射0.9%的nacl注射液,组中小鼠肿瘤抑制效果不明显。这一实验结果表明本发明所述的ppy-pvp360kda-5mg/ml纳米颗粒具有良好的体内抗肿瘤效果,在肿瘤治疗等领域具有潜在的应用前景。
本发明和已有技术相比,其技术进步是显著的。本发明通过向化学氧化聚合的反应体系中加入pvp,在合成ppy-pvp纳米颗粒的同时,一步实现对ppy-pvp纳米颗粒的结构调控和表面pvp修饰,并实现对ppy-pvp纳米颗粒的光热效率、药物负载、体内外光热治疗等一系列性能的调控。本发明的反应过程中无有害物质生成,因此,本发明的制备方法简单易行、产量高,适合规模化工业生产。
附图说明
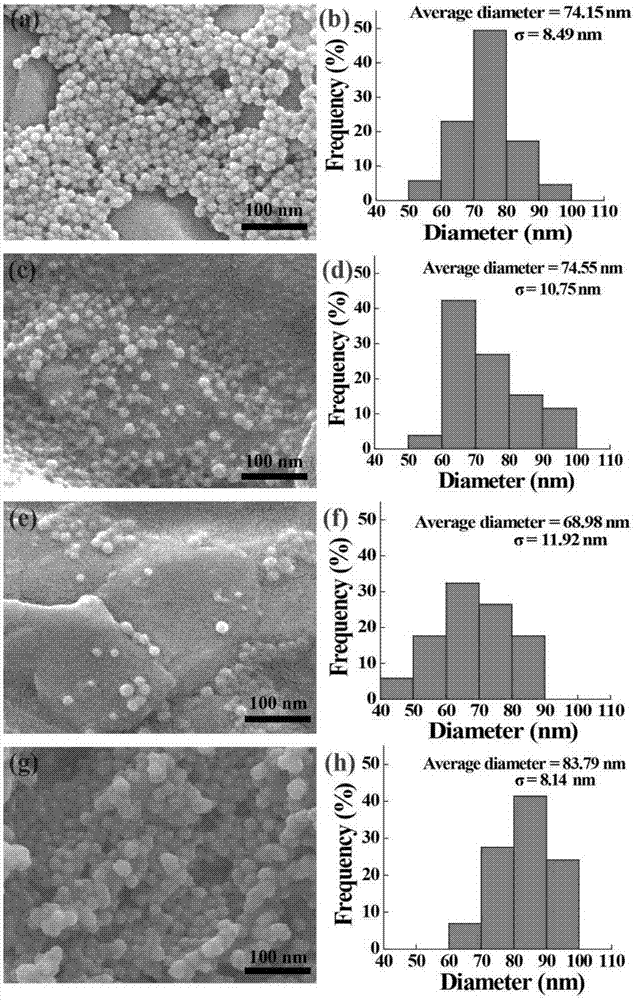
图1(a,b)ppy-pvp40kda纳米颗粒(粒径为74.15nm),(c,d)ppy-pvp360kda纳米颗粒(粒径为74.55nm),(e,f)ppy-pvp1300kda纳米颗粒(粒径为68.98nm),(g,h)ppy-pvp360kda-5mg/ml纳米颗粒(粒径为83.79nm)的sem图及其粒径分布图。
图2(a)、(c)、(e)、(g)分别为ppy-pvp40kda、ppy-pvp360kda、ppy-pvp1300kda、ppy-pvp360kda-5mg/ml四种纳米颗粒分散于生理盐水中24h、48h、72h后的水合动力学直径。(b)、(d)、(f)、(h)分别为分散于1640细胞培养基中24h、48h、72h后的水合动力学直径。静置存放72h,上述四种ppy-pvp纳米颗粒的水合动力学直径并没有发生明显的变化,证明材料具有良好的胶体稳定性,为进一步在活体水平评价它们的光热转换、杀伤肿瘤能力奠定了基础。
图3(a)不同粒径ppy-pvp纳米颗粒的紫外-可见-近红外吸收光谱(溶液的浓度为25ppm);(b)不同浓度(10ppm、40ppm)ppy-pvp360kda-5mg/ml纳米颗粒的紫外-可见-近红外吸收光谱。可以看出,溶液浓度一定时,四种不同粒径的ppy-pvp材料均可以吸收一定强度的波长为808nm的近红外激光,但随着pvp分子量、浓度的增大,光吸收逐渐减少;ppy-pvp360kda-5mg/ml纳米颗粒在808nm处的吸收最大,由此推测其近红外光吸收-热转化能力最强。
图4ppy-pvp360kda-5mg/ml纳米颗粒、纯pvp360kda的傅里叶变换红外光谱图。从图中可以看出,出现在1553,1473,1285,1042,966以及932-788cm-1处的特征峰,对应ppy中的c-c共轭、非对称伸缩振动和对称伸缩振动键、c-n伸缩振动、c-h平面弯曲和c-h环形变。2950,1646,1490-1450cm-1处的振动峰分别为pvp中c-h的伸缩振动、c=o的伸缩振动、亚甲基弯曲振动、c-n伸缩振动,说明在氧化吡咯单体氧化聚合形成聚吡咯过程中,pvp360kda分子链已经成功地连接在ppy纳米颗粒的表面(3370cm-1左右的峰是pvp分子吸附的水中o-h伸缩振动)。
图5(a)不同粒径ppy-pvp纳米颗粒分散液在功率为0.3w/cm2的808nm激光辐射下的温度变化曲线(蒸馏水作为对照);(b)ppy-pvp360kda-5mg/ml纳米颗粒冷却过程中热驱动力的自然对数对时间的线性拟合图(由此可获得系统时间常数为202.306);(c)8个周期808激光照射升温-激光关闭降温过程中ppy-pvp360kda-5mg/ml纳米颗粒分散液的温度变化示意图(浓度:100ppm,功率:2w/cm2);(d)材料浓度为100ppm时,不同粒径ppy-pvp纳米颗粒分散液和蒸馏水在功率为0.8w/cm2的808nm激光辐射下的温变曲线;(e)为(d)对应的红外热成像图片;(f)相同材料浓度(50ppm),不同粒径ppy-pvp纳米颗粒分散液在功率为0.8w/cm2的808nm激光辐射下的温变曲线;(g)为(f)对应的红外热成像图。从图5(a)可以看出,激光照射后,这四种材料的温度从环境温度(20.6℃)升高至38~50℃之间,温差达到17.4~29.4℃。在同样实验条件下,蒸馏水升温不显著(仅升高了3℃)。通过系统时间常数计算出ppy-pvp40kda(samplei)、ppy-pvp360kda(sampleii)、ppy-pvp1300kda(sampleiii)和ppy-pvp360kda-5mg/ml(sampleiv)四种材料的光热转化效率ηt分别为42.49%、39.87%、35.60%和51.61%。显然,随着pvp分子量的增大材料的光热转换效率减小,而降低pvp的浓度光热转化效率增大,其中ppy-pvp360kda-5mg/ml材料光热转化效率最高,即光热转换能力最佳。从图5(d)可以看出,随着pvp分子量的增大材料分散液的温差变小,但降低pvp的浓度温差增大;其中ppy-pvp360kda-5mg/ml纳米颗粒分散液在5min内温度升高50℃左右,显示出最佳的近红外激光吸收-热转化性能。此外,ppy-pvp360kda-5mg/ml纳米颗粒显示出了良好的热稳定性(图5(c)),经过8次激光照射升温-激光关闭降温实验过程,仍保持良好的光热转换能力,且8个周期的温度变化差异不大。
图6(a)四种ppy-pvp纳米颗粒(浓度为500ppm)处理24h后的细胞存活率(b)与(a)对应的细胞台盼蓝染色结果(1640细胞培养基为对照)。当细胞与不同的材料孵育2h后,存活率均在85%以上,证明了这四种材料具有良好的细胞相容性。
图7细胞水平光热治疗效果:(a)经功率为1.0w/cm2的808nm激光辐射5min后小鼠乳腺癌细胞(4t1细胞)的存活率(细胞先经不同浓度的ppy-pvp360kda-5mg/ml纳米颗粒处理24h,生理盐水为对照)。在试验浓度范围内(0-200μg/ml),经过功率为1.0w/cm2的808nm激光辐射5min,并继续培养24h后,4t1细胞的成活率明显降低;材料的浓度越高,对4t1细胞生长的抑制越明显。当材料的浓度为200ppm时,对肿瘤的抑制效率已超过90%;(b)激光处理后细胞的dead/live染色结果(死亡细胞可被染为红色),光学显微镜镜检结果表明当材料浓度为100ppm和200ppm时绝大部分细胞已经凋亡,进一步表明ppy-pvp360kda-5mg/ml纳米颗粒具有良好的体外肿瘤光热治疗效果。
图8四种ppy-pvp纳米颗粒的溶血率(材料浓度为500ppm,蒸馏水为对照)。共同孵育2h后,溶血率均在5%以下,即在一定实验浓度下并未观察到明显的溶血现象,证明了这四种材料具有良好的血液相容性,为后续安全地静脉注射治疗提供了保证。
图9(a)四种ppy-pvp纳米材料的dox药物负载率;(b)dox药物释放曲线。从图(a)中可以看出,dox浓度(100ppm)一定时,ppy-pvp对dox的负载效率随着pvp分子量的增大而减小,但随着pvp的浓度的降低而升高;其中,ppy-pvp360kda-5mg/ml材料负载率最高为26.39%。
如(b)图所示,在ph=5.4,t=37℃、ph=7.4,t=37℃、ph=5.4,t=50℃三组实验中,当ph=7.4,t=37℃时,药物的累积释放率是20%,而在ph=7.4,t=50℃时,药物的累积释放率达到了23%;对比ph=5.4,t=50℃,药物的累积释放量达到25%。分析得知,随着温度的升高,药物的释放量增加;随着溶液的ph的减小,药物释放量增加。而肿瘤部位的位置所处环境是一个偏酸性的生理环境,更加有利于药物的释放;而且ppy-pvp360kda-5mg/ml纳米材料的光热吸收转换可使肿瘤部位温度升高,促进药物的释放。ppy-pvp360kda-5mg/ml纳米材料对dox的释放是一种具有ph和nir激光(温度)双重响应特性的可控释放,这对更好地提高dox的化疗效果,降低化疗过程中dox的毒副作用至关重要。
图10(a)裸鼠肿瘤的温度变化曲线;(b)近红外激光辐射各时间点红外热成像图;(c)肿瘤相对体积变化图;(d)肿瘤体积变化曲线。结果表明,空白对照组(注射生理盐水,无论有无施加激光)肿瘤生长不受影响;而静脉注射不同粒径ppy-pvp纳米材料并辅以808nmnir激光照射的裸鼠肿瘤生长被有效地抑制。和细胞水平的光热治疗类似,于降低pvp分子量或浓度条件下制得的纳米颗粒具有更好的在体光热转换效果。相应地,肿瘤相对体积增加变缓;其中,ppy-pvp360kda-5mg/ml(sampleiv)-dox纳米材料显示出最佳的肿瘤治疗效果。这是因为在激光的照射下,富集在肿瘤部位的ppy-pvp纳米材料可以有效地吸收nir激光,并进行光热转换,同时负载的药物释放出来。在高温和药物的双重作用下,sampleiv-dox显示出了良好的肿瘤光热治疗效果。
具体实施方式
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外应理解,在阅读了本发明讲授的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
实施例1
将分子量40kda,浓度25mg/ml的pvp加于蒸馏水中,搅拌溶解后加入2.48g的fecl3·6h2o。在4℃温度时,加入吡咯反应4h。将所得溶液离心洗涤,获得ppy-pvp40kda纳米颗粒(图1a,b)。用imagej1.40g软件测量纳米颗粒的直径(至少测量50个),ppy-pvp40kda纳米颗粒的直径为74.15nm,pvp40kda的加入有效地改善了ppy纳米颗粒的胶体稳定性(图2a、b)。
实施例2
将分子量360kda,浓度25mg/ml的pvp加于蒸馏水中,搅拌溶解后加入2.48g的fecl3·6h2o。在4℃温度时,加入吡咯反应4h。将所得溶液离心洗涤,获得ppy-pvp360kda纳米颗粒(图1c,d)。用imagej1.40g软件测量纳米颗粒的直径(至少测量50个),ppy-pvp360kda纳米颗粒的粒径为74.55nm,pvp360kda的加入有效地改善了ppy纳米颗粒的胶体稳定性(图2c、d)。
实施例3
将分子量1300kda,浓度25mg/ml的pvp加于蒸馏水中,搅拌溶解后加入2.48g的fecl3·6h2o。在4℃温度时,加入吡咯反应4h。将所得溶液离心洗涤,获得ppy-pvp1300kda纳米颗粒(图1e,f)。用imagej1.40g软件测量纳米颗粒的直径(至少测量50个),ppy-pvp1300kda纳米颗粒的粒径为68.98nm,pvp1300kda的加入有效地改善了ppy纳米颗粒的胶体稳定性(图2e、f)。
实施例4
将分子量360kda、浓度5mg/ml的pvp加于蒸馏水中,搅拌溶解后加入2.48g的fecl3·6h2o。在4℃温度时,加入吡咯反应4h。将所得溶液离心洗涤,获得ppy-pvp360kda-5mg/ml纳米颗粒(图1g,h)。用imagej1.40g软件测量纳米颗粒的直径(至少测量50个),ppy-pvp360kda-5mg/ml纳米颗粒的粒径为83.79nm,ftir结果(图4)表明pvp360kda-5mg/ml成功地连接在了ppy纳米颗粒的表面,并有效地改善了纳米颗粒的胶体稳定性(图2g、h)。
实施例5
将四种不同材料分散于96孔细胞培养板的培养孔中,得具有不同材料浓度的悬浮液。用808nm波长的近红外激光(功率密度为0.8w/cm2)照射不同浓度梯度的材料溶液和蒸馏水(空白组),通过flire60红外热像仪记录材料分散液和蒸馏水温度随时间的变化情况及对应的红外热成像照片(图5d、e、f、g)。为了解四种材料的光热转化效率,通过激光照射、关闭各5min得到温度变化曲线(图5a),再根据降温过程线性拟合得到的系统时间常数(图5b),最终可以计算出四种ppy-pvp纳米颗粒的光热转化效率。为检测pvp360kda-5mg/ml材料的光热稳定性,重复激光照射-关闭8个周期,记录每个周期的溶液温度变化值。
如图5(a)所示,激光照射后,这四种材料的温度从环境温度(20.6℃)升高至38~50℃之间,温差达到17.4~29.4℃。在同样实验条件下,蒸馏水升温不显著(仅升高了3℃)。通过系统时间常数可以计算出ppy-pvp40kda(samplei)、ppy-pvp360kda(sampleii)、ppy-pvp1300kda(sampleiii)和ppy-pvp360kda-5mg/ml(sampleiv)四种材料的光和转化效率ηt分别为42.49%、39.87%、35.60%和51.61%。显然,随着pvp分子量的减小材料的光热转换效率增大,降低pvp的浓度光热转化效率亦呈增加趋势。其中,以ppy-pvp360kda-5mg/ml材料光热转化效率最高,光热转换能力最佳(图5d,5min内温度升高50℃左右)。同一溶液浓度、功率密度下,随着pvp分子量的增大材料分散液的温差变小,但降低pvp的浓度温差增大;同一功率密度下,溶液浓度越高材料能更加地进行光热转换而升高温度(图5d、f所示)。此外,ppy-pvp360kda-5mg/ml纳米颗粒显示出了良好的热稳定性,经过8次激光照射升温-激光关闭降温过程后,该材料仍保持良好的光热转换能力(图5c)。
实施例6
选用l929细胞作为样本,通过cck-8法验证不同粒径ppy-pvp纳米颗粒的生物相容性和体外光热治疗肿瘤效果。具体步骤如下:收集对数期l929细胞,以8000细胞/孔的密度接种于96孔细胞培养板中,置于co2培养箱中培养24h后,向各个孔中加入纳米颗粒并培养24h。根据cck-8试剂盒说明书,向每孔中加入10μlcck-8工作液。继续培养1h后,利用biotekda酶标仪读取450nm处的吸光值,分析评价不同浓度材料对l929细胞的分裂的影响(图6a)。cck-8实验结束后,用生理盐水清洗各孔3次,使用相差显微镜(leicadmilled,德国)观察与ppy-pvp纳米材料培养24h后l929细胞的微观形貌。拍照完毕后,向每个孔内加入1ml台盼蓝染色液。染色十分钟后,用生理盐水清洗台盼蓝染色液3次,使用显微镜观察台盼蓝溶液对细胞的染色情况(图6b)。
体外光热治疗肿瘤效果评价步骤如下:收集对数期4t1细胞,以8000细胞/孔的密度接种于96孔细胞培养板中,置于co2培养箱中培养24h后,向各孔中加入具有最佳光热转换效率的ppy-pvp360kda-5mg/ml纳米颗粒继续培养4h。用波长为808nm近红外激光束辐射培养板,每孔辐射5min,激光密度为1w/cm2。完毕后继续置于co2培养箱中培养24h后,用cck-8试剂盒评价激光辐射后4t1细胞的成活率(图7a)。进一步利用dead/live染色,评价材料的体外光热治疗肿瘤效果(图7b)。
如图6a所示,当细胞与不同的材料、对照组共同孵育24h后,细胞存活率均在85%以上,实验证明了这四种材料均具有良好的细胞相容性。经过808nm激光辐射5min并继续培养24h后,4t1细胞的成活率明显降低,而且材料的浓度越高,对4t1细胞生长的抑制越明显。当材料的浓度为200ppm时,对肿瘤的抑制效率已超过90%。如图7b所示,光学显微镜镜检结果表明绝大部分细胞被染为红色,即细胞已经凋亡,与cck-8实验结果一致,进一步表明ppy-pvp360kda-5mg/ml纳米颗粒具有良好的体外肿瘤光热治疗效果。
实施例7
血液相容性是血液对外源性物质或材料产生合乎要求的反应,是评价材料的应用性能的一项重要影响指标。通过体外实验评价了4种ppy-pvp纳米材料的血液相容性。实验步骤如下:取肝素稳定的昆明鼠全血2ml,离心(3min,3000rpm)并用生理盐水洗涤红细胞沉淀物3次。将所得的血红细胞用生理盐水稀释至50ml,配制成血红细胞悬浊液,置于4℃冰箱备用。设置蒸馏水组为对照组。实验组四种材料浓度为500ppm,将实验组与血红细胞悬浊液以0.15ml:0.75ml的比例混合,对照组蒸馏水与血红细胞悬浊液的离心物混合(分别设置三组平行实验)。将上述溶液在37℃条件下孵育2h,然后将孵育后的液体离心(5min,5000rpm)分离得上清液。利用紫外-可见-近红外分光光度计测量上清液在570nm处的吸光值(溶血即血细胞胀破并释放出血红蛋白,血红蛋白易溶于生理盐水,并在570nm处显示特征吸收,故570nm处的吸光值与上清液中血红蛋白的含量成正比),通过计算得到材料的溶血率(hp)。
如图7所示,当血红细胞与不同的材料、对照组共同孵育2h后,材料组血细胞的溶血率均在5%以下,即未观察到明显的溶血现象,证明了这四种材料具有良好的血液相容性,为后续安全地静脉注射治疗提供了保证。
实施例8
药物负载实验:分别向4种ppy-pvp纳米材料(500ppm)中加入1ml化疗药物dox(100ppm),搅拌(400rpm,24h)即可得到负载药物的ppy-pvp纳米材料。本实验采用高效液相色谱法(hplc)测量负载后上清液中dox的浓度,即可得到负载于材料内dox的浓度。具体操作实验步骤如下:首先配置标准浓度的dox液体(0ppm、25ppm、50ppm、75ppm、100ppm),上机测试,hplc测试条件:流动相a:乙腈溶液(50%);流动相b:ph=3的磷酸溶液(50%);测试波长:425nm;流速:0.8ml/min。将负载dox药物后的ppy-pvp纳米材料离心分离,取上清液,上机测试浓度。通过实验计算药物负载率,以寻求最大的药物负载量。
药物释放实验:分别将3mg负载有dox的ppy-pvp360kda-5mg/ml纳米材料(dox:100μg/ml,ppy-pvp360kda-5mg/ml:1mg/ml)用透析袋装到分别注有4ml的磷酸盐缓冲溶液(pbs,ph=7.4)和醋酸-醋酸钠(ph=5.4)的反应瓶中,分别置于37℃与50℃摇床中孵育,每一组做三个平行样。在每一个预定的时间点,吸取1ml的含dox缓冲液后,再加入1ml对应ph的新鲜缓冲溶液。通过hplc确定释放的dox的浓度,计算dox在不同时间点的累计释放总量。
实施例9
取30只健康裸鼠,随机平均分为7组(对照组6只,其它组均4只),每只裸鼠背部皮下注射150μl含1×106个4t1肿瘤细胞(分散于150μl不含胎牛血清的rpmi-1640细胞培养基中),按照标准流程继续饲养裸鼠2周。将不同粒径的ppy-pvp纳米材料分散于0.9%的生理盐水中(1000ppm),前六组小鼠通过尾静脉分别注射(i.v.)0.1ml的200μl生理盐水、ppy-pvp40kda(samplei)、ppy-pvp360kda(sampleii)、ppy-pvp1300kda(sampleiii)、ppy-pvp360kda-5mg/ml(sampleiv)、ppy-pvp360kdada-5mg/ml(sampleiv)-dox,最后一组通过瘤内注射(i.t.)ppy-pvp360kda-5mg/ml(sampleiv)-dox。然后,用nir激光(1w/cm2、波长为808nm)照射小鼠5min。使用ftirtme60红外热像仪监测并记录每组小鼠的肿瘤的温度和热成像图(如图10a、b)。在后续的小鼠饲养过程中,监测并记录不同时间点的相对肿瘤体积(v/v0,其中v0代表初始肿瘤体积)和每只小鼠的肿瘤外观(如图10c、d)。
如图10所示,空白对照组(注射生理盐水,无论有无施加激光)肿瘤生长未受明显影响;而静脉注射ppy-pvp纳米材料并辅以808nmnir激光照射的裸鼠肿瘤生长被有效地抑制。施以激光照射,肿瘤温差随着pvp分子量以及浓度的增加(5mg/ml和25mg/ml)而减小,肿瘤抑制效果变差;其中负载dox的sampleiv-dox对小鼠肿瘤治疗效果最好。这是因为在激光的照射下,富集在肿瘤部位的ppy-pvp纳米材料可以有效地吸收nir激光,并进行光热转换而产生高温将肿瘤杀死。
- 还没有人留言评论。精彩留言会获得点赞!