本发明涉及一种具有靶向肿瘤功能的肿瘤催化纳米反应体系的制备方法和应用。
背景技术
石墨烯量子点(gqds)具有极大的比表面积、丰富又活跃的边缘功能基团以及稳定的自发荧光,因而广泛应用到药物的递送、生物传感、成像等领域。除此之外,研究发现gqds具有类似于辣根过氧化物酶的过氧化物酶活性,在酸性条件下,能够将过氧化氢降解为羟基自由基。由此,gqds常被应用于制备检测葡萄糖的生物传感器。
目前,国内外有关gqds应用的研究报道,未见关于其肿瘤催化治疗相关应用。
技术实现要素:
本发明的目的是为了克服现有技术存在的缺点和不足,而提供一种具有靶向肿瘤功能的肿瘤催化纳米反应体系的制备方法和应用。该具有靶向肿瘤功能的肿瘤催化纳米反应器是通过将具有过氧化物酶活性石墨烯量子点(py-gqds)与葡萄糖氧化酶连接制备成催化反应器(pyg-gox),然后通过物理吸附包裹靶向肿瘤材料(rgds-peg),形成具有靶向肿瘤功能的催化纳米反应器,该反应器在肿瘤微酸性环境中,首先将环境中的葡萄糖降解为过氧化氢,再进一步利用py-gqds的过氧化物酶活性,将过氧化氢降解为羟自由基,由此杀死肿瘤细胞。
作为本发明的第一个方面,本发明公开了一种具有靶向肿瘤功能的肿瘤催化纳米反应体系,该肿瘤催化纳米反应体系包括有肿瘤催化纳米反应器以及物理吸附包裹于肿瘤催化纳米反应器外的靶向肿瘤材料;
所述的肿瘤催化纳米反应器的结构为具有过氧化物酶活性石墨烯量子点的羧基端与葡萄糖氧化酶的氨基端共价连接而成;
所述的靶向肿瘤材料为通过酰胺反应将rgds多肽与二硬脂酰磷脂酰乙醇胺-聚乙二醇(dspe-peg)共价连接制备而成。
作为本发明的第二个方面,一种具有靶向肿瘤功能的肿瘤催化纳米反应体系的制备方法,包括以下步骤:
(1)肿瘤催化纳米反应器的制备,以芘为原料,将芘与硝酸反应制备三硝基嵌二萘,该三硝基嵌二萘为前驱物,进一步利用水热反应将前驱物制备成具有过氧化物酶活性的石墨烯量子点(py-gqds),利用碳化二亚胺/n-羟基琥珀酰亚胺在常温条件下活化所述具有过氧化物酶活性的石墨烯量子点(py-gqds)的羧基端,使其与葡萄糖氧化酶(gox)的氨基端共价连接,制备肿瘤催化纳米反应器(pyg-gox(简称pg));
(2)利用碳化二亚胺/n-羟基琥珀酰亚胺在常温条件下活化分子量为3400的二硬脂酰磷脂酰乙醇胺-聚乙二醇(dspe-peg)的羧基端,通过酰胺反应将rgds多肽与二硬脂酰磷脂酰乙醇胺-聚乙二醇(dspe-peg)共价连接制备靶向肿瘤材料(rgds-peg);
(3)将步骤(2)中制备的靶向肿瘤材料通过物理吸附的方式包裹步骤(1)中制备的肿瘤催化纳米反应器,获得具有靶向肿瘤功能的肿瘤催化纳米反应体系(rgds-peg@pg);
所述的步骤(1)和(2)不分先后顺序。
进一步设置是所述的步骤(3)中物理吸附包裹的温度为30-37℃,10-12h。
进一步设置是所述步骤(2)中的二硬脂酰磷脂酰乙醇胺-聚乙二醇(dspe-peg)与rgds多肽的质量比:1:2-10。
进一步设置是所述步骤(1)中芘与硝酸反应制备三硝基嵌二萘的反应温度为80-100℃。
进一步设置是步骤(1)的水热反应的条件为180-200℃,10-12小时。
进一步设置是所述的步骤(1)中所制备的具有过氧化物酶活性的石墨烯量子点在透析袋中通过离子水透析并冷冻干燥,透析袋的截留分子量为≤3500。
进一步设置是所述的步骤(1)中具有过氧化物酶活性的石墨烯量子点和葡萄糖氧化酶的质量比为1:1-1:5。
进一步设置是所述的步骤(1)中具有过氧化物酶活性的石墨烯量子点和葡萄糖氧化酶的质量比为1:2。
本发明还提供一种具有靶向肿瘤功能的肿瘤催化纳米反应体系在制备靶向肿瘤的抗肿瘤药物中的应用,该靶向肿瘤的抗肿瘤药物中包括有所述的具有靶向肿瘤功能的肿瘤催化纳米反应体系。该抗肿瘤药物还可以包括有药学上可接受的药用辅料。
本发明中所述“药用辅料”指药学领域常规的药物载体,例如:粘合剂如纤维素衍生物、藻酸盐、明胶和聚乙烯吡咯烷酮;稀释剂如淀粉、预胶化淀粉、糊精、蔗糖、乳糖、甘露醇等,填充剂如淀粉、蔗糖等;湿润剂如甘油;崩解剂如羧甲基淀粉钠、交联聚乙烯吡咯烷酮和干淀粉等;吸收促进剂如季铵化合物;表面活性剂如聚山梨酯、脂肪酸山梨坦和脂肪酸甘油酯等;着色剂如二氧化钛、日落黄、亚甲蓝、药用氧化铁红等;润滑剂如氢化植物油、滑石粉和聚乙二醇等。包衣材料如丙烯酸树脂、羟丙甲纤维素、聚维酮、纤维醋法酯等;另外还可以在组合物中加入其它辅剂如香味剂、甜味剂等。
本发明抗肿瘤药物的各种剂型可以按照药学领域的常规生产方法制备。例如使活性成分与一种或多种载体混合,然后将其制成所需的剂型。所述药物的制剂形式包括注片剂、颗粒剂、胶囊剂、溶液剂、乳剂、混悬剂、喷雾剂、气雾剂、粉雾剂、滴剂、滴丸剂及纳米制剂等。本发明可以组合物的形式通过经胃肠道给药,注射给药、呼吸道给药、皮肤给药、粘膜给药和腔道给药等方式施用于需要这种治疗的患者。用于口服时,可将其制成常规的固体制剂如片剂、粉剂、粒剂、胶囊等,制成液体制剂如水或油悬浮剂或其它液体制剂如糖浆、酏剂等;用于肠胃外给药时,可将其制成注射用的溶液、水或油性悬浮剂等。
本发明优点:本发明通过rgds多肽与二硬脂酰磷脂酰乙醇胺-聚乙二醇(dspe-peg)共价连接的靶向肿瘤材料包裹于所述的肿瘤催化纳米反应器形成具有靶向肿瘤功能的肿瘤催化纳米反应体系,其具有非常优秀的靶向肿瘤特性。
另外,本发明制备的肿瘤催化纳米反应器(pyg-gox)在肿瘤微酸性环境下,首先通过降解环境中的葡萄糖产生大量过氧化氢,进一步把过氧化氢催化降解为羟基自由基,从而对肿瘤细胞产生明显的杀伤效果,因此可应用于抗肿瘤药物的制备。此外其在中性条件下不会产生催化作用,因而表现出极好的生物相容性,对正常组织没有毒害作用。
具体效果见实施例部分。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,根据这些附图获得其他的附图仍属于本发明的范畴。
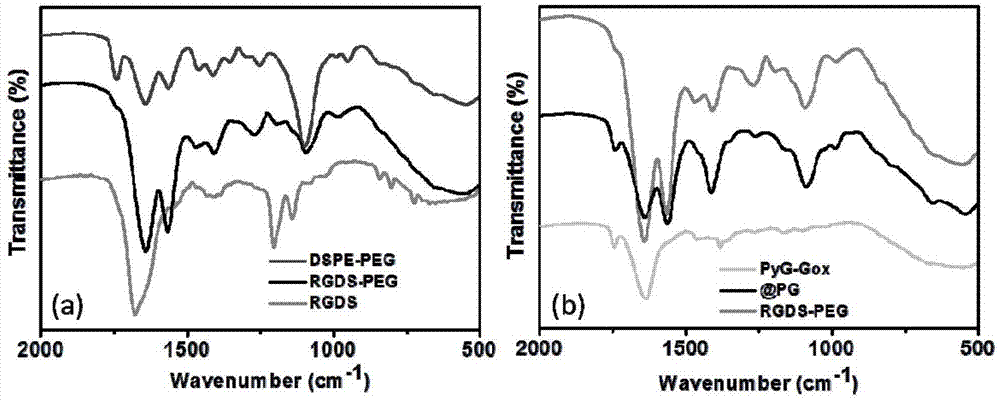
图1傅里叶红外光谱(ftir)表征rgds-peg和rgds-peg@pg的图;
图2rgds-peg@pg对肿瘤细胞系ocm-1和mcf-7杀伤力的体外检测图;
图3rgds-peg@pg对正常组织细胞系arpe-19和l929杀伤力的体外检测图;
图4激光共聚焦显微镜观察肿瘤细胞靶向吞噬rgds-peg@pg的图。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚,下面将结合附图对本发明作进一步地详细描述。
制备实施例:
本实施例包括以下步骤:
(1)以芘为原料,在80-100℃(优选为90℃)下将芘与硝酸反应制备前驱物:三硝基嵌二萘,并将其冷冻干燥;利用氢氧化钠溶液将前驱物重悬,超声反应后,将混合物加入反应釜中,通过水热反应制备石墨烯量子点(py-gqds),将py-gqds在透析袋中通过离子水透析并冷冻干燥,透析袋的截留分子量为≤3500,水热反应的条件为180-200℃(优选为190℃),10-12小时(优选为11小时);
利用碳化二亚胺/n-羟基琥珀酰亚胺在常温条件下活化步骤(1)制备的py-gqds的羧基端,使其与葡萄糖氧化酶(gox)的氨基端共价连接,制备肿瘤催化纳米反应器pyg-gox(简称pg);本步骤中py-gqds和gox的质量比为1:1-1:5(优选为1:2)。
(2)利用碳化二亚胺/n-羟基琥珀酰亚胺在常温条件下活化dspe-peg(mw,3400)的羧基端,dspe-peg为二硬脂酰磷脂酰乙醇胺-聚乙二醇,通过酰胺反应将rgds多肽与dspe-peg共价连接制备肿瘤靶向rgds-peg,发明中分别设定了不同的dspe-peg与rgds的质量比:1:2,1:5;1:10,其中靶向效果最佳的优选质量比为1:5。
(4)将步骤3中制备的rgds-peg通过物理吸附的方式包裹步骤(1)中制备的pg,获得具有靶向肿瘤功能的肿瘤催化纳米反应体系(也简称rgds-peg@pg),物理吸附的反应温度为30-37℃,10-12h。
效果试验例
一、利用傅里叶红外光谱(ftir)表征rgds-peg和rgds-peg@pg。如图1a所示,dspe-peg在1745cm-1处有明显的羧基峰,在产物rgds-peg中该峰消失并且出现在1639和1570cm-1出现了明显的酰胺键的c=o和n-h峰,以及在1400cm-1处酰胺键c-n峰。由此说明rgds与dspe-peg之间通过酰胺键形成了共价连接。此外rgds-peg在1097cm-1处出现了典型的peg的c-o-c骨架峰。如图1b所示,当rgds-peg包裹pg后形成的rgds-peg@pg在1740cm-1出现了pg典型的羧基峰,并且该产物保留了rgds-peg在1400cm-1处的c-n峰以及1097cm-1处的c-o-c峰。由此说明rgds-peg成功的包裹了pg反应体系。
二、体外检测rgds-peg@pg对肿瘤细胞系ocm-1和mcf-7的杀伤力(图2所示),将ocm-1或mcf-7细胞在在微酸性(ph6.0)或中性(ph7.4)条件下,与不同浓度的rgds-peg@pg共培养24h后,用钙黄绿素/pi染料对细胞进行染色,钙黄绿素可以标记活细胞发出绿色荧光,pi用来标记死细胞发出红色荧光。如图2所示,在ph6.0条件下当细胞与0.45μg/ml的rgds-peg@pg共培养,ocm-1或mcf-7细胞几乎全被杀死,而在ph7.4条件下,细胞死亡率很低。
三、体外检测rgds-peg@pg对正常组织细胞系arpe-19和l929的杀伤力(如图3所示),将arpe-19或l929细胞在中性(ph7.4)条件下与不同浓度的rgds-peg@pg共培养6或24h。如图3所示,与没有靶向标记的peg@pg相比,rgds-peg@pg对正常组织具有更好的细胞相容性。当细胞与0.45μg/ml的rgds-peg@pg共培养24h后,细胞的存活率依然高于80%。但是同样浓度的peg@pg处理后的细胞存活率低于10%。此外,如图2所示0.45μg/ml的rgds-peg@pg能够将ocm-1或mcf-7两种肿瘤细胞全部杀死。由此说明rgds-peg@pg对肿瘤细胞具有靶向杀伤作用。
四、激光共聚焦显微镜观察肿瘤细胞靶向吞噬rgds-peg@pg(如图4所示),将肿瘤细胞系ocm-1或正常组织细胞系arpe-19与rgds-peg@pg或py-gqds共培养3h。由于py-gqds在480nm处具有最大激发波长,因此利用共聚焦显微镜观察ocm-1细胞可以吞噬rgds-peg@pg和py-gqds两种材料,并且定位在细胞质中。但是在arpe-19细胞中仅观察到了py-gqds。说明rgds-peg@pg对肿瘤细胞具有靶向作用。
以上所揭露的仅为本发明较佳实施例而已,当然不能以此来限定本发明之权利范围,因此依本发明权利要求所作的等同变化,仍属本发明所涵盖的范围。