Linifanib的新应用的制作方法
本发明属于医药领域,特别涉及一种linifanib在制备调节脂肪代谢的组合物、药品或保健品中的应用。
背景技术:
肥胖人口在世界范围内日益增多。肥胖及其引发的相关疾病,如胰岛素抵抗、心血管疾病、肿瘤、高血脂、高血压、ii型糖尿病等严重威胁着人类的健康。体内能量消耗与能量摄入不平衡是肥胖发生的主要诱因,增加机体能量消耗或减少能量摄入是治疗肥胖的有效途径。脂肪组织的类型主要有白色脂肪组织和褐色脂肪组织。白色脂肪组织内主要为白色脂肪细胞,白色脂肪细胞内含巨大的脂滴,几乎占了整个细胞的绝大部分,细胞核呈扁平状位于细胞边缘,主要功能是将能量以甘油三酯的形式储存。在肥胖人群体内,白色脂肪组织大量增加,是危害人体健康的有害脂肪。褐色脂肪组织主要为褐色脂肪细胞,与白色脂肪细胞不同,褐色脂肪细胞的脂滴呈多室分布,线粒体含量比较高,特异性高表达一种线粒体内膜上的解偶联蛋白1(ucp1)。ucp1可以将氧化呼吸电子传递链产生的质子动力势能转化为热量,增加非战栗产热从而促进能量消耗,因此有益于抵抗肥胖发生。此外,近年来科学研究发现,在冷冻或者特定药物刺激情况下,白色脂肪组织中会出现一种形态结构类似于褐色脂肪细胞的细胞类型,该细胞被称为米色脂肪细胞,这种现象被称为白色脂肪褐色化。在功能上,米色脂肪细胞也高表达解偶联蛋白1和其他褐色脂肪细胞标志基因,如:cidea、dio2和cox8并能促进机体能量消耗。白色脂肪细胞褐色化的一个标志性特征就是解偶联蛋白1的表达明显上调,除了外在条件调控外,研究发现共转录因子pr结构域锌指蛋白16(prdm16)和过氧化物酶体增殖物活化受体γ协同刺激因子1α(pgc-1α)在分子水平上能正向调控白色脂肪细胞褐色化。prdm16通过与pparγ和pgc1a等转录因子相互作用激活大量的棕色脂肪相关基因,促进白色脂肪细胞褐色化。pgc-1α通过激活与ucp1启动子结合的核受体,如tr、rxr和ppars等调节棕色脂肪细胞ucp1基因的表达。已有大量研究表明促进白色脂肪细胞褐色化可以有效的抵抗肥胖及其相关代谢疾病的发生,因此其成为治疗肥胖的新的靶点。探寻新的调控白色脂肪细胞褐色化的小分子药物成为研究热点。
肥胖发生同时伴随着白色脂肪细胞的变大和增多,抑制新的白色脂肪细胞生成也是有效调控肥胖发生的手段之一。3t3-l1是广泛应用于研究白色脂肪细胞分化的前体脂肪细胞系。脂肪细胞分化过程与脂肪细胞特异性功能基因的表达调控密切相关,涉及多种脂肪特异性转录因子的激活,如过氧化物酶体增殖物激活受体-γ(pparγ)和ccaat增强子结合蛋白-α(c/ebpα),并伴随着脂肪代谢相关基因,如脂蛋白脂酶(lpl)、葡萄糖转运蛋4(glut4)、脂肪酸合酶(fas)、脂肪酸结合蛋白-2(ap2)等的时序表达脂肪细胞分化受到体内、外多种因素的影响,这些因素通过复杂的信号通路,激活pparγ和c/ebpα等转录因子,调节脂肪代谢相关基因的表达,进而影响脂肪细胞的分化过程。脂肪细胞分化及其调控失常与人类多种疾病如肥胖症、糖尿病、脂肪肝、高脂血症及乳腺癌等密切相关。
linifanib,结构如式(ⅰ),是一种多靶点vegf和pdgfr受体家族的抑制剂,对kdr,flt-1,pdgfrβ和flt3有明显抑制作用,但其在脂肪代谢相关的领域的应用,未见报道。
技术实现要素:
基于此,本发明的目的在于提供一种linifanib的新应用。
为实现上述目的,本发明提供了如下技术方案:
linifanib在制备防治脂肪代谢相关疾病的药品或保健品中的应用。
在其中一些实施例中,所述脂肪代谢相关疾病为肥胖症。
在其中一些实施例中,所述脂肪代谢相关疾病为糖尿病。
在其中一些实施例中,所述脂肪代谢相关疾病为脂肪肝。
在其中一些实施例中,所述脂肪代谢相关疾病为高脂血症。
linifanib在制备调节脂肪代谢的药品或保健品中的应用。
基于上述技术方案,本发明具有以下效果:
本发明经发明人大量研究得出,linifanib能够促进白色脂肪细胞褐色化、促进解偶联蛋白1(ucp1)的表达、促进褐色化标志性基因prdm16、pgclα、cidea、dio2、cox8b的mrna表达水平,同时,能够抑制脂肪前体细胞分化为成熟的脂肪细胞、显著抑制脂肪细胞生成标志性基因pparγ、cebpα和ap2的mrna表达。可见,linifanib不仅能促进脂肪细胞褐色化,还能够抑制脂肪细胞的生成,在预防和治疗脂肪代谢性相关疾病中具有重要作用,包括在肥胖症、糖尿病、脂肪肝、高脂血症的防治及药物开发中有巨大的应用前景。
附图说明
图1为linifanib在体外促进白色脂肪细胞褐色化;
图2为linifanib增强白色脂肪细胞褐色化标志性基因ucp1蛋白水平的表达;
图3为linifanib促进白色脂肪细胞褐色化标志性基因的mrna表达;
图4为linifanib能抑制脂肪细胞生成;
图5为linifanib抑制脂肪生成标志性基因的mrna表达。
具体实施方式
为了便于理解本发明,下面将参照实施例对本发明进行更全面的描述,以下给出了本发明的较佳实施例。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。提供这些实施例的目的是使对本发明的公开内容的理解更加透彻全面。
除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。本文所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。
本发明具体实施方式中所使用的linifanib(利尼伐尼),又称为abt-869,是由美国abbott公司研发的一种三磷酸腺苷竞争性酪氨酸激酶抑制剂,针对血管内皮生长因子受体vegfr和血小板衍生生长因子受体pdgfr的选择性低靶抑制活性。用于治疗癌症。。
本发明的一些实施例中,脂肪代谢相关疾病为白色脂肪细胞变大和/或白色脂肪细胞增多导致的脂肪代谢异常。
在其中一些实施例中,所述脂肪代谢相关疾病为:肥胖症、糖尿病、脂肪肝、高脂血症中的任一种。
本发明的一些实施例中,所述调节脂肪代谢为:促进白色脂肪细胞褐色化。
在其中一些实施例中,所述促进白色脂肪细胞褐色化为:促进白色脂肪细胞褐色化标志性基因ucp1蛋白水平的表达。
在其中一些实施例中,所述促进白色脂肪细胞褐色化为:促进白色脂肪细胞褐色化标志性基因prdm16、pgclα、cidea、dio2、cox8b的mrna表达。
在其中一些实施例中,所述调节脂肪代谢为:抑制脂肪细胞的生成。
在其中一些实施例中,所述抑制脂肪细胞的生成为:通过抑制前体脂肪细胞分化从而抑制脂肪细胞的生成。
在其中一些实施例中,所述抑制脂肪细胞生成为:通过抑制脂肪生成标志性基因pparγ、cebpα和ap2的mrna表达。
实施例1腹股沟的白色脂肪的原代脂肪间充质细胞的分离
(1)取一只c57bl/6j背景的12周龄的小鼠,断颈处死,在75%的酒精中浸泡5分钟,然后转移到操作台中,取出腹股沟的白色脂肪;
(2)用pbs清洗3次,用剪刀将脂肪组织剪碎,1g脂肪组织加入10ml胶原酶ⅰ溶液(用d-hanks溶液配制,100ml加入0.1g胶原酶ⅰ),放置37℃消化40分钟;
(3)用250μm滤膜过滤,加入细胞培养液,然后转移到离心管中,1000rpm离心3分钟;
(4)离心后的底部细胞为脂肪间充质细胞,弃除上清后,用新鲜的培养液悬起,铺到培养板中,第二天换液。
(5)获得的脂肪间充质细胞在添加10%胎牛血清(hyclone)高糖的dmem(hyclone)的培养液生长至90%汇合度;
(6)更换培养液为添加了mdir(0.5mm异丁基黄嘌呤,1μm地塞米松,87nm胰岛素和0.5μm罗格列酮:ibmx+dex+insulin+rosiglitazone)的诱导培养液(添加10%胎牛血清高糖的dmem的培养液),培养2天。
(7)2天后,培养液更换为只添加ir(87nm胰岛素和0.5μm罗格列酮:insulin+rosiglitazone)的诱导培养液(添加10%胎牛血清高糖的dmem的培养液),每两天更换一次,直到细胞完全分化为脂肪细胞。
将培养基更换为正常的培养基(添加10%胎牛血清高糖的dmem的培养液),同时添加指定剂量的小分子药物linifanib刺激一天。一天后,细胞可用于实时定量pcr和westernblot分析。
实施例2实时定量pcr分析脂肪细胞褐色化标志性基因的mrna表达水平
取实施例1所述的腹股沟的白色脂肪的原代脂肪间充质细胞完全分化得到的脂肪细胞,将培养基更换为正常的培养基(添加10%胎牛血清高糖的dmem的培养液),同时添加0μm(control组)和0.3μm、1μm和3μm的小分子药物linifanib刺激该脂肪细胞。24小时后,提取rna,进行实时定量pcr分析,步骤如下:
rna提取:具体操作如下:
1)分别在样品上加入300μlrna裂解液,300μlrna稀释液,室温静置5min;
2)最大转速离心5min吸取上清液;
3)加入0.5倍上清体积的无水乙醇,轻轻混匀;
4)将上清转移至收集管8000rpm,1min,弃滤液;
5)加入600μlrna洗液,8000rpm,1min,弃滤液;
6)加入600μlrna洗液,8000rpm,1min,弃滤液。空柱离心2min,晾干;
7)加入40μl无核酸酶水洗脱,收集rna样品
rna逆转录:利用superscripttmⅱrt逆转录试剂盒合成cdna;
荧光实时定量pcr:采用takara公司
反应条件:
预变性:95℃20秒;
变性:95℃,10秒;
退火:60℃,20秒;
孵育:70℃1秒;
根据基因的表达量重复38~45个循环,65~95℃做溶解曲线,每0.5℃读一次板,时间为1秒。
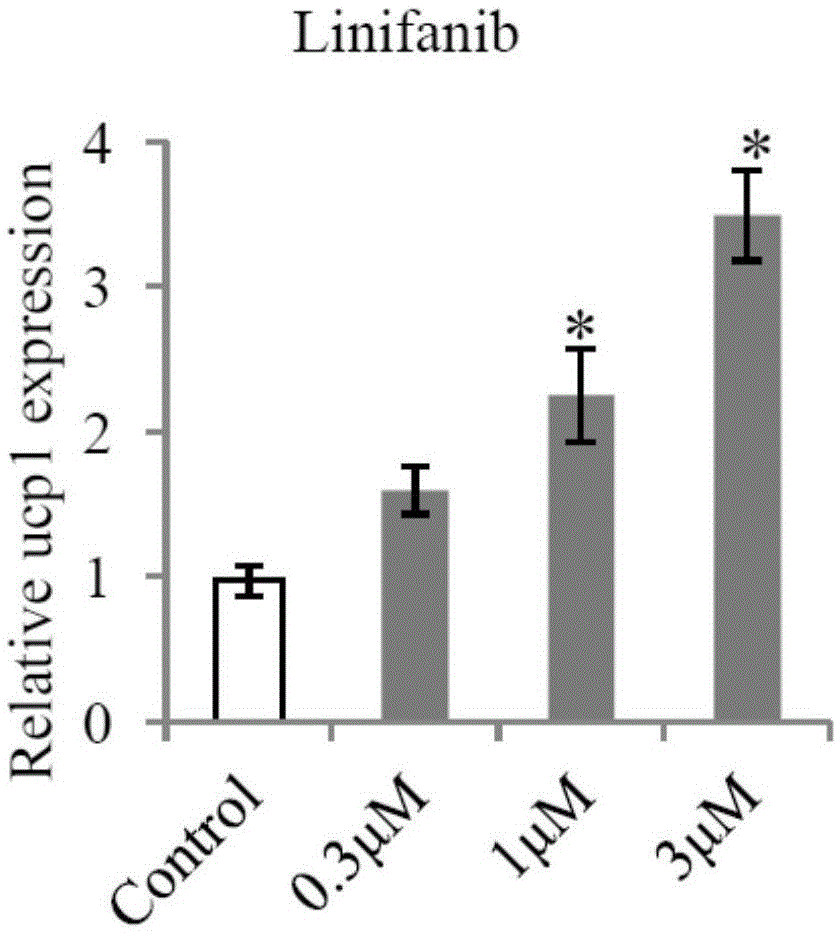
实时定量pcr采用ucp1引物,对褐色化标志性基因ucp1的mrna表达水平进行检测,分析及统计结果如1所示。可见,linifanib在3μm浓度下,可显著促进褐色化标志性基因的mrna表达水平。实时定量pcr采用以下相应基因的引物对褐色化标志性基因prdm16、pgclα、cidea、dio2、cox8b的mrna表达水平进行检测,分析及统计结果如图3所示,linifanib促进白色脂肪细胞褐色化标志性基因的mrna表达。其中,引物序列如下表1所示:
表1实时定量pcr测试引物序列
实施例3westernblot分析linifanib促进脂肪细胞ucp1蛋白的表达
取实施例1所述的腹股沟的白色脂肪的原代脂肪间充质细胞分化得到的脂肪细胞,将培养基更换为正常的培养基(添加10%胎牛血清高糖的dmem的培养液),同时添加0μm(control组)、0.3μm、1μm和3μm的药物linifanib刺激该脂肪细胞。24小时后,提取细胞内蛋白,使用westernblot方法检测ucp1蛋白表达水平的变化,westernblot具体步骤如下:
(1)配胶:将玻璃板清洗干净,用ddh2o冲洗。配制12%的分离胶,待胶凝固后即可上样。
(2)样品处理:去培养液后pbs冲洗2~3遍(冷的pbs有可能使细胞脱落)。加适量的冰预冷的裂解液后置于冰上10~20min。用细胞刮刮下细胞,12000g离心,4℃,2min。取少量上清进行定量。将所有蛋白样品调至等浓度,充分混合沉淀后加入缓冲液后在100℃水浴锅中放置6-8分钟。电泳:上样前将胶板下的气泡赶走。在60v电压下电泳。在目的蛋白泳动至距胶下缘1cm以上结束。
(3)转膜:取出凝胶,在转膜夹上分别放置海绵,滤纸,凝胶,pvdf膜,滤纸,凝胶,装好放入电转槽,加入转膜液。转膜条件为:250ma,90min。
(4)封闭:将膜从电转槽中取出,浸没于5%脱脂奶粉的tbst封闭液中缓慢摇荡2小时。
(5)一抗的准备:将western膜从封闭液中取出,滤纸贴角稍吸干,正面朝下贴在一抗上,注意不要留下气泡,4℃静置过夜。一抗孵育结束后,用tbst浸洗三次,每次10min。
(6)二抗:使用与一抗相同方法孵育二抗,室温2小时。二抗孵育结束后,孵育结束后,用tbst浸洗三次,每次10min。
(7)发光鉴定:将a、b发光液按比例稀释混合。膜用去离子水稍加漂洗,滤纸贴角吸干,反贴法覆于a、b混合液滴上,置于保鲜膜内固定于片盒中,迅速盖上胶片,关闭胶盒,根据所见荧光强度曝光。取出胶片立即完全浸入显影液中1-2min,清水漂洗一下后放在定影液中至底片完全定影,清水冲净晾干,进行分析与扫描。
结果如图2所示,即linifanib在1μm和3μm剂量下增强褐色化标志性基因ucp1蛋白水平的表达。可见,linifanib在3μm浓度下促进脂肪细胞中upc1的表达尤其显著。
实施例4linifanib在脂肪细胞分化过程中抑制脂肪细胞的生成
(一)3t3-l1前体脂肪细胞的培养与分化
(1)3t3-l1前体脂肪细胞传代铺板:90%细胞汇聚的10cm培养皿中旧培养液全部弃掉,加入2mlpbs漂洗漂浮细胞,吸弃pbs。加入1ml胰酶,放入37℃、5%二氧化碳培养箱消化约1-3min。加入2ml含10%胎牛血清和1%双抗的dmem培养基终止消化。1000rpm离心5min;加入适量新鲜配制的培养液重悬细胞,铺板到6孔板细胞培养皿,直至细胞长满。
(2)更换培养液为添加了mdi(0.5mm异丁基黄嘌呤,1μm地塞米松,87nm胰岛素:ibmx+dex+insulin)的诱导培养液(添加10%胎牛血清高糖的dmem的培养液)和指定剂量的药物linifanib,6孔板每孔培养基剂量为2ml,培养2天。
(3)2天后,培养液更换为只添加i(87nm胰岛素)的诱导培养液(添加10%胎牛血清高糖的dmem的培养液))和0μm(control组)、1μm和3μm的药物linifanib,每两天更换一次,直到对照组细胞完全分化为脂肪细胞。细胞用于后续的油红o染色和实时定量pcr分析。
(二)油红o染色
(1)待对照组(control组)六孔板中的3t3-l1前体脂肪细胞完全分化为成熟的脂肪细胞;
(2)吸去原有培养基,加入500μl10%福尔马林固定5min;
(3)除去福尔马林,加入500μl100%福尔马林,固定至少1h;
(4)吸去福尔马林,1ml60%异丙醇洗,随后除去异丙醇,让样品表面彻底干;
(5)加入油红o工作液(60%油红o储存液,40%水)500μl处理10min。吸去液体,加水洗4次,吸去水让样品表面彻底干(油红o储存液配方:0.7g油红o,200ml异丙醇摇床过夜,0.22μm滤膜过滤)。
染色结果如图4所示,可见,相比control组,3μm的linifanib药物处理的细胞颜色较浅,脂肪细胞分化受到抑制。可见,linifanib可显著抑制3t3-l1前体脂肪细胞的分化,抑制脂肪细胞的生成。
(三)实时定量pcr
将实施例所述的3t3-l1前体脂肪细胞分化得到脂肪细胞,分别对添加了0μm(control组)、1μm和3μm的linifanib的细胞,提取rna,进行实时定量pcr分析,具体步骤与实施例3基本相同。
其中实时定量pcr分别采用相应基因的引物,对脂肪细胞生成标志性基因pparγ、cebpα和ap2的mrna表达水平进行检测,分析及统计结果如图5所示。可见,linifanib在3μm浓度下,可显著抑制脂肪细胞生成标志性基因pparγ、cebpα和ap2的mrna表达。其中,引物序列如表2所示:
表2实时定量pcr测试引物序列
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对以上实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!