基因和化学药物共转运载体及其使用方法与流程
本发明属于生物材料领域,尤其涉及一种基因和化学药物共转运载体及其使用方法。
背景技术:
由于生物体对化学治疗药物耐药性的出现,单一药物在疾病治疗时往往不能获得最佳疗效,因此多种药物联合治疗成为近年来药物研究的热点。目前,联合药物治疗主要包括不同化疗组合,其中小分子化疗药物与基因药物联合治疗受到越来越多的关注。然而,其发展受到一个主要因素的阻碍,即药物运输系统的构建,其关键在于设计简单的共转运药物载体。
分子要成为基因与药物共转运载体,它必须具有两种功能:第一,作为基因载体,应该是一种高效的dna凝聚试剂。由于dna分子本身为线性伸展构象且带有负电荷,会与细胞膜外层的阴离子产生静电排斥,dna分子难以独立地穿透细胞膜进入细胞内部,因此,基因载体应该可以将dna凝聚为体积较小的颗粒,从而使dna分子易于通过内吞或胞饮作用进入细胞内;第二,作为疏水药物分子载体,需要有疏水药物分子的结合位点,负载的疏水药物进入体内后再缓慢释放。
目前研究较多的药物载体多为单一药物载体,对共转运载体的研究较少,且多为表面修饰的脂质分子,它可以提供疏水空腔和dna结合位点,然而这些脂质分子作为药物载体仍然存在两个突出问题:第一,脂质分子表面修饰过程复杂,合成步骤繁琐;第二,脂质分子的生物相容性差,在体内不易被分解。因此,研发具有较高基因转染效率和药物负载效率的药物载体有望为疾病治疗提供新的选择。
肽分子由氨基酸残基组成,具有生物相容性高、体内可降解等优点,且短肽分子的可设计性强,合成方法简单,如能设计合适的多肽分子,在其中引入较多正电荷使其具有强的dna结合能力,同时引入疏水性氨基酸残基,进一步赋予分子较强的组装聚集能力使其可以为疏水药物的负载提供疏水空腔,将有望成为优良的基因与化学药物共转运载体。
技术实现要素:
本发明提出一种基因和化学药物共转运载体及其使用方法,该载体可共转运基因药物和化学药物,且疏水药物的负载不影响多肽的自组装结构以及与dna的结合能力,可同时运送模拟疏水性药物分子和dna进入细胞。
为了达到上述目的,本发明提供了一种基因和化学药物共转运载体,将多肽分子溶于缓冲液中自组装为纳米纤维状结构,先与疏水性药物分子或模拟药物分子溶液充分结合,得到多肽/药物分子负载体溶液,再将所述多肽/药物分子负载体溶液与基因分子溶液在预定条件下充分混合制备得到,即多肽/药物/基因分子负载体溶液。
作为优选,上述技术方案中的缓冲液为浓度为20mm的hepes缓冲液。该多肽溶于缓冲液中可自组装形成纤维状结构,可以利用多肽纤维的疏水空腔负载疏水药物分子,利用多肽大量的正电荷结合负载基因药物,实现基因药物和化学药物的共输运。
作为优选,所述多肽分子具有以下序列:
ac-iiiiigplglaggrrrrrrrr-nh2,结构式为:
上述技术方案中的多肽分子含有8个带正电的精氨酸序列,可与带负电的dna结合,因此,可作为一种有效的基因转染试剂。
作为优选,所述多肽分子溶于缓冲液中自组装为纳米纤维状结构的步骤包括:
配制浓度为2.0-10.0mm的ac-iiiiigplglaggrrrrrrrr-nh2多肽分子溶液,溶于ph为7.2-7.4的缓冲溶液中,放置3天以上,其自组装为纳米纤维状结构。
上述技术方案中的多肽分子具有良好的自组装能力,在2.0mm浓度以上时可自组装形成纳米纤维状结构,为疏水药物分子的负载提供疏水空腔,因此,可作为有效的疏水性药物载体。
作为优选,所述多肽分子在浓度达到4.0mm以上时,自组装为纳米纤维状结构,纳米纤维直径为5-8nm,长度为500nm-10μm。
作为优选,所述多肽/药物分子负载体溶液的配制步骤包括:
将疏水性药物分子或模拟药物分子溶于熟化的多肽分子溶液,超声20-30分钟,放置6-24小时,使药物分子充分与多肽分子自组装后的纳米纤维作用结合,然后离心,除去溶液底部未结合的药物分子沉淀,上层溶液即为多肽/药物分子负载体溶液。
作为优选,所述疏水性药物分子为阿霉素,所述模拟药物分子为尼罗红。
作为优选,所述多肽/药物/基因分子负载体溶液的配制步骤包括:
配制浓度为50μg/ml的λ-dna溶液,溶于ph为7.2-7.4的缓冲溶液中,得到基因分子溶液;
将上述熟化的多肽/药物分子负载体溶液与基因分子溶液按照预定条件充分混合,得到多肽/药物/基因分子负载体溶液。
上述技术方案中,基因分子可以为dna或rna,此处以绿色荧光蛋白报告基因pegfp-n2为代表进行说明。
作为优选,所述预定条件为:溶液中基因分子浓度为1-50μg/ml,多肽分子正电荷与基因分子负电荷数目的比例为5.0-50.0。
上述技术方案中,当溶液中的多肽分子所带正电荷数量与dna分子所带负电荷数量的比值在2以上时,可诱导dna分子有效凝聚,并保护dna分子免受核酸酶降解;当多肽分子所带正电荷数量与dna分子所带负电荷数量的比值为5时,可以使dna分子由伸展构象转变为高度压缩的凝聚构象,并且能有效介导基因转染。
本发明还提供了一种如上述任一项技术方案所述的基因和化学药物共转运载体实现共转运的使用方法,包括:
将多肽/药物/基因分子负载体溶液与细胞共培养,培养4-12小时后将培养液换为含10%血清的dmem培养基,继续培养24-48小时后,即可实现药物向细胞内的有效输运和基因的有效转染。
上述技术方案中,共培养的具体步骤包括:
在96孔板中每孔接种100μl密度为1×105/ml的细胞悬液,细胞培养箱中培养24小时细胞贴壁后,将培养基吸出,加入100μl无血清dmem,再加入50μl多肽/药物/基因分子负载体溶液。培养6小时后将培养液换为含10%血清的dmem培养基,继续培养24-48小时即可。
作为优选,所述细胞为hek293细胞。
上述技术方案中,当多肽分子所带正电荷数量与dna分子所带负电荷数量的比值为5时,能将pegfp-n2质粒转染进入hek293细胞,基因转染效率在20%以上。并且,在基因转染浓度条件下,多肽分子对细胞的毒性不大,细胞仍然可以保持良好的形态。
与现有技术相比,本发明的优点和积极效果在于:
(1)本发明所提供的多肽分子具有良好的自组装能力,在2.0mm浓度以上时可自组装形成纳米纤维状结构,可为疏水药物分子的负载提供疏水空腔,是一种有效的疏水性药物载体;同时,其含有8个带正电的精氨酸序列,也可与带负电的dna结合,因此,也是一种有效的基因转染试剂。
(2)本发明所提供的共转运载体合成过程简单,所得载体可共转运基因药物和化学药物,且疏水药物的负载不影响多肽的自组装结构以及与dna的结合能力,可同时运送模拟疏水药物分子尼罗红和质粒dna进入细胞。
附图说明
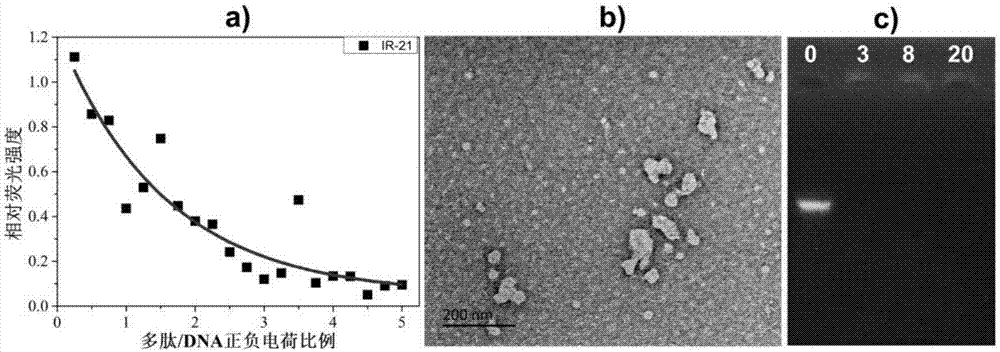
图1(a)etbr替代实验显示相对荧光强度随多肽/dna正负电荷比例的变化,(b)tem结果给出多肽/dna正负电荷比为5时dna凝聚体的形貌,(c)凝胶电泳结果给出多肽/dna正负电荷比分别为0、3、8、20时的电泳结果;
图2为本发明实施例所提供的多肽分子自组装为纳米纤维状结构示意图,其中a为圆二色谱表征图,b为透射电子显微镜图,c为原子力显微镜表征其形貌结构;
图3为本发明实施例所提供的4.0mm的多肽分子溶液负载尼罗红之后的透射电子显微镜结构;
图4为本发明实施例所提供的多肽/药物/基因分子负载体在与细胞完成培养后再倒置荧光显微镜下观察得到的药物输运及细胞转染效果,其中,(a)转染hek293细胞后的明场成像,(b)转染hek293细胞后的蓝光激发荧光成像,(c)转染hek293细胞后的绿光激发荧光成像。
具体实施方式
为了更清楚详细地介绍本发明实施例所提供的基因和化学药物共转运载体及其使用方法,下面将结合具体实施例进行描述。
实施例1
多肽分子溶液配制:
配制浓度为4.0mm的肽分子ac-iiiiigplglaggrrrrrrrr-nh2溶液,溶于ph为7.4、浓度为20mm的hepes缓冲液,放置3天以上,其自组装为纳米纤维状结构,通过圆二色谱表征其二级结构以及通过透射电子显微镜和原子力显微镜表征其形貌结构,结果如图2所示,形成直径为5-8nm,长度可达1μm以上的纤维状结构;
多肽/药物分子负载体溶液制备:配制肽分子和尼罗红分子的混合溶液,固定多肽浓度为4.0mm,加入摩尔比5%的尼罗红,超声30分钟,放置三天后离心去除溶液底部未负载的尼罗红,计算确定饱和负载量约为1wt%;多肽/药物分子负载体的透射电子显微镜结构如图3所示,保持纤维状结构;
dna溶液配制:配制绿色荧光蛋白报告基因pegfp-n2的溶液,浓度为50μg/ml,溶于ph为7.4、浓度为20mm的hepes缓冲液;
多肽/药物/基因分子负载体溶液制备:将上述多肽/药物分子负载体溶液与pegfp-n2溶液混合,使得溶液中pegfp-n2浓度为10μg/ml,肽分子正电荷与基因分子负电荷数目的比例为5.0;如图1所示,多肽分子与dna的结合可以造成荧光强度的降低,电荷比在3.0以后达到平衡,相对荧光强度降至0.1以下。透射电镜(tem)形貌表征显示肽分子可将dna凝聚,形成直径在500nm以下的致密聚集体。琼脂糖凝胶电泳结果显示,肽分子可以使dna凝聚,凝聚后的dna不能通过琼脂糖凝胶的孔洞而被滞留在点样孔中。上述结果皆证明多肽分子能够有效诱导dna分子的凝聚。
基因药物和化学药物共转运:在96孔板中每孔接种100μl密度为1×105/ml的细胞悬液,细胞培养箱中培养24小时细胞贴壁后,将培养基吸出,加入100μl无血清dmem,再加入50μl多肽/药物/基因分子负载体溶液。培养6小时后将培养液换为含10%血清的dmem培养基,继续培养24小时。在倒置荧光显微镜下观察多肽分子与质粒pegfp-n2在电荷比为5条件下转染hek293细胞后的药物输运及细胞转染效果,结果如图4所示。
如图4所示,药物输运及转染hek293细胞后的倒置荧光成像(a)明场,(b)蓝光激发,(c)绿光激发,a、b、c为共定位区域。细胞内部红色荧光的存在说明尼罗红分子成功输运到细胞内部,绿色荧光的存在说明转染成功,顺利表达出绿色荧光蛋白。因此,这一结果表明该体系成功实现了模拟药物分子(尼罗红)和绿色荧光蛋白质粒(pegfp-n2)的共输运和有效基因转染。
实施例2
实验步骤同实施例1,区别在于:多肽/药物分子负载体溶液制备步骤中将多肽分子ac-iiiiigplglaggrrrrrrrr-nh2的浓度调整为8.0mm,多肽/药物/基因分子负载体溶液制备步骤中将肽分子正电荷与基因分子负电荷数目的比例调整为20.0,体系同样能够成功实现模拟药物分子(尼罗红)和绿色荧光蛋白质粒(pegfp-n2)的共输运和有效基因转染。
实施例3
实验步骤同实施例1,区别在于:多肽/药物分子负载体溶液制备步骤中将多肽分子ac-iiiiigplglaggrrrrrrrr-nh2的浓度调整为2.0mm,多肽/药物/基因分子负载体溶液制备步骤中将肽分子正电荷与基因分子负电荷数目的比例调整为10.0,体系同样能够成功实现模拟药物分子(尼罗红)和绿色荧光蛋白质粒(pegfp-n2)的共输运和有效基因转染。
实施例4
实验步骤同实施例1,区别在于:多肽/药物分子负载体溶液制备步骤中将多肽分子ac-iiiiigplglaggrrrrrrrr-nh2的浓度调整为10mm,多肽/药物/基因分子负载体溶液制备步骤中将肽分子正电荷与基因分子负电荷数目的比例调整为50.0,体系同样能够成功实现模拟药物分子(尼罗红)和绿色荧光蛋白质粒(pegfp-n2)的共输运和有效基因转染。
- 还没有人留言评论。精彩留言会获得点赞!