一种靶向金纳米棒埃洛石纳米管复合物及其制备方法与流程
背景技术:
到目前为止,化疗和放疗是临床治疗肿瘤的主要疗法。但它们也面临一系列关键障碍,如正常组织损伤和耐药性。作为一种新兴的癌症治疗策略,光热治疗(ptt)在癌症治疗中引起了相当多的研究关注。它是通过将近红外(nir)光转化为热来通过光热剂杀死癌细胞来治疗肿瘤。目前报道的光热剂包括有机材料,碳材料,和无机材料。它们各有其优点和缺点。其中,金纳米粒子(gnps)由于其独特的尺寸,优异的生物相容性和良好的光稳定性而被广泛用于癌症的ptt。gnps的局域表面等离子共振(lspr)吸收带位于范围为450-520nm。在ptt中,nir区域中的波长的激光对组织具有最强的穿透性,因此需要将lspr吸收带移动到nir区域。因此,许多不同的gnps,如金纳米棒(gnrs),金纳米壳(gnss)和金纳米笼(gncs),已被广泛研究。特别地,通过调节还原剂的量可以获得具有不同纵横比的gnrs,以调节到nir区域的光吸收范围,从而实现最大的光热转换效率。
埃洛石纳米管(hnts)是天然存在的硅铝酸盐粘土,其化学式为al2si2o5(oh)4·nh2o。hnts具有独特的中空管状结构,内部具有铝氧烷(al-oh)基团,外部具有硅烷醇(si-oh)基团。他们的平均长度和外径分别在200-1000纳米和50-70纳米之间变化。近年来,hnts由于其空腔,高吸附容量,易于在聚合物中分散以及与生物和环境性质的相容性而被用作药物载体材料。为了增加hnts的抗肿瘤作用,已经探索了不同的表面修饰方法和不同的药物负载。hnts可以装载遗传药物,化学药物和抗菌药物来治疗疾病。例如发现,阳离子聚合物接枝的功能化hnts对姜黄素和盐酸阿霉素(dox)的药物具有增强的抗癌功效。具有ph响应性聚合物的hnts也可以构成阿托伐他汀和塞来昔布用于结肠癌治疗的药物递送平台。此外,金属纳米粒子也可以结合到hnts的表面以改善它们的功能。例如,gnps可以作为选择性催化剂和可调谐等离子体平台加载到hnts的外壁上。gnps固定的hnts表面可用于表面增强拉曼散射基板。gnrs和gnps也可以加载到hnt的内腔中。其他贵金属如银和负载hnts的铂也已被广泛研究。
技术实现要素:
目前没有任何工作专注于gnrs装饰hnts对癌症的光热疗法。各种治疗方式的组合被报道,例如化疗和ptt,基因治疗和ptt,以提高癌症治疗的能力。该领域有许多工作,联合治疗是癌症治疗的热门话题。例如,可以通过修饰te纳米棒上的多糖-蛋白质复合物来实现对癌症的同时化学光热疗法。与聚乙烯亚胺(pei)共价键合的氧化中孔碳纳米球被开发为通用的光热组合基因治疗平台。治疗基因通过抑制细胞增殖和抑制肿瘤血管生成来选择肿瘤抑制,而氧化中孔碳纳米球通过光热消除肿瘤。金纳米棒和介孔二氧化硅壳可以调节dox释放的能力。
本申请通过将化疗和光热治疗相结合,并进行靶向修饰,制备成新型的化学光热疗法纳米平台,并且两种治疗方式具有协同作用,为乳腺肿瘤的治疗提供了快速,有效和廉价的选择。
在本研究中,首先将gnrs加载到hnts官腔中,然后通过物理吸附将化疗药物dox和牛血清白蛋白(bsa)吸附在hnts的表面上。使用乙醇来触发au-hnt-dox@bsa复合物的聚集形成。为了增强乳腺癌细胞对au-hnts-dox@bsa的特异性摄取,将叶酸(fa)作为靶向配体与au-hnts-dox@bsa表面缀合,形成au-hnts-dox@bsa-fa。最后,设计的化疗和光热治疗平台用于协同治疗乳腺癌。在体外和体内实验中研究了来自au-hnts-dox@bsa-fa的光热效应和加速的dox释放行为。au-hnts-dox@bsa-fa通过靶向肿瘤组织,释放药物和升高温度而对乳腺肿瘤显示出治疗效果。
具体而言,本申请涉及,一种靶向金纳米棒埃洛石纳米管复合物,其特征在于,该复合物由gnrs(金纳米棒),hnts(埃洛石纳米管),dox(盐酸阿霉素),牛血清白蛋白(bsa),叶酸(fa)制备而成。
本申请涉及一种靶向金纳米棒埃洛石纳米管复合物,其特征在于,该复合物为au-hnts-dox@bsa-fa,其是将gnrs(金纳米棒)加载到hnts(埃洛石纳米管)管腔中,然后通过物理吸附将化疗药物dox(盐酸阿霉素)和牛血清白蛋白(bsa)吸附在hnts的表面上,再将叶酸(fa)与au-hnts-dox@bsa表面缀合制备而成。
其中各组分重量比为:gnrs:4.85%hnts:89.26%dox:1.81%bsa:2.65%fa:1.43%。
本申请还涉及靶向金纳米棒埃洛石纳米管复合物在制备治疗乳腺癌的药物中的应用,尤其是在制备采用化疗和光热治疗法协同治疗乳腺癌的药物中的应用。
本申请还涉及靶向金纳米棒埃洛石纳米管复合物的制备方法:其特征在于包括以下步骤,(1)au-hnts纳米复合材料的制备;(2)au-hnts-dox@bsa-fa纳米复合材料的制备。
其中au-hnts纳米复合材料的制备方法为:纯化hnts以去除杂质,将hnts,haucl4·3h2o,乙醇,甲苯,oac和oam混合处理,向混合物中加入抗坏血酸并搅拌,形成gnrs,将获得的au-hnts分散体离心,分散在乙醇溶液中,离心,弃去上清液。
尤其是,au-hnts纳米复合材料的制备方法为:纯化hnts以去除杂质,将hnts(15mg),haucl4·3h2o(22mg),乙醇(2ml),甲苯(2ml),oac(0.5ml)和oam(0.5ml)在20ml玻璃小瓶中混合并超声处理1分钟,将混合物磁力搅拌并加热至55℃,然后向混合物中加入200mg抗坏血酸并搅拌,搅拌2分钟后溶液由浅黄色变为紫黑色,表明形成了gnrs,将获得的au-hnts分散体以5000rpm离心,为了除去游离的gnps,将获得的产物分散在10ml甲苯中并进一步离心(3000rpm,3分钟),然后除去主要由游离gnps组成的上清液,该步骤重复三次,然后将其分散在乙醇溶液中,以5000rpm离心3分钟,弃去上清液以除去甲苯。该操作重复3次。
还涉及au-hnts-dox@bsa-fa纳米复合材料的制备方法为:将au-hnts分散在水溶液中并搅拌,然后向分散体中加入dox,1-3小时后,将bsa溶液加入上述混合物中,搅拌10-16小时后,以1-3ml·min-1的速率加入4-10ml乙醇,然后将得到的au-hnts-dox@bsa离心,洗涤;通过-fa的-cooh与bsa的-nh2的之间的缀合反应进行fa接枝到au-hnts-dox@bsa表面上:该方法为:首先,将edc和nhs加入到一定量冰冷的fa的pbs溶液中,并在室温下搅拌6-10小时以获得活化的fa(fa-nhs),然后,将所得的fa-nhs加入到au-hnts-dox@bsa分散体的pbs溶液中并在室温下搅拌,12-20小时后,将得到的au-hnts-dox@bsa-fa分散体离心,洗涤。
尤其是au-hnts-dox@bsa-fa纳米复合材料的制备方法为:将15mgau-hnts分散在6ml水溶液中并搅拌,然后向分散体中加入1mgdox,2小时后,将1ml80mg·ml-1bsa溶液加入上述混合物中,搅拌12小时后,以2.3ml·min-1的速率加入6ml乙醇,然后将得到的au-hnts-dox@bsa以12000rpm离心5分钟并用超纯水洗涤三次,通过-fa的-cooh与bsa的-nh2的之间的缀合反应进行fa接枝到au-hnts-dox@bsa表面上,首先,将edc(20mg)和nhs(12mg)加入到25ml冰冷的fa(1mg·ml-1)的pbs溶液中,并在室温下搅拌8小时以获得活化的fa(fa-nhs),然后,将8ml所得的fa-nhs加入到20ml的au-hnts-dox@bsa分散体(1mg·ml-1)的pbs溶液中并在室温下搅拌,16小时后,将得到的au-hnts-dox@bsa-fa分散体以12000rpm离心5分钟,并用超纯水洗涤三次。
附图说明
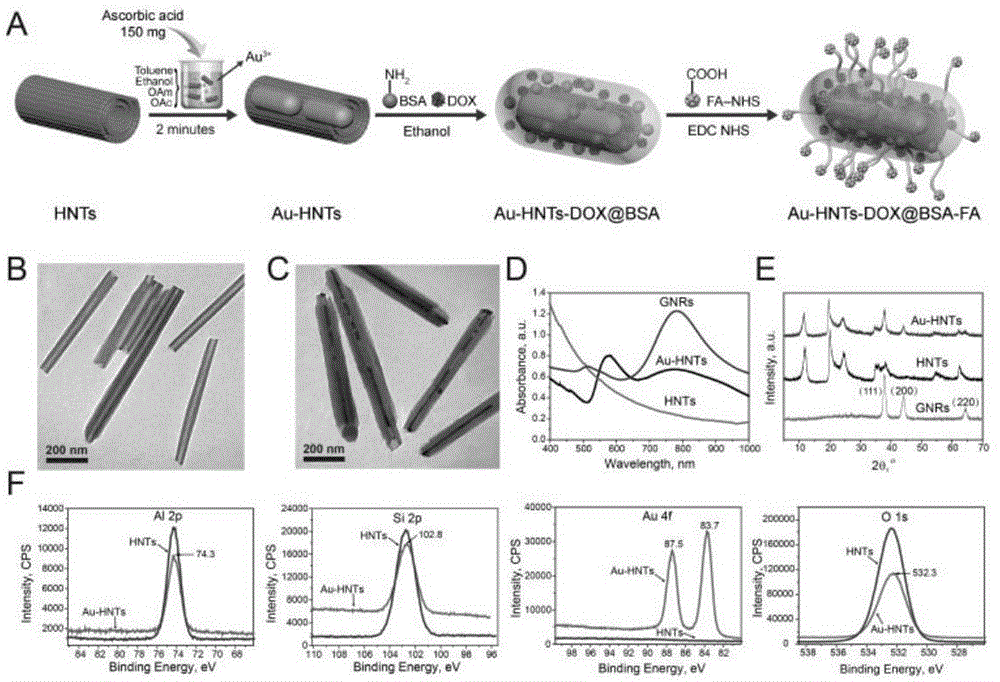
图1:(a)au-hnts-dox@bsa-fa的合成方法。(b)hnt和(c)au-hnts的tem图像。(d)不同样品的uv-可见吸收光谱。(e)不同样品的xrd图案。(f)高分辨率扫描hnts和au-hnts的al,si,au和o元素。
图2:(a)通过ir相机记录在808nm照射下不同浓度和不同功率的au-hnts溶液的温度图像。(b)用808nm激光(0.8w·cm-2)照射不同浓度的au-hnts(1ml)溶液的温度曲线。(c)在具有各种功率的nir光照射下au-hnts(800μg·ml-1,1ml)的温度曲线。(d)au-hnts(400μg·ml-1,1ml)溶液,808nm激光开启或关闭五次。
图3:(a)不同样品的溶血率。(b)au-hnts-dox@bsa-fa(1mg·l-1)在黑暗和808nm激光照射下在ph7.4下8分钟的药物释放曲线。
图4:(a)24小时后用不同浓度的hnts和au-hnts处理后hela细胞的相对存活率。(b)mcf-7细胞的活力,其在37℃下预处理至au-hnts12小时,然后通过808nm激光照射8分钟。(c)用不同样品(400μg·ml-1)处理mcf-7细胞的活力24小时,然后用或不用808nm激光(0.8w·cm-2)照射8分钟。数据显示为平均值±sd(n=4)。d)用hnts,au-hnts和au-hnts-dox@bsa-fa处理后,用或不用808nm激光(0.8w·cm-2)照射8分钟的mcf-7细胞的荧光活/死细胞图像。比例尺:50μm。(e)用hnts,au-hnts和au-hnts-dox@bsa-fa处理后,用或不用808nm激光(0.8w·cm-2)照射8分钟的mcf-7细胞凋亡和坏死的流式细胞术分析。
图5:mcf-7细胞对au-hnt-dox@bsa-fa的摄取过程。荧光显微镜观察了mcf-7细胞中au-hnts-dox@bsa-fa的荧光图像。比例尺:20μm。
图6:在携带4t1的小鼠中au-hnts-dox@bsa-fa的肿瘤靶向效率。(a)在特定时间点(2,4,8,12和24小时)携带4t1小鼠的不同器官(1、肿瘤,2、心脏,3、肝脏,4、脾,5、肺,6、肾)的dox荧光图像。静脉内注射dox(0.32mg·kg-1)和au-hnts-dox@bsa-fa(0.32mg·kg-1dox当量)后静脉注射24小时。(b)在特定时间点(2,4,8,12和24小时)定量肿瘤组织的dox荧光。这些值表示为平均值±sd(n=3)。通过t检验分析数据。与dox相比,*p<0.05,**p<0.01。
图7在携带4t1的小鼠中au-hnts-dox@bsa-fa的体内光热成像。携带4t1的小鼠静脉注射生理盐水(200μl),au-hnts@bsa-fa(20mg·kg-1)或au-hnts-dox@bsa-fa(20mg·kg-1),然后注射4小时后使用808nm激光,密度为1w·cm-2,持续8分钟。(a)通过红外热像仪捕获小鼠的光热图像。(b)记录激光照射期间小鼠肿瘤组织的温度变化。该值表示为平均值±sd(n=3)。通过双向anova和tukey的事后检验分析数据。与激光相比,***p<0.001。
图8在携带4t1的小鼠中au-hnt-dox@bsa-fa的抗肿瘤作用。来自对照组,激光组,au-hnts@bsa-fa组(20mg·kg-1),dox组(0.32mg·kg-1),au-hnts@bsa-fa(20mg·kg-1+激光组)小鼠的(a)体重和(b)肿瘤生长曲线。(c)肿瘤重量和(d)第16天来自不同组的切除的4t1实体瘤的照片。(e)通过tunel测定检查的肿瘤切片的代表性照片。观察到tunel阳性细胞核(褐色斑点)。(f)以不知情的方式在三个随机区域中计数不同组中凋亡细胞的数量。比例尺:20μm。这些值表示为平均值±sd(n=3)。通过双向anova和tukey事后检验分析体重和肿瘤体积的数据。采用单因素方差分析和tukey事后检验分析肿瘤重量和凋亡指数。与对照相比,*p<0.05,***p<0.001,与激光相比,###p<0.001,与dox对比,@@p<0.01,@@@p<0.001,对比au-hnts@bsa-fa+激光组,
图9在携带4t1的小鼠中au-hnts-dox@bsa-fa的全身毒性。在处理后第16天,来自携带4t1的小鼠的肿瘤,心脏,肝脏,脾脏,肺和肾切片的h&e染色。心脏切片中的箭头表示某些心肌细胞破裂和分散。肾切片中的箭头表示肾小球的破坏性坏死。比例尺:50μm。
图10(a)分散在pbs中的gnrs和au-hnts-dox@bsa-fa(800μg·ml-1)的数码照片。(b)10小时后分散在pbs中的gnrs和au-hnts-dox@bsa-fa的数码照片。
图11hnts,au-hnts和au-hnts-dox@bsa-fa的ftir光谱。
图12未用甲苯清洗的au-hnts的tem图像。
图13(a)hnts和au-hnts的xps光谱调查。(b)具有用于au-hnts的si,al,o和au的相应元素映射的tem图像。
图14(a-c)hnts,au-hnts和au-hnts-dox@bsa-fa的dls结果。(d)hnts,au-hnts和au-hnts-dox@bsa-fa的zeta电位。
图1524小时后用不同浓度的hnts和au-hnts处理后(a)hela细胞和(b)huvec细胞的相对存活率
图16用(a)培养基和(c)au-hnts-dox@bsa-fa处理mcf-7细胞的微结构形貌的afm图像。用(b)培养基和(d)au-hnts-dox@bsa-fa处理的mcf-7细胞的局部放大。
具体实施方式
实验部分-实验方法
1材料
hnts购自中国广州润沃材料科技有限公司。haucl4·3h2o(三水合氯化金(iii)),油酸(99.8%,oac),油胺(80%-90%,oam),1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(edc)和n-羟基琥珀酰亚胺(nhs)和fa从中国上海的aladdin试剂有限公司获得。甲苯(99.8%)和乙醇(99.7%,无水)购自中国天津的天津永大化学试剂有限公司。硝酸银(99.8%),抗坏血酸(99.7%)和十六烷基三甲基溴化铵(99.0%)购自中国上海的国药化学试剂有限公司。dox购自中国南京南京奥德福尼生物科技有限公司。牛血清白蛋白(bsa)购自中国广东省广州思佳生物科技有限公司。cck8试剂购自中国的贝博生物科技有限公司。吖啶橙(ao)和溴化乙锭(eb)购自中国的solarbio科学技术有限公司。超纯水由milli-q水系统生产。所有其他试剂未分析级并无需进一步纯化即可使用。
2au-hnts纳米复合材料的制备
根据报道的在hnts内原位快速生长gnrs的方法制备au-hnts。使用前,纯化hnts以去除杂质。将hnts(15mg),haucl4·3h2o(22mg),乙醇(2ml),甲苯(2ml),oac(0.5ml)和oam(0.5ml)在20ml玻璃小瓶中混合并超声处理1分钟。将混合物磁力搅拌并加热至55℃。然后向混合物中加入200mg抗坏血酸并搅拌,搅拌2分钟后溶液由浅黄色变为紫黑色,表明形成了gnrs。
将获得的au-hnts分散体以5000rpm离心。为了除去游离的gnps,将获得的产物分散在10ml甲苯中并进一步离心(3000rpm,3分钟),然后除去主要由游离gnps组成的上清液。该步骤重复三次。然后将其分散在乙醇溶液中,以5000rpm离心3分钟,弃去上清液以除去甲苯。该操作重复3次。
3au-hnts-dox@bsa-fa纳米复合材料的制备
将15mgau-hnts分散在6ml水溶液中并搅拌。然后向分散体中加入1mgdox。2小时后,将1ml80mg·ml-1bsa溶液加入上述混合物中。搅拌12小时后,以2.3ml·min-1的速率加入6ml乙醇。然后将得到的au-hnts-dox@bsa以12000rpm离心5分钟并用超纯水洗涤三次。通过-fa的-cooh与bsa的-nh2的之间的缀合反应进行fa接枝到au-hnts-dox@bsa表面上。首先,将edc(20mg)和nhs(12mg)加入到25ml冰冷的fa(1mg·ml-1)的pbs溶液中,并在室温下搅拌8小时以获得活化的fa(fa-nhs)。然后,将8ml所得的fa-nhs加入到20ml的au-hnts-dox@bsa分散体(1mg·ml-1)的pbs溶液中并在室温下搅拌。16小时后,将得到的au-hnts-dox@bsa-fa分散体以12000rpm离心5分钟,并用超纯水洗涤三次。
4au-hnt和au-hnt-dox@bsa-fa的表征
将hnts和au-hnts的水分散体(浓度为0.05%)滴在覆盖有碳膜的铜网上,并使用透射电子显微镜观察(tem)(jem-2100f,jeolltd.,japan),加速电压为100kv。通过紫外-可见分光光度计(uv-2550,shimadzuinstrumentltd.,suzhou,china)测量所有样品的uv-vis光谱。用x射线衍射仪(miniflex-600,rigakucorporation,japan)测试x射线衍射(xrd)分析。通过xps仪器(escalab250xi,thermofisherscientificltd.,usa)分析xps分析。检测到al,si,c,au和o的原子。使用光热成像系统(tis55,flukeelectronicinstrumentltd.,usa)监测红外成像和温度升高记录。使用808nm光纤耦合激光器的激光器(md-iii-808,长春新工业光电技术有限公司,中国)。通过流式细胞术(bdfacscanto,usa)测试细胞的细胞凋亡和坏死。通过激光扫描共聚焦显微镜(clsm)(lsm880,carlzeissag,germany)拍摄的细胞摄取图像。
5au-hnts-dox@bsa-fa的光热性能
评价au-hnts-dox@bsa-fa的光热性能,1mlau-hnts-dox@bsa-fa分散体(200-800μg·ml-1)将该混合物加入1.5mlep管中,808nm处的激光功率密度为0.2,0.4,0.8w·cm-2激光照射8分钟。一旦照射开始,每隔60秒用红外相机记录分散体的温度,同时每2分钟拍摄红外照片。每个样品重复三次以计算平均值和标准误差。在相同的测量条件下将纯水作为对照处理。
6au-hnt-dox@bsa-fa的血液相容性
将1ml新鲜兔血液加入15mlpbs溶液中,然后将混合物以1000rpm离心5分钟,弃去上清液。重复该过程3次,收集红细胞(rbc)。然后,将320μl红细胞加入到1680μlpbs溶液中以形成红细胞悬浮液。首先,将500ml超纯水和pbs溶液加入到红细胞悬浮液中作为阳性对照组和阴性对照组。将另外25μlrbc悬浮液加入到5mlhnts,au-hnts,au-hnts-dox@bsa-fapbs溶液(0.5μg·ml-1)中。轻微摇动所有样品并在37℃下孵育1小时。温育后,将rbc悬浮液以1000rpm离心5分钟。另外,将上清液以15000rpm离心5分钟以消除材料的影响。然后,用酶标仪在570nm处测量上清液的吸光度。阳性对照组100%溶血,阴性对照组0%溶血。
7体外释放dox
将au-hnts-dox@bsa-fa(10mg)加入到pbs(5ml)中并在黑暗中于37℃在ep管中不断摇动。在ep管中,将一组样品用808nm(0.8w·cm-2)激光预处理8分钟。在取样之前,用808nm(0.8w·cm-2)激光照射一组样品8分钟,另一组没有操作。在特定时间离心(10000rpm,2分钟)后,通过uv-vis分光光度计获得来自au-hnts-dox@bsa-fa的dox释放的上清液(1.5ml)。然后在释放介质中提供相同体积的新鲜pbs。
细胞实验:
8细胞培养
人乳腺癌细胞(mcf-7),人宫颈癌细胞人(hela),人脐静脉内皮细胞(huecs)和小鼠乳腺癌细胞(4t1)获自中国科学院细胞库。将mcf-7和hela细胞在dulbecco改良的eagle培养基(dmem)(gibco,usa)中培养,将4t1细胞保持在含有10%胎牛血清(gibco,usa)的rpmi1640(gibco,usa)中,在潮湿的气氛中在37℃下含有5%的co2。
9体外细胞毒性研究:
将mcf-7和hela细胞(1×104细胞/孔)接种在96孔细胞培养板中24小时,然后与hnts和au-hnts在37℃下孵育24小时。浓度分别为0,200,400和800μg·ml-1。然后,用pbs洗涤细胞两次,并加入100ml新鲜培养基。然后,向每个孔中加入10μlcck-8试剂并孵育4小时。将上清液以15,000rpm离心以消除材料对吸光度结果的影响。通过酶标仪在450nm记录吸光度。细胞活力是样品与对照组的吸光度比。将mcf-7细胞分别与浓度为200,400和800μg·ml-1的au-hnts孵育,并在37℃下孵育12小时。然后用808nm(0.8w·cm-2)激光照射细胞分别照射2,4,8分钟。然后,向每个孔中加入10μlcck-8试剂并孵育4小时。将上清液以15,000rpm离心,并通过酶标仪在450nm下记录吸光度。将hnts,au-hnts和au-hnts-dox@bsa-fa与mcf-7细胞一起温育24小时,然后用或不用808nm激光(0.8w·cm-2)照射8分钟。用pbs洗涤后,加入100μl培养物,并向每个孔中加入100μlcck-8试剂并孵育4小时。将上清液以15,000rpm离心,并通过酶标仪在450nm下记录吸光度。
10a/eb染色测定
将mcf-7细胞(8×103细胞/孔)接种于96孔板中24小时以附着它们,然后接种hnts,au-hnts和au-hnts-dox@bsa-fa(向每个孔中加入400μg·ml-1)纳米复合物,温育24小时。然后用ao/eb双荧光染料染色细胞,用pbs洗涤3次,并用荧光显微镜观察。
11细胞凋亡测定
将mcf-7细胞以5×104个细胞/孔的密度接种在12孔板中。孵育24小时后,将hnts,au-hnts和au-hnts-dox@bsa-fa(400μg·ml-1)各加入24小时。然后将细胞用新鲜的dmem培养基在37℃下用或不用808nm(0.8w·cm-2)激光照射8分钟。测试未处理的细胞作为阴性对照。然后用pbs洗涤所有细胞三次,用胰蛋白酶消化(edta消耗)并通过离心收集。将细胞重悬于0.5ml膜联蛋白结合缓冲液中。然后,将所有细胞在含碘化丙啶(pi)和含有结合缓冲液的膜联蛋白v-fitc中染色15分钟,最后通过流式细胞术检测。
12细胞摄取au-hnt-dox@bsa-fa
lscm用于测试mcf-7细胞对fa缀合的au-hnts-dox@bsa-fa的细胞摄取。通常在培养皿中培养mcf-7细胞(1×104个细胞),并使其在37℃,5%co2气氛中粘附过夜。随后分别用au-hnts-dox@bsa-fa(200μg·ml-1)处理它们2,4和8小时。用pbs洗涤细胞三次,用4%甲醛固定15分钟,并用0.1%triton透化7分钟。用dapi和alexafluor488鬼笔环肽(molecularprobes)进一步染色并通过lscm观察荧光图像。afm还进一步证实了mcf-7细胞对au-hnts-dox@bsa-fa的细胞摄取。通常,将mcf-7细胞(1×104个细胞)在培养皿中培养,并在37℃,5%co2下孵育24小时。随后用dmem和au-hnts-dox@bsa-fa(200μg·ml-1)处理12小时。将细胞用pbs洗涤三次,用4%甲醛在4℃固定30分钟,然后使用30%,50%,70%,80%,90%,95%,100%乙醇梯度进行脱水。干燥后,在afm(bioscopecatylystnanoscope-v,broker,instrumentsltd.,usa)下观察细胞的形态。
动物实验:
134t1小鼠模型
体重18-22g的6周龄雌性balb/c小鼠购自广东省医学实验动物中心。将所有小鼠在温度(23±1℃)下保持在无特定病原体的动物室中,12小时黑暗光周期,并用标准实验室饮食和水喂养。在实验前使动物适应环境一周。所有动物护理和实验程序均由暨南大学动物护理和使用委员会进行。为了建立携带4t1的小鼠,将悬浮在pbs中的4t1细胞(2×106个细胞/ml)皮下注射到balb/c小鼠的第二乳房脂肪垫中。14体内荧光成像
当肿瘤体积达到约100mm3时,携带4t1的小鼠静脉注射dox(0.32mg·kg-1)和au-hnts-dox@bsa-fa(0.32mg·dox-1当量)。分别在指定的时间点(2,4,8,12和24小时),杀死荷瘤小鼠,然后切除肿瘤负荷和主要器官,洗涤,干燥,并使用体内荧光分析成像系统(perkinelmer,usa)。15体内光热成像
当肿瘤达到约50mm3时,将小鼠随机分成三组(n=3):激光,au-hnts@bsa-fa+激光和au-hnts-dox@bsa-fa+激光。给小鼠静脉内注射生理盐水(200μl),au-hnts@bsa-fa(20mg·kg-1)和au-hnts-dox@bsa-fa(20mg·kg-1)。注射4小时后,根据报道的研究,用808nm激光以1w·cm-2的密度照射小鼠8分钟。用指示的红外热像仪捕获光热成像。记录时间间隔(0,2,4,6和8分钟)和小鼠肿瘤组织的温度变化。
16体内协同化学热疗法
当肿瘤达到约50mm3时,将小鼠随机分成6组(n=6):1)对照组(仅生理盐水,静脉注射,200μl),2)激光组(生理盐水,静脉注射,200μl和激光照射,1w·cm-2,8分钟),3)au-hnts@bsa-fa组(au-hnts@bsa-fa,静脉注射,20mg·kg-1),4)dox组(静脉注射,0.32mg·kg-1),5)au-hnts@bsa-fa+激光组(au-hnts@bsa-fa,静脉注射,20mg·kg-1,激光照射,1w·cm-2,8分钟)和6)au-hnts-dox@bsa-fa+激光组(au-hnts-dox@bsa-fa,静脉注射,0.32mg·dox-1当量,1w·cm-2,8分钟)。每3天用200μl生理盐水,au-hnts@bsa-fa,dox和au-hnts-dox@bsa-fa静脉内处理小鼠,持续15天。注射4小时后,用密度为1w·cm-2的808nm激光照射小鼠8分钟。每天测量小鼠的体重,使用测径器每三天测量肿瘤体积并根据下式计算:体积(mm3)=0.5×[长度(mm)]×[宽度(mm)]2。在实验结束时,在第16天将小鼠用乙醚处死。收获小鼠的肿瘤,心脏,肝脏,脾脏,肺脏和肾脏,称重,用4%多聚甲醛固定。
17组织病理学测定
将小鼠的固定肿瘤,心脏,肝脏,脾脏,肺脏和肾脏用石蜡包埋,并以4μm的厚度切片用于苏木精和伊红(h&e)染色。另外,为了观察肿瘤组织中的细胞凋亡指数,使用原位细胞死亡检测试剂盒(roche,switzerland)进行tunel测定,并遵循制造商的说明书。通过数字显微镜和扫描仪(m8,precipoint,germany)表征组织图像。在三个随机选择的视野中定量凋亡细胞,并通过总细胞数的百分比显示。
18统计分析
所有实验至少一式三份进行,数据表示为平均值±标准偏差(sd)。使用graphpadprism6(graphpadsoftware,usa)进行数据的统计比较。通过t检验分析在特定时间点肿瘤组织的dox荧光的定量。使用双向方差分析(anova)和tukey事后检验分析体重和肿瘤体积的数据。采用单因素方差分析和tukey事后检验分析肿瘤组织温度变化,肿瘤重量和凋亡指数。所有显着相关性的值(p<0.05)被认为是统计学显着性。
实验部分-实验结果
2.1au-hnts和au-hnts-dox@bsa-fa纳米复合材料的表征
通过油相合成法在hnts管中合成gnrs是可行的。图1a说明了au-hnts-dox@bsa-fa的合成方法。首先,在有机溶剂中通过抗坏血酸在hnts中还原氯金酸以形成金纳米棒。接下来,通过物理吸附将hnts与bsa和dox混合,然后用乙醇固定。最后,通过fa中的-cooh与-nh2在bsa中的缩合反应将fa接枝到hnts的表面上。gnrs和au-hnt-dox@bsa-fa可通过超声均匀分散在pbs溶液中(图10a)。然而,在静置10小时后,au-hnts-dox@bsa-fa仍然可以稳定地分散,但在gnrs中发生大量沉降(图10b)。在实际应用中,au-hnts在pbs中比gnrs更稳定,这是au-hnts混合系统的优点之一。在au-hnts-dox@bsa-fa的ir光谱中,在1560cm-1处的n-h键的变形振动峰和在1210cm-1处的c-n键的伸缩振动出现(图11)。这表明在bsa上接枝的伯胺和fa的形成。图1b的tem图像显示原始hnts具有独特的管状结构。通过在hnts存在下原位合成gnps,hnts的内腔填充有不同大小的gnrs(图1c)。hnts管腔中gnrs的直径和纵横比分别在9.7-16.2nm和5.5-19.8之间变化。gnrs开始在腔的两端生长,导致在hnts内部形成棒状结构。还发现gnrs也可以在hnts外部形成,但是通过用甲苯洗涤除去游离的gnrs(图12)。图1d显示了gnrs,hnts和au-hnts的uv-vis吸收光谱。gnrs显示510nm和782nm处的特征吸收。同时,au-hnts在nir区域具有相同的吸收带,这表明在hnts中形成gnrs。au-hnts纳米复合材料的xrd图案表明存在分配给hnts和金的峰(图1e)。与原始hnts相比,在au-hnts中存在分配给金的(111),(200)和(220)的衍射峰。
图13显示hnts和au-hnts的x射线光电子能谱(xps)曲线,以及hnts和au-hnts的tem元素映射图像。它表明gnrs可以在hnts的内腔中形成。氧元素的不清楚是由于gnrs合成中使用的有机物质粘附到hnts表面引起的。hnts和au-hnts的铝,硅,金和氧元素的高分辨率xps光谱示于图1f中。可以看出,与原始hnts相比,au-hnts中的金元素含量显着增加。碳含量的增加和氧的减少是因为油酸(oac)和油胺(oam)未通过洗涤过程完全除去。由于oac和oam与hnts之间的相互作用,它几乎不能完全从产品中除去。然而,它们对下列细胞毒性的影响可忽略不计。所有这些结果表明gnrs成功地加载到hnts的内腔中。此外,通过粒径和zeta电位分析合成的材料。hnts,au-hnts和au-hnts-dox@bsa-fa的平均粒径分别为336.5±2.3nm,367.2±3.6nm和424±2.8nm(图14)。粒径的增加归因于在管周围掺入有机层以及当用乙醇固定时hnts可能聚集。hnts,au-hnts和au-hnt-dox@bsa-fa的ζ电位分别为-25.2mv,-23.3mv和-19.6mv。带正电荷的dox和bsa的吸附降低了hnts的zeta电位。
为了评价au-hnts作为光热剂在水溶液中的作用,用红外相机记录了用nir光照射的au-hnts的温度变化。如图2a-2c所示,纯水在激光照射后具有可忽略的温度变化,但au-hnts具有高得多的温升。随着au-hnts的浓度和激光功率的增加,激光照射的纳米颗粒悬浮液的最终温度和升温速率相应地增加。例如,当au-hnts的浓度为400μg·ml-1时,照射8分钟后温度上升26.8℃。图2d显示au-hnts的光热效应可以在808nm激光开启或关闭的情况下重复几次。这表明au-hnts的光热效应在光热疗法期间是稳定且可重复的。诸如dox和bsa的分子的吸附不影响au-hnt的光热性质,并且au-hnts-dox@bsa-fa的光热效应与au-hnts一致。
制备au-hnts-dox@bsa-fa纳米复合材料以改善au-hnts的生物亲和力和肿瘤的治疗效果。在该系统中,光热疗法是主流,并辅以化学疗法。为了增加癌细胞对材料的摄取,将fa与作为靶向配体的au-hnts-dox@bsa的表面缀合。图3a显示了不同样品的溶血速率。纳米粒子的溶血与孔隙度,几何形状和表面功能有关。原始hnts可引起红细胞的异常破坏,并表现出84.3%的高溶血率。在以前的文献中发现了通过pei和壳聚糖寡糖接枝等hnts的表面修饰减少溶血。在这项工作中,au-hnts-dox@bsa-fa的溶血率仅为1.9%,表明它静脉注射的安全性。在动物实验过程中,au-hnts-dox@bsa-fa不会在小鼠血液中凝结形成血栓。au-hnts-dox@bsa-fa具有良好的抗凝血能力,同时降低溶血率。au-hnts的长度大于典型的纳米级药物载体的长度,但它具有纳米级的直径和低的溶血速率,并且当体内的血液循环到肿瘤细胞时通过与fa受体结合而特异性地内吞。然后通过物理吸附在搅拌下将dox加载到au-hnts上12小时。dox的负载效率计算为~1.8%(dox与au-hnts-dox@bsa-fa的质量比)。在黑暗条件下,pbs中dox的释放极低,但在激光照射后释放量大大增加(图3b)。这表明激光照射后dox释放加速。激光照射还可促进体内dox的释放。由于激光转换后的热量会破坏dox与纳米复合材料之间的强烈相互作用,因此释放更多dox分子是合理的。
2.2体外细胞摄取和化学光热治疗
在有或没有808nm激光照射(1w·cm-2,8分钟)的pbs(ph7.4)中评估hnts,au-hnts和au-hnts-dox@bsa-fa的细胞毒性。图4a显示通过用mcf-7细胞培养的au-hnts的低水平生物毒性。即使在相对高的浓度下,用au-hnts处理的hela细胞和mcf-7细胞的存活率也大于85%。同时,使用另一种癌细胞(hela细胞)和正常组织细胞(huvec)的细胞相容性测定也表明au-hnts具有良好的生物相容性(图15)。在nir激光照射后,用au-hnts处理的细胞被杀死。随着照射时间和浓度增加,细胞存活率降低。其中,图4b中高浓度细胞的存活率仅为10.5%。
图4c显示原始hnts在激光照射后不会导致细胞死亡,但是在用808nm激光照射8分钟的au-hnts组中细胞存活率仅为52.6%。au-hnts-dox@bsa-fa还通过在没有激光照射的情况下在pbs中释放少量dox来杀死细胞,并且fa-缀合的纳米颗粒也在具有阳性fa受体的mcf-7细胞的特异性靶向中起支持作用。
在没有照射的情况下,au-hnts-dox@bsa-fa组的细胞存活率为73%。用808nm激光au-hnts-dox@bsa-fa照射8分钟后,mcf-7细胞的凋亡率增加,细胞存活率仅为7.4%。
使用荧光活/死细胞测定法直接观察由au-hnts-dox@bsa-fa在mcf-7细胞中诱导的细胞死亡。如图4d所示,在用pbs和hnts处理的细胞中,清楚地观察到绿色荧光,表明细胞在孔板中仍然存活。在光照射区域,几乎所有细胞都被au-hnts(红色荧光)诱导死亡。相反,在没有激光照射的情况下清楚地观察到绿色荧光在加入au-hnts-dox@bsa-fa但未用激光照射的孔中观察到少量的红色荧光,表明少量细胞死亡。然而,在激光照射后观察到大量的红色荧光。这些结果表明au-hnts-dox@bsa-fa中的dox和gnrs在光照射下在细胞中起关键作用。为了进一步证实肿瘤细胞中有效的凋亡诱导能力,使用流式细胞术分析mcf-7细胞的凋亡和坏死。如图4e所示,hnts在激光照射后仅引起3.53%的细胞凋亡率,而au-hnts在光照射后引起65.66%的细胞凋亡率。au-hnts-dox@bsa-fa可以在没有激光照射的情况下引起18.68%的细胞凋亡率。然而,在激光照射后,au-hnts-dox@bsa-fa在激光照射后增加pbs的温度,这促进了dox的释放并导致92.26%的细胞凋亡。mcf-7细胞的凋亡是由化学光热疗法的协同作用引起的。该结果与细胞活力和荧光活/死细胞测定的结果一致。
表1mcf-7细胞凋亡的详细数据表。
从表1结果可知,au-hnts-dox@bsa-fahnts+laser组mcf-7细胞的凋亡远高于au-hnts-dox@bsa-fa,并且,au-hnts-dox@bsa-fahnts+laser组比au-hnts+laser的细胞凋亡也高。
使用mcf-7细胞评估au-hnts-dox@bsa-fa的细胞摄取。图5显示了在不同时间段用au-hnts-dox@bsa-fa孵育的mcf-7细胞的激光扫描共聚焦显微镜(lscm)图像。dox的红色荧光出现在用au-hnts-dox@bsa-fa孵育2小时的mcf-7细胞中,随着孵育时间的增加,红色荧光强度变强。这表明携带dox的修饰的hnts富含细胞。fa移植可以显着改善纳米粒子向癌细胞的递送。随着时间的推移,更多的au-hnts-dox@bsa-fa被细胞摄取,细胞质中出现的红色荧光变得更暗。
使用mcf-7细胞的原子力显微镜(afm)进一步证明该物质被细胞吞噬而不是仅富集在细胞表面上。图16a显示了mcf-7细胞的对照组,其在培养基中孵育12小时而没有任何材料。可以观察到细胞膜由于脱水而塌陷粘在基底上,并且其细胞核是突出的。图16b显示了mcf-7细胞的部分扩大。可以看出,在细胞核和细胞膜周围没有发现hnts。用au-hnts-dox@bsa-fa(200μg·ml-1)孵育12小时的mcf-7细胞的afm图像(图16c)。可以看出,核不能被识别并且整个骨架被抬高,伴随着不均匀的颗粒出现在细胞表面上。因为hnts集中在细胞周围,所以它们中的一些被细胞吸收到细胞质中以使整个骨架凸起,从而使细胞核凹陷。由于hnts显示出独特的管状微结构,因此使用afm很容易区分纳米管和细胞组分。显然,如图16d所示,一些管状颗粒或其聚集体分布在细胞膜上。然而,一些hnts在细胞膜中被吞噬(由红色箭头指示)。tem技术也被用于通过内吞作用和直接浸润来观察其他纳米管或纳米片的内化。afm的结果显示hnts能够通过胞吞作用进入细胞。
2.3体内化学光热治疗
化疗是临床治疗癌症的首选,但化疗药物如dox缺乏对癌细胞的选择性,导致许多副作用。叶酸受体在超过40%的人类癌症中过表达,包括肺癌,乳腺癌,肾癌,脑癌和卵巢癌。通过用靶向配体分子(例如fa)功能化纳米粒子可以实现主动靶向,其可以识别并结合癌细胞特异性受体,从而能够特异性识别肿瘤细胞。根据表面的特征,用于过表达fa受体的肿瘤细胞如4t1细胞,au-hnts-dox@bsa-fa被设计为肿瘤靶向的药物递送载体。
为了证实au-hnts-dox@bsa-fa在体内的肿瘤靶向功效,建立了携带4t1的小鼠模型,并且给小鼠静脉内注射dox(0.32mg·kg-1)和au-hnts-dox@bsa-fa(0.32mg·kg-1dox当量)。通过荧光成像系统在特定时间点(1,4,8,12和24小时)监测从携带4t1的小鼠切除的主要组织(肿瘤,心脏,肝,脾,肺和肾)的dox荧光。注射。如图6a和6b所示,表明肿瘤中的dox荧光在au-hnts-dox@bsa-fa给药后8小时显着积累并达到最大值,而dox处理的荧光在4小时达到最大值。此外,au-hnts-dox@bsa-fa处理的肿瘤中dox荧光强度显着高于dox组(p<0.05)。用au-hnts-dox@bsa-fa处理的小鼠24h时dox荧光明显高于dox组(p<0.01)。这些数据表明au-hnts-dox@bsa-fa在肿瘤中表现出显着的肿瘤靶向效率和良好的dox控制释放。
表2肿瘤组织的dox定量荧光强度数据。
由于au-hnts@bsa-fa在体外具有优异的光热性能,因此在携带4t1的小鼠中研究了体内的进一步光热效应,并且通过红外热成像相机实时记录图像。给小鼠静脉注射生理盐水(200μl),au-hnts@bsa-fa(0.32mg·kg-1)或au-hnts-dox@bsa-fa(20mg·kg-1)。然后,在注射4小时后将小鼠麻醉并暴露于功率密度为1w·cm-2的808nm激光。如图7a和b所示,通过红外热像仪以指定的时间间隔(0,2,4,6和8分钟)捕获并记录小鼠肿瘤中的光热图像和温度变化。用生理盐水处理的小鼠的肿瘤温度在照射8分钟后没有明显的波动。值得注意的是,用au-hnts@bsa-fa和au-hnts-dox@bsa-fa处理的小鼠局部表面肿瘤的温度在8分钟内迅速增加到58.2±0.7℃和59.0±0.4℃。一些研究表明,au具有独特的表面等离子体共振特性,可以快速吸收近红外光,并在照射过程中有效地转化为热,光热效应在au-hnts@bsa-fa和au-hnts-dox@bsa-fa之间没有显着差异。au-hnts-dox@bsa-fa表明光热效应实际上是由au-hnts@bsa-fa引起的,而dox不能增加au-hnts@bsa-fa的光热效应。据报道,当肿瘤温度达到41℃时,可以杀死癌细胞,这是由于血液补充不良造成的。因此,这些结果表明au-hnts-dox@bsa-fa具有突出的光热性能,并且它可能是用于抗肿瘤治疗的有前途的纳米材料。
表3激光照射期间小鼠肿瘤组织的温度变化数据。
根据肿瘤靶向效率和体内光热成像的结果,推测au-hnts-dox@bsa-fa具有显着的抗肿瘤效果。为了验证该假设,进一步研究了au-hnts-dox@bsa-fa在携带4t1的小鼠中的抗肿瘤活性。如图8a所示,与对照组相比,用dox处理的4t1小鼠的体重显着降低(p<0.001),而au-hnts@bsa-fa,au-hnts@bsa-fa+激光和au-hnts-dox@bsa-fa+激光组没有明显的影响。体重的减少通常是由dox的毒性引起的,因为它对小鼠显示出某些毒性作用。然而,au-hnts-dox@bsa-fa对小鼠没有毒性,这表明au-hnts-dox@bsa-fa可被认为是癌症治疗中有希望的纳米系统。
每3天记录和计算的肿瘤体积显示在图8b中。在实验结束时(第16天),分离肿瘤组织,称重并拍照,如图8c和8d所示。正如预期的那样,与对照组相比,au-hnts@bsa-fa+激光组中4t1荷瘤小鼠的肿瘤体积和肿瘤重量显着降低(p<0.001),而激光或au-hnts@bsa-fa单独治疗没有显着变化。该结果表明,au-hnts@bsa-fa具有抑制肿瘤生长的潜力,有助于在辐射下产生高光热效应,这与光热成像实验结果一致,表明au-hnts@bsa-fa具有潜在的光热作用。材料组与对照组相比,用au-hnts-dox@bsa-fa+激光(0.32mg·kg-1dox)处理的4t1小鼠的肿瘤体积和肿瘤重量显着减少(p<0.001),显着高于对照组。dox(0.32mg·kg-1)处理。正如预期的那样,au-hnts-dox@bsa-fa+激光组的小鼠在携带4t1的小鼠中表现出比au-hnts@bsa-fa+激光组更优异的抗肿瘤效果(p<0.05)。特别是,第15天对照组的平均肿瘤体积为243.85±78.88mm3,而au-hnts@bsa-fa+激光和au-hnts-dox@bsa-fa+激光的平均肿瘤体积为79.43±14.97mm3和51.22±5.06mm3。au-hnts-dox@bsa-fa具有比au-hnts@bsa-fa更好的抗肿瘤效果,这可归因于肿瘤靶向效应与化疗效果相结合。总的来说,应该注意到dox可以导致体重下降,同时在0.32mg·kg-1的低浓度小鼠中具有毒性。相反,au-hnts-dox@bsa-fa携带相同的低剂量dox(0.32mg·kg-1)显着降低肿瘤体积,而对小鼠没有显着的毒副作用。au-hnts-dox@bsa-fa可以缓解dox的毒性作用并增强抗肿瘤能力。这些数据表明,au-hnts-dox@bsa-fa+激光治疗在体内具有优异的抗肿瘤效果,远远超过光热疗法或单独化疗的效果,这可以通过协同光热,肿瘤靶向和化疗作用来解释。
另外,为了进一步证实体内抗肿瘤功效,通过tdt介导的dutp缺口末端标记(tunel)测定法检测肿瘤组织中的细胞凋亡指数(图8e和8f)。褐色斑点(红色箭头)代表肿瘤组织中的细胞凋亡。与对照组相比,au-hnts@bsa-fa+激光(p<0.001)处理和au-hnts-dox@bsa-fa+激光(p<0.001)处理导致肿瘤组织明显凋亡。此外,au-hnts-dox@bsa-fa+激光治疗比au-hnts@bsa-fa+激光治疗表现出更显着的细胞凋亡(p<0.01)。这些结果与图8b和8c中所示的肿瘤体积和肿瘤重量一致。这些数据进一步证明au-hnts-dox@bsa-fa在携带4t1的小鼠中具有优异的抗肿瘤效力。
表4在15天内不同组别的小鼠的体重
表5在15天内不同组别的小鼠的肿瘤体积
表6小鼠在15天后不同组别的肿瘤的重量
表7小鼠15天后不同组别的肿瘤的凋亡率
对肿瘤,心脏,肝脏,脾脏,肺脏和肾脏进行组织学分析,研究不同处理后4t1荷瘤小鼠对主要脏器的毒性。代表性照片显示,au-hnts@bsa-fa+激光和au-hnts-dox@bsa-fa+激光治疗可诱发明显的肿瘤坏死(图9),而对照组,激光,au-hnts@bsa-fa和dox组没有显示出明显的变化。此外,即使在低剂量的dox下,au-hnts-dox@bsa-fa也可以诱导肿瘤坏死。这些结果进一步证明au-hnts@bsa-fa+激光和au-hnts-dox@bsa-fa+激光具有有效的肿瘤抑制能力。对于正常组织,用dox治疗的小鼠可以诱导明显的心脏损伤(心肌细胞破裂和分散)和轻微的肾毒性(肾小球破坏性坏死),而其他治疗与对照治疗相比没有明显的变化。此外,所有处理的小鼠肝脏,脾脏,肺组织均无明显变化。这种现象可以解释为两个原因。一方面,au-hnts@bsa-fa被设计为药物递送载体,其可以被靶向,累积到肿瘤和控制释放的dox中,其可以通过化学疗法靶向杀死癌细胞。另一方面,肿瘤靶向的au-hnts@bsa-fa也作为潜在的光热材料,其可以在激光诱导高温下增加肿瘤组织的温度以杀死癌细胞。这些数据进一步证实au-hnts-dox@bsa-fa的纳米系统具有优异的抗肿瘤效率和较少的副作用。总的来说,au-hnts-dox@bsa-fa提供了一种多功能纳米系统,可以同时对肿瘤实现靶向化学光疗。
3.结论
通过在hnts的腔中包含gnrs,设计了用于乳腺癌的高效化学-光热联合治疗的新治疗平台。然后将抗癌药物dox加载到au-hnts的表面上。然后通过bsa的反应将修饰的hnts表面与靶向配体fa缀合。通过不同技术验证了au-hnts-dox@bsa-fa纳米复合材料的结构和性质。细胞实验表明,au-hnts-dox@bsa-fa纳米复合材料在nir激光照射下表现出强烈的化学治疗效果。激光照射促进dox的释放,允许在激光照射下联合化疗和ptt。lscm和afm的结果表明au-hnts-dox@bsa-fa可被mcf-7细胞吞噬。体内实验表明,au-hnts-dox@bsa-fa可以实现更好的肿瘤治疗,并降低对正常组织的毒性。dox可以通过纳米载体靶向肿瘤,并有效地发挥王肿瘤细胞的作用。因此,在保持良好治疗效果的同时降低了对正常组织的毒性。au-hnts-dox@bsa-hnts的新型化学光热疗法纳米平台为体外和体内乳腺肿瘤的治疗提供了快速,有效和廉价的选择。
- 还没有人留言评论。精彩留言会获得点赞!