抗炎用组合物的制作方法
本发明涉及一种能够用作饮食品或药品的抗炎用组合物、用于抑制前列腺素e2产生的组合物及用于抑制一氧化氮产生的组合物。
本发明还涉及一种具有前列腺素e2产生抑制活性及一氧化氮产生抑制活性的新型化合物。
背景技术:
前列腺素e2(pge2)在白细胞(巨噬细胞)、肥大细胞、内皮细胞及血小板等中产生。作为细胞膜磷脂的构成成分而存在的花生四烯酸被磷脂酶切出后,经过环加氧酶途径合成pge2。在炎症的过程中该途径激活,pge2的产生增加。
从特定的细胞释放出的pge2作用于附近的靶细胞,并诱发靶细胞中的炎症反应。pge2是用于在炎症部位扩大炎症反应的化学介质中的一种,它会激活炎症部位的炎症反应。
一氧化氮(no)在炎症过程中由被炎性细胞因子或细菌内毒素诱发的白细胞(巨噬细胞)的ii型一氧化氮合酶(inos)所产生(非专利文献1)。过多产生的no被转换为过氧亚硝酸之后,会显示出dna损伤及ldl氧化等细胞损伤作用(非专利文献2),因此,抑制炎症中所产生的过多的no至关重要。另外,no激活nf-κb途径等促进炎症的细胞内信号途径(非专利文献3),因此,抑制no产生在发挥抗炎作用方面也很重要(专利文献1)。
炎症是由感染症、外伤、异物等刺激因子引发、并将因刺激因子而坏死的自我细胞及组织与刺激因子本身一起排除的防御反应。炎症反应有助于消除以感染为主的有害刺激。另一方面,炎症也会损伤正常组织,因此有时反而会对机体带来损害,从而需要抑制过多的炎症反应。
作为包含天然化合物作为有效成分的pge2产生抑制剂及抗炎剂,例如,具有专利文献2中所记载的物质。另外,专利文献1中记载了,通过光照处理及/或加热处理而激活的、大豆种子或其提取物与叶绿素的混合物具有no产生抑制活性,能够用作抗炎剂。
另一方面,姜黄(curcumalonga)中包含许多倍半萜类化合物,作为来自姜黄的倍半萜类化合物,已知有姜黄酮醇a(turmeronola)、姜黄酮醇b(turmeronolb)等许多甜没药烷(bisabolane)化合物(非专利文献4)。
现有技术文献
专利文献
专利文献1:国际公开wo2012/177969
专利文献2:日本特开2012-056952号公报
非专利文献
非专利文献1:罗宾斯病理学(第8版)2章p.58-59
非专利文献2:jphysiolpharmacol.2003;54(4):469-87.
非专利文献3:currdrugtargetsinflammallergy.2005;4(4):471-9.
非专利文献4:s.lietal.,pharmaceuticalcrops,2011,2,28-54。
技术实现要素:
发明要解决的课题
本发明的目的在于提供一种抗炎用组合物、用于抑制pge2产生的组合物或用于抑制no产生的组合物。
用于解决课题的方案
本发明包括下面的发明。
(1)一种抗炎用组合物,含有式1表示的化合物或其盐作为有效成分,
式1
[化1]
式1中,r1为氢或羟基,a为式2或式3表示的基团,
式2
[化2]
式3
[化3]
r2为氢或羟基,
r3为氢或羟基,
r4为甲基、氢或羟基,
r2、r3及r4的至少一个为羟基。
(2)一种用于抑制前列腺素e2产生的组合物,含有所述式1表示的化合物或其盐作为有效成分。
(3)一种用于抑制一氧化氮产生的组合物,含有所述式1表示的化合物或其盐作为有效成分。
(4)一种式4表示的化合物或其盐,
式4
[化4]
(5)一种治疗或予防炎症的方法,包括:
向人等对象给药所述式1表示的化合物或其盐。
(6)一种所述式1表示的化合物或其盐,用于人等对象的炎症的治疗或予防。
(7)一种所述式1表示的化合物或其盐的使用,用于制造用于治疗或予防人等对象的炎症的药物组合物。
(8)一种所述式1表示的化合物或其盐在用于治疗或予防炎症的饮食品组合物中的非医疗性使用。
(9)一种抑制前列腺素e2的产生的方法,包括:
向人等对象给药所述式1表示的化合物或其盐。
(10)一种所述式1表示的化合物或其盐,用于抑制人等对象产生前列腺素e2。
(11)一种所述式1表示的化合物或其盐的使用,用于制造用于抑制人等对象产生前列腺素e2的药物组合物。
(12)一种所述式1表示的化合物或其盐在用于抑制前列腺素e2的产生的饮食品组合物中的非医疗性使用。
(13)一种治疗或予防疾病的方法,所述疾病通过抑制前列腺素e2的产生得到改善或予防,所述方法包括:
向人等对象给药所述式1表示的化合物或其盐。
(14)一种所述式1表示的化合物或其盐,用于治疗或予防人等对象的疾病,所述疾病通过抑制前列腺素e2的产生得到改善或予防。
(15)一种所述式1表示的化合物或其盐的使用,用于制造治疗或予防人等对象的疾病的药物组合物,所述疾病通过抑制前列腺素e2的产生得以改善或予防。
(16)一种所述式1表示的化合物或其盐在用于治疗或予防疾病的饮食品组合物中的非医疗性使用,所述疾病通过抑制前列腺素e2的产生得以改善或予防。
(17)一种抑制一氧化氮的产生的方法,包括:
向人等对象给药所述式1表示的化合物或其盐。
(18)一种所述式1表示的化合物或其盐,用于抑制人等对象产生一氧化氮。
(19)一种所述式1表示的化合物或其盐的使用,用于制造用于抑制人等对象产生一氧化氮的药物组合物。
(20)一种所述式1表示的化合物或其盐在用于抑制一氧化氮的产生的饮食品组合物中的非医疗性使用。
(21)一种治疗或予防疾病的方法,包括:
向人等对象给药所述式1表示的化合物或其盐,
所述疾病通过抑制一氧化氮的产生得以改善或予防。
(22)一种所述式1表示的化合物或其盐,用于治疗或予防人等对象的疾病,所述疾病通过抑制一氧化氮的产生得以改善或予防。
(23)一种所述式1表示的化合物或其盐的使用,用于制造用于治疗或予防人等对象的疾病的药物组合物,所述疾病通过抑制一氧化氮的产生得以改善或予防。
(24)一种所述式1表示的化合物或其盐在用于治疗或予防疾病的饮食品组合物中的非医疗性使用,所述疾病通过抑制一氧化氮的产生得以改善或予防。
(25)一种饮食品组合物,包含所述式4表示的化合物或其盐和作为饮食品可接受的其它成分。所述式4表示的化合物或其盐的含有量优选为在人口服摄取所述饮食品组合物时,在人的体内产生抗炎作用、抑制前列腺素e2产生的作用及抑制一氧化氮产生的作用中的一种以上的作用的有效量,更优选为相对于所述饮食品组合物的总量为0.0001重量%以上、0.001重量%以上、0.01重量%以上、0.1重量%以上或1重量%以上。
(26)一种药品组合物,包含所述式4表示的化合物或其盐和作为药品可接受的其它成分。所述式4表示的化合物或其盐的含有量优选为在向人等对象给药所述药品组合物时,在所述对象的体内产生抗炎作用、抑制前列腺素e2产生的作用及抑制一氧化氮产生的作用中的一种以上作用的有效量,更优选为相对于所述饮食品组合物的总量为0.0001重量%以上、0.001重量%以上、0.01重量%以上、0.1重量%以上或1重量%以上。
本说明书包括作为本申请的优先权的基础的日本国专利申请第2017-095713号的公开内容。
发明的效果
本发明的组合物能够用作抗炎剂、pge2产生抑制剂或no产生抑制剂。
本发明的化合物具有抗炎活性、pge2产生抑制活性或no产生抑制活性。
附图说明
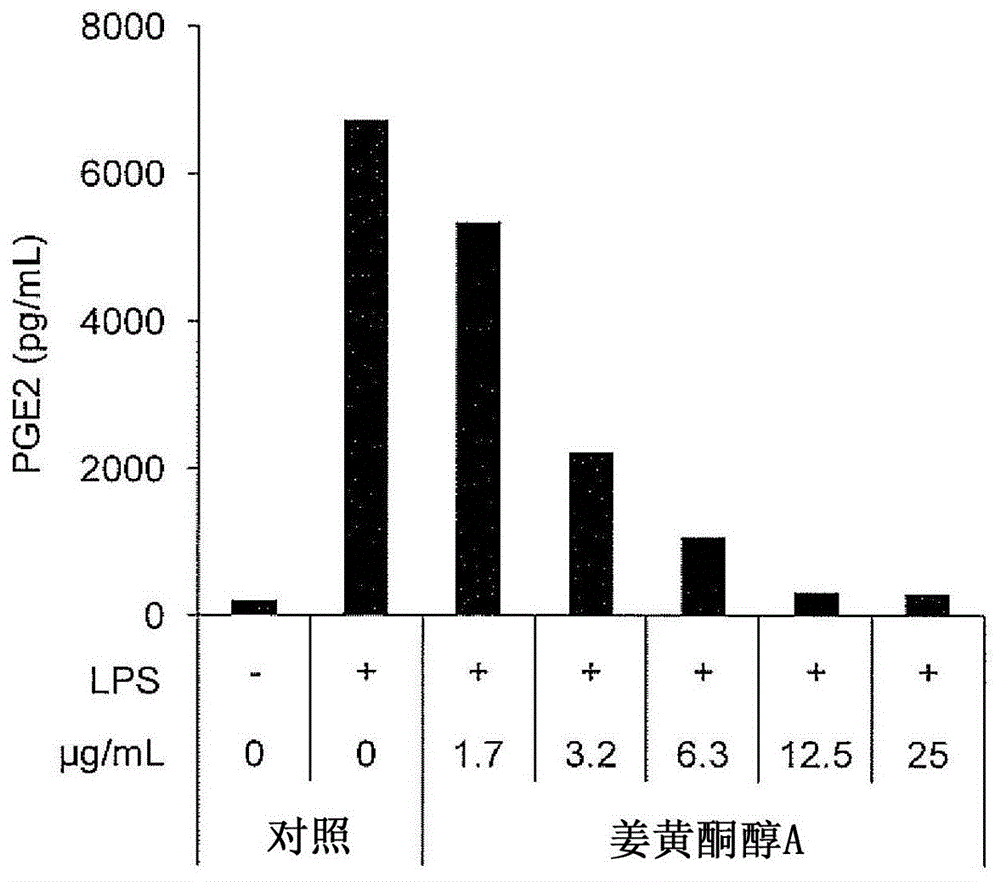
图1示出经姜黄酮醇a处理后的raw264.7的培养上清液中的pge2浓度。
图2示出经2-甲基-6-(4-羟基苯基)-2-庚烯-4-酮处理后的raw264.7的培养上清液中的pge2浓度。
图3示出经4-甲叉基-5-羟基甜没药-2,10-二烯-9-酮处理后的raw264.7的培养上清液中的pge2浓度。
图4示出经成分d-b处理后的raw264.7的培养上清液中的pge2浓度。
图5示出经姜黄酮醇b处理后的raw264.7的培养上清液中的pge2浓度。
图6示出经姜黄酮醇a处理后的raw264.7的培养上清液中的no2-浓度。
图7示出经2-甲基-6-(4-羟基苯基)-2-庚烯-4-酮处理后的raw264.7的培养上清液中的no2-浓度。
图8示出经4-甲叉基-5-羟基甜没药-2,10-二烯-9-酮处理后的raw264.7的培养上清液中的no2-浓度。
图9示出经成分d-b处理后的raw264.7的培养上清液中的no2-浓度。
图10示出经姜黄酮醇b处理后的raw264.7的培养上清液中的no2-浓度。
具体实施方式
〈活性化合物〉
本发明的组合物含有所述的式1表示的化合物或其盐作为具有抗炎活性、pge2产生抑制活性及no产生抑制活性的有效成分。在下面的说明中,有时将式1表示的化合物或其盐称为“活性化合物”。
式1表示的化合物只要为具有式1表示的平面结构的化合物即可,立体构型没有特别限制,可以为多种立体构型的化合物的混合物。需要指出,式2及式3中,被波浪线截断的键表示在式1中向着a所键合的碳的键。
下面,将对a为式2表示的基团时的式1的化合物的更优选的形式进行说明。
式2中,优选r4为甲基或羟基。式2中,优选r2、r3及r4中仅一个为羟基,更优选r2、r3及r4中仅一个为羟基且r4为甲基或羟基。
当a为式2表示的基团时,式1的化合物更优选为具有下面的平面结构中的任意一种的化合物。
[化5]
[化6]
[化7]
[化8]
其中,成分d-b为本发明人等从姜黄提取物中分离并鉴定的新型化合物。成分d-b能够命名为2-甲基-5-羟基-6-(3-羟基-4-甲基苯基)-2-庚烯-4-酮。
需要指出,在从姜黄提取物分离出的天然物中,在姜黄酮醇a、姜黄酮醇b及2-甲基-6-(4-羟基苯基)-2-庚烯-4-酮中,2-甲基-2-庚烯-4-酮的部分结构中的6位碳的立体构型为s体这一点是公知的。但是,在式1的化合物的上述更优选的例子中,只要具有上述的平面结构即可,立体结构没有特别限制。
下面,对a为式3表示的基团时的式1的化合物的更优选的形式进行说明。
式3表示的基团更优选为下式3-1
[化9]
表示的基团。式3或式3-1表示的基团为具有式3或式3-1所示的平面结构的基团即可,立体构型没有特别限制,可以包含多种立体构型的基团。
a为式3表示的基团时的式1的化合物更优选为具有下面的平面结构的化合物。
[化10]
作为式1表示的化合物的盐,只要为药学上可接受的盐即可,没有特别限制,例如,可列举:钠盐(酚性羟基的钠盐)。
〈活性化合物的制造方法〉
本发明中使用的活性化合物可以为来自植物的化合物,也可以人为地合成的化合物。例如,为光学活性的(+)-姜黄酮醇a能够通过bioscibiotechnolbiochem.1993;57(7):1137-40中记载的方法来合成。
本发明中使用的活性化合物更优选为来自植物原料的化合物,进一步优选为来自姜科姜黄属植物的化合物。作为姜科姜黄属植物,可列举:curcumalonga(姜黄)、curcumaaromatica(郁金)、curcumazedoaria(莪术)、curcumaphaeocaulis(蓬莪术)、curcumakwangsiensis(广西莪术)、curcumawenyujin(温郁金)、curcumaxanthorrhiza(印尼莪术),特别优选curcumalonga(姜黄)。能够从姜科姜黄属的植物的根茎等部位获得活性化合物。根茎使用从土中采集的部分即可,能够直接使用根茎的适当的部位,或者将其切割为适当的尺寸或形状后使用,或者将其制成粉碎物的形态后使用。植物原料也可以为被适当干燥后的原料。
活性化合物能够从包含活性化合物的植物原料中提取。作为提取溶剂,能够使用极性有机溶剂(甲醇、乙醇等)、水、非极性有机溶剂(醋酸乙酯等)。特别是,从植物原料中通过水提取获得的水提取物、对该水提取物进一步通过甲醇/水混合溶剂提取而获得的甲醇/水提取物和/或该甲醇/水提取物作为包含活性化合物的植物提取物是优选的。作为水,优选使用95℃以上的热水。植物提取物根据需要挥发去除提取溶剂后使用。也可以将包含活性化合物的植物提取物以原有的形态配合于本发明的组合物。
另外,也可以将从包含活性化合物的植物提取物对活性化合物进行高纯度化而得到的部分配合于本发明的组合物。例如,能够将包含活性化合物的植物提取物用于醋酸乙酯/水的液液分配,从而将活性化合物高纯度化至醋酸乙酯部分中。另外,也能够将包含活性化合物的植物提取物或植物提取物中的部分用于基于色谱法的精制处理,从而获得高纯度化后的活性化合物。作为色谱法,能够使用反相柱色谱法、正相薄层色谱法等。
包含活性化合物的植物提取物或其留分可以为通过常用方法实施干燥、粉末化、颗粒化、溶液化等加工而得到的物质。
活性化合物优选为精制后的物质。
〈本发明的组合物及其用途〉
本发明的组合物可以为所述的活性化合物自身,也可以为包含活性化合物和至少一种其它成分的组合物。当本发明的组合物包含活性化合物和至少一种其它成分时,可以为活性化合物和至少一种其它成分混合而成的组合物,也可以为通过适当的方式将活性化合物和至少一种其它成分制剂化而得到的组合物,还可以活性化合物和至少一种其它成分的制剂化组合物进一步与其它成分混合而成的组合物。在此,活性化合物也可以为包含所述的活性化合物的植物提取物或植物提取物中的部分的形式。本发明中的包含活性化合物的组合物的形状没有特别限制,例如,可以为液体状、流动状、凝胶状、半固形状或固形状等任意形状。
作为所述的至少一种其它成分,没有特别限制,优选为饮食品、药品等最终形式中可接受的成分,更优选为可口服摄取的成分。
作为这样的其它成分,例如,可列举:甜味料、酸味料、维生素类、矿物质类、增粘剂、乳化剂、抗氧化剂、水等。另外,也可以根据需要添加色素、香料、保存料(用于抑制细菌的繁殖、防止变质、腐败的添加物)、防腐剂、防霉剂、追加的生理活性物质等。
作为甜味料,可列举:葡萄糖、果糖、蔗糖、乳糖、麦芽糖、帕拉金糖、海藻糖、木糖等单糖或二糖、异构糖(葡果糖浆、果葡糖浆、砂糖混合异构糖等)、糖醇(赤藓糖醇、木糖醇、乳糖醇、异麦芽酮糖醇、山梨糖醇、还原糖浆等)、蜂蜜、高甜味度甜味料(三氯蔗糖、乙酰舒泛钾、索马甜、甜菊糖苷、阿斯巴甜等)等。
作为酸味料,具有柠檬酸、苹果酸、葡萄糖酸、酒石酸、乳酸、磷酸或它们的盐等,能够利用这些中的一种或两种以上。
作为维生素类,可列举:维生素a、维生素b1、维生素b2、维生素b6、维生素e、烟酸、肌醇等。
作为矿物质类,可列举:钙、镁、锌、铁等。
作为增粘剂,可列举:卡拉胶、结冷胶、黄原胶、阿拉伯胶、罗望子胶、瓜尔豆胶、刺槐豆胶、刺梧桐胶、琼脂、明胶、果胶、大豆多糖类、羧甲基纤维素(cmc)等。
作为乳化剂,可列举:甘油脂肪酸酯、蔗糖脂肪酸酯、脱水山梨糖醇脂肪酸酯、卵磷脂、植物甾醇、皂素等。
作为抗氧化剂,可列举:维生素c、生育酚(维生素e)、酶处理芦丁、儿茶素等。
所述其它成分分别能够以本领域技术人员通常在饮食品、药品等组合物中所采用的范围内的量适当配合。
活性化合物和至少一种其它成分通过适当的方式制剂化而成的组合物的形式可以为粉末、颗粒、胶囊剂、片剂(包括糖衣片等包衣片或多层片、口腔崩解剂、咀嚼片等)等固形组合物的形式,也可以为溶液剂等液体组合物的形式。
作为本发明的组合物,优选其自身为饮食品或药品,更优选为饮食品。在此,饮食品也包括食品添加物及与其它食品素材组合而用于制造饮食品的饮食品原料的形式。当包含活性化合物作为有效成分的组合物为饮食品或者与其它食品素材组合而用于制造饮食品的饮食品原料时,“饮食品”优选为功能性食品、特定保健用食品、用于补给营养的营养补充剂等形式。
通过向人等对象给药所述式1表示的化合物或其盐,能够在所述对象中治疗或予防炎症。在此,所述式1表示的化合物或其盐以用于治疗或予防炎症的有效量给药。作为给药途径,优选口服或鼻腔给药,特别优选口服给药。因此,包含所述式1表示的化合物或其盐的本发明的组合物能够用作抗炎用组合物。抗炎用组合物可以为药品组合物,也可以为饮食品组合物等非医疗用途的组合物。
通过向人等对象给药所述式1表示的化合物或其盐,能够在所述对象中抑制前列腺素e2的产生。在此,所述式1表示的化合物或其盐以用于抑制前列腺素e2的产生的有效量给药。作为给药途径,优选口服或鼻腔给药,特别优选口服给药。在接受了所述式1表示的化合物或其盐的给药的对象中,白细胞(巨噬细胞)、肥大细胞、内皮细胞、血小板等细胞中前列腺素e2的产生被抑制。因此,包含所述式1表示的化合物或其盐的本发明的组合物能够用作用于抑制前列腺素e2产生的组合物。用于抑制前列腺素e2产生的组合物可以为药品组合物,也可以为饮食品组合物等非医疗用途的组合物。
通过向人等对象给药所述式1表示的化合物或其盐,能够在所述对象中治疗或予防疾病,所述疾病通过抑制前列腺素e2的产生得以改善或予防。在此,所述式1表示的化合物或其盐以用于治疗或予防所述疾病的有效量给药。作为给药途径,优选口服或鼻腔给药,特别优选口服给药。在接受了所述式1表示的化合物或其盐的给药的对象中,白细胞(巨噬细胞)、肥大细胞、内皮细胞、血小板等细胞中前列腺素e2的产生被抑制,由此,能够治疗或予防所述疾病。
通过向人等对象给药所述式1表示的化合物或其盐,能够在所述对象中抑制一氧化氮的产生。在此,所述式1表示的化合物或其盐以用于抑制一氧化氮的产生的有效量给药。作为给药途径,优选口服或鼻腔给药,特别优选口服给药。在接受了所述式1表示的化合物或其盐的给药的对象中,白细胞(巨噬细胞)等细胞中一氧化氮的产生被抑制。因此,包含所述式1表示的化合物或其盐的本发明的组合物能够用作用于抑制一氧化氮产生的组合物。用于抑制一氧化氮产生的组合物可以为药品组合物,也可以为饮食品组合物等非医疗用途的组合物。
通过向人等对象给药所述式1表示的化合物或其盐,能够在所述对象中治疗或予防疾病,所述疾病通过抑制一氧化氮的产生得以改善或予防。在此,所述式1表示的化合物或其盐以用于治疗或予防所述疾病的有效量给药。作为给药途径,优选口服或鼻腔给药,特别优选口服给药。在接受了所述式1表示的化合物或其盐的给药的对象中,白细胞(巨噬细胞)等细胞中一氧化氮的产生被抑制,由此,能够治疗或予防所述疾病。
实施例
1.制备方法
从curcumalonga(姜黄)的根茎进行热水提取,获得热水提取物。接着,利用90%甲醇(甲醇/水=90/10(v/v))从热水提取物中进行提取,获得90%甲醇提取物。接着,将90%甲醇提取物用于醋酸乙酯/水的液液分配,获得醋酸乙酯组分。姜黄酮醇a和4-甲叉基-5-羟基甜没药-2,10-二烯-9-酮利用反相柱色谱法从所述醋酸乙酯部分中精制之后,溶解于二甲基亚砜而用于试验。2-甲基-6-(4-羟基苯基)-2-庚烯-4-酮和成分d-b利用反相柱色谱法和正相薄层色谱法从所述醋酸乙酯部分中精制之后,溶解于二甲基亚砜而用于试验。
作为姜黄酮醇b,购买长良科学株式会社的市售品,将其溶解于二甲基亚砜而用于试验。
2.各成分的确定
单离出的各成分的结构基于1hnmr、13cnmr、lcms等机器分析的结果及公知的信息来确定。
姜黄酮醇a及姜黄酮醇b记载于agric.biol.chem.,1990;54(9):2367-71。
2-甲基-6-(4-羟基苯基)-2-庚烯-4-酮记载于chem.pharm.bull.,2007;55(6):940-3。
4-甲叉基-5-羟基甜没药-2,10-二烯-9-酮记载于j.asiannat.prod.res.,2009,11,569-575。
成分d-b显示出如下由1hnmr及13cnmr获得的化学位移值。
1hnmr(500mhz,甲醇-d3)δppm:1.16(d,j=6.87hz,3h),1.85(d,j=1.15hz,3h),2.07(d,j=1.00hz,3h),2.11(s,3h),2.95(m,j=6.87,5.73hz,1h),4.10(d,j=5.73hz,1h),6.13-6.15(m,1h),6.63(dd,j=7.45,1.72hz,1h),6.66(d,j=1.72hz,1h),6.93(d,j=7.45hz,1h)。
13cnmr(126mhz,甲醇-d3)δppm:14.47,14.50,19.79,26.48,42.86,47.14,47.32,47.49,47.66,47.83,48.00,48.16,81.26,113.89,118.65,120.52,122.27,130.14,142.13,154.95,157.59,201.74。
而且,针对成分d-b,通过高分辨率lcms获得高分辨率质谱(hrms),从而获得下面的精确质量值。
hrms(esi)calcdforc15h21o3:249.1485[m+h]+,found:249.1480[m+h]+。
由这些结果确定成分d-b为新型化合物2-甲基-5-羟基-6-(3-羟基-4-甲基苯基)-2-庚烯-4-酮。
各化合物的平面结构如下表示。
[化11]
[化12]
[化13]
[化14]
[化15]
3.抗炎作用的评价
实验中使用小鼠巨噬细胞细胞株raw264.7,利用dmem(10%fbs)培养基以达到1.5×105细胞数量的方式接种于96孔板,并在co2培养箱中培养24小时至汇合。利用规定浓度(选自1.7μg/ml、3.2μg/ml、6.3μg/ml、12.5μg/ml及25μg/ml中的多种浓度)的姜黄酮醇a、2-甲基-6-(4-羟基苯基)-2-庚烯-4-酮、4-甲叉基-5-羟基甜没药-2,10-二烯-9-酮、成分d-b或姜黄酮醇b对在96孔板中培养后的小鼠巨噬细胞细胞株raw264.7进行预处理1小时前之后,添加20ng/ml的脂多糖(lps、炎症诱导因子),培养12小时。然后,回收上清液,通过竞争elisa法测定释放于上清液的前列腺素e2(pge2)量。另外,通过griess法测定释放于上清液的no2-量(通过no的氧化物来反映no量)。需要指出,利用各成分进行处理时,使用不含10%fbs的dmem。将除不利用来自姜黄的成分处理细胞之外进行相同操作的试验区作为对照/lps(+),将除不向培养12小时时的培养基中添加lps以外进行与对照/lps(+)相同的操作的试验区作为对照/lps(-)。
4.结果
经姜黄酮醇a处理后的raw264.7的培养上清液中的pge2浓度示于图1。
经2-甲基-6-(4-羟基苯基)-2-庚烯-4-酮处理后的raw264.7的培养上清液中的pge2浓度示于图2。
经4-甲叉基-5-羟基甜没药-2,10-二烯-9-酮处理后的raw264.7的培养上清液中的pge2浓度示于图3。
经成分d-b处理后的raw264.7的培养上清液中的pge2浓度示于图4。
经姜黄酮醇b处理后的raw264.7的培养上清液中的pge2浓度示于图5。
经姜黄酮醇a处理后的raw264.7的培养上清液中的no2-浓度示于图6。
经2-甲基-6-(4-羟基苯基)-2-庚烯-4-酮处理后的raw264.7的培养上清液中的no2-浓度示于图7。
经4-甲叉基-5-羟基甜没药-2,10-二烯-9-酮处理后的raw264.7的培养上清液中的no2-浓度示于图8。
经成分d-b处理后的raw264.7的培养上清液中的no2-浓度示于图9。
经姜黄酮醇b处理后的raw264.7的培养上清液中的no2-浓度示于图10。
图1~10中,“+”是指在培养12小时时的培养基中添加了20ng/mllps,“-”是指未添加lps。
工业上的利用可能性
本发明的组合物及化合物能够用于饮食品或药品领域。
本说明书中所引用的全部刊行物、专利及专利申请直接通过引用并入本说明书。
- 还没有人留言评论。精彩留言会获得点赞!