一种组织工程骨及其制备方法和应用方法与流程
本发明涉及一种医用组织工程复合材料。
背景技术:
因创伤和外科手术等原因造成骨缺损是常见的临床问题。严重骨缺损可导致骨延迟愈合和骨不连等并发症,致残率高。目前对于骨缺损的治疗,常用自体骨移植、异体骨移植等方法充填修复,但自体骨移植的来源较少,取骨数量有限;异体骨移植具有免疫源性,易引起机体的排斥反应。羟基磷灰石、磷酸钙等人工合成骨替代品已经成功应用于临床,但此类产主要作用仅为充填、支持或骨传导作用,存在骨诱导能力弱、生理修复能力差等不足。因此,开发骨诱导能力强、修复能力强的新型生物材料成为当前骨科和修复重建外科领域所面临的新挑战。
组织工程骨是指将种子细胞,经体外培养扩增后种植于具有良好生物相容性、可被人体逐步降解吸收的细胞支架或称细胞外基质上,形成的一种细胞杂化材料。将这种细胞杂化材料植入骨缺损部位,在细胞支架材料逐步降解的同时,种植的骨细胞不断增殖,从而达到修复骨组织缺损的目的。
目前的组织工程骨技术,通常利用成骨细胞、骨髓间充质干细胞(bonemarrowstromalcells,bmscs)、脂肪源性干细胞(adiposederivedstemcells,adscs)、胚胎干细胞(embryonicstemcell,es)等作为骨组织工程种子细胞;利用人工合成材料,如钙磷陶瓷、聚乳酸等,或天然生物衍生材料,由天然生物组织经一系列理化方法处理而得,如天然骨、珊瑚骨等,制成支架材料,参见专利文件cn101032430a;添加生物因子的复合材料或生物因子如骨形态发生蛋白(bonemorphogeneticgrowthfactor,bmp)、血管内皮生长因子(vascularendothelialgrowthfactor,vegf),以及引入基因工程技术的复合材料,通过在体内构建、体外构建或原位组织构建最终形成骨组织,参见专利文件cn103768656a,非专利文件资料《组织工程骨研究背景与进展》中华损伤与修复杂志(电子版)2013年第8卷第5期。但是,用这种方法培养出的组织工程骨是无序的,没有适当组织结构和力学结构的薄层原始骨组织。而体外构建的骨组织缺乏血供系统,这是目前影响骨组织构建成功与构建骨组织存活的关键因素。构建组织体积过大时,容易发生缺血、缺氧而导致种子细胞死亡,最终影响骨组织构建与形成。
目前组织工程骨的血管化是构建骨组织工程化成功的关键环节。采用受体体内容易利用的组织瓣如带蒂筋膜瓣,通过人工骨工程化培养成带蒂骨组织瓣供自体移植,是目前相对成熟的解决这个问题的方法,参见专利文件cn107988151a,非专利文件资料《组织工程骨的再血管化研究》中国临床康复第9卷第30期2005-08-14出版。但这种方式需要手术破坏受体的正常组织,增加了患者的痛苦及与手术相关的各种风险,与组织工程骨技术在降低手术工作量、减少患者痛苦的前提下促进骨组织缺损愈合的出发点相比,似乎代价过于高昂。这种方式的骨组织构建技术在本案中将其排除在组织工程骨技术定义之外。
技术实现要素:
本发明公开了一种组织工程骨。这种组织工程骨与缺损骨组织的形状尺寸相近,包括支架材料、种子细胞以及必须的生物因子,在支架材料空间结构中设置了可以与营养输送装置连接的能够给该组织工程骨内的种子细胞以及由这些种子细胞滋长出的骨组织细胞有效供给营养物质的输送管路。
这种组织工程骨的制备方法是利用成型技术,依照移植骨组织所需要的形状,制成包含支架材料、种子细胞以及必须的生物因子构建组织工程骨的外型,同时在成型过程中构建可以与营养输送装置连接的能够给该组织工程骨内的种子细胞以由这些种子细胞滋长出的骨组织细胞有效供给营养物质的输送管路。
所述的成型技术可以用常用的3d打印技术,也可以利用机械雕刻成型。
这种组织工程骨的支架材料可以采用任何现有的已经实验证实的,具备必要的机械强度、孔隙特征、组织兼容性、体内可降解性等理化、生物特性的组织工程骨支架材料。
这种组织工程骨中的种子细胞可以在支架材料成型后灌注附着,也可以在3d打印时直接“种植”在支架间隙内。
组织工程骨中营养物质的输送管路可以模拟天然骨组织的血管系统的尺寸及分布规律,也可以仅以有效输送营养物质为原则,制作的成任何形态及分布规律的形式。
营养物质的输送管路无需具备类似动脉-毛细血管-静脉系统完整结构,仅需具备类似动脉-毛细血管,或毛细血管-静脉系统的之一的形式。管路的主干一端与营养输送装置连通。
营养通道与营养输入装置连接,营养液经类似动脉-毛细血管的系统均匀到达组织工程骨各个部位,完成物质交换后的乏营养液通过基础孔隙渗出,或由基础孔隙渗入,经类似毛细血管-静脉系统营养管道由负压装置吸出。
组织工程骨中用于容纳种植细胞及其滋生出的骨组织细胞的骨架孔隙,我们称之为基础孔隙,用3d打印技术成型时,设置的具体的空隙尺寸和孔隙率可以参照实验动物或人体正常骨松质组织的空隙尺寸和孔隙率。
一般情况下,这里的种子细胞通常取自实验动物或手术患者自体组织,在排异反应不成问题的或/和自体组织获得条件不具备的前提下也可考虑取自异体。
组织工程骨中制成后,通常需要进行体外培养,稳定细胞的生长状态,观察细胞分化及生长情况,确定无污染、坏死等不能植入受者体内的状况,然后在保持与营养输送装置的连接,并继续给予体外营养输送的状态下植入骨缺损部位。
在该组织工程骨技术工程化十分成熟后,临床所需工程骨移植物完成打印并达能够到适当机械强度,可以不经体外培养观察过程,直接植入受者体内。
体外营养输送一直持续到受体自身血管组织长入组织工程骨的各个部位并足以给组织工程骨提供必要的营养,逐渐减少直至停止体外营养输入,去除体与组织工程骨连接的体外营养输送管路。
当手术所需组织工程骨体量较大,可以在3d打印过程中除正常的骨组织的基础孔隙以外,设置用于输入营养物质的类似动脉-毛细血管,或毛细血管-静脉系统的营养通道。在该组织工程骨植入受体内时,仍维持体外培养时通过营养通道的营养物质供应和代谢产物的排出。该营养体系持续工作直到受体自身的血管组织长入组织工程骨,并逐渐成长到在功能上足以替代来自体外的营养物质供应。
该技术的积极作用在于培育较大尺寸的组织工程骨,在保持整个组织工程骨整体生物活性的状态下植入体内,并从依靠体外营养输送自然过渡到由受体自身营养供应滋养,骨缺损的愈合过程大体是组织工程骨整体向正常骨组织改造重建的过程,跨过了骨组织沿组织工程骨支架在空间上爬行延伸的过程。与目前存在的所有类型的组织工程骨技术相比,可以显著的缩短病程。该技术在某种意义上相当于用组织工程法制造带蒂的骨组织瓣。
下面结合具体实施例对本发明作进一步详细说明。
附图说明
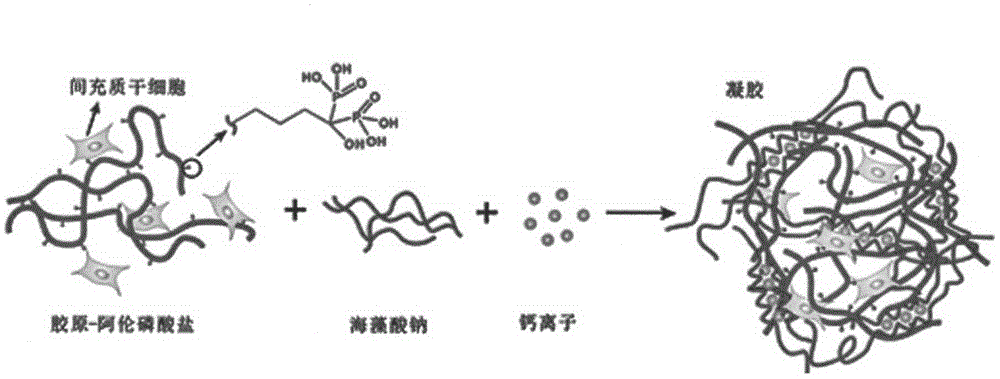
图1-2:由间充质干细胞(mscs)作为种子细胞,通过调节钙离子浓度控制细胞基质——海藻酸盐水凝胶——的机械强度和含磷酸功能基团的浓度控制mscs的成骨分化,并最终形成具有能够强度的组织工程骨的示意图。
图3:示意图,3d打印形成的组织工程骨的基本结构,依照正常骨组织的血管分布规律打印出的与预置的营养液输送管道相连通的树状营养输送管路,动脉-毛细血管模式。
图4:示意图,与图3近似的结构,毛细血管-静脉模式。
图5:示意图,机械雕刻形成的组织工程骨的基本结构,只有一条位于中央部位纵贯上下的营养输送管路和辐射状排列的基础间隙,动脉-毛细血管模式。
图6:示意图,与图3近似的结构,毛细血管-静脉模式。
图7:示意图,图5所示组织工程骨植入人体内,动脉-毛细血管模式。
图8:示意图,与图7近似,毛细血管-静脉模式。
图9:示意图,图7局部放大。
具体实施方式
实施例1
该实施例组织工程骨的种子细胞采用间充质干细胞(mesenchymalstemcells,mscs),通过控制细胞基质——海藻酸盐水凝胶——的机械强度(可用弹性模量表示)和含磷酸功能基团的浓度控制mscs的成骨分化,并最终形成具有足够强度可供植入骨缺损部位的大尺寸组织工程骨。
间充质干细胞(mesenchymalstemcells,mscs)是干细胞家族的重要成员,属于多能干细胞,在体内或体外特定的诱导条件下,可分化为脂肪、骨、软骨等多种组织。因其具有取材方便,对供体损伤小,易于分离培养,体外增殖能力强,经连续传代培养和冷冻保存后仍具有多向分化潜能等优点,已成为在细胞生物疗法和组织再生工程等领域最具临床应用前景的干细胞。细胞外基质(extracellularmatrix,ecm)是由细胞合成并分泌,分布在细胞表面或细胞之间的大分子,主要成分为多糖、蛋白或蛋白聚糖。这些物质构成复杂的网架结构,在细胞的分化、生长过程中起决定性作用。因此,可以利用材料支架模拟细胞外基质包绕mscs构建新型复合组织工程骨。目前此类研究主要集中于通过细胞因子、蛋白质(如bonemorphogeneticprotein,bmp)来促进mscs的成骨分化。一种方法是直接在支架材料中添加外源性蛋白质如bmp,通过缓释作用来调控mscs的成骨分化。但是这种方法存在蛋白质成本高昂、有效期短、蛋白质难以有效控制释放等缺点。另外一种方法是通过基因转染的方法将促成骨作用的基因导入mscs,使目的基因在mscs内表达并合成具有骨诱导作用的生长因子,从而克服了外源性生长因子在体内半衰期短、需反复给药等缺点。然而,通过病毒类载体转染虽然转染效率高,但存在安全性隐患;而采用非病毒类载体则存在转染效率低、稳定性差等缺点。间充质干细胞的分化受多种因素影响,除了上述生长因子、蛋白外,近期的研究表明mscs分化也受支架材料的机械强度、化学基团等物理、化学信号的调控。现有的研究成果表明通过控制细胞基质或培养基如海藻酸盐水凝胶的机械强度(可用弹性模量表示)和含磷酸功能基团的浓度就可以控制mscs的成骨分化,并最终形成组织工程骨。
参见附图1-2。具体方法是利用3d打印技术,用可以控制凝固所后具有的弹性模量的水凝胶材料与mscs制成临床所需形状的组织工程骨培养体,在人工培养条件下观察确定培养体中的mscs成活并开始向成骨细胞定向分化,然后将该组织工程骨用于临床。
打印过程中载有mscs的细胞混合液和形成凝胶的液态凝胶前体通过打印机不同的材料通道输送到打印头,通过预设的3d模型数据形成适当空隙尺寸和孔隙率的组织工程骨间质骨架,mscs以适当的密度分布于这些间质骨架的孔隙中。这里的间质骨架孔隙我们称之为基础孔隙,具体的空隙尺寸和孔隙率参照实验动物或人体正常骨松质组织的空隙尺寸和孔隙率。
参见附图3-4。在3d打印形成上述包含间质骨架和mscs细胞的组织工程骨基本结构11的同时,大致依照正常骨组织的血管分布规律打印出与预置的营养液输送管道相连通的树状营养输送管路12。营养液14可以在蠕动泵15的驱动下,按照输送管13——树状营养输送管路总管——树状营养输送管路分支——间质骨架孔隙——组织工程骨体外的方向流动,如图3。也可以以相反的方向流动,如图4。图中16为组织工程骨孵育容器,17为组织工程骨孵育容器罩。
实施例2
用实施例1所述的方法制备组织工程骨需要分辨率极高的组织3d打印机和苛刻的控温及无菌条件,并且打印形成的组织工程骨通常只具备较低的机械强度,需要靠组织培养生成的骨组织来增强组织工程骨的机械强度,这意味着长时间的体外培养。
参见附图5-6。可以用按照骨缺损的形状先制作合适的组织支架21,然后将种子细胞注射或灌注到支架中。支架中的空间结构也无需模拟天然骨组织的间隙结构,只要能够形成适当的孔隙率和孔隙尺寸的基础间隙23和合理尺寸及分布的营养输送管路即可。图中只有一条位于中央部位纵贯上下的营养输送管路22和辐射状排列的基础间隙23。营养液24输送方式与实施例1相同。
组织支架可以采用天然骨松材料去除有机质雕刻而成,也可以采用具有良好组织兼容性的合成高分子材料如聚乳酸,或天然生物材料如海藻酸盐水凝胶。还可以采用两种以上的材料打印,兼顾种子细胞的亲和性和较高的机械强度。
当用这种方法制备组织工程骨具有足够的强度时,接种种子细胞后,只需观察细胞已经成活并成功分布在整个组织工程骨内,即可实施植入受体的手术。
手术时按常规将组织工程骨31用内固定器械38固定到骨缺损部位时,要通过在正常骨组织39上开出的隧道并经过引出营养输送管331,参见附图7-9。
在植入手术以后的早期,以采用通过蠕动泵35和营养输送管331向组织工程骨中央的营养输送管路32正压输送营养物质,创口引流管332负压引流乏营养液和组织渗出液至负压吸引器333内。术后后期,引流管流出的创口渗出液由血性转为的透明液性后改为经创口引流管输注营养液,经组织工程骨的营养输送管负压吸引排出。这样可以利用创口的组织渗出液作为营养液,并有利于创面组织的新生血管快速长入组织工程骨内。
经拍片或ct检查,证实组织工程骨的外周部位开始形成新生骨组织时,逐渐减少营养液灌注,在组织工程骨内中央部位也产生显著的新生骨组织时即可停止营养液输入,并拔除营养输送管。
- 还没有人留言评论。精彩留言会获得点赞!