一种鸡滑液囊支原体的减毒疫苗的制备方法与流程
本发明涉及一种鸡滑液囊支原体的减毒疫苗的制备方法。
背景技术:
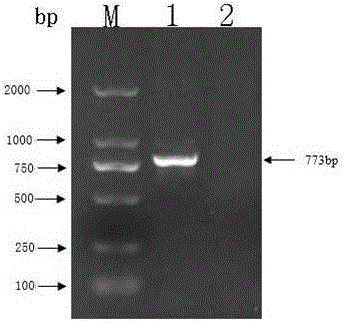
:鸡滑液囊支原体(mycoplasmasynoviae,ms)是一种世界范围内主要引起鸡关节肿大、滑液囊和腱鞘发炎的重要病原。近几年,该病在全国呈逐年上升趋势,严重影响了养禽业的健康发展。鸡滑液囊支原体病一年四季均可发生,但冬季早春易发,各种日龄鸡只都可感然,雏鸡易感性比成年鸡要高,抵抗力随日龄的增长而加强,外来引进品种或品系发病率高于本地品种。发病鸡群抵抗力下降,且在发病初期,因临床症状不明显,并且易于与多种禽类疾病相混淆,所以不易引起养殖者的重视,不能够及时采取相应的预防措施,加剧病情,增加死亡率,因此造成该病快速流行并给养殖企业造成巨大的经济损失。同鸡毒支原体(mycoplasmagallisepticum,mg)一样,鸡滑液囊支原体感染已遍及全球。在我国,无论是商品肉鸡、蛋鸡或种鸡,ms感染均有发生。因此,防控鸡滑液囊支原体病,净化种鸡群对养禽业的发展意义重大。针对鸡滑液囊支原体病的控制主要是通过疫苗免疫和药物控制两种方法,到目前为止,仅澳大利亚等国家有商品化的ms灭活疫苗和弱毒疫苗应用,且效果并不是很理想。而我国养殖场主要靠抗菌药物控制该病,但药物防治效果不佳的情况越来越明显。主要是支原体无细胞壁,对多种抗生素不敏感,抗生素治疗不能消除鸡群中ms感染。如何控制ms的传播,疫苗研究成为了防控鸡滑液囊支原体病的关键。在疫苗研究方面,主要是能够研制出更加有效安全的新疫苗,因此开发新型的鸡滑液囊支原体的减毒疫苗成为了一种趋势。技术实现要素:本发明的目的是提供一种鸡滑液囊支原体的减毒疫苗的制备方法,制备的减毒疫苗作用时间持久、高效稳定、无临床症状,适用于预防鸡滑液囊支原体。本发明的鸡滑液囊支原体减毒疫苗,包括有抗原和疫苗佐剂,其中抗原为鸡滑液囊支原体hlb-1菌株(mycoplasmasynoviaehlb-1)。已保藏于宁夏大学实验室,保藏日期为2017年3月3日。其中hlb-1株的减毒方法是通过体外传代使其自然变异弱化。本发明的疫苗,其制备方法如下:按照培养管容积的80%加入鸡滑液囊支原体改良frey氏液体培养基,菌株种子接种量为10%、培养温度为37°、震荡速度为200r/min、培养24〜30小时后菌液由红变黄时收获菌液作为种子菌液;菌株传代弱化:完成扩增的hlb-1菌株编号为h1,按10%的比例接种到装有80%改良frey氏液体培养基新的培养管中,编号为h2,按同样的方法接种传代,编号为h3,依次递推,直至编号为h95;油相制备:取同h95菌液相同体积的注射用白油,剧烈震荡乳化后,115℃灭菌40分钟,冷却后备用;疫苗制备:扩增完成后的h95菌液按1:1的比例与剧烈震荡乳化后的注射用白油混合,在h95菌液中缓缓加入乳化后的注射用白油,再以15000r/min搅拌5分钟完成制备。本发明的疫苗能够产生较高水平的抗体,持续期长,有交叉保护性,免疫后能够有效预防鸡滑液囊支原体病的发生。国内尚无鸡滑液囊支原体疫苗上市,用本发明的鸡滑液囊支原体h95株制备鸡滑液囊支原体减毒疫苗是防控该病的关键,冋时也能弥补市场空缺。附图说明图1是菌株hlb-1株pcr特异性检验图。图2是鸡滑液囊支原体hlb-1株基因序列进化树图图3是关节剖检图注:a为对照组;b为试验组。图4是肝脏剖检图注:a为对照组;b为试验组。图5是脾脏剖检图注:a为对照组;b为试验组。图6是关节病理组织切片观察图注:a为对照组(he,40ⅹ);b为试验组(he,40ⅹ)。图7是肝脏病理组织切片观察图注:a为对照组(he,400ⅹ);b为试验组(he,400ⅹ)图8是脾脏病理组织切片图注:a为对照组(he,400ⅹ);b为试验组(he,400ⅹ)。图9是梯度免疫接种和人工攻毒试验血清抗体水平变化图。图10是梯度免疫接种和人工攻毒试验体温变化图。图11是人工攻毒后体重增长变化图。图12是肝脏剖检结果图。图13是脾脏剖检结果图。图14是附关节剖检结果图。图15是肝脏病理组织切片观察图(he,400ⅹ)。图16是脾脏病理组织切片观察图(he,400ⅹ)。图17是关节病理组织切片观察图(he,40ⅹ)。具体实施方式实施例1:菌株的筛选:1鸡滑液囊支原体生产用培养基1.1鸡滑液囊支原体改良frey液体培养基(购自北京中海生物科技有限公司);1.2鸡滑液囊支原体改良frey固体培养基(购自北京中海生物科技有限公司);2鸡滑液囊支原体分离、鉴定2.1病原菌分离:在宁夏某养鸡场,疑似发生了典型的传染性滑膜炎症状,分离出血清。对分离出的血清进行elisa检测,观察检测结果,判断出感染鸡体内含有ms病原体。从发病鸡上的腿部关节中采集关节液,接种于改良frey液体培养基,置37°c,200r/min振荡培养24〜48小时,待接种后的液体培养基的颜色由红变成橘黄时收获,传代,取第2代(h2代)菌液进行鉴定。2.2病原菌鉴定形态观察:鸡滑液囊支原体分离株(命名为:hlb-1株)经鸡滑液囊支原体改良frey固体培养基,菌体形态为滑液囊支原体典型的“煎蛋样”菌落形态;将分离到的菌株接种于不含青霉素和醋酸铊等抑菌物质的改良frey氏液体培养基中,连续12次传代后,分离物保持ms应具有的形态,并且它可以通过0.45μm过滤器,说明分离株不是l细菌;生化特性:鸡滑液囊支原体分离株hlb-1株能发酵葡萄糖及麦芽糖,产酸不产气;不发酵乳糖,不能分解精氨酸;细菌l型鉴定均为阴性;可凝集鸡的红细胞;特异性:分子生物学鉴定用鸡滑液囊支原体特异性引物进行pcr扩增,结果hlb-1株能扩增出约773bp的特异性片段(图1)。2.3鸡滑液囊支原体hlb-1株vlha基因序列测定与分析2.3.1引物设计根据genbank中收录的鸡滑液囊支原体vlha基因,比对后针对保守区设计引物,由上海生物工程有限公司合成。该引物扩增的目的片段大小为773bp,引物序列如下所示:forwardprime:5'-gccattgctcctgctgttata-3';reverseprime:5'–gggtagtccactcgcatt-3'。2.3.2dna模板的制备:取hlb-1株培养物3ml,采用康为世纪细菌基因组dna提取试剂盒提取鸡滑液囊支原体基因组dna。方法如下:(1)取菌种培养物3ml置于离心管中,12000rpm离心2min,尽量吸净上清液。(2)加200μlbufferga到沉淀中,振荡菌体至彻底悬浮。(3)加入20μlproteinasek,涡旋振荡,混匀。(4)加入220μl缓冲液buffergb,震荡15sec,70℃孵育10min,简短离心去除水珠。(5)加入220μl无水c2h5oh,涡旋振荡15sec,充分混匀,简短离心去除壁内的水珠。(6)将步骤5中溶液全部加入到吸附柱cb3中,12000rpm离心30sec,弃废液,将吸附柱cb3放回收集管中。(7)加buffergd500ul到吸附柱cb3中,12000rpm离心30sec,倒掉废液,吸附柱cb3放回收集管中。(8)加bufferpw600ul到吸附柱cb3中,12000rpm离心30sec,弃倒掉废液,吸附柱cb3放回收集管中。(9)重复步骤8。(10)12000rpm离心2min,倒掉收集管中废液。将吸附柱cb3在室温下静置几分钟并彻底干燥。(11)吸附柱cb3放到新的离心管中,bufferte100ul悬空加在吸附柱cb3中间部位,25-30℃放置5min,12000rpm离心2min,收集dna溶液于-20℃保存备用。2.3.3pcr扩增及测序pcr扩增体系为:特异性pcr反应体系25μl:模板2μl,游引物p10.5μl,下游引物p20.5μl,2×taqmastermix10μl,ddh2o12μl。采用pcr扩增仪的特异性pcr反应条件:95℃预变性4min;95℃变性40s;56℃退火40s;72℃延伸40s,共30个循环;72℃延伸10min。用1%的琼脂糖凝胶在110v电压下电泳鉴定,同时以标准株作为阳性对照,结果出现了与目标片段相同的约773bp的特异性条带,说明该分离株为鸡滑液囊支原体。2.3.4测序与分析:根据genbank中收录的鸡滑液囊支原体vlha基因序列,针对保守区设计了一对引物,并进行扩增,经测序扩增出约为773bp大小的vlha基因片段,该菌株与其它不同地方的分离菌株的同源性仅为96%(图2)。2.4毒力试验:滴鼻接种30日龄无支原体感染史的健康鸡16只,设对照组a组8只,滴鼻接种改良的frey液体培养基,0.2ml/只。设试验组b组8只,并滴鼻活菌量约为1ⅹ106ccu/ml的hlb-1株菌液,0.2ml只;人工攻毒后按常规饲养,观察到18日后,发现试验组鸡有明显发病情况。结果表明,对照组a组鸡并无发病现象(表1);试验组b组的发病鸡临床症状主要为攻毒后鸡喜卧、跛行,典型症状为掌部和附关节肿胀,精神不振、羽毛蓬乱;b组鸡的跗关节和爪垫肿胀突出,关节剖开后有淡黄色粘性渗出物,渗出液呈脓稠状;a组鸡的关节处均正常未见肿胀,无炎性渗出物和渗出液(图3)。b组鸡的肝脏轻微肿大,有出血点,颜色呈现暗黄色,边缘变钝;a组鸡的肝脏色泽鲜艳,未见任何异常(图4)。b组鸡的脾脏肿大,有充血现象,a组鸡的脾脏大小正常,未见任何异常(图5)。2.5病理组织学观察:鸡关节经过固定、脱钙、石蜡包埋、切片制作及h.e染色,结果显示b组鸡的滑膜上皮增厚,少量炎性细胞渗出,血管轻度增生;a组鸡的纤维性滑膜未见明显异常(图6)。取病变部位器官组织制成石蜡切片后h.e染色,观察到b组鸡的肝细胞部分坏死、核裂,间质成分增生,轻微炎性细胞浸润,肝细胞轻度颗粒变性;a组鸡的肝细胞正常,无组织病变现象(图7)。b组鸡的脾脏结缔组织增生,出血;a组鸡的脾脏细胞正常,组织切片未见异常(图8)。表1:毒力试验结果。分组日龄(天)数量(只)攻毒剂量及方法发病率1308滴鼻接种,活菌量约为106ccu/mlhlb-1株菌液,0.2ml/只。6/82308滴鼻接种培养基,0.2ml/只。0/82.5免疫原性的测定:将鸡滑液囊支原体hlb-1株的第95代传代株h95的菌液分为3个代谢活力梯度,分别为a组1x106ccu/ml,b组1x108ccu/ml,c组1x1010ccu/ml,然后各梯度菌液与白油佐剂按1:1的比例等体积混合,边加白油边震荡混合液使其形成乳状油性弱毒苗。分别以0.2ml的剂量滴鼻接种30日龄无支原体感染史健康鸡各8只,另设不免疫却攻毒对照组d组8只和不免疫不攻毒对照组e组。a、b、c组分别免疫接种10日后,a、b、c、d组试验鸡均用活菌量约为1x106ccu/mlhlb-1株菌液滴鼻接种攻毒,每只0.2ml。观察攻毒后50日内试验鸡发病情况。试验结果表明:a组试验鸡的发病率有1/8,b组和c组试验鸡无发病现象,d组空白对照鸡则8/8发病。由表2结果可见,以活菌剂量为1x108ccu/m的传代株h95株与白油佐剂按1:1的比例等体积混合,边加白油边震荡混合液使其形成乳状油性弱毒苗,能起到很好的免疫作用。表2:免疫原性试验结果。2.5.1免疫接种后血清变化:如图9所示,对比各组血清中抗体lgg水平,在疫苗梯度免疫接种10d内,a组,b组和c组的血清抗体lgg水平达到了基本相同的水平。结果表明,疫苗梯度免疫接种后,a组,b组和c组均产生了抗体,血清中抗体lgg水平相似。人工攻毒完成2d后,d组血清中抗体lgg水平明显高于其他各组,a组、b组、c组在人工攻毒完成后血清中抗体lgg水平始终保持相对稳定状态,说明经疫苗梯度免疫接种后再吸收病原菌,鸡体内血清中抗体lgg水平将不再有明显变化。e组血清中抗体lgg水平始终保持相对稳定状态。2.5.2免疫接种后体温变化:如图10所示,对比各组鸡的平均直肠温度变化可以发现,疫苗梯度免疫接种后各组鸡的平均直肠温度虽有波动,但都在正常范围内且基本相同。人工攻毒后a组、b组、c组和d组鸡的平均直肠温度有所上升,但很快开始下降。各组鸡的平均直肠温度浮动在1℃内且鸡的平均直肠温度在正常温度范围内。在人工攻毒完成后30d内,e组鸡的平均直肠温度最高,但与a组、b组、c组鸡的平均直肠温度基本相同并无明显差异,人工攻毒完成30d后各组鸡的平均直肠温度虽仍有波动,但基本相同。2.5.3人工攻毒后体重变化:观察图1-11,对比各组鸡从人工攻毒当天起40d内体重增长情况,b组与e组的平均体重增长相同,平均每只鸡增重1.05kg左右,高于另外3组。a组与c组的平均体重增长相同,平均每只鸡增重1kg左右。d组平均体重增长最低,平均每只鸡体重增长只有0.56kg左右,分别对各组鸡的体重增长进行对比分析,发现各组鸡体重变化差异性显著(p<0.05)。2.5.4实验后解剖和病理观察:从临床对比发现,b、c组都能起100%免疫,a组与b、c组在免疫上有所差别。对a、b、d、e组鸡解剖和观察,由(图12)可知,a、b、e组的肝脏未见病变现象,d组的肝脏颜色呈土黄色,边缘变钝,有出血点;对比观察(图13)可知,a、b、e组的脾脏未见病变现象,d组的脾脏肿大,有充血现象;对比观察(图14)可知,a、b、e组的跗关节未见炎症发生,d组的跗关节剖检后有淡黄色粘性渗出物,渗出液呈脓稠状。对比观察(图15)可知,a、b、e组的肝细胞正常,无组织病变现象,d组的肝细胞部分坏死、核裂,有轻度颗粒变性和轻微炎性细胞浸润,间质成分和小叶间胆管增生。对比观察(图16)可知,a、b、e组的脾脏细胞正常,未见任何异常,d组的脾脏的脾小体有出血现象,结缔组织增生。对比观察(图17)可知,a、b、e组纤维性滑膜未见明显异常,d组滑膜轻度增生,血管扩张,少量炎性细胞渗出。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1