高浓度布比卡因多囊脂质体及其制备工艺、配液系统的制作方法
本发明涉及制剂
技术领域:
,具体涉及一种高浓度布比卡因多囊脂质体及其制备工艺、配液系统。
背景技术:
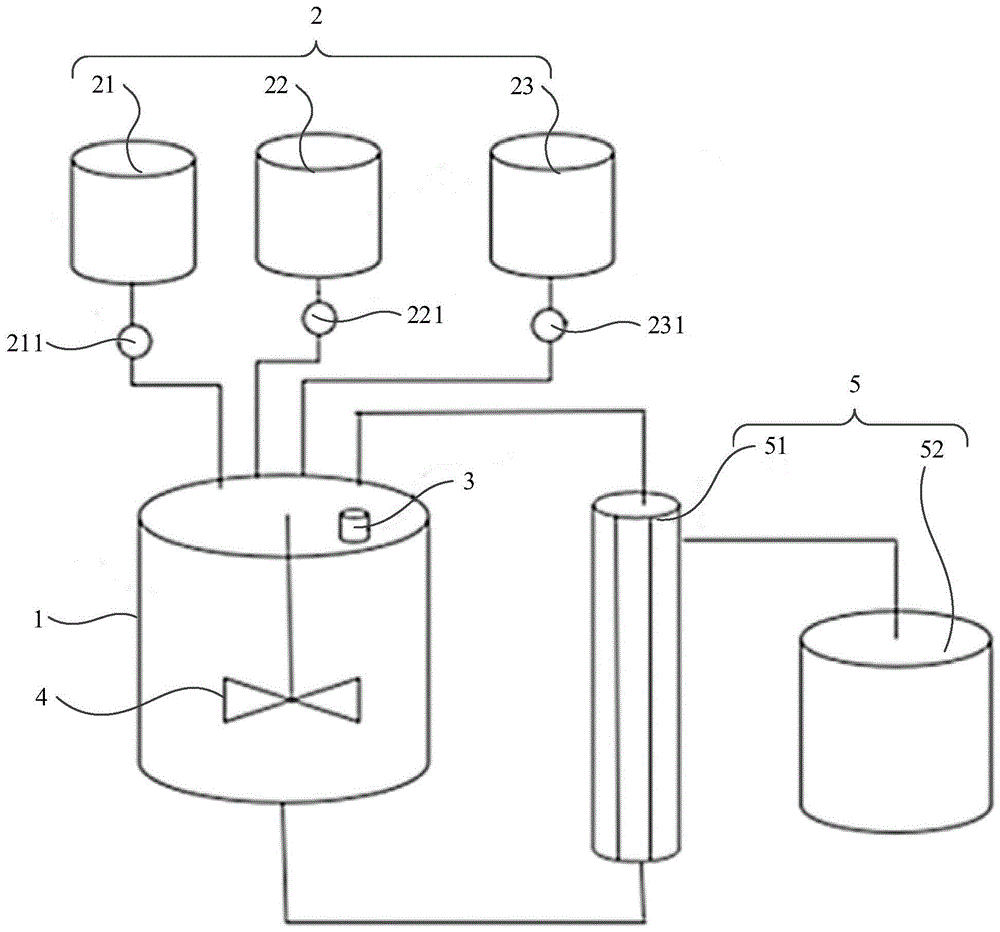
:多囊脂质体(mvls)的微观结构为多个脂质体聚合成球形,每个脂质体由疏水膜和内水相组成。多囊脂质体内部有很多大大小的被脂质双分子层隔开的囊泡,这种独特的结构赋予脂质体较强的刚性。当其中的某个囊泡破裂时,药物只是从破裂的囊泡中释放,完整的囊泡仍可保持原状,这使得药物的渗漏率降低且药物从脂质体中释放时没有突释现象,实现控制药物在一天至几周的时间范围内缓慢释放。然而,在多囊脂质体的合成过程中,如何除去有机溶剂和无菌控制是配液系统的难点。现有的制备系统由于需要较多的液体无菌控制点,造成无菌工艺的控制较难。其次,在制备过程中均是通过气液平衡原理,即将含有有机溶剂的复乳与氮气混合后除去有机溶剂,需要使用氮气发生装置和气体无菌过滤,这都会增加无菌控制的难度。例如,申请号为201711495716.3的专利(对比例1)中公布了一种布比卡因多囊脂质体制备装置,其技术方案的制备装置包括:3个配液罐,5个带有磁力搅拌装置的配液罐,1个带搅拌装置的配液罐,1个带搅拌装置和特殊三通管道装置的配液罐,1套交叉流(切向流)过滤系统,5个液体无菌过滤器,1个气体无菌过滤器。其技术方案的制备工艺包括如下步骤:配置第一水相;配置第一油相;配置第二油相;初次乳化:第一油相与第一水相混合剪切乳化;加入第二油相再次乳化;配置第二水相;制备水包油包水乳液:将第二水相与乳化液混合剪切;去除溶剂:通过特殊内置管道,使的复乳内包裹氮气,使它们充分混合;配置第三水相;使用超滤置换复乳外水相成第三水相;以及浓缩得最终产品。再如,申请号为201510296573.8的专利(对比例2)中公布了用于制备大直径合成膜囊泡的方法,其技术方案的制备装置包括:3个配液罐,6个带有磁力搅拌装置的配液罐,1个带有特殊设计喷嘴和罐体进出气装置的配液罐,1个热交换器系统,1个管道式剪切机,1套带有加热加湿装置的氮气输送系统,1套交叉流(切向流)过滤系统,6个液体无菌过滤器,3个气体无菌过滤器。其技术方案的制备工艺包括如下步骤:配置第一水相;配置第一油相;使用在线管道式剪切机混合第一油相与第一水相;初乳经过热交换器后重复剪切(约10-100次);配置第二水相;形成水包油包水复乳:将初乳与第二水相及氮气混合雾化喷出;去除有机溶剂:在去除溶剂罐体中使用大量氮气形成涡旋,使得经雾化喷出的复乳小液滴与氮气充分结合;配置第三水相;使用第三水相通过另一两通喷嘴清洗除溶剂罐体,收集复乳;配置第四水相;使用高温第四水相加热初乳;配置第五水相;超滤置换复乳外水相成第五水相;以及浓缩得最终产品。又如,申请号为9585838b2的专利(对比例3)中公布了productionofmultivesicularliposomes,其技术方案的制备装置包括:3个配液罐,4个带有磁力搅拌装置的配液罐,1个带搅拌装置的配液罐,1个带搅拌装置和爆气装置的配液罐,1套交叉流(切向流)过滤系统,4个液体无菌过滤器,1个气体无菌过滤器。其技术方案的制备工艺包括如下步骤:配置第一水相;配置第一油相;初次乳化:将第一水相与第二水相混合剪切;配置第二水相;二次乳化:将初乳与第二水箱混合剪切;去除溶剂:通入氮气经由爆气装置使氮气与复乳充分混合除去溶剂;配置第三水相;超滤置换复乳外水相成第三水相;以及浓缩得最终产品。技术实现要素:本发明的目的是提供一种高浓度布比卡因多囊脂质体及其制备工艺、配液系统,以提高配液效果。为了解决上述技术问题,本发明提供了一种配液系统,包括:主配液罐、与主配液罐相连的若干副配液罐,以及分别位于主配液罐上的加热装置、抽气装置;其中所述加热装置适于加热主配液罐内的试液;所述抽气装置适于保持主配液罐的真空度,以抽走试液中挥发的有机溶剂。进一步,所述副配液罐至少为三个,即一号副配液罐、二号副配液罐、三号副配液罐;其中一号副配液罐适于储存合成多囊脂质体的原辅料;二号副配液罐适于储存合成多囊脂质体的第一水相;三号副配液罐适于储存合成多囊脂质体的第二水相。进一步,各副配液罐与主配液罐之间均设有相应的无菌过滤器。进一步,所述原辅料按重量份组成包括:depc:156.7-173.3份;dppg:17.1-18.9份;胆固醇:88.3-97.7份;三辛酸甘油酯:37-41份;盐酸布比卡因:285-315份;以及磷酸:45.6-50.4份。进一步,所述第一水相按重量份组成包括:赖氨酸:7-75份;葡萄糖:10-100份;以及适量注射用水。进一步,所述第二水相包括0.9%氯化钠溶液。进一步,所述主配液罐和各副配液罐内均设有相应的搅拌装置。进一步,所述配液系统还包括与主配液罐相连的切向流装置,以用于置换试液中的外水相。又一方面,本发明还提供了一种多囊脂质体的制备工艺,包括:制备无菌原辅料溶液;一次乳化,即在无菌原辅料溶液中加入有机溶剂,形成油包水乳液;二次乳化,即在油包水乳液中加入第一水相,形成水包油包水复乳;去除所述有机溶剂;以及置换复乳外水相,即将所述水包油包水复乳中的外水相置换成第二水相,获得所述多囊脂质体。进一步,所述制备无菌原辅料溶液的方法包括:将如前所述的原辅料与乙醇在一号副配液罐中混合,搅拌至完全溶解;通过一号无菌过滤器进入主配液罐;通过加热装置加热主配液罐内的滤液;通过抽气装置保持主配液罐的真空度,直至乙醇挥发并抽走;以及向主配液罐内加入注射用水,并搅拌均匀,形成所述无菌原辅料溶液。进一步,所述滤液的加热温度为20-80℃,其环境真空度为20-220mbar。进一步,所述有机溶剂包括:二氯甲烷、三氯甲烷中的至少一种。进一步,将有机溶剂加入一号副配液罐中,并通过一号无菌过滤器进入主配液罐中,以与无菌原辅料溶液混合形成所述油包水乳液。进一步,在二号副配液罐中加入如前所述的第一水相,并通过二号无菌过滤器进入主配液罐中,以与油包水乳液混合形成所述水包油包水复乳。进一步,保持水包油包水复乳的温度为0-80℃,其环境真空度为20-220mbar,直至抽气装置抽走所述有机溶剂。进一步,在三号副配液罐中加入如前所述的第二水相,并通过三号无菌过滤器进入主配液罐中,以通过切向流装置将水包油包水复乳中的外水相置换成0.9%氯化钠溶液。另一方面,本发明还提供了一种多囊脂质体,所述多囊脂质体适于通过如前所述的制备工艺合成。本发明的有益效果是,本发明的配液系统通过将若干副配液罐并联在主配液罐上,既可以满足配液过程中各种原料的添加过程,又可以保持主配液罐的密封和无菌环境,减少了液体无菌控制点的数量;利用加热抽真空的方式使主配液罐中的有机溶剂挥发、抽走,不需要使用氮气发生装置和气体无菌过滤,不需要在气体方面控制无菌,降低了无菌工艺的控制难度,提高了配液过程中的无菌环境,具有产物浓度高、低成本、适于工业化生产的特点。附图说明下面结合附图和实施例对本发明进一步说明。图1是本发明的配液系统的结构示意图;图2是本发明的多囊脂质体的工艺流程图;图中:主配液罐1,副配液罐2,一号副配液罐21,一号无菌过滤器211,二号副配液罐22,二号无菌过滤器221,三号副配液罐23,三号无菌过滤器231,抽气装置3,主配液罐上的搅拌装置4,切向流装置5,中空纤维膜51,废液罐52。具体实施方式现在结合附图对本发明作进一步详细的说明。这些附图均为简化的示意图,仅以示意方式说明本发明的基本结构,因此其仅显示与本发明有关的构成。实施例1图1是本发明的配液系统的结构示意图。如图1所示,本实施例1提供了一种配液系统,包括:主配液罐1、与主配液罐1相连的若干副配液罐2,以及分别位于主配液罐1上的加热装置(未显示)、抽气装置3;其中所述加热装置适于加热主配液罐1内的试液;所述抽气装置3适于保持主配液罐1的真空度,以抽走试液中挥发的有机溶剂。可选的,所述主配液罐例如但不限于采用夹套式配液罐,可以通过夹套中水温来控制罐体内的试液温度,即所述加热装置;以及所述抽气装置包括但不限于抽风机。本实施例1的配液系统通过将若干副配液罐并联在主配液罐上,既可以满足配液过程中各种原料(如原辅料、乙醇、有机溶剂、第一水相、第二水相等)的添加过程,又可以保持主配液罐的密封和无菌环境,减少了液体无菌控制点的数量;利用加热抽真空的方式(加热装置和抽气装置)使主配液罐中的有机溶剂挥发、抽走,不需要使用氮气发生装置和气体无菌过滤,不需要在气体方面控制无菌,降低了无菌工艺的控制难度,提高了配液过程中的无菌环境。作为副配液罐的一种可选的实施方式。见图1,所述副配液罐2至少为三个,即一号副配液罐21、二号副配液罐22、三号副配液罐23;其中一号副配液罐21适于储存合成多囊脂质体的原辅料;二号副配液罐22适于储存合成多囊脂质体的第一水相;三号副配液罐23适于储存合成多囊脂质体的第二水相。可选的,各副配液罐与主配液罐11均设有相应的无菌过滤器,即一号无菌过滤器211、二号无菌过滤器221、三号无菌过滤器231。可选的,所述原辅料按重量份组成包括:depc(二芥酰基卵磷脂):156.7-173.3份;dppg(1,2-棕榈酰磷脂酰甘油):17.1-18.9份;胆固醇:88.3-97.7份;三辛酸甘油酯:37-41份;盐酸布比卡因:285-315份;以及磷酸:45.6-50.4份。可选的,所述第一水相按重量份组成包括:赖氨酸:7-75份;葡萄糖:10-100份;以及适量注射用水。可选的,所述注射用水与有机溶剂的体积比为4:1。可选的,所述第二水相包括0.9%氯化钠溶液。本实施方式的副配液罐分别通过相应的无菌过滤器与主配液罐相连,在满足配液加料的同时,加强了对各种液体原料的无菌控制,从而保证主配液罐的无菌环境,提高了配液效果。进一步,所述主配液罐和各副配液罐内均设有相应的搅拌装置,所述搅拌装置包括但不限于电动扇叶,在图1中示出了主配液罐1上的搅拌装置4,各副配液罐上的搅拌装置均未示出。进一步,见图1,所述配液系统还包括与主配液罐11相连的切向流装置5(切向流过滤装置),以用于置换试液中的外水相。其中,所述切向流装置5包括:与主配液罐11相连的中空纤维膜51、与中空纤维膜相连的废液罐52。实施例2图2是本发明的多囊脂质体的工艺流程图。在实施例1的基础上,见图2,本实施例2提供了一种多囊脂质体的制备工艺,包括如下步骤:步骤s1,制备无菌原辅料溶液;步骤s2,初级乳化,即将有机溶剂加入无菌原辅料溶液中,形成油包水乳液;步骤s3,中级乳化,即将第一水相加入油包水乳液中,形成水包油包水复乳;步骤s4,去除所述有机溶剂;以及步骤s5,置换复乳外水相,即将所述水包油包水复乳中的外水相置换成第二水相,获得所述多囊脂质体。具体的,本实施例2的制备工艺可以通过相应的配液系统完成。关于配液系统的具体结构及实施过程参见实施例1的相关论述,此处不再赘述。作为制备无菌原辅料溶液的一种可选的实施方式。见图1和图2,所述步骤s1中制备无菌原辅料溶液的方法包括:步骤s11,将如前所述的原辅料与乙醇在一号副配液罐21中混合,搅拌至完全溶解;步骤s12,通过一号无菌过滤器211进入主配液罐1中;步骤s13,通过加热装置加热主配液罐1内的滤液;步骤s14,通过抽气装置3保持主配液罐1的真空度,直至乙醇挥发并抽走;以及步骤s15,向主配液罐1内加入注射用水,并搅拌均匀,形成所述无菌原辅料溶液。可选的,所述乙醇选用无水乙醇。可选的,所述滤液的加热温度为20-80℃,可选为30℃、45℃、60℃,其环境真空度(主配液罐的真空度)为20-220mbar,可选为50mbar、80mbar、120mbar、160mbar。由于乙醇的沸点与环境真空度呈反比。当真空压力为0.0737mpa(737mba)时,无水乙醇的沸点为39℃,因此环境真空度在220mbar以下时,无水乙醇的沸点更低,为了节省热能,又保证乙醇可以达到沸点,以完全挥发,可以将滤液加热至39℃。本实施方式的无菌原辅料溶液通过将原辅料与乙醇混合溶解,并通过一号无菌过滤器输送至主配液罐,保证原辅料混合均匀形成无菌原辅料溶液,有可以通过加热抽真空的方式除去乙醇,降低无菌原辅料溶液中的杂质含量,提高产物(多囊脂质体)的纯度。进一步,见图1和图2,步骤s2中初级乳化的具体过程如下:将有机溶剂加入一号副配液罐21中,并通过一号无菌过滤器211进入主配液罐11中,以与步骤s1中制备的无菌原辅料溶液混合,形成所述油包水乳液。可选的,所述有机溶剂包括:二氯甲烷、三氯甲烷中的至少一种。进一步,见图1和图2,步骤s3中中级乳化的具体过程如下:向二号副配液罐22中加入如前所述的第一水相,并通过二号无菌过滤器221进入主配液罐1中,以与步骤s2中制备的油包水乳液混合,形成所述水包油包水复乳。进一步,见图1和图2,步骤s4中去除所述有机溶剂的具体过程如下:可以通过加热抽真空的方式保持步骤s3中制备的水包油包水复乳温度为0-80℃,其环境真空度(主配液罐的真空度)为20-220mbar,直至抽气装置抽走所述有机溶剂。进一步,见图1和图2,步骤s5中置换复乳外水相的具体过程如下:在三号副配液罐23中加入如前所述的第二水相,并通过三号无菌过滤器231进入主配液罐1中,以通过切向流装置5将水包油包水复乳(在步骤s4中去除有机溶剂)中的外水相置换成0.9%氯化钠溶液。实施例3在实施例2的基础上,本实施例3提供了一种多囊脂质体,所述多囊脂质体适于通过如前所述的制备工艺合成。关于多囊脂质体的组分含量及具体制备工艺参见实施例2的相关论述,此处不再赘述。此外,本多囊脂质体及其制备工艺、配液系统相较于现有技术方案,还具有以下优点:第一点,现有技术方案中的活性物质均为磷酸布比卡因,而本申请的技术方案中活性物质采用盐酸布比卡因,其中磷酸布比卡因通过盐酸布比卡因碱化再加磷酸制备。由于二者在乙醇中的溶解度不同,会进而影响产物的配制效果;盐酸布比卡因更容易溶解在乙醇中,其浓度可达300mg/ml以上,而现有的多囊脂质体一般采用磷酸布比卡因制备,受限于制备工艺,很难在工业化生产过程中突破盐酸布比卡因在水中的溶解度(一般在40-60mg/ml),从而导致制备的磷酸布比卡因多囊脂质体浓度过低,因此在切向流过滤置换外水相之后还需要使用切向流过滤浓缩药液,而本发明的盐酸布比卡因及其制备工艺只需要用切向流过滤置换外水相。第二点,现有技术方案中的均使用气液平衡原理去除有机溶剂,即使用大量氮气或者空气与液体充分长时间混合来去除易挥发的有机溶剂,而多囊脂质体相对比较柔软,在大量气体冲击的环境下容易破碎,造成产物的得率较低。而本申请的技术方案中使用加热抽真空(减压加热)的方式使有机溶剂主动挥发并抽走,不会对多囊脂质体产生气体冲击,也不需要在气体方面控制无菌,降低了无菌工艺的控制难度;同时可以加热至有机溶剂的沸点,以提高有机溶剂的挥发速度和挥发量,也提高了产品得率,如表1所示。第三点,本申请的技术方案中使用乙醇溶解原原辅料,解决了api(活性药物成分或原料药)溶解度低的问题,缩短了制备工艺的运行时间,相较于现有技术方案中的制备工艺,运行时间可减少30%-40%,如表1所示。第四点,本申请的技术方案中在初级乳化时api的浓度提高了5倍,这意味着保持产量不变的情况下,配液罐的体积可缩小至原有体积的1/5,节约了设备成本。表1各技术方案中的配液效果对比表技术方案对比例1对比例2对比例3实施例1单批次时间6小时5小时5小时3.5小时产物得率70%±10%80%±5%70%±10%95%±5%药物包封率90%±3%93%±3%92%±3%93%±3%综上所述,本多囊脂质体及其制备工艺、配液系统通过并联在主配液罐上的若干副配液罐,以分别完成无菌原辅料溶液、有机溶剂、第一水相、第二水相的配制、无菌控制,最后在主配液罐中使无菌原辅料溶液依次各种处理过程,如加热抽真空的方式除去乙醇、有机溶剂的一次乳化、第一水相的二次乳化、加热抽真空的方式除去有机溶剂、第二水相的置换复乳外水相等,最终得到产物多囊脂质体。在各种处理过程中,既可以满足各种原料的添加、无菌控制,又可以保持主配液罐的密封和无菌环境,降低了无菌工艺的控制难度,提高了配液过程中的无菌环境,从而保证了产品的配液效果。因此,相较于现有制备系统的成本高、无菌保障难、工艺复杂、产物得率低等缺点,本多囊脂质体及其制备工艺、配液系统具有设备结构简单、工艺流程少、液体无菌控制点数量少、无菌控制容易、产物得率高、生产效率高等优点,适于工业化生产。实施例4(1)制备无菌原辅料溶液。将depc、dppg、胆固醇、三辛酸甘油酯、盐酸布比卡因、磷酸按固定比例投入一号副配液罐中,并加入无水乙醇,搅拌至完全溶解,形成浓度为depc165g/l、dppg18g/l、胆固醇93g/l、三辛酸甘油酯39g/l、盐酸布比卡因300g/l、磷酸48g/l的溶液并投入一号副配液罐中;通过一号无菌过滤器输送至主配液罐中;通过加热装置加热至20℃,并打开抽气装置使主配液罐内的气压保持在120mbar,直至乙醇完全蒸发;最后注入注射用水至主配液罐内,并保持主配液罐内的温度为0-80℃,搅拌均匀。(2)一次乳化。将二氯甲烷加入一号副配液罐,并通过一号无菌过滤器进入主配液罐,高速搅拌形成油包水乳液。(3)制备第一水相。将赖氨酸、葡萄糖按比例投入二号副配液罐,并加入适量注射用水(注射用水与二氯甲烷的体积比为4:1),搅拌至完全溶解,形成浓度为赖氨酸29g/l、葡萄糖50g/l的第一水相。(4)二次乳化:将二号副配液罐中的第一水相通过二号无菌过滤器加入进主配液罐(温度为0-80℃),搅拌制备成水包油包水复乳。(5)去除有机溶剂。主配液罐(保持中级乳化时的温度0-80℃),打开6抽气装置使主配液罐保持20-220mbar压力,直至去除二氯甲烷。(6)配置第二水相。在三号副配液罐中加入氯化钠和注射用水,配置成0.9%氯化钠溶液。(7)置换复乳外水相。三号副配液罐中的0.9%氯化钠溶液通过三号无菌过滤器进入主配液罐中;使用切向流装置将主配液罐中水包油包水复乳的外水相置换成0.9%氯化钠溶液,得到最终产品。实施例5(1)制备无菌原辅料溶液。将depc、dppg、胆固醇、三辛酸甘油酯、盐酸布比卡因、磷酸按固定比例投入一号副配液罐中,并加入无水乙醇,搅拌至完全溶解,形成浓度为depc156.7g/l、dppg17.1g/l、胆固醇88.3g/l、三辛酸甘油酯37g/l、盐酸布比卡因285g/l、磷酸45.6g/l的溶液并投入一号副配液罐中;通过一号无菌过滤器输送至主配液罐中;通过加热装置加热至45℃,并打开抽气装置使主配液罐内的气压保持在20mbar,直至乙醇完全蒸发;最后注入注射用水至主配液罐内,并保持主配液罐内的温度为0-80℃,搅拌均匀。(2)一次乳化。将三氯甲烷加入一号副配液罐,并通过一号无菌过滤器进入主配液罐,高速搅拌形成油包水乳液。(3)制备第一水相。将赖氨酸、葡萄糖按比例投入二号副配液罐,并加入适量注射用水(注射用水与三氯甲烷的体积比为4:1),搅拌至完全溶解,形成浓度为赖氨酸7g/l、葡萄糖10g/l的第一水相。(4)二次乳化:将二号副配液罐中的第一水相通过二号无菌过滤器加入进主配液罐(温度为0-80℃),搅拌制备成水包油包水复乳。(5)去除有机溶剂。主配液罐(保持中级乳化时的温度0-80℃),打开6抽气装置使主配液罐保持20-220mbar压力,直至去除三氯甲烷。(6)配置第二水相。在三号副配液罐中加入氯化钠和注射用水,配置成0.9%氯化钠溶液。(7)置换复乳外水相。三号副配液罐中的0.9%氯化钠溶液通过三号无菌过滤器进入主配液罐中;使用切向流装置将主配液罐中水包油包水复乳的外水相置换成0.9%氯化钠溶液,得到最终产品。实施例6(1)制备无菌原辅料溶液。将depc、dppg、胆固醇、三辛酸甘油酯、盐酸布比卡因、磷酸按固定比例投入一号副配液罐中,并加入无水乙醇,搅拌至完全溶解,形成浓度为depc173.3g/l、dppg18.9g/l、胆固醇97.7g/l、三辛酸甘油酯41g/l、盐酸布比卡因315g/l、磷酸50.4g/l的溶液并投入一号副配液罐中;通过一号无菌过滤器输送至主配液罐中;通过加热装置加热至80℃,并打开抽气装置使主配液罐内的气压保持在220mbar,直至乙醇完全蒸发;最后注入注射用水至主配液罐内,并保持主配液罐内的温度为0-80℃,搅拌均匀。(2)一次乳化。将三氯甲烷加入一号副配液罐,并通过一号无菌过滤器进入主配液罐,高速搅拌形成油包水乳液。(3)制备第一水相。将赖氨酸、葡萄糖按比例投入二号副配液罐,并加入适量注射用水(注射用水与三氯甲烷的体积比为4:1),搅拌至完全溶解,形成浓度为赖氨酸75g/l、葡萄糖100g/l的第一水相。(4)二次乳化:将二号副配液罐中的第一水相通过二号无菌过滤器加入进主配液罐(温度为0-80℃),搅拌制备成水包油包水复乳。(5)去除有机溶剂。主配液罐(保持中级乳化时的温度0-80℃),打开6抽气装置使主配液罐保持20-220mbar压力,直至去除三氯甲烷。(6)配置第二水相。在三号副配液罐中加入氯化钠和注射用水,配置成0.9%氯化钠溶液。(7)置换复乳外水相。三号副配液罐中的0.9%氯化钠溶液通过三号无菌过滤器进入主配液罐中;使用切向流装置将主配液罐中水包油包水复乳的外水相置换成0.9%氯化钠溶液,得到最终产品。实施例7(1)制备无菌原辅料溶液。将depc、dppg、胆固醇、三辛酸甘油酯、盐酸布比卡因、磷酸按固定比例投入一号副配液罐中,并加入无水乙醇,搅拌至完全溶解,形成浓度为depc160g/l、dppg17.5g/l、胆固醇90g/l、三辛酸甘油酯38g/l、盐酸布比卡因295g/l、磷酸47g/l的溶液并投入一号副配液罐中;通过一号无菌过滤器输送至主配液罐中;通过加热装置加热至39℃,并打开抽气装置使主配液罐内的气压保持在80mbar,直至乙醇完全蒸发;最后注入注射用水至主配液罐内,并保持主配液罐内的温度为0-80℃,搅拌均匀。(2)一次乳化。将二氯甲烷加入一号副配液罐,并通过一号无菌过滤器进入主配液罐,高速搅拌形成油包水乳液。(3)制备第一水相。将赖氨酸、葡萄糖按比例投入二号副配液罐,并加入适量注射用水(注射用水与二氯甲烷的体积比为4:1),搅拌至完全溶解,形成浓度为赖氨酸15g/l、葡萄糖25g/l的第一水相。(4)二次乳化:将二号副配液罐中的第一水相通过二号无菌过滤器加入进主配液罐(温度为0-80℃),搅拌制备成水包油包水复乳。(5)去除有机溶剂。主配液罐(保持中级乳化时的温度0-80℃),打开6抽气装置使主配液罐保持20-220mbar压力,直至去除二氯甲烷。(6)配置第二水相。在三号副配液罐中加入氯化钠和注射用水,配置成0.9%氯化钠溶液。(7)置换复乳外水相。三号副配液罐中的0.9%氯化钠溶液通过三号无菌过滤器进入主配液罐中;使用切向流装置将主配液罐中水包油包水复乳的外水相置换成0.9%氯化钠溶液,得到最终产品。实施例8(1)制备无菌原辅料溶液。将depc、dppg、胆固醇、三辛酸甘油酯、盐酸布比卡因、磷酸按固定比例投入一号副配液罐中,并加入无水乙醇,搅拌至完全溶解,形成浓度为depc170g/l、dppg18.4g/l、胆固醇95g/l、三辛酸甘油酯40g/l、盐酸布比卡因310g/l、磷酸49g/l的溶液并投入一号副配液罐中;通过一号无菌过滤器输送至主配液罐中;通过加热装置加热至45℃,并打开抽气装置使主配液罐内的气压保持在50mbar,直至乙醇完全蒸发;最后注入注射用水至主配液罐内,并保持主配液罐内的温度为0-80℃,搅拌均匀。(2)一次乳化。将有机溶剂(二氯甲烷和三氯甲烷)加入一号副配液罐,并通过一号无菌过滤器进入主配液罐,高速搅拌形成油包水乳液。(3)制备第一水相。将赖氨酸、葡萄糖按比例投入二号副配液罐,并加入适量注射用水(注射用水与二氯甲烷的体积比为4:1),搅拌至完全溶解,形成浓度为赖氨酸45g/l、葡萄糖75g/l的第一水相。(4)二次乳化:将二号副配液罐中的第一水相通过二号无菌过滤器加入进主配液罐(温度为0-80℃),搅拌制备成水包油包水复乳。(5)去除有机溶剂。主配液罐(保持中级乳化时的温度0-80℃),打开6抽气装置使主配液罐保持20-220mbar压力,直至去除二氯甲烷和三氯甲烷。(6)配置第二水相。在三号副配液罐中加入氯化钠和注射用水,配置成0.9%氯化钠溶液。(7)置换复乳外水相。三号副配液罐中的0.9%氯化钠溶液通过三号无菌过滤器进入主配液罐中;使用切向流装置将主配液罐中水包油包水复乳的外水相置换成0.9%氯化钠溶液,得到最终产品。以上述依据本发明的理想实施例为启示,通过上述的说明内容,相关工作人员完全可以在不偏离本项发明技术思想的范围内,进行多样的变更以及修改。本项发明的技术性范围并不局限于说明书上的内容,必须要根据权利要求范围来确定其技术性范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1