一种骨再生材料的制备方法与流程
本发明涉及生物医学工程领域,具体涉及一种骨再生材料的制备方法。
背景技术:
血小板源生长因子(pdgf)和骨形成蛋白2(bmp-2)是最重要的两种骨生长因子。作为自然伤口愈合反应的一部分,pdgf是骨损伤(例如骨折)后第一个立即释放的因子。在pdgf出现后,其他因子,包括bmp-2,通过招募产骨细胞并形成一种支撑结构(包括血管),帮助形成骨再生所需的合适环境。现有技术中,无法以一种受控的方式有效传递这些生长因子,因此用它们治疗骨损伤的研究已经受到阻碍。当非常大数量的生长因子传递太快时,它们就被从治疗部位迅速清除,因此它们对组织修复的作用减小,也可能引起有害的副作用。所以,理想的生长因子需要在数天或数周时间内,被缓慢地释放或者在病灶处持续作用。
技术实现要素:
有鉴于此,本发明的目的在于提供一种骨再生材料的制备方法,本发明制备的骨再生材料可以缓慢地释放血小板源生长因子(pdgf)和骨形成蛋白2(bmp-2)等骨生长因子,具有更好地骨生长修复效果。
为解决上述技术问题,本发明提供了一种骨再生材料的制备方法,包括如下步骤:
s1:将壳聚糖和聚氧化乙烯完全溶解于乙酸溶液,搅拌均匀,得到纺丝液;
s2:采用所述纺丝液进行静电纺丝,得到壳聚糖/聚氧化乙烯纳米纤维;
s3:将所述壳聚糖/聚氧化乙烯纳米纤维用dmem培养基洗涤至中性,烘干之后经等离子处理体处理活化得到活化纳米纤维;
s4:将所述活化纳米纤维以1:100~300的浴比浸泡在含有重组骨生长因子和表没食子儿茶素没食子酸酯/类胡萝卜素脂质体的dmem培养基中以真空度为0.100~0.024mbar进行负压闪爆,然后进行接枝反应,得接枝纳米纤维,其中,所述表没食子儿茶素没食子酸酯/类胡萝卜素脂质体包括亲水内核层和外部磷脂双分子层,所述亲水内核层载有表没食子儿茶素没食子酸酯,所述外部磷脂双分子层载有类胡萝卜素;
s5:将所述接枝纳米纤维离心、冻干,得骨再生材料。
优选的,步骤s1中,所述壳聚糖的粘均分子量为5.0×105,脱乙酰度为80~85%;所述聚氧化乙烯的平均分子量为1.0×106;所述乙酸溶液的浓度为90v/v%。
优选的,所述纺丝液中壳聚糖和聚氧化乙烯的总浓度为10~30g/l,其中,壳聚糖与聚氧化乙烯的质量比为1:1~4。
优选的,步骤s3中,所述烘干的温度为37~45℃,烘干时间为2~4h。
优选的,步骤s3中,所述等离子体处理的条件为:气体采用氮气或氧气,处理功率为250~300w,压强50~60pa,处理时间为10~15min。
优选的,步骤s4中所述类胡萝卜素为虾青素、番茄红素中的一种。
优选的,步骤s4中,所述重组骨生长因子包括血小板源生长因子和骨形成蛋白2,所述含有重组骨生长因子和表没食子儿茶素没食子酸酯/类胡萝卜素脂质体的dmem培养基中血小板源生长因子的浓度为40~80mg/l,骨形成蛋白2的浓度为20~40mg/l。
优选的,步骤s4中,所述含有重组骨生长因子和表没食子儿茶素没食子酸酯/类胡萝卜素脂质体的dmem培养基中表没食子儿茶素没食子酸酯的浓度为50~200mg/l,类胡萝卜素浓度为200~500mg/l。
优选的,步骤s4中,所述接枝反应的反应温度为0~4℃,反应时间为12~24h。
优选的,步骤s5中,所述离心的重力加速度为10000g,时间10min;所述冻干的温度为-30~-20℃,真空度为0.100~0.024mbar,冻干时间为3~5d。
本发明与现有技术相比,具有以下优点和效果:
1)本发明的纳米纤维制备方法利用多项技术,包括静电纺丝技术、低温等离子处理技术、负压闪爆技术等,这些技术的使用大大提高了骨生长因子与纤维的结合率,负载量更大,制得的纳米纤维能够更好地促进成骨细胞生长及骨组织损伤后的再生。
2)利用egcg能促进成骨细胞增殖和骨向分化。将其包载在脂质体中。由于egcg易被氧化,因此在脂质体膜上同时载入类胡萝卜素。类胡萝卜素具有比egcg更强的抗氧化性,因此能够保护脂质体内核中的egcg不被氧化,保持促骨生长活性。因此,本发明的纳米纤维与当前骨损伤的治疗标准相比诱导骨生长的效果更加优异。
附图说明
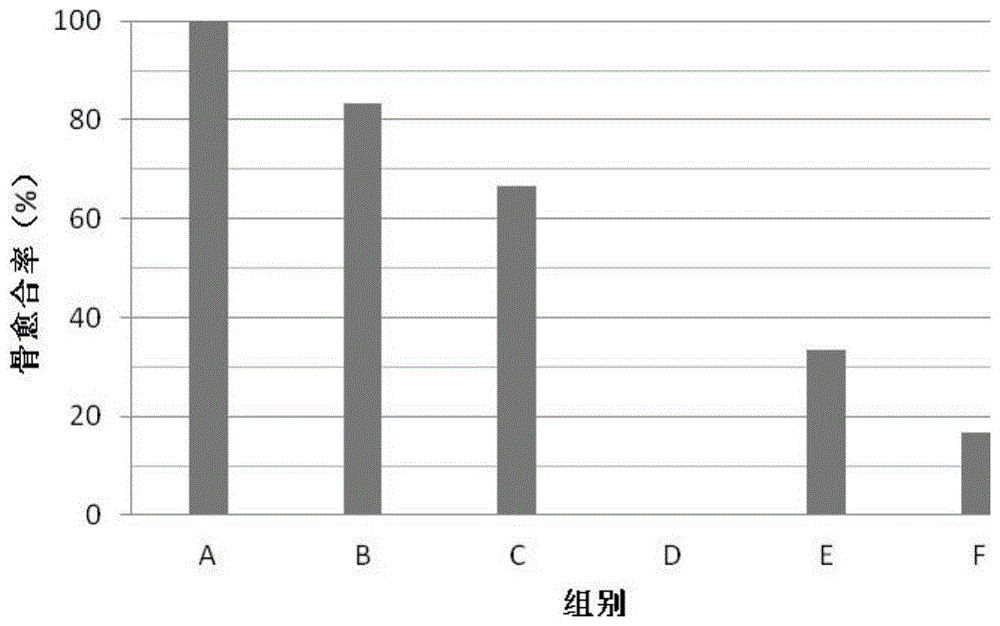
图1是动物实验中实施例与对比例的骨愈合率。
具体实施方式
为了进一步理解本发明,下面结合实施例对本发明优选实施方案进行描述,但是应当理解,这些描述只是为了进一步说明本发明的特征和优点,而不是对本发明权利要求的限制。
本发明所有原料,对其来源没有特别限制,在市场上购买的或按照本领域技术人员熟知的常规方法制备的即可。
本发明提供了一种骨再生材料的制备方法,包括如下步骤:
s1:将壳聚糖和聚氧化乙烯完全溶解于乙酸溶液,搅拌均匀,得到纺丝液;
s2:采用步骤s1制备得到的纺丝液进行静电纺丝,得到壳聚糖/聚氧化乙烯纳米纤维;
s3:将步骤s2制备得到的壳聚糖/聚氧化乙烯纳米纤维用dmem培养基洗涤至中性,烘干之后经等离子处理体处理活化得到活化纳米纤维;
s4:将步骤s3制备得到的活化纳米纤维以1:100~300的浴比浸泡在含有重组骨生长因子和表没食子儿茶素没食子酸酯/类胡萝卜素脂质体的dmem培养基中以真空度为0.100~0.024mbar进行负压闪爆,然后进行接枝反应,得接枝纳米纤维,其中,所述表没食子儿茶素没食子酸酯/类胡萝卜素脂质体包括亲水内核层和外部磷脂双分子层,所述亲水内核层载有表没食子儿茶素没食子酸酯,所述外部磷脂双分子层载有类胡萝卜素;
s5:将步骤s4制备得到的接枝纳米纤维离心、冻干,得骨再生材料。
具体的,本发明首先将壳聚糖和聚氧化乙烯完全溶解于乙酸溶液,搅拌均匀,得到纺丝液;本发明中壳聚糖为市售商品,优选采用粘均分子量为5.0×105、脱乙酰度为80~85%的壳聚糖;本发明中聚氧化乙烯为市售商品,优选采用平均分子量为1.0×106的聚氧化乙烯;乙酸溶液的浓度优选为90v/v%。本发明制备的纺丝液中壳聚糖和聚氧化乙烯的总浓度优选为10~30g/l,其中,壳聚糖与聚氧化乙烯的质量比优选为1:1~4。
纺丝液制备完成后,进行静电纺丝,得到壳聚糖/聚氧化乙烯纳米纤维;本发明中静电纺丝工艺中,注射器规格优选为10ml,针头规格优选为平头,7号针;静电纺丝条件优选为,电压12~20kv,距离7~10cm,进样速率0.3~1.0ml/h,温度25~35℃。
得到壳聚糖/聚氧化乙烯纳米纤维后,用dmem培养基洗涤至中性,优选为洗涤至ph值为7,然后烘干,本发明中烘干的温度优选为37~45℃,烘干时间优选为2~4h。烘干之后经等离子处理体处理活化得到活化纳米纤维;本发明中,等离子体处理的条件优选为:气体采用氮气或氧气,处理功率为250~300w,压强50~60pa,处理时间为10~15min。
得到活化纳米纤维后,将活化纳米纤维以1:100~300的浴比浸泡在含有重组骨生长因子和表没食子儿茶素没食子酸酯/类胡萝卜素脂质体的dmem培养基中以真空度为0.100~0.024mbar进行负压闪爆,然后在温度为0~4℃条件下进行接枝反应,反应时间为12~24h,得接枝纳米纤维。
本发明中,重组骨生长因子包括血小板源生长因子和骨形成蛋白2,其中,血小板源生长因子在含有重组骨生长因子和表没食子儿茶素没食子酸酯/类胡萝卜素脂质体的dmem培养基中的浓度优选为40~80mg/l,骨形成蛋白2的浓度优选为20~40ml/l。
本发明中,含有重组骨生长因子和表没食子儿茶素没食子酸酯/类胡萝卜素脂质体的dmem培养基中表没食子儿茶素没食子酸酯(egcg)浓度优选为50-200mg/l,类胡萝卜素浓度优选为200-500mg/l。
本发明中含有重组骨生长因子和表没食子儿茶素没食子酸酯/类胡萝卜素脂质体的dmem培养基可采用以下方法制备:将卵磷脂、胆固醇和胡萝卜素溶于氯仿,倒入圆底烧瓶中,在室温下旋蒸至容器壁形成一层均一的薄膜,再将溶有50-200mg/legcg、40-80mg/lpdgf和20-40mg/lbmp-2的10mldmem培养基加热至55℃,并倒入上一步的覆有薄膜的圆底烧瓶中,55℃超声水浴15min,然后在室温下静置4h,即得含有重组骨生长因子和表没食子儿茶素没食子酸酯/类胡萝卜素脂质体的dmem培养基。本发明中,卵磷脂、胆固醇和胡萝卜素的质量比优选为100:10:(2~5)。本发明中类胡萝卜素优选选自虾青素、番茄红素中的一种。
最后,将接枝纳米纤维离心、冻干,得骨再生材料。本发明中离心的重力加速度优选为10000g,离心时间优选为10min;冻干的温度优选为-30~-20℃,真空度优选为0.100~0.024mbar,冻干时间优选为3~5d。
为了进一步理解本发明,下面结合实施例对本发明提供的一种骨再生材料的制备方法进行详细说明,本发明的保护范围不受以下实施例的限制。
实施例1
s1、将0.5g壳聚糖(粘均分子量5.0×105,脱乙酰度为80%)和1.5g聚氧化乙烯(平均分子量1.0×106)完全溶解于100ml90%(v/v)乙酸溶液,搅拌均匀,得到纺丝液;
s2、采用纺丝液进行静电纺丝,使用的注射器规格为10ml,针头规格为平头,7号针;静电纺丝条件为,电压15kv,距离8cm,进样速率0.5ml/h,温度30℃得到壳聚糖/聚氧化乙烯纳米纤维;
s3、将壳聚糖/聚氧化乙烯纳米纤维用dmem培养基洗涤至ph为7,37℃烘4h之后经等离子处理器处理活化,等离子体处理的条件为:气体采用氧气,处理功率为280w,压强55pa,处理时间为15min;
s4、用100mg卵磷脂、10mg胆固醇和3mg虾青素溶于10ml氯仿,倒入圆底烧瓶中,在室温下旋蒸至容器壁形成一层均一的薄膜;再将溶有100mg/legcg、80mg/lpdgf和40mg/lbmp-2的10mldmem培养基加热至55℃,并倒入上一步的覆有薄膜的圆底烧瓶中,55℃超声水浴15min,然后在室温下静置4h,即得含有重组骨生长因子和表没食子儿茶素没食子酸酯/类胡萝卜素脂质体的dmem培养基。
s5、将步骤s3得到的纳米纤维浸泡在步骤s4的含有重组骨生长因子和表没食子儿茶素没食子酸酯/类胡萝卜素脂质体的dmem培养基中进行负压闪爆,负压闪爆的真空度为0.024mbar,之后进行接枝反应,接枝反应的浸泡浴比为1:200,浸泡温度为4℃,浸泡时间为24h;
s6、将完成接枝反应的抗菌纳米纤维离心,离心重力加速度为10000g,时间10min,之后冻干,温度为-30℃,真空度为0.024mbar,冻干时间为4d,即得一种等离子体表面接枝骨生长因子的新型骨再生材料。
实施例2
s1、将0.25g壳聚糖(粘均分子量5.0×105,脱乙酰度为80%)和0.75g聚氧化乙烯(平均分子量1.0×106)完全溶解于100ml90%(v/v)乙酸溶液,搅拌均匀,得到纺丝液;
s2、采用纺丝液进行静电纺丝,使用的注射器规格为10ml,针头规格为平头,7号针;静电纺丝条件为,电压12kv,距离7cm,进样速率0.3ml/h,温度25℃得到壳聚糖/聚氧化乙烯纳米纤维;
s3、将壳聚糖/聚氧化乙烯纳米纤维用dmem培养基洗涤至ph为7,45℃烘2h之后经等离子处理器处理活化,等离子体处理的条件为:气体采用氮气,处理功率为250w,压强50pa,处理时间为10min;
s4、用100mg卵磷脂、10mg胆固醇和2mg番茄红素溶于10ml氯仿,倒入圆底烧瓶中,在室温下旋蒸至容器壁形成一层均一的薄膜;再将溶有50mg/legcg、40mg/lpdgf和20mg/lbmp-2的10mldmem培养基加热至55℃,并倒入上一步的覆有薄膜的圆底烧瓶中,55℃超声水浴15min,然后在室温下静置4h,即得含有重组骨生长因子和表没食子儿茶素没食子酸酯/类胡萝卜素脂质体的dmem培养基。
s5、将步骤s3得到的纳米纤维浸泡在步骤s4的含有重组骨生长因子和表没食子儿茶素没食子酸酯/类胡萝卜素脂质体的dmem培养基中进行负压闪爆,负压闪爆的真空度为0.024mbar,之后进行接枝反应,接枝反应的浸泡浴比为1:200,浸泡温度为4℃,浸泡时间为24h;
s6、将完成接枝反应的抗菌纳米纤维离心,离心重力加速度为10000g,时间10min,之后冻干,温度为-30℃,真空度为0.024mbar,冻干时间为4d,即得一种等离子体表面接枝骨生长因子的新型骨再生材料。
实施例3
s1、将0.75g壳聚糖(粘均分子量5.0×105,脱乙酰度为80%)和2.25g聚氧化乙烯(平均分子量1.0×106)完全溶解于100ml90%(v/v)乙酸溶液,搅拌均匀,得到纺丝液;
s2、采用纺丝液进行静电纺丝,使用的注射器规格为10ml,针头规格为平头,7号针;静电纺丝条件为,电压20kv,距离10cm,进样速率1.0ml/h,温度35℃得到壳聚糖/聚氧化乙烯纳米纤维;
s3、将壳聚糖/聚氧化乙烯纳米纤维用dmem培养基洗涤至ph为7,37℃烘4h之后经等离子处理器处理活化,等离子体处理的条件为:气体采用氧气,处理功率为300w,压强60pa,处理时间为15min;
s4、用100mg卵磷脂、10mg胆固醇和5mg虾青素溶于10ml氯仿,倒入圆底烧瓶中,在室温下旋蒸至容器壁形成一层均一的薄膜;再将溶有200mg/legcg、40mg/lpdgf和40mg/lbmp-2的10mldmem培养基加热至55℃,并倒入上一步的覆有薄膜的圆底烧瓶中,55℃超声水浴15min,然后在室温下静置4h,即得含有重组骨生长因子和表没食子儿茶素没食子酸酯/类胡萝卜素脂质体的dmem培养基。
s5、将步骤s3得到的纳米纤维浸泡在步骤s4的含有重组骨生长因子和表没食子儿茶素没食子酸酯/类胡萝卜素脂质体的dmem培养基中进行负压闪爆,负压闪爆的真空度为0.024mbar,之后进行接枝反应,接枝反应的浸泡浴比为1:200,浸泡温度为4℃,浸泡时间为24h;
s6、将完成接枝反应的抗菌纳米纤维离心,离心重力加速度为10000g,时间10min,之后冻干,温度为-30℃,真空度为0.024mbar,冻干时间为4d,即得一种等离子体表面接枝骨生长因子的新型骨再生材料。
对比例1
s1、将0.5g壳聚糖(粘均分子量5.0×105,脱乙酰度为80%)和1.5g聚氧化乙烯(平均分子量1.0×106)完全溶解于100ml90%(v/v)乙酸溶液,搅拌均匀,得到纺丝液;
s2、采用纺丝液进行静电纺丝,使用的注射器规格为10ml,针头规格为平头,7号针;静电纺丝条件为,电压15kv,距离8cm,进样速率0.5ml/h,温度30℃得到壳聚糖/聚氧化乙烯纳米纤维;
s3、将壳聚糖/聚氧化乙烯纳米纤维用dmem培养基洗涤至ph为7,37℃烘4h之后经等离子处理器处理活化,等离子体处理的条件为:气体采用氧气,处理功率为280w,压强55pa,处理时间为15min;
s4、将步骤s3得到的纳米纤维浸泡在dmem培养基中进行负压闪爆,负压闪爆的真空度为0.024mbar,之后进行接枝反应,接枝反应的浸泡浴比为1:200,浸泡温度为4℃,浸泡时间为24h;
s5、将完成接枝反应的抗菌纳米纤维离心,离心重力加速度为10000g,时间10min,之后冻干,温度为-30℃,真空度为0.024mbar,冻干时间为4d,即得一种等离子体处理的纳米纤维。
对比例2
s1、将0.5g壳聚糖(粘均分子量5.0×105,脱乙酰度为80%)和1.5g聚氧化乙烯(平均分子量1.0×106)完全溶解于100ml90%(v/v)乙酸溶液,搅拌均匀,得到纺丝液;
s2、采用纺丝液进行静电纺丝,使用的注射器规格为10ml,针头规格为平头,7号针;静电纺丝条件为,电压15kv,距离8cm,进样速率0.5ml/h,温度30℃得到壳聚糖/聚氧化乙烯纳米纤维;
s3、将壳聚糖/聚氧化乙烯纳米纤维用dmem培养基洗涤至ph为7,37℃烘4h之后经等离子处理器处理活化,等离子体处理的条件为:气体采用氧气,处理功率为280w,压强55pa,处理时间为15min;
s4、用100mg卵磷脂、10mg胆固醇和3mg番茄红素溶于10ml氯仿,倒入圆底烧瓶中,在室温下旋蒸至容器壁形成一层均一的薄膜;再将溶有100mg/legcg、80mg/lpdgf和40mg/lbmp-2的10mldmem培养基加热至55℃,并倒入上一步的覆有薄膜的圆底烧瓶中,55℃超声水浴15min,然后在室温下静置4h,即得含有重组骨生长因子和表没食子儿茶素没食子酸酯/类胡萝卜素脂质体的dmem培养基。
s5、将步骤s3得到的纳米纤维浸泡在步骤s4的含有重组骨生长因子和表没食子儿茶素没食子酸酯/类胡萝卜素脂质体的dmem培养基中,之后进行接枝反应,接枝反应的浸泡浴比为1:200,浸泡温度为4℃,浸泡时间为24h;
s5、将完成接枝反应的抗菌纳米纤维离心,离心重力加速度为10000g,时间10min,之后冻干,温度为-30℃,真空度为0.024mbar,冻干时间为4d,即得一种等离子体表面接枝骨生长因子的纳米纤维。
对比例3
s1、将0.5g壳聚糖(粘均分子量5.0×105,脱乙酰度为80%)和1.5g聚氧化乙烯(平均分子量1.0×106)完全溶解于100ml90%(v/v)乙酸溶液,搅拌均匀,得到纺丝液;
s2、采用纺丝液进行静电纺丝,使用的注射器规格为10ml,针头规格为平头,7号针;静电纺丝条件为,电压15kv,距离8cm,进样速率0.5ml/h,温度30℃得到壳聚糖/聚氧化乙烯纳米纤维;
s3、将壳聚糖/聚氧化乙烯纳米纤维用dmem培养基洗涤至ph为7,37℃烘4h;
s4、用100mg卵磷脂、10mg胆固醇和3mg虾青素溶于10ml氯仿,倒入圆底烧瓶中,在室温下旋蒸至容器壁形成一层均一的薄膜;再将溶有100mg/legcg、80mg/lpdg和40mg/lbmp-2的10mldmem培养基加热至55℃,并倒入上一步的覆有薄膜的圆底烧瓶中,55℃超声水浴15min,然后在室温下静置4h,即得含有重组骨生长因子和表没食子儿茶素没食子酸酯/类胡萝卜素脂质体的dmem培养基。
s5、将步骤s3得到的纳米纤维浸泡在步骤s4的含有重组骨生长因子和表没食子儿茶素没食子酸酯/类胡萝卜素脂质体的dmem培养基中进行负压闪爆,负压闪爆的真空度为0.024mbar,之后进行接枝反应,接枝反应的浸泡浴比为1:200,浸泡温度为4℃,浸泡时间为24h;
s6、将完成接枝反应的抗菌纳米纤维离心,离心重力加速度为10000g,时间10min,之后冻干,温度为-30℃,真空度为0.024mbar,冻干时间为4d,即得一种表面接枝骨生长因子的纳米纤维。
动物实验:
将大鼠股骨截断3mm,用实施例及对比例制备的骨再生材料进行接续处理,外部固定处理,每组随机选取6只大鼠。常规饲养3天后,用x线照片检查骨愈合率,检测结果如图1所示,a~f分别对应实施例1~3以及对比例1~3制备的骨再生材料在动物实验中的骨愈合率。根据图1可知,实施例1~3的骨愈合率明显高于对比例1~3,表明本发明提供的制备方法制备的骨再生材料能够显著促进新骨的生长以及骨愈合。
以上显示和描述了本发明的基本原理和主要特征和本发明的优点,对于本领域技术人员而言,显然本发明不限于上述示范性实施例的细节,而且在不背离本发明的精神或基本特征的情况下,能够以其他的具体形式实现本发明。因此,无论从哪一点来看,均应将实施例看作是示范性的,而且是非限制性的,本发明的范围由所附权利要求而不是上述说明限定,因此旨在将落在权利要求的等同要件的含义和范围内的所有变化囊括在本发明内。尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。
- 还没有人留言评论。精彩留言会获得点赞!