矢车菊素-3-O-葡萄糖苷在制备治疗/或预防镉引发的精子质量下降的药物中的应用的制作方法
本发明涉及生物医药技术领域,更具体地,涉及矢车菊素-3-o-葡萄糖苷在制备治疗/或预防镉引发的精子质量下降的药物中的应用。
背景技术:
流行病学研究表明男性精子数量和浓度在近40年间下降了50%,不育率高达15%。其中,来自环境污染物的暴露是男性不育率持续攀升的重要原因之一。镉(cadmium,cd)作为一种可通过食物、水及空气等多种途径进入体内并蓄积的重金属环境污染物,能通过氧化损伤等多种途径造成精子质量下降。青春期雄性生殖系统正处于发育阶段,与性成熟阶段相比,其对cd造成的损伤更为敏感。矢车菊素-3-o-葡萄糖苷(cyanidin-3-o-glucoside,c3g)作为广泛分布于植物水果中的水溶性花色苷,具有很强的抗氧化活性,且对镉离子具有螯合作用,是潜在的拮抗镉毒性的功能因子。目前研究中没有报道关于c3g对cd诱导青春期精子质量下降的改善作用,对于其保护机理也尚不清除。
技术实现要素:
本发明的目的是为了克服现有技术的不足,提供一种矢车菊素-3-o-葡萄糖苷在制备治疗/或预防镉引发的精子质量下降的药物中的应用。
本发明的第一个目的是提供矢车菊素-3-o-葡萄糖在制备治疗/或预防cd引发的精子质量下降的药物中的应用。
本发明的第二个目的是提供矢车菊素-3-o-葡萄糖在制备治疗/或预防cd引发的精子数量和/或活力及运动能力下降的药物中的应用。
为了实现上述目的,本发明是通过以下技术方案予以实现的:
本发明采用动物实验,采用一定剂量的矢车菊素-3-o-葡萄糖苷对cd暴露引起的青春期小鼠精子质量下降的调控作用进行了研究,本发明发现,与cd损伤组相比,摄入c3g显著提高了精子数量,改善精子活力及活率,有效地提高了精子质量。青春期口服cd暴露可通过组蛋白表观遗传异常修饰,进而导致组蛋白-鱼精蛋白替换阻滞,使得精子发生阻滞在精子变形期。而c3g干预可维持正常组蛋白修饰,有效缓解组蛋白-鱼精蛋白阻滞,使得精子变形过程顺利进行。此外,青春期cd暴露造成的精子变形失败使得精子核容易受到cd诱导的氧化应激所介导的dna损伤,进而导致精细胞凋亡。
因此本发明要求保护以下内容:
矢车菊素-3-o-葡萄糖在制备治疗/或预防cd引发的精子质量下降的药物中的应用。
优选地,所述精子质量下降表现为精子数量、活率、活力及运动能力下降。
所述精子数量通过精子密度表示。
所述运动能力包括精子直线运动速率(straight-linevelocity,vsl)、平均路径速率(averagepathvelocity,vap)、精子头侧摆幅度(amplitudeoflateralheaddisplacement,vlh)、曲线速率(curvilinearvelocity,vcl)、鞭打频率(beat-crossfrequency,bcf)及平均角位移。
优选地,所述精子质量下降是由于精子发生过程阻滞引起。
更优选地,所述精子发生过程阻滞为发生在精子变形期。
更优选地,所述精子发生过程阻滞是由于cd暴露诱导的精子变形期的精子核组蛋白-鱼精蛋白替换失败引起。
更有选地,所述cd暴露发生在青春期。
更优选地,所述精子质量下降是由于精子变形失败后,cd氧化应激作用导致精子凋亡。
更优选地,所述精子凋亡是通过dna损伤、mapk信号通路和线粒体凋亡信号通路转导。
本发明还要求保护矢车菊素-3-o-葡萄糖在制备治疗/或预防cd引发的精子数量和/或活力及运动能力下降的药物中的应用。优选地,人体使用剂量0.15mg/kg.bw~10mg/kg.bw。
此用量是根据小鼠摄食1kg小鼠饲料中c3g的含量为150~1000mg/kg的量和小鼠-人体的剂量效应换算
与现有技术相比,本发明具有如下有益效果:
本发明发现,矢车菊素-3-o-葡萄糖苷(cyanidin-3-o-glucoside,c3g)可改善青春期cd暴露造成的精子质量下降。c3g干预可通过组蛋白修饰缓解精子变形期的组蛋白-鱼精蛋白替换过程、改善睾丸抗氧化系统使得精子免受cd氧化应激诱导的细胞凋亡,使得精子发生过程维持正常,保证精子的正常生成。
附图说明
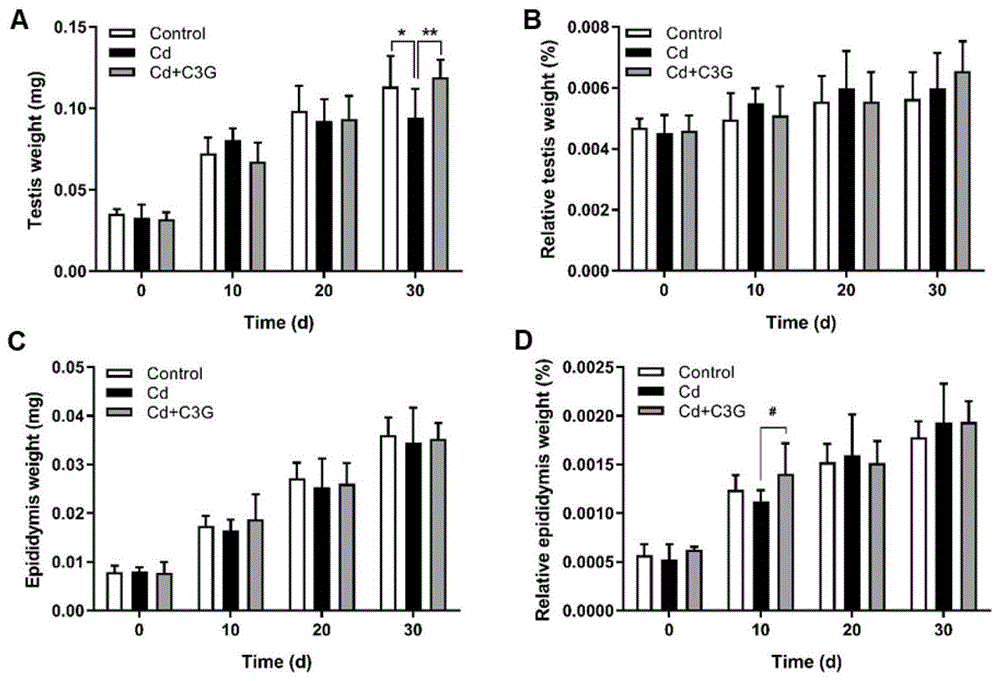
图1为睾丸和附睾的重量及系数变化;a为睾丸重量变化;b为睾丸重量系数变化;c为附睾重量变化;d为附睾重量系数变化。
图2为小鼠肛殖距变化。
图3为睾丸及附睾组织切片h&e染色观察(200×);a为睾丸h&e染色图片;b为附睾头h&e染色图片;c为附睾尾h&e染色图片。
图4为小鼠睾丸管腔johnsen’s评分。
图5为精子形态畸形率及密度;a为精子照片;b为精子数量变化;c为精子畸形率变化。
图6为精子活力及活率;a为精子活力变化;b为精子活率变化。
图7为精子运动参数;a为直线运动速率vsl的变化;b为平均路径速率vap的变化;c为精子头侧摆幅度vlh的变化;d为曲线速率vcl的变化;e为鞭打频率bcf的变化;f为平均角位移mad的变化;g为精子的线性度lin的变化;h为前向性str的变化。
图8为睾丸生精上皮分期pas染色。
图9为不同精子变形阶段晚期精子和支持细胞比例。
图10为组蛋白h2a和h2b在睾丸中的蛋白表达水平;a为h2a和h2b的免疫组化染色;b为h2a和h2b的电泳图;c为h2a和h2b表达量的变化。
图11为过渡蛋白和鱼精蛋白在睾丸中的mrna表达水平;a为tnp1的mrna表达水平;b为tnp2的mrna表达水平;c为prm1的mrna表达水平;d为prm2的mrna表达。
图12为泛素化组蛋白ub-h2a和ub-h2b在睾丸中的蛋白表达水平。
图13为组蛋白h2a和h2b的相关泛素连接酶和结合酶在睾丸中的mrna表达水平;a为组蛋白h2a相关泛素酶的mrna水平;b为组蛋白h2b相关泛素酶的mrna水平。
图14为睾丸组织hdac,hat含量;a为hdac的含量;b为hat含量。
图15为睾丸组织组蛋白h4及不同位点乙酰化组蛋白h4的表达。
图16为睾丸组织组蛋白h3k9me1及h3k9me2的蛋白水平表达;a为h3k9me1和h3k9me2的免疫荧光表达;b为h3k9me1和h3k9m2的电泳图;c为h3k9me1的表达变化;d为h3k9me2的表达变化。
图17为睾丸组织g9a的蛋白水平表达。
图18为睾丸组织mda水平。
图19为睾丸组织gsh和gssg水平;a为gsh的含量变化;b为gssg的含量变化;c为gsh和gssg的比例变化。
图20为睾丸组织sod活力。
图21为8-ohdg在圆形精子中的表达。
图22为睾丸中细胞凋亡tunel染色。
图23为睾丸中erk蛋白的表达;a为erk和p-erk的电泳图;b为erk含量的变化;c为p-erk的含量变化;d为p-erk和erk的比例变化。
图24为睾丸中jnk蛋白的表达;a为jnk和p-jnk的电泳图;b为jnk含量的变化;c为p-jnk的含量变化;d为p-jnk和jnk的比例变化。
图25为睾丸中p38蛋白的表达;a为p38和p-p38的电泳图;b为p38含量的变化;c为p-p38的含量变化;d为p-p38和p38的比例变化。
图26为睾丸中p53蛋白的表达;a为p53和p-p53的电泳图;b为p53含量的变化;c为p-p53的含量变化;d为p-p53和p53的比例变化。
图27为睾丸中bcl-2家族蛋白的表达;a为bax、bcl-2及bad的电泳图;b为bax的含量变化;c为bcl-2的含量变化;d为bad的含量变化。
图28为睾丸中cleaved-caspase3和cleaved-parp蛋白的表达;a为cleaved-caspase3和totalcaspase3的电泳图;为cleaved-caspase3和totalcaspase3的比例变化;c为cleaved-parp和fullparp的电泳图;d为cleaved-parp和fullparp的比例变化。
具体实施方式
下面结合说明书附图和具体实施例对本发明作出进一步地详细阐述,所述实施例只用于解释本发明,并非用于限定本发明的范围。下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
一、实验材料
1、实验动物
昆明雄性小鼠,3周龄96只,购于广东省实验动物中心。实验动物在暨南大学动物房饲养,光照昼夜12小时交替。温度保持在22-26℃,相对湿度为60%-80%,自由摄食。
2、动物饲料
动物饲料基础配方为普通ain93-g饲料配方,cd+c3g组额外添加500mg/kg.dietc3g。饲料委托江苏美迪森生物医药有限公司制作,置于-20℃保存。
3、引物使用信息
表1pcr引物信息:
所有引物均委托上海生工生物工程有限公司合成。
二、实验方法
1、附睾尾精子参数测定
将左侧附睾尾剪碎迅速置于1.0ml预热后的dmem培养基中,37℃释放30min,充分混合后取10.0μl精子混悬液加入精子计数板中,利用计算机辅助精液分析系统进行精子连续帧动态拍照和单帧静态拍照,用于测定精子活力、运动相关参数、精子数量、畸形率测定及形态分析。
2、苏木素-伊红染色
取睾丸及附睾石蜡包埋蜡块按5μm厚度切片,置于烘箱70℃烤片2h。梯度脱蜡至水,苏木素染色35s,伊红染色3s,然后脱水透明。采用中性树胶和新鲜二甲苯以4:1混合后封片,自然晾干。镜检,拍照。
3、睾丸生精上皮johnsen’s评分
参照标准对睾丸管腔生精上皮进行johnsen’s评分,每只老鼠分析不少于50个生精小管。
4、过碘酸-希夫碱染色
采用过碘酸希夫碱染色试剂盒(南京森贝伽公司)对睾丸生精小管进行染色,步骤参照试剂盒说明书。
5、免疫组化
睾丸切片进行烤片及脱蜡后,采用微波抗原修复。将切片置于3%双氧水中,室温避光孵育25min以阻断内源性过氧化物酶,然后pbs摇床洗涤3次。采用免疫组化笔圈出组织位置,滴加3%bsa均匀覆盖组织,室温封闭30min。弃去封闭液后,滴加按一定比例稀释后的一抗,将切片置于湿盒中4℃孵育过夜。弃去一抗,玻片用pbs摇床洗涤3次。滴加相应种属二抗,室温孵育50min。弃去二抗,玻片用pbs摇床洗涤3次,滴加dab显色液,并立即用显微镜观察以控制显色时间,苏木素复染35s,流水冲洗5min。脱水透明及封片,镜检,拍照。
6、免疫荧光
睾丸切片进行烤片及脱蜡后,采用微波抗原修复。采用免疫组化笔圈出组织位置,加入自发荧光猝灭剂5min,流水冲洗10min。滴加3%bsa,室温封闭5min,弃去封闭液后,滴加按一定比例稀释后的一抗,将切片置于湿盒中4℃孵育过夜。弃去一抗,玻片用pbs摇床洗涤3次,滴加相应种属荧光二抗,室温避光孵育50min。弃去二抗,玻片用pbs摇床洗涤3次,滴加dapi染液,避光室温孵育10min。玻片用pbs摇床洗涤3次,滴加抗荧光猝灭封片剂封片。将切片置于荧光显微镜下,用相应激发波长进行激发,观察并采集图像。
7、蛋白提取及免疫印迹
(1)组织蛋白提取
准确称取动物组织,以1:9加入蛋白裂解液,匀浆至无肉眼可见固体。(将匀浆后的样品于4℃、14000g条件下离心10min,取上清待用。采用bca法对上清进行蛋白浓度测定。根据所得上清蛋白浓度,以2.0μg/μl蛋白浓度对上清进行稀释。稀释采用1/5终体积proteinbuffer(5×),剩余体积用pbs补齐。将样品涡旋震荡混匀,100℃煮沸7min,-20℃保存待用。
(1)蛋白免疫印迹
sds-page胶配制:配胶所用试剂均来自于试剂盒。根据所需分离目标蛋白的分子量,依次将去离子水,30%arc-bis,tris-hcl(ph8.8或ph6.8),10%sds,10%过硫酸铵混合,临用前加入temed,配制不同浓度分离胶及浓缩胶。
蛋白电泳:配制分离胶及浓缩胶,加入电泳缓冲液,依次加入蛋白样品及proteinladder开始恒压电泳,待溴酚蓝达到胶底部时停止。
湿法转膜:在转膜液中打开转膜夹,使其黑色阴极面朝下,依次放入海绵、滤纸、胶、pvdf膜、滤纸、海绵,合上转膜夹,置于电转槽中,加入4℃预冷的转膜液。根据不同分子量需求设定转膜条件,恒流转膜。
封闭:取出pvdf膜,tbst缓冲液洗涤1次后,加5%脱脂奶粉后室温摇床封闭1.5h。
一抗孵育:弃去封闭液,tbst缓冲液洗涤3次,每次5min,弃去洗涤液后,加入稀释后的一抗,4℃摇床孵育过夜。
二抗孵育:回收一抗,tbst缓冲液洗涤3次,每次10min,加入稀释后的对应种属二抗,室温摇床孵育1h。
显影:弃去二抗,tbst缓冲液洗涤3次,每次10min。加入ecl发光液反应,于自动显影曝光仪中显影。使用clinxchemianalysis软件进行条带灰度分析。
8、rna提取及qrt-pcr
(1)组织rna提取
将组织浸泡在1mltrizol中,在组织研磨器中匀浆至无肉眼可见固体。加入氯仿200μl抽提s,静置5min。以4℃,12000g条件离心10min,取上层水相置于新的ep管中。加入等体积异丙醇,摇匀15s,静置10min。以4℃,12000g条件离心15min,得到沉淀。)往沉淀中加入1ml用depc水新配制的75%乙醇,轻轻晃动洗涤沉淀。以4℃,12000g条件离心15min,得到沉淀。将ep管倒置于滤纸上晾干。加入适量depc水,溶解沉淀。取rna母液,在nanodrop上测定rna的浓度及a260/280纯度。
(2)rna逆转录
rna逆转录所用试剂均来自于takara试剂盒。去dna反应及逆转录反应均参照试剂盒说明书进行。
(3)实时荧光定量pcr
按照表2配制反应体系,按照以下条件进行扩增。预变性(repeat:1):95℃,30s;pcr反应(repeat:40):95℃,5s;60℃,30s;dissociation。
表2realtimepcr反应体系
(4)qpcr结果处理
根据反应得到的ct值,求得ct(目的)-ct(内参)=δct,再通过组间计算求得δδct及2-δδct。
9、tunel凋亡测定
睾丸切片进行烤片及脱蜡后,用免疫组化笔圈出组织区域,在圈内滴加蛋白酶k工作液,37℃孵育25min。弃去液体,玻片用pbs摇床洗涤3次。滴加破膜工作液,常温孵育20min,弃去液体,玻片用pbs摇床洗涤3次。将tdt和dutp按照1:9混合,滴加到组织上,切片放于湿盒中,37℃恒温孵育2h。弃去液体,玻片用摇床洗涤3次,滴加dapi染液,避光室温孵育10min。弃去液体,玻片用pbs摇床洗涤3次,用抗荧光猝灭封片剂封片,激发镜检观察并拍照。
10、睾丸组织mda,sod,gsh水平测定
微量丙二醛(malondialdehyde,mda),总超氧化物歧化酶(sod)活力及还原型谷胱甘肽(glutathione,gsh)水平均参照测定试剂盒(南京建成生物工程研究所)说明书进行。
11、睾丸组织hdt及hdac的elsia测定
组蛋白乙酰化酶(histoneacetyltransferase,hat)及组蛋白去乙酰化酶(histonedeacetylase,hdac)测定均根据elisa试剂盒(江苏酶免生物科技有限公司)说明书进行。
12、数据处理及统计分析
westernblot条带采用clinxchemianalysis软件进行分析,elisa测定标准曲线采用curveexpert进行拟合,数据组间差异性比较采用spss22.0及graphpadprism7.0进行分析,统计图采用graphpadprism7.0绘制。睾丸评分及精子数据结果采用中位数和极限值进行(medianwithrange)表示,组间比较采用非参数秩和检验(kruskal-wallistest);其余所有采用数据结果以平均值±标准差(mean±sd)表示,组间比较采用单因素方差分析(one-wayanova)。*p<0.05为具有统计学显著性差异,**p<0.01表示差异极显著。
实施例1c3g对小鼠睾丸及精子的保护作用
一、动物分组处理
采用普通ain93-g饲料适应性喂养4天后,老鼠被按照体重分层法随机分为三组:control组,cd组,cd+c3g组,每组各28只。control组给予普通ain93-g饲料,并每天灌胃生理盐水;cd组给予普通ain93-g饲料,并每天灌胃5mg/kg.bwcdcl2溶液;cd+c3g组给予花色苷饲料饮食,并每天灌胃5mg/kg.bwcdcl2溶液。各组小鼠均自由饮水摄食,连续处理30天。分别在第10d、20d、30d每组各麻醉分别处死8只、8只、12只老鼠,采集其样本用于后续实验。另设0d组12只幼鼠,在适应性喂养结束后不作任何处理直接麻醉处死,采集样本,以作为基础对照。
以2%戊巴比妥钠腹腔注射麻醉小鼠,摘去眼球取血,随后依次分离睾丸、附睾。血液室温静置30min后,分离上层血清,置于-80℃保存待用。左侧附睾尾用于精子分析;左侧睾丸切分两份后,一份迅速置于液氮中冷冻并转移到-80℃保存用于蛋白提取,另取一份投入trizol中用于rna提取;右侧睾丸用针头破膜后投入到mdf固定液中进行固定,用于组织蜡块包埋;右侧附睾投入4%多聚甲醛中固定,用于组织蜡块包埋。
二、小鼠体征指标变化
1、实验方法
睾丸及附睾重量是评价生殖损伤的重要指标之一,肛殖距(anogenitaldistance,agd)是评价性成熟过程中雄性生殖能力的重要指标。因此检测睾丸及附睾重量,和肛殖距。
2、实验结果
如图1所示,在本项研究中,随着青春期第二性征的出现,小鼠睾丸及附睾重量不断增加。然而,cd损伤过后,小鼠睾丸重量的发育增长停留在了第20d,而c3g干预后,其重量仍然持续增长并与对照组一致(图1a)。但由于体重改变的影响,各组间的睾丸系数并没有显著性的改变(图1b)。各组的附睾重量在整个处理过程中并没有显著性的改变,而在第10d,c3g干预组的附睾系数有较明显的提升,但在后续的处理过程中,其回到了正常水平。
肛殖距(anogenitaldistance,agd)是评价性成熟过程中雄性生殖能力的重要指标。通过在处死小鼠前量取其agd发现,青春期cd暴露后会导致小鼠在性成熟时agd明显减小,而c3g干预有一定的改善,但没有统计学差异(图2)
三、睾丸、附睾组织病理学分析及生精上皮评分
1、实验方法
通过h&e染色,在光学显微镜下观察睾丸、附睾头及附睾尾的组织结构
2、实验结果
如图3a所示,随着性成熟进程,对照组小鼠睾丸管腔中出现了多级生精细胞,在第20d时生精小管中出现带有鞭毛的长型精子,30d时出现并排于管腔中部等待释放的成熟精子。cd损伤组在第30d管腔中部成熟精子明显减少(黑色箭头),而在c3g干预后有所改善。此外,各组小鼠生精上皮基底细胞排列紧密,高柱状上皮细胞静纤毛清晰、游离缘整齐,生精小管结构均较为完整,没有出现管腔萎缩、空泡及生精细胞层数减少。在cd损伤后,附睾头和附睾尾管腔中均出现了明显的精子减少,且出现均质化样(黑色星号),c3g干预后附睾头及附睾尾管腔中精子密度及形态均较为正常(图3b,c)。此外,各组小鼠附睾组织形态学结构均无异常。
结合组织学观察结果,对处理30d后性成熟的小鼠采用johnsen’s评分方法进行睾丸管腔评分。由于cd暴露后管腔中晚期精子明显减少,所以johnsen’s得分明显下降,而c3g干预显著改善了生精上皮得分,具有显著性差异(图4)。
四、c3g干预提高了精子密度及活性
1、实验方法
通过分离处理30d性成熟后的小鼠附睾尾精子,采用casa测定精子数量、畸形率及活力,以表征c3g的保护精子能力。
2、实验结果
如图5所示,青春期cd暴露后附睾尾精子密度明显减少,而c3g干预明显提高了精子密度,使得精子数量回到了正常水平。而各组精子的畸形率均在正常范围,说明在本项研究暴露条件下,cd毒性并未造成精子畸形率的异常。精子活率及活力对生育能力有直接影响。分析各组精子活率及活力结果如图6所示,青春期cd暴露后,精子不仅数量减少而且活率和活力均远低于对照组水平,而cd+c3g组精子活率和活力与正常组无差异。同时,c3g还显著改善了由cd暴露引起的精子直线运动速率(straight-linevelocity,vsl)、平均路径速率(averagepathvelocity,vap)、精子头侧摆幅度(amplitudeoflateralheaddisplacement,vlh)、曲线速率(curvilinearvelocity,vcl)、鞭打频率(beat-crossfrequency,bcf)及平均角位移(meanangulardisplacement,mad)降低(图7a-f)。精子的线性度(linearity,lin)及前向性(straightnesscoefficient,str)在此模型中并未有改变(图7g-h)。
实施例2c3g通过组蛋白修饰改善cd诱导的生精阻滞
一、c3g缓解cd诱导的精子发生阻滞
1、实验方法
通过pas染色法对睾丸生精上皮进行分期。
2、实验结果
结果表明生精上皮第ⅶ-ⅷ期管腔中的长型精子es在cd暴露后明显减少,且核型被破坏(图8)。同时对精子变形过程不同阶段管腔中的晚期精子和支持细胞数量比例进行统计,发现cd暴露后从第11-12阶段开始,晚期精子比例相比较于对照组显著性下降(图9),揭示了青春期cd暴露将精子发生过程阻滞在了精子变形阶段。干预结果表明,c3g处理后小鼠生精上皮各周期表型正常,同时相对于cd损伤组,在精子变形阶段的精细胞和支持细胞比例也有了显著地提升。这说明了,c3g干预使cd诱导的精子发生阻滞得到了很好的缓解,确保了精子发生的顺利进行。
二、c3g改善cd诱导的精子核鱼精蛋白替换过程阻滞
1、实验方法
精子发生过程中的组蛋白-鱼精蛋白替换过程开始于第12阶段前后,精子核中的组蛋白先被过渡蛋白替换进而被鱼精蛋白替换,有助于染色质浓缩,是精子变形过程中核蛋白重组的重要步骤。考虑到精细胞与支持细胞比例在第12阶段后出现了较大的差异,因此通过免疫组化以及wb技术分析了组蛋白h2a和h2b在睾丸中的表达。
2、实验结果
如图10a所示,cd暴露后,在第ⅶ-ⅷ期管腔中处于精子变形最后阶段的16阶段的精子核中仍有大量的组蛋白滞留(红色箭头es),而这一情况在对照组和c3g干预组中均没有明显出现。同时,组蛋白h2a和h2b于睾丸中的蛋白水平在c3g干预过后,相比较于cd损伤组有明显的下调(图10b-d)。进一步通过qpcr分析过渡蛋白和鱼精蛋白的mrna表达水平,结果表明cd损伤后,过渡蛋白1(tnp1)、过渡蛋白2(tnp2)、鱼精蛋白1(prm1)和鱼精蛋白1(prm2)的mrna水平都受到了明显的抑制,而通过日常摄入c3g,其表达都有了一定程度的上升(图11a-d)。以上结果表明,c3g干预有效地改善了cd诱导的精子核鱼精蛋白替换过程阻滞。
三、c3g可以促进组蛋白泛素化的顺利进行
1、实验方法
精子的组蛋白-鱼精蛋白替换受到组蛋白表观遗传学修饰的精密调控,组蛋白的泛素化是精子延伸时期球形核小体移除的前提,是促进组蛋白替换的先决条件之一。通过免疫组化分析h2a和h2b的泛素化表达。
2、实验结果
如图12所示,泛素化组蛋白h2a(ub-h2a)的表达在cd暴露后出现了一定程度的减弱(红色箭头ps),并在c3g干预后与对照组无异。泛素化组蛋白h2b(ub-h2b)则在圆形精子中出现了滞留现象(红色箭头rs),并在c3g干预后表达正常。
进一步分析相关泛素链接酶和泛素结合酶在睾丸中的表达,发现介导h2a泛素化的环指蛋白2(ringfingerprotein2,rnf2)、环指蛋白1(ringfingerprotein1,ring1)及daz互作锌指蛋白3(dazinteractingzincfingerprotein3,2a-hub)的mrna水平在cd暴露后出现了显著性的降低,同时c3g处理上调了这些酶的表达;而多梳家族环指蛋白4(polycombgroupringfingerprotein4,bmi1)的表达则在cd暴露出现了上调,c3g组有所抑制但没有统计学差异(图13a)。介导h2b泛素化的环指蛋白8(ringfingerprotein8,rnf8)及环指蛋白40(ringfingerprotein40,rnf40)两种酶的mrna水平也在cd暴露后出现了异常,并在干预后得到了一定程度的改善(图13b)。其他相关的酶的mrna水平在各组间没有显著性差异。
四、c3g和cd暴露对组蛋白乙酰化和去乙酰化的影响
1、实验方法
组蛋白的替换过程还与其乙酰化程度有关。通过elisa测定睾丸中hat和hdac的含量。
2、实验结果
结果显示,各组间的hdac水平没有显著性的差异,而cd暴露后睾丸中hat的含量出现了一定程度的下降(图14)。但wb结果显示,各组间组蛋白h4及多个位点的组蛋白乙酰化水平并没有发生改变(图15)。因此,青春期cd暴露及c3g干预并没有对组蛋白的乙酰化产生影响。
五、c3g降低了g9a介导的组蛋白h3k9me1和h3k9me2的表达
1、实验方法
组蛋白泛素化和组蛋白甲基化之间通常存在着一定程度的串扰,而组蛋白甲基化异常影响着精子的发生。已有研究表明青春期cd暴露会通过介导组蛋白甲基转移酶(euchromatichistone-lysinen-methyltransferase2,g9a)的上调组蛋白甲基化水平进而导致精子发生失败。因此我们通过免疫荧光和wb考察了组蛋白h3的甲基化水平。
2、实验结果
结果表明,组蛋白h3第9位赖氨酸单甲基化(histoneh3lysine9monomethylation,h3k9me1)和组蛋白h3第9位赖氨酸双甲基化(histoneh3lysine9dimethylation,h3k9me2)表达在cd暴露后明显上调,而c3g处理组与cd损伤组相比有明显地下调(图16)。同时,g9a在睾丸中的含量在c3g干预后得到了明显地下调(图17)。结果说明,c3g可以抑制g9a的表达,进而维持组蛋白的正常甲基化。
实施例3c3g对cd诱导氧化损伤介导的精细胞凋亡的保护作用及机制
一、c3g抑制cd导致的睾丸组织氧化应激损伤
1、实验方法
cd可通过诱导氧化应激对机体产生氧化损伤,而c3g作为一种抗氧化活性物质,是抑制其损伤的潜在化合物。mda是一种脂质过氧化终产物,其含量代表脂质过氧化程度,因此检测其含量。
2、实验结果
由图18可知,cd暴露后mda含量明显上升,而c3g干预显著降低了其水平。gsh是体内一种抗氧化物质,可抵抗机体氧化损伤。由图19可知,cd损伤后睾丸中的gsh被过量消耗水平下降,gsh/gssg比例显著下降。而在c3g干预后,其水平明显上升,揭示着gsh/gssg抗氧化酶系统得到了改善。sod可将机体内过量的超氧阴离子自由基(superoxideradical,o2-·)转化为过氧化氢(hydrogenperoxide,h2o2),gsh则负责将h2o2还原为h2o以降低机体氧化水平。而由图20所示,睾丸中的sod活力在cd暴露后明显下降,而在c3g组中sod的活力有很明显的恢复。
二、c3g减轻了睾丸中圆形精子的dna损伤
1、实验方法
8-羟基脱氧鸟苷(8-hydroxy-2’deoxyguanosine,8-ohdg)是ros攻击dna鸟嘌呤碱基而产生的氧化性加合物,被认为是dna氧化损伤的标志物。通过免疫荧光检测8-ohdg在睾丸中的表达。
2、实验结果
由图21可知,cd暴露组由于受到cd氧化损伤的影响,圆形精子中的8-ohdg表达增多,提示dna受到了损伤。而c3g干预组尽管也有部分8-ohdg表达,但明显相比较于cd暴露组有所减轻。这说明c3g保护使得精细胞免受cd氧化应激引起的dna损伤。
三、c3g减轻了睾丸精细胞的凋亡
1、实验方法
采用末端脱氧核苷酸转移酶介导的dutp缺口末端标记测定法(terminaldeoxynucleotidyltransferasedutpnickendlabeling,tunel)荧光染色能对凋亡细胞的核dna中产生的3’-oh末端进行原位标记以指示凋亡细胞。
2、实验结果
如图22所示,通过对睾丸切片进行tunel染色,结果发现cd暴露组的生精细胞出现了大量凋亡,其凋亡主要出现在初级精母细胞及长型精子。而c3g干预组的初级精母细胞虽然还有一定程度的凋亡,但长型精子的凋亡数目明显减少。
四、c3g调控mapk通路相关蛋白的表达
1、实验方法
丝裂原活化蛋白激酶(mitogen-activatedproteinkinase,mapk)信号通路可受机体氧化应激影响,并能调控细胞生长与凋亡。wb检测其表达。
2、实验结果
结果表明,睾丸在cd暴露后,细胞外调节蛋白激酶(extracellularsignal-regulatedkinase,erk)的磷酸化水平受到了显著性地抑制,而在c3g干预过后得到了明显地改善(图23)。同时,研究表明mapk通路另一蛋白c-jun氨基末端激酶(c-junn-terminalkinase,jnk)的磷酸化水平在cd暴露后上升,而c3g组的p-jnk表达有所降低回到正常水平(图24)。p38蛋白是介导响应机体氧化应激的主要mapk通路蛋白,其在cd暴露后的磷酸化水平相比较于对照组显著性地上调,而干预结果表明c3g可以抑制p38磷酸化表达并将其维持在正常的表达水平(图25)。
五、c3g调控p53及精细胞凋亡通路相关蛋白的表达
1、实验方法
p53蛋白在维持细胞完整性和各种应激反应中起着重要作用,p38/mapk可磷酸化p53特殊位点,进而通过调节bcl-2家族成员蛋白引起凋亡的发生;bcl-2家族蛋白表达的异常改变会使得细胞色素c(cytochromec,cytc)从线粒体释放进而启动半胱天冬蛋白酶-9(caspase-9)及半胱天冬蛋白酶-3(caspase-3)的激活,导致caspase级联反应发生,促使细胞凋亡。因此检测相关蛋白含量。
2、实验结果
研究结果表明,cd暴露组睾丸的p53及其磷酸化水平在损伤过后均出现了显著性表达上调(图26,同时促凋亡蛋白bax和bad明显上升,抗凋亡蛋白bcl-2表达显著下调(图27)。c3g干预结果表明,p53及其磷酸化水平相对于cd损伤组表现出了一定程度的抑制,但p-p53/p53值和损伤组没有差异(图26),同时bax、bad及bcl-2的表达均得到了调控改善(图27)。
由图28a-b可知,睾丸中的caspase-3在cd损伤后被大量激活,而在经过c3g干预后其活化水平得到了一定程度的下调。活化后的caspase-3可切割聚腺苷二磷酸核糖多聚酶(polyadp-ribosepolymerase,parp)进而影响损伤修复,研究结果表明parp在cd损伤后由于上游细胞凋亡信号的作用被剪切失活,标志着凋亡的发生,而c3g组parp表达正常揭示dna修复进程没有被影响(图28c-d)。以上结果表明了c3g干预减轻了cd损伤引起的睾丸细胞凋亡。
- 还没有人留言评论。精彩留言会获得点赞!