一种可用于预防和/或治疗沙门氏菌感染的产品的制作方法
本发明涉及一种可用于预防和/或治疗沙门氏菌感染的产品,属于生物医药技术领域。
背景技术:
沙门氏菌(salmonella)属于肠杆菌科,是一种全球性的人畜共患病原菌,也是一种重要的食源性致病菌,沙门氏菌感染后的潜伏期一般为12~36h,由其引起的沙门氏菌病(salmonellosis)临床表现为腹部痉挛、腹泻、发烧、呕吐、胃肠炎等,严重时甚至可引起败血症或新生儿致死等情况。
沙门氏菌的传播媒介广泛,食源性的感染途径包括被沙门氏菌污染的水,新鲜或加工的肉类、乳品、蛋类、贝类、蔬菜等,发展中国家每年感染沙门氏菌的人数约为2000万,欧美发达国家的人群同样受到沙门氏菌的困扰,仅美国每年感人沙门氏菌的人数就可达140万。
沙门氏菌使得世界各国蒙受巨大的经济损失,严重威胁人们的健康,因此,控制沙门氏菌的感染对保证食品安全和人类公共卫生安全有着重要的意义。
目前,临床上应用于治疗沙门氏菌感染的药物以抗生素为主,但是,使用抗生素治疗沙门氏菌感染的同时会杀死大量对人体有益的肠道共生菌群,使得人体出现肠道功能紊乱等副作用;并且,长期使用抗生素导致沙门氏菌对常用的抗生素产生抗性,多重耐药性沙门氏菌的出现已经成为普遍现象;另外,抗生素的过度使用会使环境中的抗生素含量增加,致使生态失衡。除抗生素外,部分中药配方也可缓解感染后的症状,但效果不理想。
因此,急需找到一种既能够避免杀死大量对人体有益的肠道共生菌群,使得人体出现肠道功能紊乱等副作用;又能够避免沙门氏菌产生抗性,致使生态失衡;且效果良好的可用于治疗沙门氏菌感染的药物。
技术实现要素:
[技术问题]
本发明要解决的技术问题是提供一种既能够避免杀死大量对人体有益的肠道共生菌群,使得人体出现肠道功能紊乱等副作用;又能够避免沙门氏菌产生抗性,致使生态失衡;且效果良好的可用于预防和/或治疗沙门氏菌感染的产品。
[技术方案]
为解决上述技术问题,本发明提供了一种可用于预防和/或治疗沙门氏菌感染的产品,所述产品的成分包含植物乳杆菌(lactobacillusplantarum)zs2058和丁香酚,或者,所述产品的成分包含植物乳杆菌(lactobacillusplantarum)zs2058的代谢物和丁香酚,或者,所述产品的成分包含植物乳杆菌(lactobacillusplantarum)zs2058、植物乳杆菌(lactobacillusplantarum)zs2058的代谢物和丁香酚;所述植物乳杆菌为植物乳杆菌(lactobacillusplantarum)zs2058;所述植物乳杆菌(lactobacillusplantarum)zs2058已于2006年4月10日保藏于中国典型培养物保藏中心保藏,保藏编号为cctccno.m206033,保藏地址为武汉市武昌路伽山。
在本发明的一种实施方式中,所述产品中,植物乳杆菌(lactobacillusplantarum)zs2058的含量不低于1×108cfu/g。
在本发明的一种实施方式中,所述产品中,丁香酚的含量不低于300mg/kg。
在本发明的一种实施方式中,所述丁香酚为纯度不低于98%的丁香酚单体。
在本发明的一种实施方式中,所述产品的成分还包含载体。
在本发明的一种实施方式中,所述载体为药学上可接受的载体。
在本发明的一种实施方式中,所述载体为药学上可接受的填充剂、润湿剂、崩解剂、粘合剂或润滑剂中的一种或多种。
在本发明的一种实施方式中,所述填充剂为微晶纤维素、乳糖、甘露醇、淀粉或糊精中的一种或多种;所述润湿剂为乙醇或甘油中的一种或多种;所述崩解剂为羧甲基淀粉钠、交联羧甲基淀粉钠、交联聚维酮或低取代羟丙基纤维素中的一种或多种;所述粘合剂为淀粉糊、糖浆、饴糖、炼蜜或液状葡萄糖中的一种或多种;所述润滑剂为硬脂酸镁、硬脂酸富马酸钠、滑石粉或二氧化硅中的一种或多种。
本发明还提供了上述一种可用于预防和/或治疗沙门氏菌感染的产品在抑制沙门氏菌方面不以疾病的诊断和治疗为目的的应用。
本发明还提供了上述一种可用于预防和/或治疗沙门氏菌感染的产品在制备药品或食品方面不以疾病的诊断和治疗为目的的应用。
[有益效果]
(1)本发明的产品能够抑制沙门氏菌生长,使得沙门氏菌的生长量降低90.4%,本发明的产品能够降低沙门氏菌的粘附、侵袭能力,使得粘附、侵袭ht-29细胞的沙门氏菌显著减少,并且,本发明的产品能够抑制沙门氏菌毒力基因的表达,使得沙门氏菌毒力基因inva、avra、ssrb、hila、sopd的表达量分别降低69.3%、62.4%、57.4%、53.4%、31.3%,显著优于单独使用zs2058或丁香酚的抑制效果,可见,本发明的产品预防和/或治疗沙门氏菌感染的效果强。
(2)植物乳杆菌zs2058和丁香酚分别能使小鼠感染沙门氏菌后的存活率从60%提高到70%和63.3%,而本发明的产品能使小鼠感染沙门氏菌后的存活率从从60%提高到80%,分别为植物乳杆菌zs2058和丁香酚1倍和5倍,可见,本发明的产品预防和/或治疗沙门氏菌感染的效果强。
(3)未口服本发明产品的小鼠肝脏中的炎症因子il-6、tnfα、il-1β、il-10含量在感染沙门氏菌2天后较健康小鼠有所降低,在感染沙门氏菌5天后较健康小鼠显著上升,而口服本发明产品的小鼠肝脏中的炎症因子il-6、tnfα、il-1β、il-10含量在感染沙门氏菌2天后较未口服小鼠显著升高,在感染沙门氏菌5天后较未口服小鼠显著降低,可见,本发明的产品可增强小鼠免疫功能。
(4)口服本发明产品的小鼠结肠中紧密连接蛋白zo-1和occludin的表达量较正常组小鼠显著上调,claudin-1的表达量与正常组小鼠相差无几,并且,口服本发明产品的小鼠的肠道菌群多样性也与正常组小鼠相差无几,可见,本发明的产品能够保护沙门氏菌感染小鼠的肠道屏障和肠道菌群多样性,不会使得小鼠出现肠道功能紊乱等副作用。
(5)本发明的产品能够避免沙门氏菌产生抗性,致使生态失衡。
附图说明
图1:植物乳杆菌zs2058在不同浓度丁香酚的影响下的生长曲线。
图2:沙门氏菌在不同浓度丁香酚的影响下的生长曲线。
图3:植物乳杆菌zs2058和沙门氏菌在与不同浓度丁香酚共培养12h时的生长情况对比。
图4:ht-29细胞模型中植物乳杆菌zs2058和丁香酚对沙门氏菌粘附能力的影响。
图5:ht-29细胞模型中植物乳杆菌zs2058和丁香酚对沙门氏菌侵袭能力的影响。
图6:ht-29细胞模型中植物乳杆菌zs2058和丁香酚对沙门氏菌毒力基因的抑制作用。
图7:植物乳杆菌zs2058和丁香酚对沙门氏菌感染小鼠死亡率的影响。
图8:植物乳杆菌zs2058和丁香酚对感染沙门氏菌2天后小鼠肝脏中il-1β水平的影响。
图9:植物乳杆菌zs2058和丁香酚对感染沙门氏菌5天后小鼠肝脏中il-1β水平的影响。
图10:植物乳杆菌zs2058和丁香酚对感染沙门氏菌2天后小鼠肝脏中il-6水平的影响。
图11:植物乳杆菌zs2058和丁香酚对感染沙门氏菌5天后小鼠肝脏中il-6水平的影响。
图12:植物乳杆菌zs2058和丁香酚对感染沙门氏菌2天后小鼠肝脏中tnf-α水平的影响。
图13:植物乳杆菌zs2058和丁香酚对感染沙门氏菌5天后小鼠肝脏中tnf-α水平的影响。
图14:植物乳杆菌zs2058和丁香酚对感染沙门氏菌2天后小鼠肝脏中il-10水平的影响。
图15:植物乳杆菌zs2058和丁香酚对感染沙门氏菌5天后小鼠肝脏中il-10水平的影响。
图16:植物乳杆菌zs2058和丁香酚对感染沙门氏菌2天后小鼠结肠紧密连接基因zo-1表达的影响。
图17:植物乳杆菌zs2058和丁香酚对感染沙门氏菌2天后小鼠结肠紧密连接基因occludin表达的影响。
图18:植物乳杆菌zs2058和丁香酚对感染沙门氏菌2天后小鼠结肠紧密连接基因claudin-1表达的影响。
图19:植物乳杆菌zs2058和丁香酚对感染沙门氏菌2天后小鼠肠道菌群多样性的影响。
具体实施方式
下述实施例中涉及的植物乳杆菌(lactobacillusplantarum)zs2058已于2006年4月10日保藏于中国典型培养物保藏中心保藏,保藏编号为cctccno.m206033,保藏地址为武汉市武昌路伽山;下述实施例中涉及的沙门氏菌为鼠伤寒沙门氏菌sl1344,记载于公开号为cn102140430a的专利申请文本中;下述实施例中涉及的丁香酚购自百灵威公司;下述实施例中涉及的检测il-1β(货号:dy401-05)、il-6(货号:dy406-05)、tnfα(货号:dy410-05)和il-10(货号:dy417-05)的elisa试剂盒购自r&d公司;下述实施例中涉及的ht-29细胞购自南京科佰生物科技有限公司;下述实施例中涉及的rpmi-1640培养基(货号:c11875500b)购自gibco,usa公司。
本发明涉及的培养基如下:
mrs液体培养基(g/l):鱼粉蛋白胨10g、牛肉浸膏10g、酵母粉5g、葡萄糖20g、柠檬酸氢二铵2g、无水乙酸钠5g、磷酸氢二钾2g、七水硫酸镁0.5g、一水硫酸锰0.25g、吐温801ml,ph调至6.2~6.4,115℃、20min湿热灭菌。
mrs固体培养基(g/l):鱼粉蛋白胨10g、牛肉浸膏10g、酵母粉5g、葡萄糖20g、柠檬酸氢二铵2g、无水乙酸钠5g、磷酸氢二钾2g、七水硫酸镁0.5g、一水硫酸锰0.25g、琼脂粉15g、吐温801ml,ph调至6.2~6.4,115℃、20min湿热灭菌。
mrs-培养基(g/l):鱼粉蛋白胨10g、牛肉浸膏10g、酵母粉5g、柠檬酸氢二铵2g、无水乙酸钠5g、磷酸氢二钾2g、七水硫酸镁0.5g、一水硫酸锰0.25g、吐温801ml,ph调至6.2~6.4,115℃、20min湿热灭菌。。
lb培养基(g/l):酵母粉5g,胰蛋白胨10g,氯化钠5g,121℃、15min湿热灭菌。
bhi培养基(g/l):38.5gbhi粉末(购自生工生物工程股份有限公司)。
本发明涉及的菌种活化方法为:
用接种环从保菌管中挑取植物乳杆菌zs2058菌液在mrs固体培养基上划线,于37℃恒温培养箱中培养,直至长出单菌落。
用接种环从保菌管中挑取鼠伤寒沙门氏菌sl1344菌液在lb固体平板中划线。放在37℃恒温培养箱中培养,直至长出单菌落。
本发明涉及的菌种培养方法为:
挑取植物乳杆菌zs2058的单菌落接种至mrs液体培养基中,37℃静置培养14~18h,得到植物乳杆菌zs2058菌液;将植物乳杆菌zs2058菌液离心,收集菌体,用pbs缓冲液洗涤后用mrs-培养基或pbs缓冲液重悬至浓度为1×109cfu/ml,得到植物乳杆菌zs2058的菌悬液。
挑取沙门氏菌的单菌落接种至mrs液体培养基中,37℃静置培养14~18h,得到沙门氏菌菌液;将沙门氏菌菌液离心,收集菌体,用pbs缓冲液洗涤后用mrs-培养基或pbs缓冲液重悬至浓度为1×109cfu/ml,得到沙门氏菌的菌悬液。
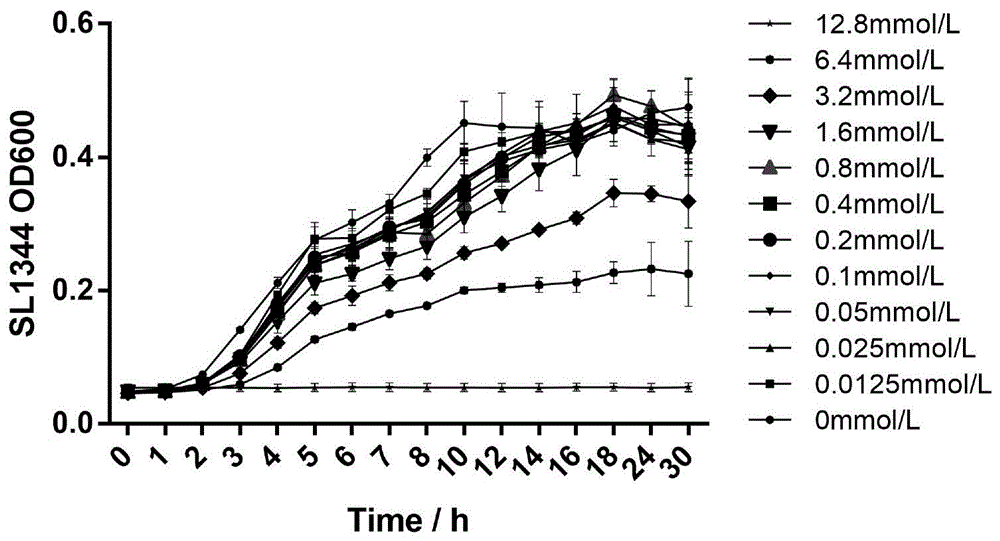
实施例1:丁香酚对植物乳杆菌zs2058和沙门氏菌生长的影响
将植物乳杆菌zs2058的菌悬液和沙门氏菌的菌悬液分别用mrs-培养基稀释至浓度为2×106cfu/ml,得到植物乳杆菌zs2058的的稀释液和沙门氏菌的稀释液;在植物乳杆菌zs2058的的稀释液和沙门氏菌的稀释液中分别加入浓度为0mmol/l、0.0125mmol/l、0.025mmol/l、0.05mmol/l、0.1mmol/l、0.2mmol/l、0.4mmol/l、0.8mmol/l、1.6mmol/l、3.2mmol/l、6.4mmol/l、12.8mmol/l的丁香酚,37℃静置培养,培养期间,前8h每隔1h用酶标仪测定一次稀释液的od600,8~12h时每隔2h测定一次稀释液的od600以检测植物乳杆菌zs2058和沙门氏菌在不同浓度的丁香酚的影响下的生长曲线,每组4个平行(检测结果如图1-3所示)。
由图1-3可知,丁香酚对植物乳杆菌zs2058和沙门氏菌生长的影响不同;当丁香酚浓度不超过6.4mmol/l时,丁香酚对植物乳杆菌zs2058的生长几乎没有影响,而丁香酚对沙门氏菌生长的抑制则有明显的浓度依赖性,说明,相比植物乳杆菌zs2058,沙门氏菌对丁香酚更加敏感,即丁香酚对沙门氏菌的抑制作用更明显。
以1×106cfu/ml的接种量在bhi培养基中接种沙门氏菌;将接种了沙门氏菌的bhi培养基分为4组,分别为ctrl组、丁香酚组(e)、植物乳杆菌zs2058组(z)以及植物乳杆菌zs2058联合丁香酚组(ze),其中,ctrl组不做处理,在丁香酚组(e)的bhi培养基中额外加入1.6mmol/l的丁香酚,在植物乳杆菌zs2058组(z)的bhi培养基中额外加入1×107cfu/ml的植物乳杆菌zs2058,在植物乳杆菌zs2058联合丁香酚组(ze)的bhi培养基中额外加入1.6mmol/l的丁香酚和1×107cfu/ml的植物乳杆菌zs2058;将四组bhi培养基于37℃恒温培养箱中培养24h;24h后,梯度稀释,采用平板计数法检测四组bhi培养基中沙门氏菌的数量,每组3个平行。
检测结果为:ctrl组、丁香酚组(e)、植物乳杆菌zs2058组(z)以及植物乳杆菌zs2058联合丁香酚组(ze)的bhi培养基中沙门氏菌的平均数量分别为1265×106cfu、715×106cfu、261×106cfu、122×106cfu。可见,丁香酚和植物乳杆菌zs2058z对沙门氏菌的生长都有显著的抑制作用,并且,丁香酚和植物乳杆菌zs2058z在抑制沙门氏菌方面存在协同作用[cdi=(122/1265)/((715/1265)×(261/1265))=0.827]。
实施例2:丁香酚和/或植物乳杆菌zs2058对沙门氏菌粘附、侵袭能力以及毒力基因表达的影响
用rmpi-1640培养基在含5%(v/v)co2的37℃培养箱中培养ht-29细胞至ht-29细胞的细胞密度达到80%,传至6孔板,得到长满ht-29细胞的孔板;将长满ht-29细胞的孔板分为四组,分别为ctrl组、丁香酚组(e)、植物乳杆菌zs2058组(z)以及植物乳杆菌zs2058联合丁香酚组(ze),其中,在ctrl组的孔板中加入1×109cfu/孔的沙门氏菌,在丁香酚组(e)的孔板中加入0.2mmol/l的丁香酚和1×109cfu/孔的沙门氏菌,在植物乳杆菌zs2058组(z)的孔板中加入1×109cfu/孔的植物乳杆菌zs2058和1×109cfu/孔的沙门氏菌,在植物乳杆菌zs2058联合丁香酚组(ze)的孔板中加入0.2mmol/l的丁香酚、1×109cfu/孔的植物乳杆菌zs2058和1×109cfu/孔的沙门氏菌,将四组孔板于37℃恒温培养箱中培养4h;4h后,通过梯度稀释和平板计数检测四组孔板中粘附和侵袭的沙门氏菌个数表征其粘附能力和侵袭能力,并且,收集四组孔板中的培养物,提取培养物的总rna进行反转录和pcr,检测沙门氏菌中主要的毒力基因(inva、sopd、avra、hila、ssrab)的表达情况(检测结果如图4-6所示)。
由图4可知,ctrl组、丁香酚组(e)、植物乳杆菌zs2058组(z)以及植物乳杆菌zs2058联合丁香酚组(ze)粘附的沙门氏菌平均数量分别为:238.8×105cfu、119×105cfu、85.7×105cfu、42×105cfu。可见,丁香酚和植物乳杆菌zs2058都能使粘附的沙门氏菌显著减少,并且,丁香酚和植物乳杆菌zs2058z在降低沙门氏菌粘附能力方面存在协同作用[cdi=(42/238.8)/((119/238.8)×(85.7/238.8))=0.963]。
由图5可知,ctrl组、丁香酚组(e)、植物乳杆菌zs2058组(z)以及植物乳杆菌zs2058联合丁香酚组(ze)侵袭的沙门氏菌平均数量分别为:431.1×104cfu、286×104cfu、145.5×104cfu、36×104cfu。可见,丁香酚和植物乳杆菌zs2058都能减少侵袭进入ht-29细胞中的沙门氏菌数量,并且,丁香酚和植物乳杆菌zs2058z在破坏沙门氏菌侵袭能力方面存在协同作用[cdi=(36/431.1)/((286/431.1)×(145.5/431.1))=0.373]。
由图6可知,丁香酚和植物乳杆菌zs2058对沙门氏菌的毒力基因都有一定的抑制作用,且植物乳杆菌zs2058联合丁香酚对毒力基因的抑制作用更显著。
实施例3:丁香酚和/或植物乳杆菌zs2058对沙门氏菌感染小鼠存活率的影响
取7周龄雌性c57bl/6小鼠30只,于饲养室温为20~26℃,湿度为40~70%,12h/12h昼夜交替,自由进食及饮水的条件下适应性喂养1周后,随机分为5组,每组6只,5组分别为空白对照组(c)、模型组(m)、丁香酚组(e)、植物乳杆菌zs2058组(z)以及植物乳杆菌zs2058联合丁香酚组(ze)。
将沙门氏菌菌悬液用pbs缓冲液稀释至浓度为1×107cfu/ml,得到沙门氏菌稀释液;将植物乳杆菌zs2058用pbs缓冲液稀释至浓度为1×107cfu/ml,得到植物乳杆菌zs2058稀释液;将丁香酚用pbs缓冲液稀释至浓度为300mg/ml,得到丁香酚稀释液。
实验共25天:空白对照组小鼠感染前10天每天灌胃0.1mlpbs缓冲液;模型组小鼠感染前10天每天灌胃0.1mlpbs缓冲液,10天后,取0.1ml沙门氏菌稀释液以灌胃的方式感染小鼠,观察15天;植物乳杆菌zs2058组小鼠感染前10天每天灌胃0.1ml植物乳杆菌zs2058稀释液,10天后,取0.1ml沙门氏菌稀释液以灌胃的方式感染小鼠,观察15天;丁香酚组小鼠感染前10天开始用添加300mg/kg丁香酚的饲料喂养,10天后,取0.1ml沙门氏菌稀释液以灌胃的方式感染小鼠,观察15天;植物乳杆菌zs2058联合丁香酚组小鼠感染前10天开始用添加300mg/kg丁香酚的饲料喂养且每天灌胃0.1ml植物乳杆菌zs2058稀释液,10天后,取0.1ml沙门氏菌稀释液以灌胃的方式感染小鼠,观察15天。
感染后每天观察小鼠存活状态,统计感染后15天内小鼠存活率(结果见图7所示)。
由图7可知,空白对照组小鼠存活率为100%,模型组小鼠存活率为60%,植物乳杆菌zs2058组小鼠存活率为70%,丁香酚组小鼠存活率为63.3%,植物乳杆菌zs2058联合丁香酚组小鼠存活率为80.0%,可见,植物乳杆菌zs2058联合丁香酚组提高沙门氏菌感染小鼠存活率的效果分别是植物乳杆菌zs2058组和丁香酚组的1倍[(80%-60%)/(70%-60%)×100%=200%]和5倍[(80%-60%)/(63.3%-60%)×100%=600%],远高于植物乳杆菌zs2058组和丁香酚组。
实施例4:丁香酚和/或植物乳杆菌zs2058对沙门氏菌感染小鼠肝脏中炎症因子il-6、tnfα、il-1β、il-10含量的影响
取7周龄雌性c57bl/6小鼠30只,于饲养室温为20~26℃,湿度为40~70%,12h/12h昼夜交替,自由进食及饮水的条件下适应性喂养1周后,随机分为5组,每组6只,5组分别为空白对照组(c)、模型组(m)、丁香酚组(e)、植物乳杆菌zs2058组(z)以及植物乳杆菌zs2058联合丁香酚组(ze)。
将沙门氏菌菌悬液用pbs缓冲液稀释至浓度为1×107cfu/ml,得到沙门氏菌稀释液;将植物乳杆菌zs2058用pbs缓冲液稀释至浓度为1×107cfu/ml,得到植物乳杆菌zs2058稀释液;将丁香酚用pbs缓冲液稀释至浓度为300mg/ml,得到丁香酚稀释液。
实验过程如下:空白对照组小鼠感染前10天每天灌胃0.1mlpbs缓冲液;模型组小鼠感染前10天每天灌胃0.1mlpbs缓冲液,10天后,取0.1ml沙门氏菌稀释液以灌胃的方式感染小鼠;植物乳杆菌zs2058组小鼠感染前10天每天灌胃0.1ml植物乳杆菌zs2058稀释液,10天后,取0.1ml沙门氏菌稀释液以灌胃的方式感染小鼠;丁香酚组小鼠感染前10天开始用添加300mg/kg丁香酚的饲料喂养,10天后,取0.1ml沙门氏菌稀释液以灌胃的方式感染小鼠;植物乳杆菌zs2058联合丁香酚组小鼠感染前10天开始用添加300mg/kg丁香酚的饲料喂养且每天灌胃0.1ml植物乳杆菌zs2058稀释液,10天后,取0.1ml沙门氏菌稀释液以灌胃的方式感染小鼠。
分别于感染2天和5天后处死沙门氏菌感染小鼠,取小鼠肝脏研磨成肝匀浆,用elisa试剂盒检测沙门氏菌感染小鼠肝脏中的炎症因子il-6、tnfα、il-1β、il-10的含量(结果见图8-15所示)。
由图8-15可知,感染后2天后,相比空白对照组,模型组小鼠肝脏中的炎症因子含量显著下降,而丁香酚组、植物乳杆菌zs2058组以及植物乳杆菌zs2058联合丁香酚组小鼠肝脏中的炎症因子含量显著上升,尤其是植物乳杆菌zs2058联合丁香酚组,上升幅度尤为明显;感染后5天,相比空白对照组,模型组小鼠肝脏中的炎症因子含量显著上升,丁香酚组、植物乳杆菌zs2058组小鼠肝脏中的炎症因子含量略有下调,而植物乳杆菌zs2058联合丁香酚组小鼠肝脏中的炎症因子含量显著下调。说明植物乳杆菌zs2058和丁香酚联合时能增强小鼠机体免疫,在沙门氏菌入侵时及时产生炎症因子杀灭病原体,从而起到预防沙门氏菌感染的效果。
实施例5:丁香酚和/或植物乳杆菌zs2058对沙门氏菌感染小鼠结肠中肠道屏障相关蛋白(紧密连接蛋白)表达量的影响
取7周龄雌性c57bl/6小鼠30只,于饲养室温为20~26℃,湿度为40~70%,12h/12h昼夜交替,自由进食及饮水的条件下适应性喂养1周后,随机分为5组,每组6只,5组分别为空白对照组(c)、模型组(m)、丁香酚组(e)、植物乳杆菌zs2058组(z)以及植物乳杆菌zs2058联合丁香酚组(ze)。
将沙门氏菌菌悬液用pbs缓冲液稀释至浓度为1×107cfu/ml,得到沙门氏菌稀释液;将植物乳杆菌zs2058用pbs缓冲液稀释至浓度为1×107cfu/ml,得到植物乳杆菌zs2058稀释液;将丁香酚用pbs缓冲液稀释至浓度为300mg/ml,得到丁香酚稀释液。
实验过程如下:空白对照组小鼠感染前10天每天灌胃0.1mlpbs缓冲液;模型组小鼠感染前10天每天灌胃0.1mlpbs缓冲液,10天后,取0.1ml沙门氏菌稀释液以灌胃的方式感染小鼠;植物乳杆菌zs2058组小鼠感染前10天每天灌胃0.1ml植物乳杆菌zs2058稀释液,10天后,取0.1ml沙门氏菌稀释液以灌胃的方式感染小鼠;丁香酚组小鼠感染前10天开始用添加300mg/kg丁香酚的饲料喂养,10天后,取0.1ml沙门氏菌稀释液以灌胃的方式感染小鼠;植物乳杆菌zs2058联合丁香酚组小鼠感染前10天开始用添加300mg/kg丁香酚的饲料喂养且每天灌胃0.1ml植物乳杆菌zs2058稀释液,10天后,取0.1ml沙门氏菌稀释液以灌胃的方式感染小鼠。
感染2天后处死沙门氏菌感染小鼠,取小鼠结肠,用trizol法提取小鼠结肠的总rna,反转录后,通过pcr检测沙门氏菌感染小鼠结肠中结肠紧密连接蛋白zo-1、occludin和claudin-1的表达量;其中,claudin-1负责结肠内小分子(如电解质等)的转运,occludin和zo-1则参与结肠内大分子以及细胞的进出,而沙门氏菌入侵时会降解occludin和zo-1从而更好地入侵,被破坏的肠道屏障需要上调claudin-1重构缓解电解质的流失(结果见图16-18所示)。
由图16-18可知,感染后2天后,相比空白对照组,模型组小鼠结肠内occludin和zo-1的表达有不明显下调,claudin-1则明显上调,而植物乳杆菌zs2058联合丁香酚组小鼠结肠内occludin和zo-1上调,claudin-1表达量与对照组相当,这可能是因为植物乳杆菌zs2058和丁香酚联合时对肠道屏障有很好的保护作用。
实施例6:丁香酚和/或植物乳杆菌zs2058对沙门氏菌感染小鼠肠道菌群多样性的影响
取7周龄雌性c57bl/6小鼠30只,于饲养室温为20~26℃,湿度为40~70%,12h/12h昼夜交替,自由进食及饮水的条件下适应性喂养1周后,随机分为5组,每组6只,5组分别为空白对照组(c)、模型组(m)、丁香酚组(e)、植物乳杆菌zs2058组(z)以及植物乳杆菌zs2058联合丁香酚组(ze)。
将沙门氏菌菌悬液用pbs缓冲液稀释至浓度为1×107cfu/ml,得到沙门氏菌稀释液;将植物乳杆菌zs2058用pbs缓冲液稀释至浓度为1×107cfu/ml,得到植物乳杆菌zs2058稀释液;将丁香酚用pbs缓冲液稀释至浓度为300mg/ml,得到丁香酚稀释液。
实验过程如下:空白对照组小鼠感染前10天每天灌胃0.1mlpbs缓冲液;模型组小鼠感染前10天每天灌胃0.1mlpbs缓冲液,10天后,取0.1ml沙门氏菌稀释液以灌胃的方式感染小鼠;植物乳杆菌zs2058组小鼠感染前10天每天灌胃0.1ml植物乳杆菌zs2058稀释液,10天后,取0.1ml沙门氏菌稀释液以灌胃的方式感染小鼠;丁香酚组小鼠感染前10天开始用添加300mg/kg丁香酚的饲料喂养,10天后,取0.1ml沙门氏菌稀释液以灌胃的方式感染小鼠;植物乳杆菌zs2058联合丁香酚组小鼠感染前10天开始用添加300mg/kg丁香酚的饲料喂养且每天灌胃0.1ml植物乳杆菌zs2058稀释液,10天后,取0.1ml沙门氏菌稀释液以灌胃的方式感染小鼠。
感染2天后处死沙门氏菌感染小鼠,取小鼠盲肠内容物,提取盲肠内容物中基因组dna,对v3-v4区进行特异性pcr扩增,16srdna测序,分析粪便菌群多样性(结果见图19所示)。
由图19可知,感染后2天后,相比空白对照组,模型组、植物乳杆菌zs2058组和丁香酚组小鼠肠道菌群多样性都有显著地减少,而zs2058联合丁香酚预防组小鼠肠道菌群多样性则与空白对照组比较相近,说明只有植物乳杆菌zs2058和丁香酚联合时才能保护肠道菌群多样性。
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
- 还没有人留言评论。精彩留言会获得点赞!