一种同时载有siRNA和顺铂前药的新型酸敏纳米载体及其制备方法与应用与流程
本发明涉及生物医药领域,更具体地,本发明涉及一种同时载有sirna和顺铂前药的新型酸敏纳米载体及其制备方法与应用。
背景技术:
化疗是肿瘤治疗的基石,但是化疗药物缺乏靶向性,肿瘤细胞被杀伤的同时正常细胞也会受到极大损害(肝肾功能障碍/骨髓移植等),这导致部分患者无法耐受化疗副作用而中断治疗。
为解决化疗药物缺乏靶向性的问题,有方法提出利用癌驱动相关基因进行治疗。肿瘤细胞中有多种癌驱动相关基因,癌驱动相关基因在肿瘤中相对正常细胞高表达,其与肿瘤的发生/发展,侵袭/转移密切相关。现阶段,针对癌驱动相关基因的药物主要有小分子激酶抑制剂和单克隆抗体,如针对her2+肿瘤的拉帕替尼和曲妥珠单抗。但对癌驱动相关基因的小分子激酶抑制剂和单克隆抗体药效不高,并且容易造成耐药,制备成本高,患者经济负担重。
也有采用白蛋白紫杉醇的技术方案,白蛋白紫杉醇是将白蛋白纳米颗粒作为药物载体,结合紫杉醇的一种纳米化疗药。白蛋白紫杉醇纳米药物具有粒径小、比表面积大、黏附性好的特点,可提高药物的生物利用度,形成较高的局部浓度,从而提高疗效,减少了紫杉醇的毒副作用。并且,因半胱氨酸酸性分泌蛋白(secretedproteinacidicandrichincysteine,sparc)在肿瘤内富集,而白蛋白可与sparc结合,此特性使化疗药物更好的靶向于肿瘤区域。sparc虽然在肿瘤中富集,但特异性不够强(普遍存在于正常组织器官中),化疗药物毒副作用不可避免。
也有采用抗体偶联药物(antibody-drugconjugates,adcs)的技术方案,抗体偶联药物是将具有靶向性质的抗体和强细胞毒性的药物(主要是化疗药)偶联而成的一种新型抗肿瘤药物,主要由靶向性的抗体、偶联的药物及连接子构成。例如现在针对her2+乳腺癌的tdm-1,是将人源化抗her2抗体曲妥珠单抗(trastuzumab,herceptin)与高活性抗有丝分裂的美登素衍生物dm1偶联而形成抗体偶联药物。由于dm1具有极强的细胞毒性,未能在临床上使用。曲妥珠单抗则可靶向结合于her2+乳腺癌细胞,阻断促进肿瘤生长信号,同时也可激活机体免疫系统攻击肿瘤细胞,tdm1可通过其抗体识别、结合并内化进入her2阳性肿瘤细胞,在肿瘤细胞内解离释放dm1,从而杀灭肿瘤细胞。而在解离前t-dm1无活性,因此避免了传统化疗药物对正常组织的损伤作用。不过,抗体偶联药物连接子不稳定会使得药物的全身暴露,能和表达相同抗体的正常组织结合,存在脱靶效应,并且价格昂贵。
rna干扰(rnainterference,rnai)技术是近年来发展迅速的一种治疗方式,在多种疾病的治疗应用中潜能巨大。和小分子靶向药物相比,sirna对靶点的选择性会更好,能够特异性结合靶基因并下调靶基因表达,不会影响细胞中其它正常基因的表达。但是rnai技术在临床转化时最大难题是缺少低毒高效的载体将sirna输送到病灶部位和细胞内。对于基于rnai技术的癌症治疗,sirna在输送过程需要突破一系列生理屏障,例如如何靶向肿瘤细胞、穿透肿瘤组织和细胞膜、从内涵体高效逃逸,以及在细胞质内有效释放sirna等。虽然使用传统的病毒载体如腺病毒和逆转录病毒传递sirna可以克服上述各种生理屏障,但那种方式具有制备困难、sirna容量小、靶向特异性差、免疫原性强等缺点。
技术实现要素:
本发明旨在克服上述现有技术的至少一种不足,提供一种同时载有sirna和顺铂前药的新型酸敏纳米载体,该新型酸敏纳米载体靶向性强,能够沉默肿瘤化疗耐药基因,增加化疗敏感性,且制备成本低。
本发明的另一目的在于提供所述同时载有sirna和顺铂前药的新型酸敏纳米载体的制备方法。
本发明的另一目的在于提供所述同时载有sirna和顺铂前药的新型酸敏纳米载体的应用。
本发明采取的技术方案如下:
一种细胞内涵体ph响应的高分子材料的制备方法,包括如下步骤:
s1、溴代聚乙二醇(meo-peg-br)的合成:
将聚乙二醇(meo-peg-oh)和三乙胺溶于二氯甲烷中,在冰盐浴中,滴加α-溴异丁酰溴,在室温下搅拌反应20~30小时后,分别用氢氧化钠和盐酸水溶液洗涤反应液,最后用去离子洗涤,收集有机相,用无水硫酸镁干燥后,浓缩溶液,加入冷乙醚沉淀出产物,真空干燥后收集白色粉末状产物;其中,聚乙二醇、三乙胺、α-溴异丁酰溴的用量分别为1.5~1.8mmol、8~10mmol、8~10mmol,氢氧化钠和盐酸水溶液的浓度均为0.8~1.2mol/l;
s2、聚乙二醇-b-聚(2-(二异丙基氨基)乙基甲基丙烯酸酯(meo-peg-b-pdpa)的合成:
将10~15mmol2-(二异丙基氨基)乙基甲基丙烯酸酯((dpa-ma)、0.12~0.18mmol溴代聚乙二醇(meo-peg-br)和0.12~0.18mmoln,n,n',n',n'-五甲基二亚乙基三胺(pmdeta),加入到聚合管中,然后加入2~5ml二甲基甲酰胺和2~5ml2-异丙醇溶解单体和溴代聚乙二醇,冷冻-解冻除去氧气,在氮气氛下加入0.12~0.18mmolcubr,并将聚合管真空密封,在38~42℃聚合20~30小时后,加入四氢呋喃稀释产物,然后使用中性三氧化二铝柱除去催化剂cubr,收集滤液,将滤液转移至透析管中,截留分子量为5000~8000的产物,用去离子水透析,最后真空冷冻干燥产品。
本发明利用上述制备方法制备得到了一种易于转化、细胞内涵体ph响应的高分子材料——聚乙二醇-b-聚(2-(二异丙基氨基)乙基甲基丙烯酸酯)(methoxyl-polyethyleneglycol-b-poly(2-(diisopropylamino)ethylmethacrylate),meo-peg-b-pdpa),其pka为6.24,在内涵体ph范围内(6.0-6.5),后续可将其用于构建酸敏纳米载体。
优选地,步骤s1中加入冷乙醚沉淀出产物这一过程是反复沉淀了3次。
优选地,步骤s2中除去氧气的过程是冷冻-解冻三次除去氧气。
优选地,步骤s2中用去离子水透析为用去离子水继续透析3天。
所述的制备方法制备得到的细胞内涵体ph响应的高分子材料聚乙二醇-b-聚(2-(二异丙基氨基)乙基甲基丙烯酸酯。
一种同时载有sirna和顺铂前药的新型酸敏纳米载体的制备方法,包括如下步骤:
(1)化疗前体药物顺铂前药的制备:
取一定量的二氯二胺顺铂溶于dmf(二甲基甲酰胺)中,随后向该溶液中加入辛酸酐,在58℃~62℃条件下搅拌反应15~20小时后,滤去沉淀,浓缩滤液,然后加入冷的乙醚沉淀出产品,用乙醚洗涤,最后真空干燥,收集黄色产品化疗前体药物顺铂前药;其中,二氯二胺顺铂、二甲基甲酰胺、辛酸酐的用量分别为0.3~0.5mmol、8~12ml、1.2~1.3mmol。
(2)新型酸敏纳米载体的制备:
选取dmf作为溶剂,配置浓度为18~22mg/ml的聚乙二醇-b-聚(2-(二异丙基氨基)乙基甲基丙烯酸酯溶液和4~6mg/ml顺铂前药的溶液,随后取180~220μl聚乙二醇-b-聚(2-(二异丙基氨基)乙基甲基丙烯酸酯溶液、10~20μl顺铂前药溶液、8~12μl浓度为0.8~1.2nmol/ulsirna水溶液,与45~55μl浓度为8~12mg/ml的阳离子脂质体g0c14溶液混合,在搅拌条件下,逐滴加入到4~6ml去离子水中形成纳米粒子;随后将该溶液转移至超滤膜中,离心得到上层均质溶液(纳米颗粒均匀分布,无沉淀),用去离子水洗涤后,收集纳米粒子即为同时载有sirna和顺铂前药的新型酸敏纳米载体。
上述制备方法利用易于转化、细胞内涵体ph响应的高分子材料——聚乙二醇-b-聚(2-(二异丙基氨基)乙基甲基丙烯酸酯)制备出了酸敏纳米载体,所制备出的高分子材料的pka约为6.24,在内涵体ph范围内(6.0-6.5),因此使用该材料制备的纳米载体共输送sirna和prodrug时,能够对内涵体的酸性ph做出响应,加快sirna和prodrug的胞内释放,沉默化疗耐药相关的靶基因并增加化疗敏感性,协同杀伤肿瘤细胞,在沉默肿瘤耐药相关基因的同时还能增强化疗药物的敏感性,减少制药成本。
优选地,步骤(2)所得的纳米粒子最后分散到磷酸缓冲盐溶液中。
由所述的制备方法制备得到的载有sirna和顺铂前药的纳米材料。
所述的载有sirna和顺铂前药的纳米材料在肿瘤治疗中的应用。
与现有技术相比,本发明的有益效果为:本发明制备的易于转化、细胞内涵体ph响应的高分子材料的pka为6.24,在内涵体ph范围内(6.0-6.5),因此使用该材料制备的纳米载体共输送sirna和prodrug时,能够对内涵体的酸性ph做出响应,加快sirna和prodrug的胞内释放,沉默化疗耐药相关的靶基因并增加化疗敏感性,协同杀伤肿瘤细胞。
附图说明
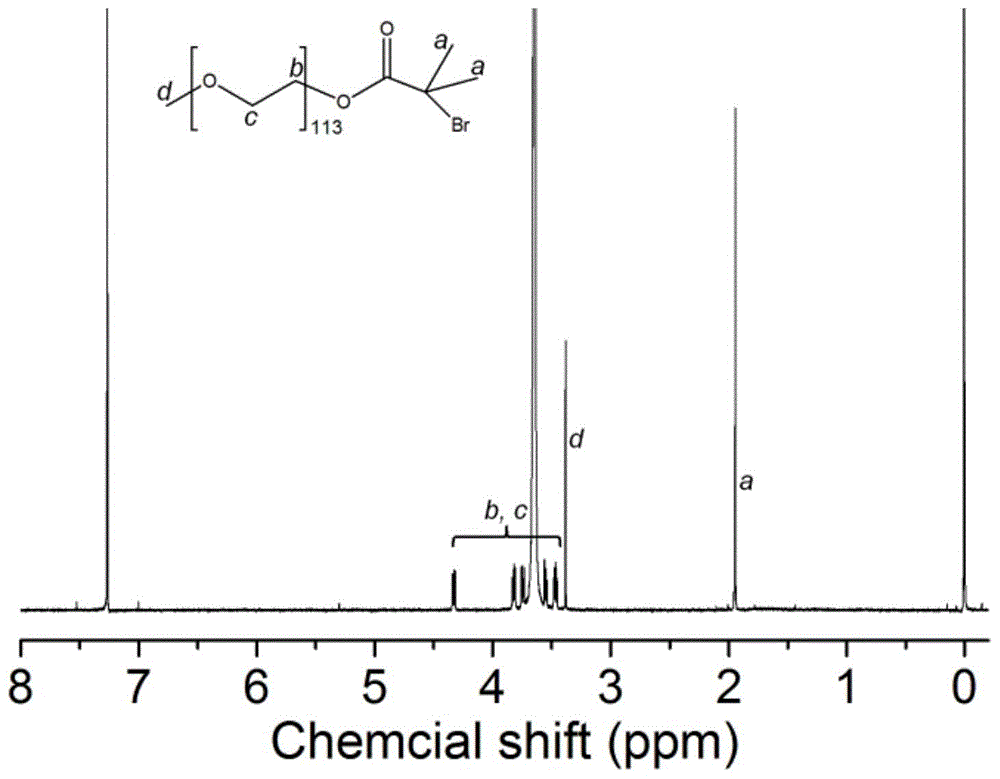
图1为meo-peg-br的核磁共振氢谱图。
图2为meo-peg-b-pdpa的核磁共振氢谱图。
图3为化疗前体药物顺铂前药的核磁共振氢谱图。
图4为载有sirna的纳米粒子的尺寸分布图。
图5为载有sirna的纳米粒子的微观形貌。
图6为纳米粒子的sirna的控制释放曲线。
图7为载有荧光染料标记sirna和顺铂前药的纳米粒子在不同时间的荧光照片。
图8为顺铂耐药基因tbce筛选及生物学功能验证图。
图9为肿瘤细胞对于顺铂的敏感性测试图。
图10为sitbce及顺铂prodrug的纳米颗粒的药代动力学特征及生物分布图。
图11为载sitbce和顺铂(ddp)的prodrug的纳米粒子的治疗效果图。
图12为各组裸鼠心、肝、脾、肺,肾的he染色图。
具体实施方式
本发明附图仅用于示例性说明,不能理解为对本发明的限制。为了更好说明以下实施例,附图某些部件会有省略、放大或缩小,并不代表实际产品的尺寸;对于本领域技术人员来说,附图中某些公知结构及其说明可能省略是可以理解的。
实施例1
一种同时载有sirna和顺铂前药的新型酸敏纳米载体,其制备过程如下:
(1)溴代聚乙二醇(meo-peg-br)的合成:
将聚乙二醇(meo-peg-oh)和三乙胺溶于二氯甲烷中,在冰盐浴中,滴加α-溴异丁酰溴,在室温下搅拌反应20~30小时后,分别用50ml氢氧化钠和盐酸水溶液洗涤反应液,最后用去离子洗涤,收集有机相,用无水硫酸镁干燥后,浓缩溶液,加入冷乙醚沉淀出产物,真空干燥后收集白色粉末状产物;其中,聚乙二醇、三乙胺、α-溴异丁酰溴的用量分别为1.6mmol、9mmol、9mmol,氢氧化钠和盐酸水溶液的浓度均为1.0mol/l;图1为meo-peg-br的核磁共振氢谱,由图1可知得到了目标产品meo-peg-br。
(2)聚乙二醇-b-聚(2-(二异丙基氨基)乙基甲基丙烯酸酯(meo-peg-b-pdpa)的合成:
使用原子转移自由基聚合法合成两亲性具有不同分子量的高分子材料meo-peg-b-pdpa,本实施例合成的为meo-peg113-b-pdpa80:取2-(二异丙基氨基)乙基甲基丙烯酸酯(2.6g,12mmol)溴代聚乙二醇(meo-peg-br)(0.75g,0.15mmol)和n,n,n',n',n'-五甲基二亚乙基三胺(pmdeta)(31.5μl,0.15mmol)加入到聚合管中,然后加入3mldmf和3ml2-异丙醇溶解单体,冷冻-解冻三次除去氧气,在氮气氛下加入cubr(21.6mg,0.15mmol),并将聚合管真空密封,在40℃聚合24小时后,加入四氢呋喃稀释产物,然后使用中性三氧化二铝柱除去催化剂cubr,收集滤液,将滤液转移至透析管中,截留分子量为5000~8000的产物,用去离子水透析,最后真空冷冻干燥产品。图2是meo-peg-b-pdpa的核磁共振氢谱,由图2可知到了目标产品meo-peg-b-pdpa。
(3)化疗前体药物顺铂前药的制备:
取一定量的二氯二胺顺铂(0.11g,0.33mmol)溶于10mldmf(二甲基甲酰胺)中,随后向该溶液中加入辛酸酐(1.26mmol),在58℃~62℃条件下搅拌反应15~20小时后,滤去沉淀,浓缩滤液,然后加入冷的乙醚沉淀出产品,用50ml乙醚洗涤,最后真空干燥,收集黄色产品化疗前体药物顺铂前药。图3为化疗前体药物-顺铂前药的核磁共振氢谱,由图3可知,得到了目标产物化疗前体药物顺铂前药。
(4)新型酸敏纳米载体的制备:
选取dmf作为溶剂,配置浓度为20mg/ml的聚乙二醇-b-聚(2-(二异丙基氨基)乙基甲基丙烯酸酯溶液和5mg/ml顺铂前药的溶液,随后取200μl聚乙二醇-b-聚(2-(二异丙基氨基)乙基甲基丙烯酸酯溶液、10μl顺铂前药溶液、10μlsirna水溶液(depc水溶解,浓度为1nmol/10ul),与50μl阳离子脂质体(g0c14,浓度为10mg/ml)溶液混合,在搅拌条件下(1200rpm),逐滴加入到5ml去离子水中形成纳米粒子;随后将该溶液转移至超滤膜中,离心(2850rpm10分钟)得到上层均质溶液(纳米颗粒均匀分布,无沉淀),用5ml去离子水洗涤3次后,收集纳米粒子即为同时载有sirna和顺铂前药的新型酸敏纳米载体。
使用nano-zszen3600型粒径仪测定纳米粒子的尺寸。使用tecnaig20s-twin型的tem观测纳米粒子的形貌。载有sirna的纳米粒子的尺寸分布和微观形貌分别见图4和图5。由图4、图5可知,本发明制备的产物粒径为纳米级。
实施例2
按照上述方法,将荧光标记的sirna(如cy5-siran/fam-siran,可从吉玛基因直接订购)包载在纳米粒子中,超滤并洗涤3次后,所得上层纳米溶液200ulgai分散在1mlpbs中。将该纳米粒子溶液转移至透析管中,随后将透析管放置于37℃pbs水溶液中(ph=7.4或ph=6.0)。在指定的时间点,取出5μl纳米粒子溶液并加入到100μl二甲亚砜溶液。使用荧光分光光度计测量荧光染料的荧光强度。sirna的累计释放率按下面公式计算:累计释放量(%)=(mt/m∞)×100;其中mt是在指定时间点从纳米粒子里释放出的sirna,m∞是纳米粒子里负载的sirna。图6是纳米粒子的sirna的控制释放曲线,由图6可知该纳米载体可响应弱酸环境并快速释放负载的sirna及顺铂前药。
实施例3
将细胞接种在6孔板中,加入1ml含10%胎牛血清的培养基孵育24小时,让其充分贴壁。随后加入载有荧光染料标记sirna和顺铂前药的纳米粒子。孵育4小时后,移去培养基并用pbs冲洗细胞三次。加入lysotrackergreen和hoechst33342分别标记内涵体(endosomes)和细胞核(nucleus),使用激光共聚焦显微镜观测纳米粒子的内涵体逃逸。图7是载有荧光染料标记sirna和顺铂前药的纳米粒子与细胞培养1小时、3小时和6小时后荧光照片。由图7可知,随着时间推移sirna可从内涵体逃逸出来进入胞质,该实验结果从活体水平证明了上述合成的纳米载体可响应弱酸环境,有利于sirna进入胞质发挥生物学功能。
实施例4
从中山大学孙逸仙纪念医院收集临床上铂类化合物化疗后的肝癌3例,未经任何药物治疗的肝癌19例,通过转录组测序,寻找影响肝细胞癌顺铂化疗敏感性的关键基因。通过数据清洗,聚类分析,寻找差异基因(图8a);并在体外小剂量(2μm)顺铂处理肝癌细胞系(bel-7402/huh7)24小时,利用pcr检测差异基因是否升高(图8b)。我们发现:顺铂化疗后肝癌组织中细胞骨架相关蛋白tbce(tubulinfoldingcofactore)显著升高(图8c),体外顺铂可诱导其在肝癌细胞系表达升高(图8b)。为进一步明确tbce在肝癌顺铂化疗的作用,我们利用sirna体外敲降肝癌细胞tbce表达,能显著增加肿瘤细胞对于顺铂的敏感性(图8d、图9)。由图可知,基因tbce在肝癌组织高表达且与肝癌患者生存预后相关;敲降tbce表达可增加显著增加肿瘤细胞对于顺铂的敏感性。
实施例5
上述载有sitbce及顺铂prodrug的纳米颗粒,能够延长sirna及顺铂的血液循环时间并富集于肿瘤部位,是其临床应用的关键技术难点。为此,我们在体内验证其药代动力学特征及生物分布。我们通过尾静脉注射包载cy5-sirna及顺铂前药的纳米药物(200ul/只,cy5-sirna1nmol),对照组给与等量的游离cy5-sirna;注射后分别于0min、10min、30min、1h、2h、4h、8h、12h、24h通过连续眼眶后静脉取血10ul,检测血液中cy5荧光信号(表征纳米药物的血液循环特征)。24小时后,安乐死小鼠,摘取心肝脾肺肾观察纳米药物的生物分布。发明人发现,该共载sirna及顺铂prodrug的纳米药物可长时间血液循环(图10a)并高效富集在肿瘤部位(图10b)。由此可见,所述载有sitbce及顺铂prodrug的纳米颗粒可显著延长sirna血液循环时间,并高效富集在肿瘤部位。
实施例6
我们在体内验证载sitbce和顺铂(ddp)的prodrug的纳米粒子的作用,把25只裸鼠分5组,在背部皮下种植1×107的bel-7402-ddp细胞,等待瘤子长大到体积约150-200mm3时我们分别给予:1)pbs200ul(pbs);2)载有sitbce的纳米材料(np(sitbce));3)载有乱序sirna(sinc)及ddpprodrug的纳米材料(np(sinc+ddp));4)载有sitbce和ddpprodrug的纳米材料(np(sitbce+ddp))。
每隔2天尾静脉注射200ul纳米药物(sitbce为1nmol),注射3次后观察约2周,发现np(sitbce+ddp)组的治疗效果最好(图11a、11b、11d)。对各组裸鼠进行体重检测(图11c)及心(heart),肝(liver),脾(spleen),肺(lung),肾(kinney)的he染色,发现各治疗组的均无明显毒性损伤(图12)。由此可见,其在体内疗效效果佳并对其他器官并无不良影响。
显然,本发明的上述实施例仅仅是为清楚地说明本发明技术方案所作的举例,而并非是对本发明的具体实施方式的限定。凡在本发明权利要求书的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明权利要求的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!