神经调节蛋白1在制备增强TRPC6通道活性产品中的应用的制作方法
本发明涉及神经系统疾病治疗领域,尤其涉及一种神经调节蛋白1在制备增强trpc6通道活性产品中的应用。
背景技术:
经典瞬时受体电位通道6型(transientreceptorpotentialcationchannelsubfamilycmember6,trpc6)通道是一类非选择性阳离子通道,属于瞬时受体电位通道家族(trp)。trpc6通道在外周和神经系统内都有丰富的表达,在中枢神经系统中主要表达在神经元上,其中在海马、皮层以及背侧纹状体中表达较高,与精神分裂症、脑卒中、老年痴呆、癫痫等多种神经系统疾病相关。在外周则主要表达在内皮细胞上,与家族遗传性局灶性节段性肾小球硬化、肾功能衰竭等疾病相关。该离子通道特异性的调节剂是深入研究trpc6离子通道在疾病中的作用机制研究的重要工具。目前关于trpc6通道的高选择性小分子激动剂的产品非常少。
由于trpc6是一种非选择性的阳离子通道,能够调节胞内的ca2+浓度。而蛋白质巯基亚硝基化(proteins-nitrosylation)作为一种可逆的蛋白质转录后修饰,可以通过亚硝基与蛋白质半胱氨酸巯基共价结合,进而完成调节离子通道、代谢酶、半胱氨酸蛋白酶、磷酸酶活性等过程。有文献报道trpc6通道通过调节心肌细胞的亚硝基化,从而参与了杜氏肌萎缩症的发病机制。然而,关于trpc6通道自身的亚硝基化参与的其他生理和病理过程未见有相关报道。
trpc6离子通道特异性的调节剂是深入研究trpc6离子通道在疾病中的作用机制研究的重要工具。目前围绕作用于trpc6通道活性的试剂产品以抑制剂或拮抗剂为主,而用于制备激活/促进/增强trpc6通道活性的试剂产品种类非常有限。其中贯叶金丝桃素(hyperforin,hyp)是唯一已知的trpc6通道选择性激活剂,尽管其被广泛应用,但其化学稳定性较差,化学上不稳定;后续开发出了hyp9(一种间苯三酚衍生物),它能够增加钙进入细胞的数量,并选择性增加trpc6通道电流,然而除此之外,该激动剂hyp9特异性不足,还能间接抑制突触后5-羟色胺和去甲肾上腺素的再摄取。trpc6通道激动剂产品稀少不利于现有技术对trpc6通道的生理病理学机制研究,也不利于开发出以trpc6通道为作用靶点的新用途。目前,通过离子通道蛋白亚硝基化进而增强trpc6通道活性的试剂产品未见报道。
神经调节蛋白1(neuregulin-1,nrg1)是一类包含表皮生长因子样结构域(egf)的多肽类神经生长因子,由位于8号染色体短臂的8p12-21区域的nrg1基因编码。目前有超过30种的异构剪切体被发现,根据n末端的不同分为i到vi种类型。nrg1主要是通过作用于erbb4受体发挥生理功能。在过去十几年中的研究表明nrg1和erbb4受体在发育和成年的大脑都有丰富的表达,包括与精神疾病密切相关的前额皮质(pfc)和海马体(hippocampus)等脑区,其中erbb4被发现主要表达在γ-氨基丁酸(gaba)能中间神经元上。gaba是一种广泛分布于中枢神经系统内的抑制性神经递质,主要用于调控神经元的兴奋性,维持神经系统兴奋和抑制平衡,对于调节神经系统稳态具有重要作用;此外,gaba能突触传递异常可导致多种精神类疾病的发生和发展,调节gaba能突触传递已成为治疗失眠、癫痫、焦虑和精神分裂症等神经系统疾病非常重要的手段之一。研究发现nrg1在海马、前额叶、杏仁核等脑区可以通过erbb4受体增强gaba释放,进而影响了锥体神经元的兴奋性和突触可塑性,在精神分裂症、癫痫和中风等神经和精神疾病的发病和治疗中发挥重要的作用。
截至目前,还未见到nrg1通过亚硝基化作用影响trpc6通道功能的研究报道。
技术实现要素:
本发明的目的在于提供一种神经调节蛋白1在制备增强trpc6通道活性产品中的应用,在神经和精神疾病治疗领域具有较好的应用前景。
为实现以上目的,本发明提供一种神经调节蛋白1在制备增强trpc6通道活性产品中的应用。
具体的,所述神经调节蛋白1通过促进trpc6亚硝基化来增强trpc6通道活性。
具体的,所述增强trpc6通道活性产品为trpc6通道的激动剂。
在本发明一些实施例中,所述增强trpc6通道活性产品为治疗神经和精神疾病的药物。
在本发明一些实施例中,所述神经和精神疾病包括精神分裂症、焦虑症、失眠、癫痫、中风、抑郁、自闭症等中的至少一种。
在本发明一些实施例中,所述神经调节蛋白1为天然提取的神经调节蛋白1或者基因重组表达的神经调节蛋白1。
在本发明一些实施例中,所述基因重组表达的神经调节蛋白1的氨基酸序列如序列表中序列1所示。
在本发明一些实施例中,所述增强trpc6通道活性产品为制剂或包括所述制剂的试剂盒。
在本发明一些实施例中,所述制剂包括粉剂与液体制剂中的至少一种。
在本发明一些实施例中,所述粉剂为粉针剂,所述液体制剂为注射液。
在本发明一些实施例中,所述神经调节蛋白1为人源性神经调节蛋白1。
本发明的有益效果:
本发明通过免疫荧光实验发现trpc6通道蛋白在海马区与nrg1的erbb4受体共标;进一步通过免疫印迹证明了nrg1能促进trpc6通道蛋白的亚硝基化。然后通过全细胞膜片钳实验证明亚硝基化抑制剂和trpc6通道阻断剂都能够阻断nrg1-erbb4通路对gaba释放的促进作用,同时在表达erbb4受体的中间神经元上敲除trpc6通道阻断了nrg1对促进gaba释放的作用,进而导致神经元节律性振荡和精神分裂症样行为学的异常。本发明的研究结果表明,nrg1能够通过促进trpc6通道蛋白的亚硝基化来激活trpc6通道,进而增加gaba的释放。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对本发明范围的限定。
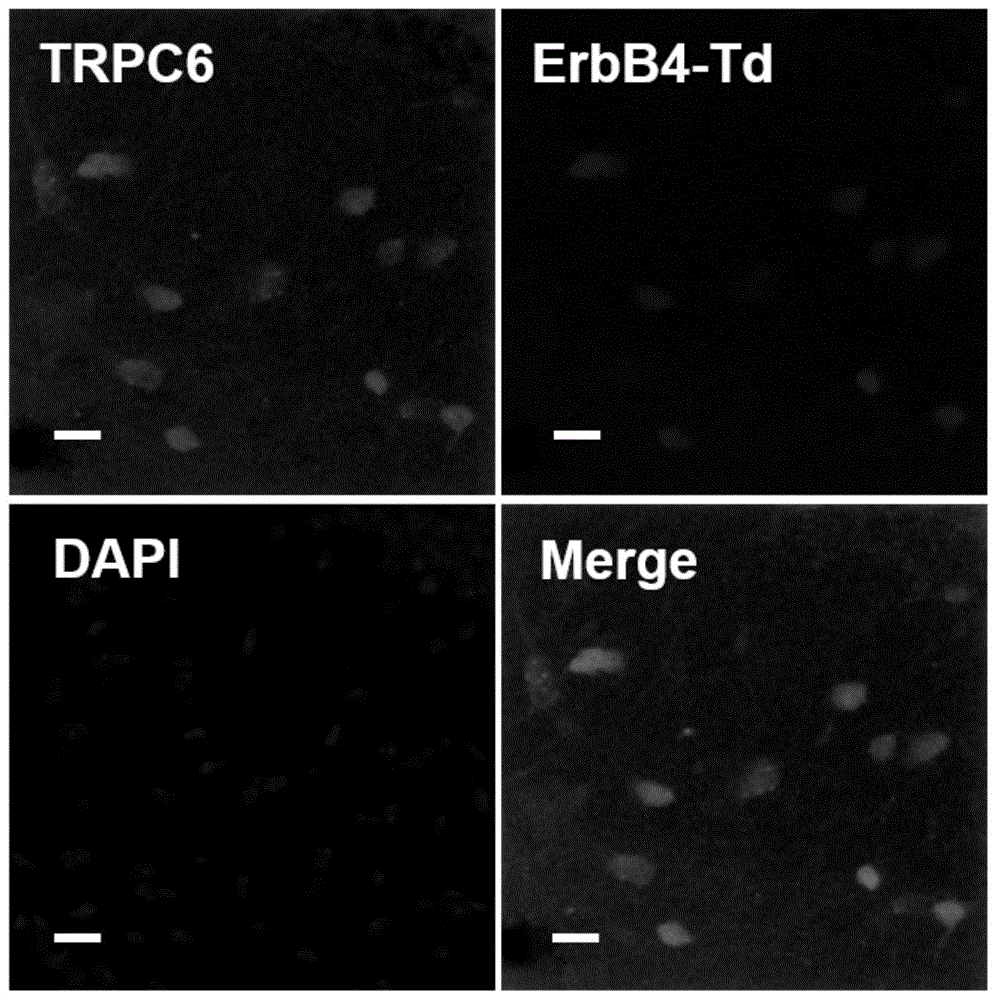
图1示出了erbb4-td小鼠的大脑海马ca1区中erbb4受体与trpc6通道蛋白的共标情况。
图2为rnrg1-β1促进trpc6亚硝基化对升高c57bl/6小鼠海马ca1区mipscs频率作用的影响。a为rnrg1-β1对trpc6及其亚硝基化水平的代表性westernblot示意图(单位:kd);b为rnrg1-β1对trpc6亚硝基化水平的统计结果;c为rnrg1-β1对biotin-trpc6水平的统计结果。d为分别不存在亚硝基化抑制剂(左)、存在亚硝基化抑制剂n-乙基马来酰亚胺(nem,右)时,加入rnrg1-β1前后的mipscs代表性示意图(比例尺:250ms,50pa);e为各组mipscs的频率统计图。
图3为阻断trpc通道、trpc5通道或trpc6通道对rnrg1-β1升高c57bl/6小鼠海马ca1区mipscs频率作用的影响。a为分别存在trpc通道阻断剂skf96365(左)、trpc5通道阻断剂galangin(中)、trpc6通道阻断剂ml-7(右)时,加入rnrg1-β1前后的mipscs代表性示意图(比例尺:250ms,50pa);b为各组的mipscs的频率统计图。
图4为全身性敲除trpc6对rnrg1-β1升高小鼠海马ca1区mipscs频率作用的影响。a为野生型同窝对照小鼠和全身性敲除trpc6小鼠代表性westernblot示意图;b为westernblot统计图;c为各组小鼠在加入rnrg1-β1前后的mipscs代表性示意图(比例尺:250ms,50pa);d为各组的mipscs的频率统计图。
图5为在erbb4阳性的中间神经元上敲除trpc6对rnrg1-β1升高小鼠海马ca1区mipscs频率作用的影响。a为构建在erbb4阳性的中间神经元上敲除trpc6小鼠的过程示意图;b为病毒(paav-hu6-trpc6sgrna-pcag-mcherry-wpre-polya)注射位点的示意图;c为病毒注射位点的免疫荧光结果;d为erbb4-cas9小鼠注射病毒后,trpc6和trpc5蛋白表达的westernblot示意图;e为erbb4-cas9小鼠注射病毒后,trpc6蛋白表达的westernblot统计结果;f为erbb4-cas9小鼠注射病毒后,trpc5蛋白表达的westernblot统计结果;g为两组小鼠加入rnrg1-β1前后的mipscs代表性示意图(比例尺:250ms,50pa);h为两组的mipscs的频率统计图。
图6为在erbb4阳性的中间神经元上敲除trpc6的小鼠神经元节律性振荡研究。a为小鼠在屏蔽的脑电记录箱中记录海马脑区场电位信号;b为海马脑区场电位进行滤波后得到的各频段的波形(delta:0.4-4hz;theta:4-12hz;beta:12-30hz;gamma:30-80hz);c为两组小鼠海马脑区场电位的时频图(热度图);d为两组小鼠海马脑区场电位功率谱分析结果;e为两组小鼠海马脑区场电位各频段平均功率统计结果。
图7为在erbb4阳性的中间神经元上敲除trpc6的小鼠行为学研究。a为两组小鼠旷场活动的统计结果;b为两组小鼠在y迷宫中交替行为的统计结果;c为两组小鼠在三箱社交行为学中互动时间的统计结果;d为两组小鼠前脉冲抑制实验的统计结果。
具体实施方式
本发明通过深入研究nrg1对trpc6通道的作用机制,发现nrg1能够促进trpc6通道蛋白的亚硝基化,进而促进gaba的释放,该发现说明nrg1是trpc6通道的一种激动剂,可用于神经和精神疾病的治疗,并且为深入研究trpc6通道在疾病中的作用机制研究提供了重要工具;同时还提示可以进一步开发nrg1的临床用药价值,为临床提供通过激活trpc6通道来促进gaba释放的临床药物。
本发明的研究内容包括:
本发明通过膜片钳、免疫荧光、westernblot、行为学、基因打靶等方法证明nrg1-erbb4信号通路通过trpc6的亚硝基化调控了gaba的释放,敲除trpc6会导致小鼠海马神经元节律性振荡和精神疾病样行为学的异常。
首先通过免疫荧光实验发现trpc6通道蛋白在海马脑片与nrg1的erbb4受体共表达。
进一步通过免疫印迹实验证明了nrg1能促进trpc6通道蛋白的亚硝基化。然后通过全细胞膜片钳实验证明trpc6通道阻断剂能够阻断nrg1-erbb4通路对gaba释放的促进作用。
为了更进一步验证nrg1对trpc6通道的激活作用,我们在小鼠全身性敲除trpc6和erbb4阳性(即表达erbb4受体的)中间神经元上敲除trpc6通道,发现都能有效地阻断nrg1促进gaba释放的作用。并且在erbb4阳性中间神经元上敲除trpc6通道的小鼠表现出海马神经元节律性振荡和精神疾病样行为学的异常,提示内源性的nrg1可能对于维持正常的神经元节律性振荡和行为学具有重要意义。
以上结果表明,nrg1能够通过促进trpc6通道蛋白的亚硝基化来激活trpc6通道,进而增加gaba的释放,来发挥一系列生物学效应。
下面将结合具体实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
实施例1
本实施例通过免疫荧光标记提供trpc6通道蛋白在大脑海马区与nrg1的erbb4受体的共标情况。
1.实验动物饲养:
spf级erbb4-td小鼠:雄性,年龄6周。spf级动物中心饲养,饲养区温度一般在25℃-28℃之间,湿度控制在40%-70%之间,微电脑控制日光灯照明系统,12h明暗自动交替。动物中心定期打扫卫生、更换动物垫料、添加饲料,可自由摄取spf级繁殖级饲料和饮水。
2.药品及主要试剂:
他莫昔芬购自sigma-aldrich公司(中国,上海)。
3.实验方法及具体步骤:
将erbb4-creert2和rosa::lsl-tdtomato小鼠杂交获得erbb4-td小鼠(erbb4-td小鼠体内表达erbb4受体的神经元均会同时表达红色荧光蛋白,以此完成对erbb4蛋白的荧光标记)。该小鼠于适龄时腹腔注射他莫昔芬(tam,100mg/kg,i.p.)诱导cre重组酶表达,即可使得表达erbb4受体的中间神经元表达红色荧光。取小鼠脑片进行与trpc6免疫荧光抗体共标实验。1wt%bsa(含10%v/v山羊血清,0.25%v/vtriton)封闭,37℃,30分钟,封闭结束后孵育trpc6一抗(rabbitanti-trpc6,sigma,1:1000),37℃,2小时后,4℃过夜。次日,pbs清洗后,孵育二抗(goatanti-rabbit488),37℃,2小时。最后室温孵育dapi(1:10000)5分钟。裱片,封片,显微镜下观察拍照。
4.实验结果:
结果如图1所示,图1中,trpc6表示trpc6通道蛋白在神经元的表达情况(绿色荧光),erbb4-td表示erbb4受体在神经元的表达情况(红色荧光),dapi标记神经元的细胞核(蓝色荧光)。
结果显示,erbb4-td小鼠的大脑海马ca1区中出现了erbb4受体与trpc6通道蛋白在同一神经元中共表达的情况,说明表达erbb4受体的神经元同时表达了trpc6通道蛋白。
实施例2
本实施例通过蛋白免疫印迹和膜片钳电生理检测nem干预前后nrg1对trpc6通道蛋白的亚硝基化水平和促进gaba释放的影响。
1.实验动物饲养:同实施例1。
2.药品及主要试剂:氯化铯、hepes、egta、atp-mg、gtp-na、氯化钠、氯化钾、磷酸二氢钠、硫酸镁、氯化镁、氯化钙、碳酸氢钠、葡萄糖、蔗糖、nem均购自sigma-aldrich公司(中国,上海);重组人神经调节蛋白1(recombinanthumannrg1-β1,rnrg1-β1)(氨基酸序列:shlvkcaekektfcvnggecfmvkdlsnpsrylckcpneftgdrcqnyvmasfykhlgiefmeae)购自prospec公司(以色列,雷霍沃特);qx-314、ttx、cnqx、dl-ap5均购自tocris公司(英国,布里斯托尔)。
3.实验方法及具体步骤:
(1)组织样本制备:取8周龄c57bl/6小鼠,将小鼠深度麻醉后断头取脑,运用振动切片机在冰冻切片液中制作厚度为300μm且含有海马区域的脑片。切片液成分为:220mm蔗糖,2.5mm氯化钾,1.3mm氯化钙,2.5mm硫酸镁,1mm磷酸二氢钠,26mm碳酸氢钠,以及10mm葡萄糖。切片完成后转移至人工脑脊液中加入1μmttx,100μmdl-ap5和20μmcnqx,人工脑脊液成分为:126mm氯化钠,3mm氯化钾,1.2mm磷酸二氢钠,1mm硫酸镁,2.0mm氯化钙,26mm碳酸氢钠,以及10mm葡萄糖。
(2)提取亚硝基化蛋白实验:购买硫醇化蛋白检测试剂盒(s-nitrosylatedproteindetectionkit,cayman)具体步骤详见试剂盒说明书。取rnrg1-β1孵育后的脑组织:隔离、冲洗,裂解细胞并抑制自由硫醇。离心去除碎片(10000g,10分钟),重复裂解一次确保完全溶解,取上层清液进行蛋白定量,将蛋白质浓度稀释成2mg/ml。样本与重组阻断剂(1ml原液)按照1:9的比例配制,得到的亚硝基化蛋白可用于westernblot实验。
(3)westernblot实验:首先,将rnrg1-β1孵育后的脑组织样本中置于蛋白裂解缓冲液中(成分:50mmtris-hcl,ph值7.4,150mm氯化钠,2mmedta,1wt%脱氧胆酸钠盐,1wt%sds,1mmpmsf,50mm氟化钠,1mm钒酸钠,1mm二硫苏糖醇,同时加入混合蛋白酶抑制剂与混合磷酸化酶抑制剂)。组织匀浆后,冰浴裂解30分钟,再以12,000rpm离心15分钟,取上清。然后,使用增效bca蛋白检测试剂盒(beyotime)测定总蛋白浓度,并将其调整至4.5mg/ml。取适量蛋白上清,加入5×sds上样缓冲液,使用99℃水浴锅加热变性10min。接着,取50μg煮好的蛋白蛋样品,将其上样到10wt%的sds-聚丙烯酰胺凝胶中进行电泳。电泳完成后,将sds-聚丙烯酰胺凝胶上的蛋白电转到pvdf膜上(biorad)。将印迹在含10%v/v脱脂牛奶的pbst溶液(成分:100nm磷酸盐缓冲液,ph7.5,含150nmnacl和0.1%v/vtween-20)中室温封闭1h。然后将印迹置于一抗(rabbitanti-trpc6)中,在4℃冰箱中孵育过夜。次日,将印迹膜置于山羊抗兔hrp偶联二抗中,在37℃下孵育1h。然后,使用ecl发光液在化学发光系统(chemidoctmxrs+,biorad)观察蛋白条带。最后imagej软件对蛋白条带进行半定量分析。
值得一提的是,亚硝基化trpc6通道蛋白(即图2a至图2c中sno-trpc6)的检测方法需要先对脑组织进行(2)提取亚硝基化蛋白实验处理,再进行(3)westernblot检测;未进行亚硝基化的trpc6也就是trpc6总蛋白(即图2a-2c中trpc6)的检测方法是脑组织处理后不经提取亚硝基化蛋白实验处理,直接进行(3)western检测。
(4)全细胞膜片钳实验:取8周龄c57bl/6小鼠,将小鼠深度麻醉后断头取脑,运用振动切片机在冰冻切片液中制作厚度为300μm且含有海马区域的脑片。切片液成分为(mm):220蔗糖,2.5氯化钾,1.3氯化钙,2.5硫酸镁,1磷酸二氢钠,26碳酸氢钠,以及10葡萄糖。在记录液(人工脑脊液)中加入1μmttx,100μmdl-ap5和20μmcnqx,运用电压钳模式(-70mv)全细胞记录海马ca1区域锥体神经元微小抑制性突触后电流(mipscs)。记录液成分为(mm):126氯化钠,3氯化钾,1.2磷酸二氢钠,1硫酸镁,2.0氯化钙,26碳酸氢钠,以及10葡萄糖。电极内液成分为(mm):140氯化铯,10hepes,0.2egta,1氯化镁,4atp-mg,0.3gtp-na,以及5qx-314(ph7.25,280mosm)。
4.分组处理:
图2中,“nrg1+nem+”表示人工脑脊液中事先加入亚硝基化抑制剂nem(300μm),脑片放入后,加入5nmrnrg1-β1孵育一小时;“nrg1+nem-”表示人工脑脊液中未添加亚硝基化抑制剂nem,脑片放入后,加入5nmrnrg1-β1孵育一小时;“nrg1-nem-”表示人工脑脊液中既未添加亚硝基化抑制剂nem,也未添加rnrg1-β1。
图3中,control表示记录液中未添加任何阻断剂或抑制剂;nrg1表示在未添加任何阻断剂或抑制剂情况下,仅添加5nmrnrg1-β1。nem表示在记录液中添加的nem的浓度为300μm;nem+nrg1表示在记录液中添加的nem的浓度为300μm,添加的rnrg1-β1的浓度为5nm。
图2a至图2c中:最左侧一列表示蛋白质分子量的大小数值,单位为kd;trpc6表示trpc6总蛋白;biotin-trpc6表示生物素化的trpc6通道蛋白(biotin-trpc6),也即位于细胞膜表面的trpc6通道蛋白。
trpc6通道蛋白为跨膜蛋白,包括嵌入细胞膜内的部分和位于细胞膜表面的部分,本发明通过对脑组织样本进行生物素化,并检测生物素化的trpc6通道蛋白(biotin-trpc6)的含量,来检测细胞膜上的trpc6通道蛋白的表达量。
5.实验结果:
图2的结果表明,rnrg1-β1处理后,trpc6总蛋白和biotin-trpc6的含量都没有发生变化,亚硝基化的trpc6蛋白增加,也即是说,trpc6通道蛋白的亚硝基化水平升高,而亚硝基化抑制剂nem(300μm)可抑制rnrg1-β1对trpc6亚硝基化的促进作用。
图3的结果显示:正常情况下,灌流5nmrnrg1-β1可引起海马ca1区域锥体神经元mipscs的频率的增加,说明该区域的gaba释放量增加。而使用nem抑制亚硝基化的情况下,灌流5nmrnrg1-β1未能引起海马ca1区域锥体神经元mipscs的频率的增加,这个结果表明抑制亚硝基化后,rnrg1-β1对gaba释放无增强作用。
实施例3
本实施例通过膜片钳电生理提供阻断trpc6通道前后nrg1对gaba释放的影响的情况。
1.实验动物饲养:同实施例1。
2.药品及主要试剂:氯化铯、hepes、egta、atp-mg、gtp-na、氯化钠、氯化钾、磷酸二氢钠、硫酸镁、氯化镁、氯化钙、碳酸氢钠、葡萄糖、蔗糖均购自sigma-aldrich公司(中国,上海);rnrg1-β1购自prospec公司(以色列,雷霍沃特);qx-314、ttx、cnqx、dl-ap5均购自tocris公司(英国,布里斯托尔);skf96365购自merckmillipore公司(美国,比尔里卡);ml-7购自mce公司(美国,蒙茅斯章克申)。
3.实验方法及具体步骤:取成年雄性c57bl/6小鼠(普通小鼠)进行膜片钳实验,实验操作同前(实施例2)。记录液中提前加入trpc通道的阻断剂skf96365(20μm)或trpc5通道的阻断剂galangin(10μm)或trpc6通道的阻断剂ml-7(100μm),观察加入5nmrnrg1-β1前后锥体神经元mipscs的变化。
值得一提的是,trpc通道是一种统称,包含7种亚型的trpc通道(即trpc1-7通道),也即是说,trpc6通道为trpc通道中的一个亚型。skf96365是trpc通道的广谱阻断剂,一般认为其可以同时阻断7类trpc通道。
4.分组处理:
图3中,skf96365表示采用阻断剂skf96365阻断trpc通道,skf96365+nrg1表示采用阻断剂skf96365阻断trpc通道,同时加入5nmrnrg1-β1。其中,skf96365的浓度为20μm。galangin表示采用阻断剂galangin阻断trpc5通道,galangin+nrg1表示采用阻断剂galangin阻断trp5c通道,同时加入5nmrnrg1-β1。其中galangin的浓度为10μm。ml-7表示采用阻断剂ml-7阻断trpc6通道,ml-7+nrg1表示采用阻断剂ml-7阻断trpc6通道,同时加入5nmrnrg1-β1。其中ml-7的浓度为100μm。
5.实验结果:
图3结果显示,阻断trpc通道或trpc6通道时,脑片灌流rnrg1-β1未能引起mipscs频率的增加,对gaba释放无增强作用。而阻断trpc5通道时,脑片灌流rnrg1-β1依然可以引起mipscs频率的增加,提示rnrg1-β1增强gaba释放的作用仍存在。
实施例4
本实施例通过膜片钳电生理提供全身性敲除trpc6通道后nrg1对gaba释放影响的情况。
1.实验动物饲养:trpc6全身性敲除(trpc6-/-)小鼠及其同窝对照小鼠在spf级动物中心饲养,饲养环境及条件同实施例1。
2.药品及主要试剂:氯化铯、hepes、egta、atp-mg、gtp-na、氯化钠、氯化钾、磷酸二氢钠、硫酸镁、氯化镁、氯化钙、碳酸氢钠、葡萄糖、蔗糖、他莫昔芬均购自sigma-aldrich公司(中国,上海);rnrg1-β1购自prospec公司(以色列,雷霍沃特);qx-314、ttx、cnqx、dl-ap5均购自tocris公司(英国,布里斯托尔);注射用病毒购自和元生物技术(上海)股份有限公司(中国,上海);trpc6一抗:trpc6rabbitpolyclonalantibody(proteintech,18236-1-ap),hrp二抗goatanti-rabbitiggh&l(hrp)(abcam,ab6721)。
3.实验方法及具体步骤:
trpc6-/-小鼠验证westernblot实验方法同前(实施例2)
采用trpc6-/-及其同窝对照小鼠进行膜片钳实验,实验操作同前(实施例2)。
trpc6-/-小鼠基于基因同源重组原理在胚胎干细胞中敲除trpc6基因,选取后代交配从而获得trpc6蛋白全身性敲除的转基因小鼠。
4.分组处理:
图4中,wt表示野生型小鼠,trpc6-/-表示全身性敲除trpc6小鼠。脑片灌流rnrg1-β1的浓度为5nm。
5.实验结果:
图4结果显示,同wt小鼠相比,trpc6-/-小鼠海马区域trpc6蛋白表达量明显减少。trpc6-/-小鼠的脑片灌流rnrg1-β1未能增加海马ca1区锥体神经元mipscs频率,全身性敲除trpc6通道可阻断rnrg1-β1促进gaba释放这一作用。
实施例5
本实施例通过膜片钳电生理提供条件性敲除trpc6通道后nrg1对gaba释放影响的情况。
1.实验动物饲养:erbb4-creert2小鼠、lsl-cas9小鼠在spf级动物中心饲养,饲养环境及条件同实施例1。
2.药品及主要试剂:氯化铯、hepes、egta、atp-mg、gtp-na、氯化钠、氯化钾、磷酸二氢钠、硫酸镁、氯化镁、氯化钙、碳酸氢钠、葡萄糖、蔗糖、他莫昔芬均购自sigma-aldrich公司(中国,上海);rnrg1-β1购自prospec公司(以色列,雷霍沃特);qx-314、ttx、cnqx、dl-ap5均购自tocris公司(英国,布里斯托尔);注射用病毒购自和元生物技术(上海)股份有限公司(中国,上海);trpc6一抗:trpc6rabbitpolyclonalantibody(proteintech,18236-1-ap),hrp二抗:goatanti-rabbitiggh&l(hrp)(abcam,ab6721)。
3.实验方法及具体步骤:
对于erbb4阳性的中间神经元上敲除trpc6的小鼠,其获得基于crispr-cas9技术,将erbb4-creert2和lsl-cas9小鼠杂交获得erbb4-cas9小鼠及其同窝对照鼠erbb4-creert2小鼠,使得erbb4阳性的神经元细胞中特异性表达cas9。两组小鼠于4周时腹腔注射他莫昔芬(tam,100mg/kg,i.p.)诱导cre重组酶表达,并于5-6周时在小鼠海马ca1区域(ap:-2.0mm,ml:±1.5mm,dv:-1.4mm)注射病毒(paav-hu6-trpc6sgrna-pcag-mcherry-wpre-polya)。cre重组酶在sgrna病毒诱导后激活,能特异性敲除erbb4阳性神经元上的trpc6基因,待病毒表达3周后,取小鼠做脑片膜片钳实验,实验操作同前(实施例2)。在膜片钳实验中,对小鼠进行nrg1处理时,在记录液中添加的rnrg1-β1的浓度为5nm。
条件性敲除trpc6的验证westernblot实验方法同前(实施例2)。
4.分组处理:
图5中,control表示对照组小鼠,erbb4-trpc6-/-表示特异性敲除trpc6小鼠。对照组小鼠为erbb4-creert2小鼠,但是注射了他莫昔芬诱导cre重组酶表达,同时脑立体定位注射病毒。由于该小鼠缺乏cas9,所以注射病毒并未能引起基因敲除效果,故可设置为对照。
5.实验结果:
图5显示,#2病毒的敲除效率明显很高(#1病毒、#2病毒、#3病毒为不同产品型号的病毒paav-hu6-trpc6sgrna-pcag-mcherry-wpre-polya),trpc6的表达显著减少,而trpc5的表达均没有变化,证明敲除的特异性。同时,对于在erbb4阳性的中间神经元上敲除trpc6的小鼠,灌流rnrg1-β1不能增加海马ca1区锥体神经元的mipscs频率,即在erbb4阳性的中间神经元上敲除trpc6通道这一操作阻断了rnrg1-β1促进gaba释放的作用。
实施例6
本实施例通过在体电生理检测条件性敲除trpc6小鼠的变化。
1.实验动物饲养:erbb4-creert2小鼠、lsl-cas9小鼠在spf级动物中心饲养,饲养环境及条件同实施例1。
2.药品及主要试剂:他莫昔芬购自sigma-aldrich公司(中国,上海);注射用病毒购自和元生物技术(上海)股份有限公司(中国,上海)。
3.实验方法及具体步骤:采用在erbb4阳性的中间神经元上敲除trpc6小鼠(即erbb4-trpc6-/-小鼠)及其对照小鼠(即erbb4-creert2小鼠)进行在体电生理检测。小鼠构建方式操作同前(实施例5)。
在体电生理记录:
(1)电极制作及手术:采用自制多通道镍铬合金丝电极(#stablohm675,直径35μm,cfw,美国),在异氟烷麻醉状态下通过脑立体定位仪定位,将电极埋入小鼠海马ca1区(ap:-2.0mm,ml:+1.5mm,dv:1.6mm),使用牙科水泥固定电极。术后恢复一周后进行记录。
(2)场电位记录:将小鼠头上电极通过前置放大器连接多通道记录系统(32-channel,apollo,bio-signaltech),并将小鼠放入屏蔽箱中,开始记录海马脑区场电位。
(3)场电位信号分析:首先运用neuroexplorer对场电位信号进行功率谱分析,比较两组小鼠海马场电位功率谱改变。接着对各频段进行滤波,获得delta、theta、beta、gamma等节律性振荡信号。比较对照组小鼠与特异性敲除trpc6小鼠之间各频段节律震荡的差异。所有记录完成后取脑切片观察以确定电极记录位点的准确性。
4.分组处理:
图6中,control表示对照组小鼠,erbb4-trpc6-/-表示特异性敲除trpc6小鼠。其中,对照组小鼠为erbb4-creert2小鼠。
5.实验结果:
海马场电位结果提示在erbb4阳性的中间神经元上敲除trpc6的小鼠海马场电位功率明显高于对照组小鼠(图6d),尤其在beta段和gamma段有显著提高(图6e)。
实施例7
本实施例通过行为学检测条件性敲除trpc6小鼠的变化。
1.实验动物饲养:erbb4-creert2小鼠、lsl-cas9小鼠在spf级动物中心饲养,饲养环境及条件同实施例1。
2.药品及主要试剂:他莫昔芬购自sigma-aldrich公司(中国,上海);注射用病毒购自和元生物技术(上海)股份有限公司(中国,上海)。
3.实验方法及具体步骤:采用在erbb4阳性的中间神经元上敲除trpc6小鼠(即erbb4-trpc6-/-小鼠)及其对照小鼠(即erbb4-creert2小鼠)进行行为学检测。小鼠构建方式操作同前(实施例5)。
行为学实验:取两组小鼠进行旷场活动、y迷宫、三箱社交活动、前脉冲抑制实验等行为学检测。对于每项行为学实验,待测小鼠均于实验正式开始前1小时放置于行为学房间进行环境适应。
旷场活动检测时,将小鼠置于隔声箱内的试验箱(长45厘米×宽45厘米×高45厘米)中央自由探索30分钟,由置于箱内上方的红外摄像机记录其活动,随后统计其30分钟内的活动总距离。每轮行为学测试结束后均用50%的酒精清洁实验设备,清除气味,并待其彻底干燥后进行下一轮实验。
y迷宫检测时,将y形迷宫的三个臂分别被标记为a、b和c。小鼠被放在a臂的末端,让其在迷宫中自由探索5分钟。当小鼠连续探索三个不同的臂时,计算为一个交替行为。自发交替行为的百分比计算如下:交替行为(%)=((交替行为的数量)/(进臂总次数-2))×100。每轮行为学测试结束后均用50%的酒精清洁实验设备,清除气味,并待其彻底干燥后进行下一轮实验。
三箱社交活动检测时,首先将小鼠置于空的三个连接在一起的箱子内,让其自由探索五分钟;随后将两个空的有机玻璃圆筒放在两端的箱子内,同一位置放入箱内任其自由探索十分钟;最后,将其中一个圆筒内放入一只陌生小鼠,再将待测小鼠同一位置放入箱内,任其自由探索十分钟。实验结束后统计待测小鼠在空圆筒和有陌生小鼠的圆筒附近停留的时间。每轮行为学测试结束后均用50%的酒精清洁实验设备,清除气味,并待其彻底干燥后进行下一轮实验。
在进行前脉冲抑制实验时,小鼠被放置在一个安装在塑料框架上的有机玻璃管中。在正式试验之前,小鼠在70db的背景白噪声中适应5分钟,随后给出前脉冲刺激(75,80或85db的声音刺激)和听觉诱发的惊吓刺激(120db的声音刺激)。在惊吓刺激开始后的100毫秒内(采样频率为1khz)测量小鼠的运动。前脉冲抑制(%)的计算公式为:100×(惊吓刺激的反应幅度-前脉冲刺激的反应幅度)/惊吓刺激的反应幅度。每轮行为学测试结束后均用50%的酒精清洁实验设备,清除气味,并待其彻底干燥后进行下一轮实验。
4.分组处理:
图7中,control表示对照组小鼠,erbb4-trpc6-/-表示特异性敲除trpc6小鼠。其中,对照组小鼠为erbb4-creert2小鼠。
5.实验结果:
图7显示,在旷场测试中,erbb4-trpc6-/-小鼠表现出过度活动,其活动总距离明显升高;y迷宫测试中,敲除鼠交替行为的百分比下降,提示其工作记忆可能受损;敲除鼠还表现出社交能力的弱化和感觉门控能力受损。行为学结果表明,在erbb4阳性的中间神经元上敲除trpc6的小鼠存在一定程度上的精神分裂症样行为学缺陷。
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
序列表
<110>广州中医药大学(广州中医药研究院)
<120>神经调节蛋白1在制备增强trpc6通道活性产品中的应用
<160>1
<170>siposequencelisting1.0
<210>1
<211>65
<212>prt
<213>homosapiens
<400>1
serhisleuvallyscysalaglulysglulysthrphecysvalasn
151015
glyglyglucysphemetvallysaspleuserasnproserargtyr
202530
leucyslyscysproasngluphethrglyaspargcysglnasntyr
354045
valmetalaserphetyrlyshisleuglyilegluphemetgluala
505560
glu
65
- 还没有人留言评论。精彩留言会获得点赞!