用于减少动物中的粪臭素和/或吲哚的方法与流程
背景技术:
胞内劳森氏菌(lawsonia(l.)intracellularis)是猪增生性肠病("ppe")的致病因子,其影响基本上所有动物,包括:兔、雪貂、仓鼠、狐狸、马以及其它不同的动物如鸵鸟和鸸鹋。胞内劳森氏菌是全球猪中最普遍的肠道病原体,并且正在全球范围内造成猪生产中的重大损失。
胞内劳森氏菌疫苗已被批准用于在美国和欧洲(商标
杀死的胞内劳森氏菌疫苗也已在如wo2009144088a2、wo97/20050a1和wo2002/26250a2中进行描述。
猪肉气味是在猪肉的烹饪或食用过程中可以是明显的气味或味道。存在对于猪肉气味重要的几种化合物,最重要的是雄烯酮、粪臭素和吲哚。
雄烯酮(雄性类固醇信息素)在雄性猪的睾丸中产生。为了肉类生产而饲养的雄性猪经常在出生后不久就被去势,以防止动物中的公猪异味(猪肉气味)的发展。
相比之下,粪臭素和吲哚是雄性猪和雌性猪两者中的色氨酸代谢的分解产物。脂肪组织中如此高的粪臭素和吲哚浓度可以引起所述难闻的气味或味道。
贮存于脂肪组织中的粪臭素的量取决于几个方面,例如粪臭素的产生速率、肠通过时间、肠吸收和肝代谢。粪臭素的产生通过源于饮食或内源性蛋白质的氨基酸色氨酸的微生物分解而在肠中发生。肠中产生的大部分可利用的粪臭素跨越肠壁被吸收,并且在血液中转运到肝,在其中大多数被降解。然而,肝中的粪臭素降解被雄烯酮阻碍。降解产物然后在尿中排泄。粪便仅含有少量的粪臭素。未降解的粪臭素然后沉积在脂肪和肌肉中。
动物中粪臭素的量受几个参数影响。饮食成分影响粪臭素的脂肪浓度。进一步地,其它管理技术也在粪臭素生产中起作用。示例性地,以高放养率的猪具有比低放养率保持清洁的猪更高脂肪浓度的粪臭素。
skrlep等人2012(theveterinaryjournal;194;第417-419页)描述了猪肉气味甚至可以在具有肠道感染的去势猪中出现。skrlep等人2012研究了具有由胞内劳森氏菌和猪痢疾短螺旋体(brachyspirahyodysenteriae)引起的急性痢疾暴发的猪,并且导致恶病质和高死亡率。
重要的是,已描述了补充有抗生素(泰乐菌素或维吉尼亚霉素)或抗生素饲料添加剂的饮食一般而言不影响粪臭素的脂肪浓度(hawe等人1992;animprod.;5454:第413-419页;hansen等人1994;livestprodsci;39:第269-274页;xue等人1997;jshap;5(4);第151-158页)。仅对于一种抗生素(杆菌肽),观察到粪臭素水平的减少(hansen等人1997;animalscience,64,351–363)。根据所述研究尚不清楚通过抗生素治疗肠中的细菌感染是否对脂肪组织中的粪臭素或吲哚水平具有任何或至少基本的益处。
总之,猪的脂肪组织中的粪臭素或吲哚水平受几个参数的影响,所述参数例如肠中粪臭素或吲哚的肠吸收、肝代谢、饮食成分、猪的放养率、公猪的去势、肠感染等等。然而,抗生素饲料一般而言不影响粪臭素或吲哚的脂肪浓度。
因此,需要分别用于降低猪和猪的猪肉气味中的粪臭素或吲哚水平的新方法。
技术实现要素:
在描述本发明的各方面之前,必须注意,如本文和所附权利要求中所使用的,单数形式“一个”、“一种”和“该/所述”包括复数指示物,除非上下文另有明确说明。因此,例如,提及“一种抗原”包括多种抗原,提及“病毒”是提及本领域技术人员已知的一种或多种病毒及其等价物,等等。除非另有定义,否则本文使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常理解相同的含义。尽管现在描述了优选方法、装置和材料,但类似于或等价于本文描述的那些的任何方法和材料都可以用于本发明的实践或测试中。本文提到的所有出版物都引入本文作为参考,用于描述且公开如出版物中报道的细胞系、载体和方法学的目的,所述出版物可以与本发明结合使用。本文中的任何内容均不应解释为承认本发明无权凭借在先发明而早于此类公开。
本发明解决了现有技术中固有的问题,并且提供了现有技术中的明显进步。一般地,本发明提供了用于降低动物中的粪臭素和/或吲哚浓度或量的方法,其包括向所述动物施用有效量的包含胞内劳森氏菌抗原的免疫原性组合物。
进一步地,本发明提供了预防动物中的猪肉气味的方法,其包括向所述动物施用有效量的包含胞内劳森氏菌抗原的免疫原性组合物。
有利地,通过本公开内容提供的实验数据公开了通过本发明的方法,可以降低猪组织中的粪臭素和/或吲哚水平。进一步地,通过降低猪组织中的粪臭素和/或吲哚水平,可以降低猪肉气味或公猪异味(boartaint)。
术语“降低”意指与相同物种的非免疫对照组的对象相比,粪臭素和/或吲哚的浓度或量降低至少10%,优选至少20%,更优选至少30%,甚至更优选至少40%,甚至更优选至少50%,甚至更优选至少60%,甚至更优选至少70%,甚至更优选至少80%,甚至更优选至少90%,甚至更优选至少95%,且最优选100%。如何测量粪臭素和/或吲哚的浓度是本领域技术人员的一般知识。示例性地,可以通过高效液相层析测量粪臭素和/或吲哚的浓度。
术语“粪臭素和/或吲哚”是本领域技术人员众所周知的。粪臭素也被称为3-甲基吲哚。粪臭素和吲哚两者均为雄性和雌性猪两者中色氨酸代谢的分解产物。
术语量与术语浓度可互换使用。
术语“预防”一般涉及将有效量的本发明的免疫原性组合物施用于有需要或可以受益于此类治疗/预防的对象或对象畜群。术语“治疗”指一旦对象或畜群的至少一些动物被/已经被此类胞内劳森氏菌感染,并且其中此类动物已经显示了由此类胞内劳森氏菌感染引起或与此类胞内劳森氏菌感染相关的一些临床体征,则施用有效量的免疫原性组合物。术语“预防”指在此类对象被胞内劳森氏菌的任何感染之前、或者至少在此类动物未显示由此类胞内劳森氏菌感染引起或与此类胞内劳森氏菌感染相关的任何临床体征时、或一群动物中的任何动物均未显示由此类胞内劳森氏菌感染引起或与此类胞内劳森氏菌感染相关的任何临床体征时的对象施用。术语“预防”和“治疗和/或预防”在本申请中可互换使用。
如本文使用的,术语“有需要”或“有需要的”意指施用/治疗与健康或临床体征中的加强或改善、或者对动物的健康的任何其它积极的医学作用有关,所述动物接受根据本发明的免疫原性组合物。
如本文使用的,在组合物的上下文中,术语“有效量”意指能够诱导免疫应答的免疫原性组合物的量,所述免疫应答降低了动物中疾病的发生率、或者减轻了感染的严重性或疾病的发生率,并且因此降低了所述动物中的粪臭素和/或吲哚量。此类有效量能够减轻畜群中的特定胞内劳森氏菌感染的发生率、或降低特定胞内劳森氏菌感染的临床体征的严重性,并且因此降低了所述动物中的粪臭素和/或吲哚量。特别地,有效量指tcid50/剂量。可替代地,在疗法的上下文中,术语“有效量”指这样的疗法量,其足以降低或改善疾病或病症或者其一种或多种症状的严重性或持续时间,预防疾病或病症的进展,引起疾病或病症的消退,预防与疾病或病症相关的一种或多种症状的复发、发展、发作或进展,或者增强或改善另一种疗法或治疗剂的预防或治疗。
术语“免疫原性组合物”指包含至少一种抗原的组合物,所述抗原在免疫原性组合物施用于其的宿主中引发免疫应答。此类免疫应答可以是对本发明的免疫原性组合物的细胞和/或抗体介导的免疫应答。优选地,免疫原性组合物诱导免疫应答,并且更优选地,赋予针对胞内劳森氏菌感染的一种或多种临床体征的保护性免疫。宿主也被描述为“对象”。优选地,本文描述或提到的任何宿主或对象是动物。
通常,“免疫应答”包括但不限于下述效应中的一种或多种:特异性针对本发明的免疫原性组合物中包括的一种或多种抗原的抗体、b细胞、辅助性t细胞、抑制性t细胞、和/或细胞毒性t细胞和/或γ-δt细胞的产生或激活。优选地,宿主将显示保护性免疫应答或治疗应答。
“保护性免疫应答”或“保护性免疫”将通过由受感染宿主正常展示的临床体征的降低或缺乏,更快的恢复时间,和/或受感染宿主的组织或体液或排泄物中减少的感染持续时间或减少的病原体滴度得到证实。
在其中宿主展示保护性免疫应答,使得对新感染的抵抗力得到增强和/或疾病的临床严重性得到降低的情况下,免疫原性组合物被描述为“疫苗”。
术语“胞内劳森氏菌”是本领域技术人员已知的。胞内劳森氏菌是猪增生性肠病(“ppe”)的致病因子。
如本文使用的,“抗原”指但不限于在宿主中引发针免疫应答的组分,所述免疫应答针对包含此类抗原或其免疫活性组分的目的免疫原性组合物或疫苗。抗原或免疫活性组分可以是完整的微生物(以灭活或修饰的活形式),或者其任何片段或级分,如果施用于宿主,其可以在宿主中引发免疫应答。抗原可以是或可以包含以其原始形式,或作为所谓的改良活疫苗(mlv)中的减毒生物的整个活生物。抗原可以进一步包含所述生物的适当要素(亚单位疫苗),由此通过以下生成这些要素:破坏整个生物或此类生物的生长培养物和获得所需结构的后续纯化步骤,或者通过合适系统(如但不限于细菌、昆虫、哺乳动物或其它物种)的适当操纵诱导的合成过程,以及任选地通过后续的分离和纯化程序,或者通过使用合适的药物组合物直接掺入遗传材料,在需要疫苗的动物中诱导所述合成过程(多核苷酸疫苗接种)。抗原可以包含在所谓的死疫苗(kv)中通过适当方法灭活的整个生物。如果生物是细菌,则死疫苗称为死菌苗。
劳森氏菌属抗原
在本发明的一个方面,胞内劳森氏菌抗原是杀死的胞内劳森氏菌或修饰的活胞内劳森氏菌。
在本发明的一个方面,杀死的胞内劳森氏菌是全细胞杀死的胞内劳森氏菌。
在wo2009144088a2、wo97/20050a1和wo2002/26250a2中已描述了杀死的胞内劳森氏菌疫苗。
任何常规的灭活方法都可以用于本发明的目的。因此,可以通过本领域技术人员已知的化学和/或物理处理来进行灭活。优选的灭活方法包括添加环化二元乙烯亚胺(bei),包括添加已被环化为二元乙烯亚胺(bei)的氢溴酸2-溴乙撑胺(bea)溶液。优选的进一步的化学灭活剂包含但不限于tritonx-100、脱氧胆酸钠、十六烷基三甲基溴化铵、β-丙内酯、硫柳汞、苯酚和甲醛(福尔马林)。然而,灭活也可以包括中和步骤。优选的中和剂包括但不限于硫代硫酸钠、亚硫酸氢钠等等。
优选的福尔马林灭活条件包括约0,02%(v/v)–2,0%(v/v),更优选约0,1%(v/v)–1,0%(v/v),再更优选约0,15%(v/v)–0,8%(v/v),甚至更优选约0,16%(v/v)–0,6%(v/v),且最优选约0,2%(v/v)–0,4%(v/v)的福尔马林浓度。温育时间取决于胞内劳森氏菌的抵抗力。一般而言,温育过程进行直到在合适的培养系统中无法检测到胞内劳森氏菌的生长。
优选地,灭活的胞内劳森氏菌是福尔马林灭活的,优选使用如上文所述的浓度。
优选的β-丙内酯灭活条件包括约0,005%(v/v)–4,0%(v/v),且更优选约0,05%(v/v)–2,0%(v/v)的β-丙内酯浓度。温育时间取决于胞内劳森氏菌的抵抗力。一般而言,温育过程进行直到在合适的培养系统中无法检测到胞内劳森氏菌的生长。
优选地,灭活的胞内劳森氏菌通过β-丙内酯灭活,优选使用如上文所述的浓度。
优选地,免疫原性组合物包含102至1014个杀死的胞内劳森氏菌细胞/剂量,更优选104至1012个杀死的胞内劳森氏菌细胞/剂量,且甚至更优选106至1010个杀死的胞内劳森氏菌细胞/剂量。
优选地,免疫原性组合物包含25至2000μg杀死的胞内劳森氏菌/剂量,更优选50至1000μg杀死的胞内劳森氏菌/剂量,且甚至更优选100至800μg杀死的胞内劳森氏菌/剂量。
在本发明的一个方面,免疫原性组合物包含106至1010个杀死的胞内劳森氏菌细胞/剂量、或100至800μg杀死的胞内劳森氏菌/剂量。
在本发明的一个方面,修饰的活胞内劳森氏菌是无毒力分离株,或胞内劳森氏菌是减毒的。
术语“减毒的”指具有降低毒力的病原体。在本发明中,“减毒”与“无毒力”同义。在本发明中,减毒的胞内劳森氏菌是这样的胞内劳森氏菌,其中毒力已降低,使得它不引起胞内劳森氏菌感染的临床体征,但能够在靶动物中诱导免疫应答,但也可以意指与由非减毒的胞内劳森氏菌感染且未接受减毒细菌的动物“对照组”相比,临床体征在由减毒的胞内劳森氏菌的感染动物中的发生率或严重性降低。在这个上下文中,术语“降低/降低的”意指与如上文定义的对照组相比,至少10%,优选25%,甚至更优选50%,再更优选60%,甚至更优选70%,再更优选80%,甚至更优选90%,甚至更优选95%,且最优选100%的降低。因此,减毒的无毒力胞内劳森氏菌菌株或分离株是适合于掺入包含修饰的活胞内劳森氏菌的免疫原性组合物内的菌株或分离株。
胞内劳森氏菌的致病性和非致病性减毒细菌菌株是现有技术中众所周知的。例如,wo96/39629和wo05/011731描述了胞内劳森氏菌的非致病性减毒菌株及其制备方法。
特别地,wo96/39629描述了胞内劳森氏菌的减毒细菌菌株和保藏菌株atcc55783的制备。
wo05/011731描述了胞内劳森氏菌的减毒细菌菌株和保藏菌株pta-4926的制备。
在本发明的一个方面,无毒力分离株是pta-4926或atcc55783。
在本发明的一个方面,无毒力胞内劳森氏菌分离株或减毒的胞内劳森氏菌是
待施用于易感动物的推荐剂量优选为约3.0tcid50(组织培养感染剂量50%终点)/剂量至约9.0tcid50/剂量,且更优选为约4.0tcid50/剂量至约7.0tcid50/剂量。
在本发明的一个方面,免疫原性组合物包含约3.0至约9.0tcid50的修饰的活胞内劳森氏菌/剂量。
在本发明的一个方面,免疫原性组合物包含约4.0至约7.0tcid50的修饰的活胞内劳森氏菌/剂量。
动物
术语“动物”优选指哺乳动物,例如小鼠、大鼠、豚鼠、兔、仓鼠、猪、绵羊、犬、猫、马、猴或牛。更优选地,动物是猪。
在本发明的一个方面,动物是哺乳动物。
在本发明的一个方面,动物是猪。
必须理解,术语“猪”包含仔猪、母猪、小母猪、公猪等。
在本发明的一个方面,动物或猪是雄性或雌性的。
在本发明的一个方面,动物或猪是雄性的。
在本发明的一个方面,雄性动物或猪是去势或未去势的。
在本发明的一个方面,动物是雌性猪或去势的雄性猪。
肠道或劳森氏菌属感染
在本发明的一个方面,动物患有胃肠道感染。
在本发明的一个方面,动物患有肠道感染。
如本文使用的,术语“胃肠道感染”或“肠道感染”指所述动物的胃肠道或肠道中的病毒、细菌或寄生虫感染。所述感染可以在所述动物中引起临床或亚临床肠疾病。
在本发明的一个方面,动物患有由肠道病原体的感染。优选地,肠道病原体选自(但不限于)以下列表:胞内劳森氏菌、短螺旋体属(brachyspira)物种、致病性大肠杆菌(escherichiacoli)、沙门氏菌属(salmonella)物种、汉普森短螺旋体(b.hampsonii)和b.murdochii。
在本发明的一个方面,动物患有由胞内劳森氏菌的感染。
在本发明的一个方面,动物患有由胞内劳森氏菌和猪痢疾短螺旋体的感染。
组织
在本发明的一个方面,粪臭素是3-甲基吲哚。
在本发明的一个方面,粪臭素和/或吲哚的浓度在肠、脂肪、肌肉、肉或肝组织中是降低的。
在本发明的一个方面,粪臭素和/或吲哚的浓度在脂肪、肌肉或肉中是降低的。
在本发明的一个方面,该方法降低了猪肉气味或公猪异味。
猪肉气味
如本文使用的,术语“猪肉气味”或“公猪异味”涉及猪肉的气味和/或风味,其一般而言在所述猪肉的烹饪或食用过程中变得明显。所述气味和/或风味可以达到肉对于人消耗无法接受的程度。一般而言的雄性猪以及至较少程度的雌性猪和去势的雄性猪也显示出与公猪异味或猪气味相关的现象。存在对于猪肉气味重要的几种化合物,最重要的是雄烯酮、粪臭素和吲哚。脂肪组织/液态脂肪中粪臭素的感觉阈值为0.2μg/g(参见示例性的skrlep等人2012(theveterinaryjournal;194;第417-419页))。脂肪组织/液态脂肪中吲哚的感觉阈值为0.3μg/g。
在本发明的一个方面,该方法降低了胞内劳森氏菌感染的临床体征。
如本文使用的,术语胞内劳森氏菌感染的“临床体征”包括但不限于降低的平均每日重量增长(adwg),增加的重量增长变化性,增加的饲料转换率,回肠、盲肠和结肠中的肉眼可见病灶,腹泻,可检测的细菌负荷,胞内劳森氏菌的脱落或其组合。
因此,在本发明的一个方面,所述方法导致与相同物种的未免疫动物相比,选自以下的功效参数中的改善:增加的平均每日重量增长(adwg),降低的重量增长变化性,优化的饲料转换率,降低的回肠、盲肠和结肠中的肉眼可见病灶,减少的腹泻,降低的细菌负荷,降低的胞内劳森氏菌脱落或其组合。
优选地,与未处理或用在本发明之前可获得的免疫原性组合物处理,但随后被特定胞内劳森氏菌感染的对象相比,临床体征在发生率或严重性方面降低至少10%,更优选至少20%,再更优选至少30%,甚至更优选至少40%,再更优选至少50%,甚至更优选至少60%,再更优选至少70%,甚至更优选至少80%,再更优选至少90%,再更优选至少95%并且最优选100%。
粪臭素浓度的降低
在本发明的一个方面,与由胞内劳森氏菌感染的未接种疫苗的对照组的动物相比,粪臭素浓度在脂肪组织中降低了至少50%。
在本发明的一个方面,粪臭素的浓度在由胞内劳森氏菌感染的动物的脂肪组织中降低至小于0.2μg/g。
在本发明的一个方面,粪臭素的浓度在由胞内劳森氏菌感染的动物的脂肪组织中降低至小于0.15μg/g。
在本发明的一个方面,粪臭素的浓度在由胞内劳森氏菌感染的动物的脂肪组织中降低至小于0.1μg/g。
在本发明的一个方面,粪臭素的浓度在由胞内劳森氏菌感染的动物的脂肪组织中降低至低于感觉阈值。
吲哚浓度的降低
在本发明的一个方面,与由胞内劳森氏菌感染的未接种疫苗的对照组的动物相比,吲哚浓度在脂肪组织中降低了至少50%。
在本发明的一个方面,吲哚的浓度在由胞内劳森氏菌感染的动物的脂肪组织中降低至小于0.3μg/g。
在本发明的一个方面,吲哚的浓度在由胞内劳森氏菌感染的动物的脂肪组织中降低至小于0.15μg/g。
在本发明的一个方面,吲哚的浓度在由胞内劳森氏菌感染的动物的脂肪组织中降低至小于0.05μg/g。
在本发明的一个方面,吲哚的浓度在由胞内劳森氏菌感染的动物的脂肪组织中降低至低于感觉阈值。
动物的年龄
在本发明的一个方面,免疫原性组合物从三周龄开始施用于动物。
在本发明的一个方面,免疫原性组合物从10日龄开始施用于动物。
在本发明的一个方面,免疫原性组合物从一日龄开始施用于动物。
在本发明的一个方面,免疫原性组合物进一步包含兽医学可接受的载体。
在本发明的一个方面,兽医学可接受的载体是稀释剂。
“稀释剂”可以包括水、盐水、右旋糖、乙醇、甘油等等。等渗剂尤其可以包括氯化钠、右旋糖、甘露醇、山梨糖醇和乳糖。稳定剂尤其包括白蛋白和乙二胺四乙酸的碱金属盐。
在本发明的一个方面,兽医学可接受的载体是生理学缓冲液。
在本发明的一个方面,药学可接受的载体是磷酸盐缓冲盐水。
优选地,免疫原性组合物进一步包含蔗糖明胶稳定剂。
优选地,免疫原性组合物可以进一步包括一种或多种其它免疫调节剂,例如白介素、干扰素或其它细胞因子。在本发明的上下文中有用的佐剂和添加剂的量和浓度可以由技术人员容易地确定。
在本发明的一个方面,所述兽医学可接受的载体选自溶剂、分散介质、包衣、稳定试剂、稀释剂、防腐剂、抗菌剂和抗真菌剂、等渗剂、吸收延迟剂、佐剂、免疫刺激剂及其组合。
在一些方面,本发明的免疫原性组合物含有佐剂。如本文使用的,“佐剂”可以包括氢氧化铝和磷酸铝,皂苷例如quila、qs-21(cambridgebiotechinc.,cambridgema)、gpi-0100(galenicapharmaceuticals,inc.,birmingham,al),油包水乳剂,水包油乳剂,水包油包水乳剂。乳剂可以特别地基于轻质液态石蜡油(欧洲药典型);类异戊二烯油,例如角鲨烷或角鲨烯;源于烯烃,特别是异丁烯或癸烯的低聚的油;含有线性烷基的酸或醇的酯,更特别为植物油、油酸乙酯、丙二醇二(辛酸酯/癸酸酯)、甘油三(辛酸酯/癸酸酯)或丙二醇二油酸酯;支链脂肪酸或醇的酯,特别是异硬脂酸酯。该油与乳化剂结合使用,以形成乳剂。乳化剂优选为非离子型表面活性剂,特别是脱水山梨醇、二缩甘露醇(例如脱水甘露醇油酸酯)、二醇、聚甘油、丙二醇以及油酸、异硬脂酸,蓖麻油酸或羟基硬脂酸的酯,其任选地是乙氧基化的,以及聚氧丙烯-聚氧乙烯共聚物嵌段,特别是pluronic产品,尤其是l121。参见hunter等人,thetheoryandpracticalapplicationofadjuvants(编辑stewart-tull,d.e.s.),johnwileyandsons,ny,第51-94页(1995),以及todd等人,vaccine15:564-570(1997)。示例性佐剂是由m.powell和m.newman编辑的“vaccinedesign,thesubunitandadjuvantapproach”,plenumpress,1995的第147页上描述的spt乳剂,以及在同一本书的第183页上描述的乳剂mf59。
佐剂的进一步实例是选自丙烯酸或甲基丙烯酸的聚合物以及马来酸酐和烯基衍生物的共聚物的化合物。有利的佐剂化合物是丙烯酸或甲基丙烯酸的聚合物,其尤其与糖或多元醇的聚烯基醚交联。这些化合物由术语卡波姆(phameuropa,第8卷,第2期,1996年6月)已知。本领域技术人员还可以参考美国专利号2,909,462,其描述了与多羟基化化合物交联的此类丙烯酸类聚合物,所述多羟基化化合物具有至少3个羟基,优选不多于8个,至少三个羟基的氢原子被替换为具有至少2个碳原子的不饱和脂肪族原子团。优选的原子团是含有2至4个碳原子的原子团,例如乙烯基、烯丙基和其它烯键式不饱和基团。不饱和原子团本身可以含有其它取代基,例如甲基。以名称carbopol;(bfgoodrich,ohio,usa)销售的产品是特别适当的。它们与烯丙基蔗糖或烯丙基季戊四醇交联。在这些之中,可以提到carbopol974p、934p和971p。最优选的是carbopol971p的使用。在马来酸酐和烯基衍生物的共聚物中有共聚物ema(monsanto),其是马来酸酐和乙烯的共聚物。这些聚合物在水中的溶解导致酸溶液,其优选被中和至生理ph,以便提供免疫原性、免疫学或疫苗组合物本身将掺入其内的佐剂溶液。
进一步合适的佐剂尤其包括但不限于ribi佐剂系统(ribiinc.),嵌段共聚物(cytrx,atlantaga),saf-m(chiron,emeryvilleca),单磷酰脂质a,阿夫立定脂胺佐剂,来自大肠杆菌的不耐热肠毒素(重组或其它形式),霍乱毒素,ims1314或胞壁酰二肽,或者天然存在的或重组的细胞因子或其类似物,或者内源性细胞因子释放的刺激物。
预计佐剂可以以约100μg至约10mg/剂量的量,优选以约100μg至约10mg/剂量的量,更优选以约500μg至约5mg/剂量的量,甚至更优选以约750μg至约2.5mg/剂量的量,且最优选以约1mg/剂量的量添加。可替代地,佐剂可以以按最终产物的体积计约0.01至50%的浓度,优选以约2%至30%的浓度,更优选以约5%至25%的浓度,再更优选以约7%至22%的浓度,且最优选以10%至20%的浓度。
在本发明的一个方面,所述兽医学可接受的载体是选自以下的佐剂:氢氧化铝、磷酸铝、皂苷、油包水乳剂、水包油乳剂、水包油包水乳剂、丙烯酸或甲基丙烯酸的聚合物、马来酸酐和烯基衍生物的共聚物、ribi佐剂系统、嵌段共聚物、saf-m、单磷酰脂质a、阿夫立定脂胺、来自大肠杆菌的不耐热肠毒素(重组或其它形式)、霍乱毒素、ims1314、胞壁酰二肽及其组合。
在本发明的一个方面,兽医学可接受的载体是水包油包水乳剂或卡波姆。
在本发明的一个方面,其中免疫原性组合物施用一次。
此外已显示了在此类免疫原性组合物的此类单剂量施用后,一个剂量的本发明的免疫原性组合物是有效的。
在本发明的一个方面,免疫原性组合物配制用于单剂量施用。
优选地,单剂量具有约0.1ml至2.5ml,更优选约0.2ml至2.0ml,甚至更优选约0.2ml至1.75ml,再更优选约0.2ml至1.5ml,甚至更优选约0.4ml至1.25ml,甚至更优选约0.4ml至1.0ml的总体积,其中单个0.5ml剂量或1.0ml剂量是最优选的。最优选地,单剂量具有0.5ml、1ml、1.5ml或2ml的总体积。
然而,免疫原性组合物可以以两个或更多个剂量施用,其中第一个剂量在第二个(加强剂)剂量施用之前施用。优选地,第二个剂量在第一个剂量之后至少15天施用。更优选地,第二个剂量在第一个剂量之后的15至40天之间施用。甚至更优选地,第二个剂量在第一个剂量之后至少17天施用。再更优选地,第二个剂量在第一个剂量之后的17至30天之间施用。甚至更优选地,第二个剂量在第一个剂量之后至少19天施用。再更优选地,第二个剂量在第一个剂量之后的19至25天之间施用。最优选地,第二个剂量在第一个剂量之后至少21天施用。在两次施用方案的一个优选方面,免疫原性组合物的第一和第二个剂量两者均以相同的量施用。优选地,每个剂量为上文指定的优选量,其中对于第一个剂量和第二个剂量1ml的剂量是最优选的。除第一个剂量和第二个剂量方案之外,替代实施方案包含进一步的后续剂量。例如,可以在这些方面中施用第三个、第四个或第五个剂量。优选地,以与第一个剂量相同的量施用后续的第三个、第四个和第五个剂量方案,其中各剂量之间的时帧与上文提到的第一个剂量和第二个剂量之间的时机一致。
在本发明的一个方面,免疫原性组合物以两个剂量施用。
优选地,免疫原性组合物局部或全身施用。照常规使用的合适的施用途径是经口或肠胃外施用,例如鼻内、静脉内、肌内、腹膜内、皮下以及吸入。然而,取决于化合物的性质和作用模式,免疫原性组合物也可以通过其它途径施用。然而,最优选地,免疫原性组合物鼻内或经口施用,例如通过饮用水或通过经口灌服。
在本发明的一个方面,其中所述免疫原性组合物肌内、皮下、鼻内或经口施用。
在本发明的一个方面,杀死的胞内劳森氏菌肌内或皮下施用。
在本发明的一个方面,修饰的活胞内劳森氏菌经口或鼻内施用。
在本发明的一个方面,免疫原性组合物是疫苗。
具体实施方式
本发明提供了下述实施方案
1.一种用于降低动物中的粪臭素和/或吲哚浓度或量的方法,其包括向所述动物施用有效量的包含胞内劳森氏菌抗原的免疫原性组合物。
2.一种包含胞内劳森氏菌抗原的免疫原性组合物,其用于降低动物中的粪臭素和/或吲哚浓度或量的方法中,所述方法包括向所述动物施用有效量的所述免疫原性组合物。
3.一种预防动物中的猪肉气味的方法,其包括向所述动物施用有效量的包含胞内劳森氏菌抗原的免疫原性组合物。
4.一种包含胞内劳森氏菌抗原的免疫原性组合物,其用于预防动物中的猪肉气味的方法中,所述方法包括向所述动物施用有效量的所述免疫原性组合物。
5.根据条款1至4中任何一个的方法,其中所述胞内劳森氏菌抗原是杀死的胞内劳森氏菌或修饰的活胞内劳森氏菌。
6.根据条款5的方法,其中所述杀死的胞内劳森氏菌是全细胞杀死的胞内劳森氏菌。
7.根据条款6的方法,其中所述免疫原性组合物包含106至1010个杀死的胞内劳森氏菌细胞/剂量、或100至800μg量的杀死的胞内劳森氏菌/剂量。
8.根据条款5的方法,其中所述修饰的活胞内劳森氏菌是无毒力分离株,或所述胞内劳森氏菌是减毒的。
9.根据条款8的方法,其中所述无毒力分离株是pta-4926或atcc55783。
10.根据条款8或9的方法,其中所述免疫原性组合物包含约3.0至约9.0tcid50的修饰的活胞内劳森氏菌/剂量。
11.根据条款8至10中任何一个的方法,其中所述免疫原性组合物包含约4.0至约7.0tcid50的修饰的活胞内劳森氏菌/剂量。
12.根据条款1至11中任何一个的方法,其中所述动物是猪。
13.根据条款1至12中任何一个的方法,其中所述动物或猪是雄性或雌性的。
14.根据条款1至13中任何一个的方法,其中所述动物或猪是雄性的。
15.根据条款14的方法,其中所述雄性动物或猪是去势或未去势的。
16.根据条款1至15中任何一个的方法,其中所述动物患有肠道感染。
17.根据条款1至16中任何一个的方法,其中所述动物患有由肠道病原体的感染。
18.根据条款1至17中任何一个的方法,其中所述动物患有胞内劳森氏菌的感染、或胞内劳森氏菌和猪痢疾短螺旋体的感染。
19.根据条款1或2或5至18中任何一个的方法,其中粪臭素是3-甲基吲哚。
20.根据条款1至19中任何一个的方法,其中所述粪臭素和/或吲哚的浓度在肠、脂肪、肌肉、肉或肝组织中是降低的。
21.根据条款1至20中任何一个的方法,其中所述粪臭素和/或吲哚的浓度在脂肪、肌肉或肉中是降低的。
22.根据条款1至21中的任一项所述的方法,其中所述方法降低了猪肉气味或公猪异味。
23.根据条款1至22中任何一个的方法,其中所述方法减少了胞内劳森氏菌感染的临床体征。
24.根据条款1至23中任何一个的方法,其中与由胞内劳森氏菌感染的未接种疫苗的对照组的动物相比,所述粪臭素浓度在脂肪组织中降低了至少50%。
25.根据条款1至24中任何一个的方法,其中所述粪臭素的浓度在由胞内劳森氏菌感染的动物的脂肪组织中降低至小于0.2μg/g。
26.根据条款1至24中任何一个的方法,其中所述粪臭素的浓度在由胞内劳森氏菌感染的动物的脂肪组织中降低至小于0.15μg/g。
27.根据条款1至24中任何一个的方法,其中所述粪臭素的浓度在由胞内劳森氏菌感染的动物的脂肪组织中降低至小于0.1μg/g。
28.根据条款1至27中任何一个的方法,其中所述粪臭素的浓度在由胞内劳森氏菌感染的动物的脂肪组织中降低至低于感觉阈值。
29.根据条款1至28中任何一个的方法,其中与由胞内劳森氏菌感染的未接种疫苗的对照组的动物相比,所述吲哚浓度在脂肪组织中降低了至少50%。
30.根据条款1至29中任何一个的方法,其中所述吲哚的浓度在由胞内劳森氏菌感染的动物的脂肪组织中降低至小于0.3μg/g。
31.根据条款1至29中任何一个的方法,其中所述吲哚的浓度在由胞内劳森氏菌感染的动物的脂肪组织中降低至小于0.15μg/g。
32.根据条款1至29中任何一个的方法,其中所述吲哚的浓度在由胞内劳森氏菌感染的动物的脂肪组织中降低至小于0.05μg/g。
33.根据条款1至32中任何一个的方法,其中所述吲哚的浓度在由胞内劳森氏菌感染的动物的脂肪组织中降低至低于感觉阈值。
34.根据条款1至33中任何一个的方法,其中所述免疫原性组合物从三周龄开始施用于所述动物。
35.根据条款1至34中任何一个的方法,其中所述免疫原性组合物从10日龄开始施用于所述动物。
36.根据条款1至35中任何一个的方法,其中所述免疫原性组合物从一日龄开始施用于所述动物。
37.根据条款1至36中任何一个的方法,其中所述免疫原性组合物进一步包含兽医学可接受的载体。
38.根据条款37的方法,其中所述兽医学可接受的载体选自溶剂、分散介质、包衣、稳定试剂、稀释剂、防腐剂、抗菌剂和抗真菌剂、等渗剂、吸收延迟剂、佐剂、免疫刺激剂及其组合。
39.根据条款37或38的方法,其中所述兽医学可接受的载体是佐剂或生理学缓冲液。
40.根据条款37至39中任何一个的方法,其中所述兽医学可接受的载体是选自以下的佐剂:氢氧化铝、磷酸铝、皂苷、油包水乳剂、水包油乳剂、水包油包水乳剂、丙烯酸或甲基丙烯酸的聚合物、马来酸酐和烯基衍生物的共聚物、ribi佐剂系统、嵌段共聚物、saf-m、单磷酰脂质a、阿夫立定脂胺、来自大肠杆菌的不耐热肠毒素(重组或其它形式)、霍乱毒素、ims1314、胞壁酰二肽及其组合。
41.根据条款37至40中任何一个的方法,其中所述兽医学可接受的载体是水包油包水型乳剂或卡波姆。
42.根据条款1至41中任何一个的方法,其中所述免疫原性组合物施用一次。
43.根据条款1至41中任何一个的方法,其中所述免疫原性组合物以两个剂量施用。
44.根据条款1至43中任何一个的方法,其中所述免疫原性组合物肌内、皮下、鼻内或经口施用。
45.根据条款1至7和12至44中任何一个的方法,其中所述被杀死的胞内劳森氏菌肌内或皮下施用。
46.根据条款1至5和8至44中任何一个的方法,其中所述修饰的活胞内劳森氏菌经口或鼻内施用。
47.根据条款1至46中任何一个的方法,其中所述免疫原性组合物是疫苗。
附图说明
下述附图构成本说明书的部分,并且包括以进一步证实本发明的某些方面。通过参考与本文呈现的具体实施方案的详细描述组合的这些附图中的一个或多个附图,可以更好地理解本发明。
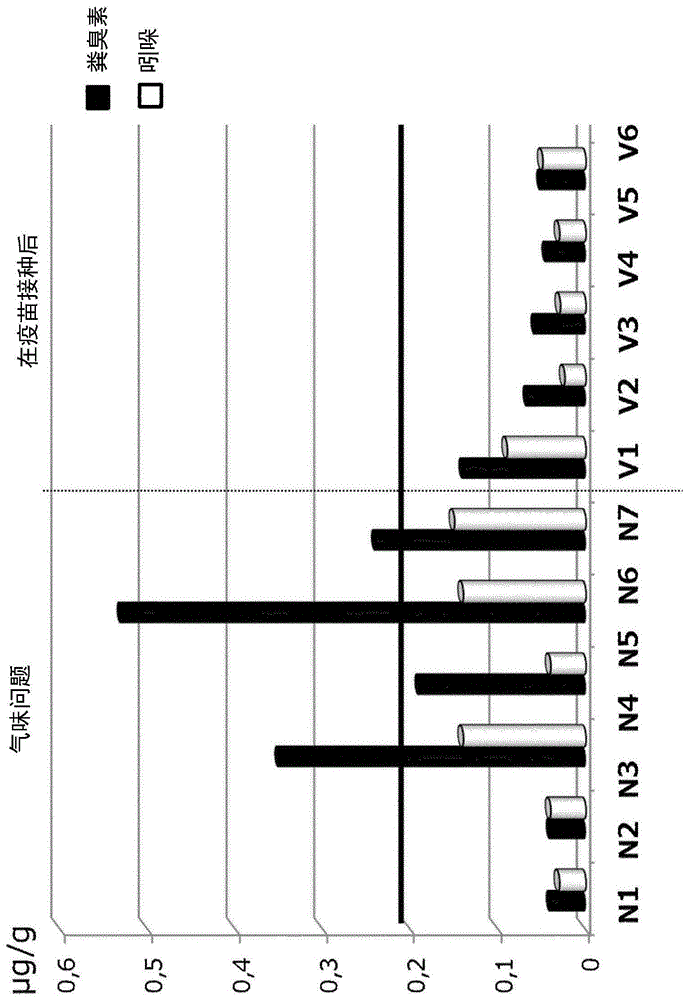
图1示出了在背脂肪样品中的粪臭素和吲哚浓度。n:在气味问题期间未接种疫苗,v:接种疫苗。
实施例
下述实施例仅预期示出本发明。它们不应以任何方式限制权利要求的范围。
在500头母猪出生至育成农场的后期肥育者中观察到黑焦油性腹泻和猝死,指示由胞内劳森氏菌感染引起的疾病。在尸检时发现覆盖有假膜的回肠粘膜的软管状增厚,证实了临床诊断(数据未显示)。进一步地,诊断了由猪痢疾短螺旋体的感染(数据未显示)。此外,对于li(胞内劳森氏菌)抗体(bioscreen回肠炎抗体-elisa)测试了血清样品,确认了在120日龄时的血清转换(数据未显示)。大约同一时间,猪肉销售目的地报告了他们的顾客投诉了猪肉气味。这种猪肉来自有phe问题的分批。该分批的七个屠体样品提交给nhfoodsltd.r&dcenter,用于测定背脂肪中的粪臭素和吲哚浓度。粪臭素浓度为0.04-0.53μg/g(平均0.22μg/g),三个样品(42%)超过了0.2μg/g的感觉阈值(参见图1)。吲哚浓度小于0.3μg/g的感觉阈值,范围为0.03-0.15μg/g(平均0.09μg/g)(参见图1)。
根据制造商的指示,在40日龄时实施了用经口活减毒的胞内劳森氏菌疫苗(
粪臭素为肠道中色氨酸的微生物分解的副产物,其具有强烈的气味。脂肪中未降解的粪臭素是升高的。然而,针对li感染的疫苗接种改善了临床症状以及猪肉气味。我们认定由胞内劳森氏菌的感染可导致增加的异常发酵或增加的肠道吸收,其引起肠道中升高的粪臭素产生。
- 还没有人留言评论。精彩留言会获得点赞!
- 双吲哚甲烷衍生物促进CuCl催化Sonogashira交叉偶联反应的方法
- 吲哚-3-甲醇、二吲哚甲烷及其衍生物用于治疗过敏性咽炎药物的应用
- 吲哚-3-甲醇、二吲哚甲烷及其衍生物用于治疗接触性皮炎药物的应用
- 吲哚-3-甲醇、二吲哚甲烷及其衍生物用于治疗银屑病药物的应用
- 吲哚-3-甲醇、二吲哚甲烷及其衍生物用于治疗顽固性牙周炎药物的应用
- 吲哚-3-甲醇、二吲哚甲烷及其衍生物用于治疗慢性食管炎药物的应用
- 吲哚-3-甲醇、二吲哚甲烷及其衍生物用于治疗胃溃疡药物的应用
- 吲哚-3-甲醇、二吲哚甲烷及其衍生物用于治疗前列腺炎药物的应用
- 吲哚-3-甲醇、二吲哚甲烷及其衍生物用于治疗肾小球肾炎药物的应用
- 一种制备二吲哚甲烷类化合物的方法