鉴定中间体的方法
1.本文描述了一种鉴定靶蛋白折叠中间体的方法,所述中间体适于作为药物研发过程的靶点进行测试。所述方法是通过计算机计算实现的。
背景技术:
2.蛋白质是如何折叠的,为什么它们会以这种方式折叠,以及每种蛋白质的折叠途径是如何在其序列和结构中编码的,这些问题对于蛋白质的结构与设计、折叠与错误折叠、调节与功能、临床问题及工业应用具有重要意义。
3.b.nolting 1999(蛋白质折叠动力学:生物物理学方法,斯普林格,柏林);w.a.eaton等,2000(annu.rev.biophys.biomol.struct.29,327);v.daggett和a.fersht 2003(nat.rev.mol.cell biol.4,497)描述了理解蛋白质折叠动力学的尝试。确定新的治疗靶点是一个长期的需求。
4.在这里,首次证明了一种新的计算方法,能够鉴定蛋白质折叠过程的相关途径,显示出其在鉴定可药用靶蛋白折叠中间体方面的用途,为以前未涉及的药理学靶点的药物研发开辟了新的道路。
技术实现要素:
5.本发明的目的由所附权利要求书限定。
6.具体地,本发明涉及一种鉴定靶蛋白折叠中间体的方法,所述中间体适于作为药物研发过程的靶点进行测试,并且涉及一种基于靶向折叠中间体的计算机药物研发方法。
7.特别地,本发明允许鉴定一旦与选择的配体结合就稳定的折叠中间体,这可以使得例如稳定的折叠中间体从细胞中去除,从而抑制其活性。
8.在另一个实施方案中,本发明允许鉴定一旦与选定的配体结合就可以稳定并且可能被活化的中间体。
附图说明
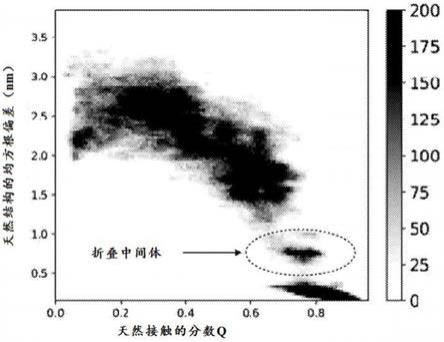
9.图1:人类prpc折叠途径构象的频率分布直方图,用偏置函数法(bf)计算。轨迹被投射在本文描述的两个集合变量上:天然接触的分数q与天然结构的均方根偏差(rmsd)(pdb代码:1qlz)。
10.图2:代表了prpc折叠中间体中访问量最大的结构的三个主要簇(称为簇c1、c2和c3)。
11.图3:朊病毒蛋白prp(fi
‑
prp)折叠中间体中的潜在可药用性区域。
具体实施方式
12.本文描述了一种鉴定靶蛋白折叠中间体的方法,所述中间体适于作为药物研发过程的靶点进行测试。
13.所述方法包括如下所述步骤,这些步骤通过计算机计算来实现。
14.所述方法提供了对定义蛋白质折叠途径的事件的时间序列建模的步骤,所述步骤包括对沿着所述折叠途径的一种或多种蛋白质折叠中间体的结构和/或能量和/或物理化学性质进行建模和/或计算。所述建模步骤可以包括,例如,沿着折叠途径对蛋白质折叠中间体依次建模。
15.然后,所述方法包括基于鉴定特性(包括所述结构和能量和/或物理化学性质),沿着模拟的折叠途径鉴定至少一种候选蛋白质折叠中间体的步骤;以及基于筛选特性(包括所述结构和能量和/或物理化学性质),在所述至少一种候选蛋白质折叠中间体中选择一种或多种靶蛋白折叠中间体的步骤。
16.所述筛选特性与蛋白质折叠中间体的可药用性相关。
17.根据本说明书,“折叠途径”描述了随着时间的推移蛋白质从未折叠到自然折叠的转变,即氨基酸链如何达到热力学稳定状态。
18.在本发明的一个实施方案中,本说明书中提到的“蛋白质折叠”和“折叠途径”的应用背景为内源性蛋白质合成,而不是变性或复性过程或构象异构体或“短暂的构象”。
19.根据本说明书,“可药用性”是蛋白质或蛋白质的任何“构象异构体”结合药物(例如,小分子、任何其他有机化合物、肽或抗体)的能力,从而为患者带来潜在的治疗益处。“构象异构体”是同一多肽的不同构象。它反映了多肽的构象异构和大分子热力学状态的统计特性。
20.如上所述,所述方法提供了两个不同的步骤:“鉴定候选蛋白质折叠中间体”(基于折叠中间体的第一组特性,在本说明书中称为“鉴定特性”)和“筛选靶蛋白折叠中间体”(基于折叠中间体的第二组特性,在本说明书中称为“筛选特性”)两个不同的步骤。
21.在说明书的以下部分,将描述“鉴定特性”和“筛选特性”的几个实例。显然,“鉴定特性”和“筛选特性”可以不同,并且在本发明的优选实施例中实际上是不同的。
22.根据所述方法的一个实施方案,所述鉴定特性包括蛋白质折叠中间体的能量和/或物理化学性质。
23.根据本实施方案的实施选项,鉴定特性包括蛋白质的中间体和天然状态之间的自由能障,或介于中间体与朝向天然状态的下一个中间体之间的自由能障。在这种情况下,鉴定步骤包括将一种中间体鉴定为“候选蛋白质折叠中间体”,所述中间体的特征在于所述中间体与天然状态或朝向天然状态的下一个中间体之间的自由能障大于自由能阈值。
24.在一个实施例中,自由能阈值为7.5kj/mol。
25.根据所述实施方案的另一个实施方案,鉴定特性包括中间体的寿命,定义为从中间体到天然状态或沿着折叠途径到下一个中间体的转变的反向速度。
26.在这种情况下,所述方法进一步包括评估所述中间体的寿命的步骤,并且鉴定步骤包括将寿命长于最小寿命阈值的中间体鉴定为“候选蛋白质折叠中间体”。
27.在一个实施例中,最小寿命阈值可以是生理条件下蛋白质半衰期的至少三倍。
28.根据本方法的一个实施方案,鉴定至少一种候选蛋白质折叠中间体的步骤包括鉴定亚稳态。
29.现在考虑第二组特性,即“筛选特性”,提供了以下详细信息。
30.根据本方法的一个实施方案,筛选特性包括与所考虑的候选蛋白质折叠中间体的
可药用性相关的结构特性。
31.根据本方法的另一个实施方案,筛选特性包括用于蛋白质热点(hot
‑
spot)识别的评分参数。
32.在本说明书中,与药物研究中常用的术语一致,“热点”是靶蛋白上具有高配体结合倾向的位点,因此对药物研发具有重要意义。
33.根据本方法的一个实施方案,筛选步骤还包括选择天然状态下不存在的具有筛选特性的中间体作为靶蛋白折叠中间体。
34.根据一个实施方案,筛选步骤还包括选择天然状态下不存在的具有可药用性口袋(pocket)的中间体作为靶蛋白折叠中间体。
35.在本说明书中,与药物研究领域中常用的术语一致,术语“口袋”表示蛋白质三级结构中适宜结合小分子的空腔。
36.特别地,可药用性口袋的概念是指一种与疾病相关的蛋白质靶点的特定结合位点,能够结合药物样分子从而获得调节蛋白质的生理功能。
37.当不能从3d结构(例如配体
‑
蛋白复合物)或其他实验数据(例如耐药性突变)中确定结合位点时,可以使用计算方法来建议可能的位点。
38.本说明书的以下内容提及在所述方法中用于表征结合位点/口袋的几个特性和/或参数和/或整体口袋描述符(global pocket descriptors)(及相应的示例性值)。
39.根据另一个实施方案,筛选的步骤还包括选择具有可药用性口袋的中间体作为靶蛋白折叠中间体,其特征在于,所述可药用性口袋的均方根偏差(rmsd)大于天然状态下存在的口袋的均方根偏差阈值。
40.在实施例中,所述均方根偏差阈值等于2埃或大于2埃
41.根据本方法的一个实施方案,筛选特性包括所考虑的候选蛋白质折叠中间体中可药用性口袋的存在,其中可药用性口袋根据口袋参数来定义。
42.根据本方法的一个实施方案,筛选步骤包括结合口袋鉴定、结合口袋表征、结合口袋可药用性预测的步骤。
43.在这种情况下,筛选步骤包括基于所述口袋参数与相应阈值的比较,在所鉴定的候选蛋白质折叠中间体中选择一种或多种靶蛋白折叠中间体。
44.根据本实施方案的不同实施选项,上述口袋参数包括尺寸参数、和/或形状参数、和/或位置参数、和/或疏水性与亲水性的比率。
45.特别地,口袋的尺寸参数可以包括口袋的容积和/或口袋的深度和/或口袋的封闭和暴露程度。暴露和封闭程度提供了一种不同的方法来衡量位点对溶剂的开放程度。
46.在一个实施例中,口袋容积阈值至少为
47.在一个实施例中,口袋暴露阈值小于0.49,口袋封闭阈值至少为0.78。
48.在一个实施例中,口袋深度阈值至少为
49.在筛选特性中,用于蛋白质热点识别的评分参数已经在前面提及。
50.关于该特征,本方法的不同实施例提供了以下评分参数:包括“位点分数”(sitescore),和/或“可药用性分数”(dscore),和/或“药物分数”(drugscore)和/或口袋平衡(pocketbalance)。
51.在蛋白质与蛋白质中间体的建模和表征领域,这些参数本身是已知的,并且,基于与不同特性相关的值的组合,适合于评估蛋白质天然状态或蛋白质折叠中间体的“成药性”(druggability)。
52.事实上,这种评分参数来自已知的评估软件包。
53.例如,网站地图(sitemap)(halgren ta(2009)“identifying and characterizing binding sites and assessing druggability”,j.chem.inf.model 49:377
‑
389)通过仅三个单一描述符的线性组合(结合口袋的大小、其封闭性和对其亲水性的罚分)来预测位点分数(site score)和可药用性分数(dscore)。
54.另一个实例是dogsitescorer(a.volkamer,d.kuhn,t.grombacher,f.rippmann,m.rarey,“combining global and local measures for structure
‑
based druggabilitypredictions”j.chem.inf.model.2012,52,360
‑
37),它还生成一个从0到1范围内的可药用性分数(drugscore)。
55.显然,在本方法的其他实施例中,可以使用其他已知的评分参数,和/或可以定义和采用新的评分参数。
56.在这种情况下,筛选也是基于评分参数与相应阈值的比较。
57.在本方法的一些实施例中,评分参数阈值选择如下。
58.在一个实施例中,口袋位点分数阈值为0.8。
59.在一个实施例中,口袋可药用性分数(dscore)阈值为0.98。
60.在一个实施例中,口袋药物分数(drugscore)阈值为0.5。
61.在一个实施例中,口袋平衡阈值为1.0。
62.如上所述,本方法提供了用于鉴定候选蛋白质折叠中间体和筛选靶蛋白折叠中间体的基本特性。
63.此外,本方法还为上述鉴定和筛选步骤提供了标准。这些标准基于例如相应阈值与所选的用于鉴定和/或筛选的特性相关的参数和/或值的比较。
64.在上述描述中已经提供了阈值的示例性值。尽管如此,本领域技术人员可以理解,本方法不受所提及的示例性值的限制,因为阈值可以根据蛋白质的类型或其他要求而具体变化。
65.根据本方法的一个实施方案,通过基于分子力学(mm)或量子力学
‑
分子力学(qm
‑
mm)方法的计算机模拟,对蛋白质折叠途径的时间序列建模。
66.根据本实施方案的不同实施选项,上述计算机模拟通过基于棘轮机构(ratchet
‑
and
‑
pawl)分子动力学的计算机模拟、和/或偏置函数计算方法、和/或通过自洽路径采样计算方法来执行。
67.本领域的技术人员可以容易地理解,上述算法及计算方法仅仅是示例性的,为公开清楚而提供,本方法可以通过应用本文没有明确提及的提供同类结果的其他算法及计算方法来实现。
68.关于有效进行上述蛋白质折叠途径的时间序列建模步骤的示例性算法,更多详细信息可参见科学论文:“s.orioli,s.a beccara,和p.faccioli,j.chem.phys.147,064108(2017)”;“c.camilloni,r.a.broglia,和g.tiana,j.chem.phys.134,045105(2011)”;“s.a beccara,l.fant,和p.faccioli,phys.rev.lett.114,098103(2015)”。
69.根据本方法的其他可能的实施方案,通过基于任何其他计算机方法的计算机模拟来进行对蛋白质折叠途径的时间序列建模的步骤,从而重建蛋白质折叠途径或鉴定折叠中间体。
70.根据本方法的其他可能的实施方案,对蛋白质折叠途径的时间序列进行建模的步骤是通过重建蛋白质折叠途径或鉴定折叠中间体的任何实验方法来进行的。
71.本发明描述了一种基于靶向折叠中间体的计算机药物研发方法。
72.根据上述任何一个实施方案,所述方法包括以下步骤:鉴定靶蛋白折叠中间体,所述中间体适于作为计算机药物研发方法的靶点进行测试。
73.基于此,计算机药物研发的方法实现了对所选的靶蛋白折叠中间体进行计算机药物的研究。
74.根据本方法的一个实施方案,对每个选定的靶蛋白折叠中间体进行计算机药物研发的步骤(其中已经鉴定了可药用性口袋或热点)包括:根据在靶蛋白折叠中间体中鉴定的一个或多个可药用性口袋和/或热点的特性鉴定潜在的配体,其中所述一个或多个可药用性口袋和/或热点被认为是可能的结合位点;然后,通过计算机模拟对每种已鉴定的配体与每种已鉴定的结合位点的相互作用建模;最后,根据上述模型选择配体。
75.在本方法的不同实施方案中,原则上可以采用任何已知的计算机药物研发程序。
76.本文还包括包含至少一个指令的计算机程序,当由计算机执行时,所述指令使计算机执行任何上述实施方案中描述的用于鉴定靶蛋白折叠中间体的方法。
77.本文还包括计算机程序,所述计算机程序包括至少一个程序指令,当由计算机执行时,所述程序指令使计算机执行上述任一示例性实施例中所述的计算机药物研发的方法。
78.显然,在本说明书的上下文中,术语“计算机”旨在最广义上包括超级计算机和/或计算机集群,或者任何其他类型的已知电子处理器。
79.本公开还包括承载上述一个或多个计算机程序的载体和/或介质和/或承载媒介。
80.在说明书的以下部分,提供了关于本发明的示例性、非限制性实施例的更多细节。
81.以下描述的内容概述了技术人员在执行本方法时进行的实际操作。
82.(i)目标鉴定。
83.目标鉴定和筛选过程已经在上面进行了广泛描述。
84.(ii)可药用性口袋鉴定。
85.对选定的候选蛋白质折叠中间体进行计算机搜索分析,选择在溶剂中暴露的、具有可药用性口袋的靶蛋白折叠中间体,所述口袋在所选的蛋白质折叠中间体中是唯一的,并且在蛋白质的天然形态中不存在。
86.(iii a)小分子鉴定。
87.在本发明的一个实施方案中,筛选步骤包括选择最高级别的口袋,即最高级别的靶蛋白折叠中间体,然后将其用于虚拟药物筛选,以鉴定潜在的小分子配体。根据研究领域/目标,设计并构建特定的(ad
‑
hoc)虚拟化学库。应用现有技术中的计算方法/工具,例如基于对接的虚拟筛选、配体亲和力评估、配体效率(le)和配体亲脂性效率(lle)、去除泛活性筛选干扰化合物和潜在聚合物、物理化学和admet化合物性质评估、虚拟化合物的相似性和聚类分析,选择最有前景的候选物。
88.本文所描述和要求保护的方法允许以有效的方式选择最有前景的候选物,随后在成本更高、耗时更长的体外实验中进行测试。
89.(iii b)其他分子鉴定。
90.在本发明的其他实施方案中,根据所述方法鉴定的化合物可以包括抗体(和抗体衍生物)、毒素、核酸;这些分子也可以由内源性代谢物代表。
91.(iv)细胞水平测定
92.例如,通过虚拟筛选预测的配体在稳定转染的异源细胞系统中通过测试其翻译后以剂量依赖性方式降低靶蛋白表达的能力而得到验证。
93.原则上,任何以足够高的亲和力与蛋白质折叠中间体结合的化合物都可以降低其能量状态,稳定其结构,从而延长其半衰期。在细胞环境中,这种稳定作用可能产生异常长寿命的折叠中间体,所述中间体被细胞的折叠质量监控机制识别,从而阻碍翻译后正确添加修饰,和/或导致其降解(例如,通过蛋白酶体途径的降解和/或自噬)。遵循这一原则,在标准异源细胞系统(例如hek293、cho、sh
‑
sy5y或hela细胞)中,以剂量依赖的方式,通过标准生物化学技术(例如蛋白质印迹),测试鉴定出的折叠中间体的计算机预测的候选配体,以选择能够降低或完全抑制靶蛋白整体表达的化合物(例如,已鉴定出合适的靶折叠中间体的蛋白质)。如果在可用的细胞系统中靶蛋白并未内源表达,则设计表达载体并稳定转染细胞以表达靶蛋白。
94.实施例
95.朊病毒疾病与prpc的构象转化有关,prpc是一种内源性糖基磷脂酰肌醇(gpi)锚定的细胞表面糖蛋白,转化为一种错误折叠的异构体,称为“瘙痒形式的prp”(或prpsc),在受到影响的个体的中枢神经系统中积累。prpsc是一种感染性蛋白质(朊病毒),缺乏任何可检测的编码核酸信息,通过直接结合prpsc并触发其构象重排成新的prpsc分子来复制。大量证据表明,指定朊病毒生物学特性的必要信息仅编码在prpsc的结构中,并且不同的prpsc构象异构体可以产生不同的菌株特性,包括各种形式朊病毒疾病的神经病理学和临床特征。prp基因中与疾病相关的突变被认为有利于prpc错误折叠成聚集的和致病的prpsc样形式。尽管具有这些独特的特征,越来越多的来自遗传、生物物理和生物化学研究的证据表明,朊病毒疾病的致病机制可能是发生在其他几种疾病中的神经退行性途径的根源。越来越多的证据表明,能够调节prpc表达和/或活性的化合物可以为多种神经退行性疾病提供全新的治疗视角。
96.本文描述的方法已被用于鉴定靶向prpc折叠中间体的小分子,因此其可能在翻译后抑制prpc的表达。
97.应用显式溶剂中的bf程序计算prp折叠路径,使用gromacs 4.6.5的amber ff99sb
‑
ildn力场和tip3p溶剂模型,其中bf方法集成在plumed 2.0.2插件中。已经考虑从能量最小的prp天然结构开始,通过热去折叠的md模拟获得12个独立展开构象。对于12个初始展开条件中的每一个,rmd生成的所有20个rmd试验轨迹均通过评估其bf功能来评分。丢弃三组轨迹,因为这三组均没有折叠途径聚合到自然状态。应用本方案,通过根据bf程序选择最小偏差轨迹(lbts),收集了9个独立的折叠轨迹,详见s.a beccara,l.fant,和p.faccioli,phys.rev.lett.114,098103(2015)。
98.为了寻找候选的折叠中间体,应用称为棘轮机构(ratchet
‑
and
‑
pawl)分子动力学
算法计算的折叠轨迹(详见s.a beccara,l.fant,和p.faccioli,phys.rev.lett.114,098103(2015))来计算天然接触分数的集合变量q和rmsd的比例的二维频率分布直方图。蛋白质构型的变量q是通过将所述构型中相对距离小于7.5埃的原子对的数量除以天然构型中相对距离小于7.5埃的原子对的数量而得出。
99.已经观察到在0.5nm<rmsd<0.9nm和0.65<q<0.85的途径上存在折叠中间体(见图1,圈出部分)。为了提取描述所获得的折叠途径的构型,应用lbts的两步滤波:
100.(i)对于lbts所探查的每组构型,仅保留了位于图1中高密度区域的构型。为了执行此任务,已计算出观察到给定构型的概率的负对数(根据q和rmsd定义),并且已经排除了所有具有高于3.5kbt(长寿命状态区域)的全局最小值的稳定性偏差的点。
101.(ii)为了仅关注感兴趣的区域,仅保留显示0.5nm<rmsd<0.9nm和0.65<q<0.85的构型。
102.中间构象的聚类分析应用k
‑
means聚法进行(rstudio:integrated development for r.rstudio,inc.,boston,ma)。使用“肘形法”选择簇的数量。以接触映射距离作为聚类指标。聚类过程产生了3个不同的集群,在此称为簇c1、c2和c3(见图2)。从最密集的这种簇(c2和c3)中取样的构象显示出置换的螺旋
‑
1,具有潜在的结合位点。为了鉴定三个簇(c1、c2和c2)的每一个的单个代表性构象,首先,我们计算该组中的平均接触映射,然后我们鉴定该组中的结构,使得其接触映射和簇中的平均接触映射之间的距离最小。
103.计算机模拟和虚拟药物筛选已被用于鉴定fi
‑
prp的潜在配体,侧重于在簇c3的代表性元素中存在而在prpc的天然状态中不存在的独特的结合位点(图3)。根据以下程序在此站点进行计算机药物筛选:
104.从簇c3的代表性构象出发,我们在300k的显式溶剂模型中进行了50ns的分子动力学(md)研究。在这样的模型中,主链原子的相对位置保持固定,以便专门对侧链的排列采样。
105.这种md轨迹所访问的构象结构集中在两组,因为md轨迹表明存在两个主要的口袋。我们从每组中随机抽取了10个构象。
106.我们使用sitemap分析了由此产生的20个构象,以鉴定包含最大可药用性位点的构象。
107.使用包含约250000个小分子的asinex商业文库,将上一步骤中鉴定的构象作为药物筛选的目标。
108.根据预期的药效学及药代动力学对这种虚拟筛选的结果进行筛选,得到由275个虚拟活性化合物组成的最终库。为了说明目的,我们在此报告该组候选药物的化学结构,预计其具有最高的结合亲和力:
109.式1
110.原则上,以足够的亲和力与蛋白质折叠中间体结合的化合物可以降低其能量状态,稳定其结构,从而延长其半衰期。在细胞环境中,对于直接在内质网(er)管腔内合成的蛋白质,如prpc,这种稳定作用可能产生异常长寿命的折叠中间体,可被内质网质量控制(erqc)机制识别,阻碍正确添加翻译后的修饰,并可能导致降解(例如,er相关的降解和/或自噬)。根据这一原则,可以测试通过所建议的筛选方案鉴定出的fi
‑
prp的假定配体诱导其在稳定转染的hek293细胞中表达的野生型(wt)prpc的降解和/或翻译后修饰的能力。首先,应在每种分子浓度增加的情况下(指示性地为0.01~50μm)孵育细胞。然后,应通过蛋白质印迹分析得到prpc表达水平。高亲和力的小分子有望引起prp细胞表达的剂量依赖性降低。
111.如上所述,所描述的方法基于上述特征而允许实现本发明的范围。
112.特别地,本方法允许以独特的方式鉴定折叠中间体中的结合口袋(不能通过已知的溶液鉴定),这带来了与鉴定药物潜在靶点相关的明显优势。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1