心房至心室心脏疗法中的捕获的制作方法
本申请要求于2018年9月26日提交的美国临时申请序列号62/736,905的权益,其全部内容通过引用并入本文。
本公开总体上涉及用于心房至心室(vfa)心脏疗法的医学可植入装置和方法。更具体地,所述装置和方法涉及使用vfa心脏疗法的左心室捕获。
心脏传导系统包括窦房(sa)节点、房室(av)节点、his束、束支和浦肯野(purkinje)纤维。在sa节点中启动心跳,可以将其描述为心脏的自然“起搏器”。由sa节点引起的电脉动导致心房心肌收缩。电脉动或电脉冲或信号经由av节点传导至心室,该av节点固有地延迟传导以允许心房在心室开始收缩之前停止收缩,从而提供适当的av同步性。电脉动经由his束、束支和浦肯野纤维从av节点传导至心室心肌。
传导系统异常(如av节点传导不良或sa节点功能不良)的患者可以接受可植入医疗装置(imd),如起搏器,以恢复更正常的心律和av同步性。一些类型的imd,如心脏起搏器、植入式心脏复律除颤器(icd)或心脏再同步治疗(crt)装置,经由一个或多个位于心脏内或附近的植入式心内膜、心外膜或冠状静脉引线上的电极为患者的心脏提供治疗性电刺激。治疗性电刺激可以以脉冲或电击的形式递送到心脏,用于起搏、心脏复律或除颤。在一些情况下,imd可以感测到心脏的固有去极化,并基于该感测来控制将治疗性刺激递送到心脏。
将治疗性电刺激递送到心脏可有助于解决心脏病况,如患者中可能发生的心室不同步。心室不同步可被描述为缺乏同步性或心脏左右心室收缩时机的差异。收缩时机的明显差异会降低心脏效率。由imd递送到心脏的crt可以通过使心脏心室的机电活动重新同步来增强心脏输出。当对右心房、右心室和左心室起搏时,crt可能包括“三腔起搏”。
除心脏起搏外,还可以通过递送电击疗法以进行心脏复率或心脏除颤来治疗心律失常,例如通过icd,该icd可以感测患者的心律并根据心律失常检测方案对节律进行分类,以便检测心动过速或心颤发作。检测到的心律失常可能包括室性心动过速(vt)、快速室性心动过速(fvt)、室颤(vf)、房性心动过速(at)和房颤(at)。抗心动过速起搏(atp)可用于治疗室性心动过速(vt),从而基本终止许多单形的快速节律。
可使用双腔室医疗装置,其包括经静脉心房引线和经静脉心室引线,其中该经静脉心房引线携带可放置在右心房中的电极,该经静脉心室引线携带可经由右心房放置在右心室中的电极。双腔室医疗装置本身通常植入到皮下袋中,并且经静脉引线隧穿至皮下袋中。双腔室医疗装置可以感测心房电信号和心室电信号,并且可以根据需要提供心房起搏和心室起搏,以促进正常的心律和av同步。一些双腔室医疗装置可以治疗房性和室性心律失常。
已经引入或提议将如无引线起搏器的心内医疗装置完全植入患者心脏内,从而无需使用经静脉引线。无引线起搏器的外壳上可以包括一个或多个电极,以递送治疗性电信号和/或感测心脏的固有去极化。心内医疗装置可在患者心脏的单个腔室内提供心脏治疗功能,如感测和起搏。单腔室心内装置还可治疗房性或室性心律失常或心颤。一些无引线起搏器不在心内,并且可以定位在心脏外部,并且在一些实例中,可以经由固定机构固定在心脏壁上。
在一些患者中,单腔室装置可以充分解决患者的需求。然而,仅能够进行单腔室感测和治疗的单腔室装置可能无法完全解决所有患者(例如患有一些形式的av不同步或心动过速的患者)的心脏传导疾病或异常。除一些情况下的icd功能外,双腔室感测和/或起搏功能可用于恢复更正常的心律。
技术实现要素:
本公开的技术、方法和过程总体上涉及用于心房至心室(vfa)心脏再同步治疗(crt)的可植入医疗装置、系统和方法。另外,本公开的技术、方法和过程可以与心脏疗法一起应用或使用,包括单腔室或多腔室起搏(例如,双腔室或三腔室起搏)、房室同步起搏、异步起搏、触发起搏或心动过速相关疗法。
可以将vfa装置植入右心房(ra),并将组织穿刺电极从右心房延伸到左心室心肌。组织穿刺电极可用于将起搏疗法递送至左心室以用于各种心脏疗法。为了确定起搏是否已经捕获了左心室和/或起搏是否有效,可以按照左心室搏动来测量电活动,或者可以进行其他生理反应测量。可以评估电活动和其他生理反应测量值(例如,与各种阈值等比较),以确定起搏治疗是否已经有效地捕获了左心室。
另外,如果确定心室起搏疗法无效或尚未捕获左心室,则可以调整心室起搏疗法,直到使心室起搏疗法有效捕获左心室为止。例如,可以调整或修改一个或多个起搏设置,并且可以监测电活动或其他生理信息。可以再次评估所监测的电活动或其他生理信息,以确定心室起搏疗法现在是否已经有效地捕获了左心室。例如,可以调整房室(a-v)起搏延迟,直到确定左心室捕获。有利地,在一个或多个实施例中,本公开的技术可以用于校准或递送更优的起搏疗法,而无需使用监测到的患者心脏右心室的电活动。
换句话说,本公开描述了在无引线vfa起搏装置的情况下监测心室捕获有效性和修改一个或多个治疗参数的方法,该无引线vfa起搏装置被植入av间隔区域中并且具有可感测/起搏心房以及心室(尤其是左心室)的电极以用于再同步起搏。
一种说明性可植入医疗装置可包括多个电极。该多个电极可包括组织穿刺电极和右心房电极,该组织穿刺电极可从右心房的koch三角区穿过右心房内膜和中央纤维体而植入以对位于患者心脏左心室心肌基底和/或中隔区的左心室递送心脏疗法或感测其电活动,该右心房电极可定位在右心房内以对患者心脏的右心房递送心脏疗法或感测其电活动。该说明性可植入医疗装置可进一步包括:治疗递送电路,该治疗递送电路可操作地耦合至该多个电极以对患者心脏递送心脏疗法;感测电路,该感测电路可操作地耦合至该多个电极以感测患者心脏的电活动;以及控制器,该控制器包含可操作地耦合至该治疗递送电路和该感测电路的处理电路系统。该控制器可以被配置为监测左心室捕获有效性。监测左心室捕获有效性可包括使用该组织穿刺电极递送左心室搏动,使用该组织穿刺电极跟随左心室搏动监测左心室的电活动以及基于所监测的电活动确定左心室搏动的左心室组织捕获有效性。
一种说明性方法可以包括提供组织穿刺电极,该组织穿刺电极从右心房的koch三角区穿过右心房内膜和中央纤维体而植入以对位于患者心脏左心室心肌基底和/或中隔区的左心室递送心脏疗法或感测其电活动;提供右心房电极,该右心房电极可定位在右心房内以对患者心脏的右心房递送心脏疗法或感测其电活动。该说明性方法可以进一步包括:使用该组织穿刺电极递送左心室搏动;跟随左心室搏动,使用该组织穿刺电极监测该左心室的电活动;以及基于所监测的电活动确定左心室搏动的左心室组织捕获有效性。
一种说明性可植入医疗装置可包括多个电极,该多个电极包括至少一个组织穿刺电极和右心房电极,其中该组织穿刺电极可从右心房的koch三角区穿过右心房内膜和中央纤维体而植入以对位于患者心脏左心室心肌基底和/或中隔区的左心室递送心脏疗法或感测其电活动,该右心房电极可定位在右心房内以对患者心脏的右心房递送心脏疗法或感测其电活动。该说明性可植入医疗装置可进一步包括:治疗递送电路,该治疗递送电路可操作地耦合至该多个电极以对患者心脏递送心脏疗法;感测电路,该感测电路可操作地耦合至该多个电极以感测患者心脏的电活动;以及控制器,该控制器包含可操作地耦合至该治疗递送电路和该感测电路的处理电路系统。该控制器可以进一步被配置为使用该组织穿刺电极来进行左心室搏动治疗,基于使用至少该组织穿刺电极监测的电活动来监测多个心动周期中左心室捕获有效性,基于在多个心动周期中左心室捕获有效性的监测确定未正在发生有效的左心室捕获,并响应于确定未正在发生有效的左心室捕获而调整左心室起搏。
一种实例性vfa装置是用于递送av同步心室感测疗法的无引线起搏/感测装置。该装置可以被植入到av间隔区域中,并且具有心房中的感测/起搏阴极(例如,心房阴极)、心室中的感测/起搏阴极(例如,心室阴极)和作为共同阳极的第三电极。在从这种装置进行心室起搏的递送期间,可以基于以下标准,通过分析近场起搏电描记图(例如,从心室阴极到心房阳极)的形态特征来监测治疗的有效性:(1)电描记图基线的绝对振幅<以毫伏为单位的阈值;(2)起搏事件后的一定时间范围内的最小负偏差比某一以毫伏为单位的阈值更低;以及(3)相对于起搏事件的时机所测量的负最小值的时机小于某一以毫秒为单位的间隔。如果满足以上所有三个标准,则可以确定发生有效的组织捕获,因此可以为这种vfa装置提供特定的心室搏动以及有效心室起搏的诊断。
该实例性装置还可基于有效或无效起搏的指示进行连续的治疗调整。例如,如果起搏对于y个跳动中的至少x个跳动无效,则该装置可能会运行一系列诊断测试来对其进行纠正。如果处于ddd(r)模式,则该装置可以启动捕获测试以测量捕获阈值,并基于高于捕获阈值的某个值来重置输出。如果起搏对于y个跳动中的x个跳动继续无效,则该装置可能会在某些步骤中减少av延迟以进行起搏,并继续监测有效程度。av延迟可能有一个下限(例如,对于固有的心房感测为60毫秒,对于心房起搏为70毫秒),超过该下限将不会进一步减小。如果处于vvi(r)模式,并且该装置获取了y个无效起搏跳动中的至少x个跳动以及y个感测跳动中的至少w个跳动,则可能会增加心率并继续监测捕获有效性。在vvi模式下,心率的增量可以修改为某个最大速率(例如,每分钟130次跳动)。如果在vvi模式下,该装置确定y个无效起搏跳动中的至少有x个跳动但没有感测到的节拍,则可以启动捕获阈值测试以建立捕获阈值并重置起搏输出。该实例性装置可以继续跟踪有效起搏的比例,并且如果有效起搏下降到一定程度以下,则发出警报。
在下文的附图和描述中阐述本公开的一个或多个方面的细节。本公开所描述的技术的其他特征、目的和优点将根据描述和附图并且根据权利要求书而显而易见。
附图说明
图1是用于与例如图16-18的说明性方法一起使用的说明性心脏治疗系统的概念图,该系统包括植入在患者心脏中的心内医疗装置和位于患者心脏外部的单独的医疗装置。
图2-4是用于与例如图16-18的说明性方法一起使用的包括医疗装置的说明性心脏治疗系统的概念图,该医疗装置包括带有植入在患者心脏中的电极的引线。
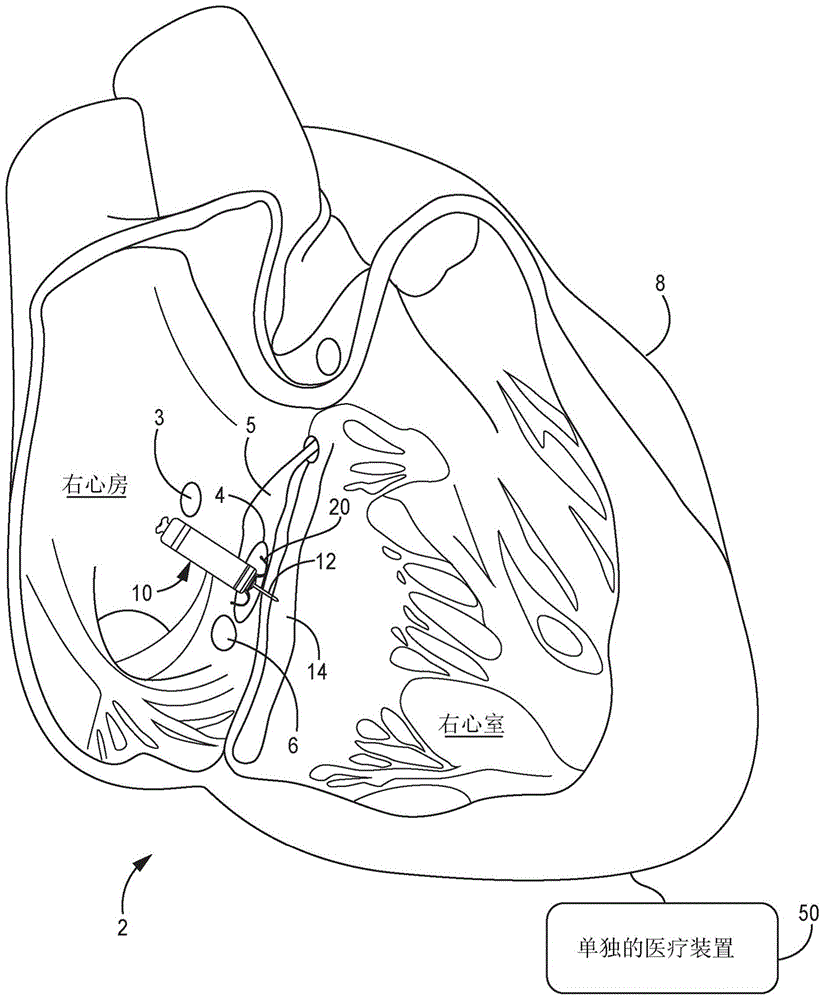
图5是图1的心内医疗装置的放大概念图和患者心脏的解剖结构。
图6是用于与例如图1-4的实例性系统和装置一起使用的在左心室的标准17段视图中的患者心脏图的概念图,其示出了各种电极植入位置。
图7是用于与例如图1-4的说明性系统和装置一起使用的具有远端固定和电极组件的心内医疗装置的立体图,该远端固定和电极组件包括被实现为环形电极的远端壳体基电极。
图8是可以被封装在例如图1-4的医疗装置的壳体内以提供本文描述的功能和治疗的说明性电路系统的框图。
图9是用于与例如图1-4的说明性系统和装置一起使用的另一说明性心内医疗装置的立体图。
图10是用于与例如图1-4的说明性系统和装置一起使用的使用心房运动检测器来检测心房活动的说明性方法的流程图。
图11是用于与例如图1-4的说明性系统和装置一起使用的检测心音以表示生理反应信息的说明性方法的流程图。
图12是用于与例如图1-4的说明性系统和装置一起使用的检测生物阻抗以表示生理反应信息的说明性方法的流程图。
图13是用于与例如图1-5和7-9的说明性系统和装置一起使用的用于监测左心室捕获有效性的说明性方法的概念图。
图14是用于与例如图1-5和7-9的说明性系统和装置一起使用的用于确定左心室捕获有效性的监测近场电描记图的一部分。
图15是用于与例如图1-5和7-9的说明性系统和装置一起使用的用于监测左心室捕获有效性的说明性方法的另一概念图。
具体实施方式
本公开的过程、方法和技术总体上涉及用于心房至心室(vfa)心脏再同步治疗的可植入医疗装置、系统和方法。另外,本公开的过程、方法和技术总体上涉及其他心脏疗法,包括单腔室或多腔室起搏(例如,双腔室或三腔室起搏)、房室同步起搏、异步起搏、触发起搏、心脏再同步起搏或心动过速相关疗法。尽管本文中参考了如起搏器或icd的可植入医疗装置,但该方法和过程可与任何与患者心脏有关的医疗装置、系统或方法一起使用。受益于本公开的各种其他应用对于本领域技术人员将变得显而易见。
可有利于提供无经静脉引线的可植入医疗装置(例如,无引线装置)。也可有利于提供一种能够用于各种心脏疗法的可植入医疗装置,如心脏再同步起搏、单腔室或多腔室起搏(例如,双腔室或三腔室起搏)、房室同步起搏、异步起搏、触发起搏、或心动过速相关疗法。此外,可有利于提供一种能够与单独的医疗装置通信的系统,例如,在某些心动过速的情况下提供触发起搏或提供电击疗法。更进一步,可有利于将可植入医疗装置配置为仅使用心内装置或与一根或多根引线或单独的医疗装置结合使用以提供自适应起搏治疗。
本公开提供了一种可植入医疗装置,其包括组织穿刺电极以及可选地右心房电极和/或右心房运动检测器。该可植入医疗装置可以是从右心房植入左心室心肌的vfa装置。例如,该可植入医疗装置可用于自适应心脏治疗,自适应心脏治疗可基于测量的心率、固有av传导等中的一项或多项来适配起搏延迟。可以进行生理反应测量,并且该vfa装置可以被配置为基于生理反应信息递送心脏疗法。特别地,该vfa装置可以被配置为基于不同的心率和/或固有的av传导来适配起搏治疗,例如,通过确定和递送具有最佳房室(av)起搏延迟的起搏治疗。有利地,在一个或多个实施例中,本公开的技术可用于校准或递送起搏治疗,而无需使用患者心脏右心室的所监测的电活动。
该组织穿刺电极可以从右心房的koch三角区通过右心房内膜和中央纤维体植入患者心脏的左心室心肌的基底和/或中隔区域。在无引线可植入医疗装置中,该组织穿刺电极可以从该装置的壳体的远端区域无引线地延伸,并且右心房电极可以无引线地耦合至该壳体(例如,其一部分或位于壳体的外部)。在一个或多个实施例中,右心房运动检测器可以位于该可植入医疗装置内。在带引线的可植入医疗装置中,一个或多个电极可以使用可植入引线耦合至壳体。当植入该装置时,该电极可用于感测患者心脏的一个或多个心房和/或心室中的电活动。该运动检测器可用于感测患者心脏的一个或多个心房和/或心室中的机械活动。特别地,可以监测右心房和左心室的活动,并且可选地,可以监测右心室的活动。该电极可用于递送心脏疗法,如用于房颤的单腔室起搏、用于心动过缓的房室同步起搏、异步起搏、触发起搏、用于心室不同步的心脏再同步起搏、抗心动过速起搏或电击疗法。电击疗法可以由该可植入医疗装置启动。同样可以被植入的如血管外icd的单独的医疗装置可以与该可植入医疗装置可操作地连通并且可以响应于该装置提供的如信令脉冲(例如,触发的、信令的或独特的电脉冲)的触发而进行电击。
图1-4示出了各种心脏治疗系统的实例,该各种心脏治疗系统可以被配置为与例如图13-15所示的方法一起使用以监测左心室捕获和进行起搏治疗。尽管本公开描述了无引线和有引线的可植入医疗装置,但是首先参照图1,该图示出了心脏治疗系统2的概念图,该心脏治疗系统包括心内医疗装置10,该心内医疗装置可以配置用于单腔室或双腔室治疗并且被植入患者心脏8中。在一些实施例中,装置10可以配置用于单腔室起搏,并且可以例如在单腔室起搏和多腔室起搏(例如,双腔室或三腔室起搏)之间切换。如本文所使用的,“心内”是指被配置为完全植入患者心脏内以例如提供心脏治疗的装置。示出的装置10被植入在患者心脏8的右心房(ra)的目标植入区域4中。装置10可包括一个或多个固定件20,其将装置的远端锚定在目标植入区域4中的心房内膜上。目标植入区域4可以位于his束5和冠状窦3之间并且可以邻近三尖瓣6。装置10可被描述为心房至心室(vfa)装置,其通常置于右心房内并可感测或提供对一个或两个心室(例如,根据情况,右心室、左心室或两个心室)的治疗。特别地,装置10可以包括组织穿刺电极,该组织穿刺电极可以从右心房的koch三角区通过右心房内膜和中央纤维体植入到患者心脏的左心室心肌的基底和/或中隔区域中。
装置10可以被描述为无引线可植入医疗装置。如本文所使用的,“无引线”是指没有延伸出患者心脏8的引线的装置。换句话说,无引线装置可以具有不从患者心脏外部延伸到患者心脏内部的引线。一些无引线装置可以通过静脉引入,但是一旦被植入,该装置就没有或可能不包括任何经静脉引线,并且可以被配置为提供心脏治疗而不使用任何经静脉引线。进一步,尤其当装置的壳体位于心房中时,无引线vfa装置不使用引线就可操作地连接到心室中的电极。另外,无引线电极可以在不使用电极和壳体之间的引线的情况下耦合至医疗装置的壳体。
装置10可以包括镖电极组件12,该镖电极组件限定或具有从装置10的远端区域延伸的直轴。镖电极组件12可通过心房心肌和中央纤维体被放置或至少被配置为放入心室心肌14,或沿着心室间隔放置,而无需完全穿过心室内膜或外膜表面。镖电极组件12可以在轴的远端区域处携带或包括电极,使得该电极可以定位在心室心肌内,以感测心室信号并递送心室脉冲(例如,使左心室去极化以启动左心室收缩)。在一些实例中,在轴的远端区域处的电极是用于双极电极对中以进行起搏和感测的阴极电极。尽管所示的植入区域4可以使镖电极组件12的一个或多个电极能够定位在心室心肌中,但是已经认识到,具有本文公开的方面的装置可以被植入其他位置以进行多腔室起搏(例如,双腔室或三腔室起搏)、带多腔室传感的单腔室起搏、单腔室起搏和/或传感、或其他适当的临床治疗和应用。
应当理解,尽管在本文中将装置10描述为包括单个镖电极组件,但是装置10可以包括多于一个的镖电极组件,其通过心房心肌和中央纤维体放置或配置成放置进心室心肌14或沿着心室间隔放置,而不会完全穿透心室内膜或外膜表面。另外,每个镖电极组件可在轴的远端区域或沿着轴的其他区域(例如,近端或中心区域)携带或包括多于一个的单个电极。
心脏治疗系统2还可以包括单独的医疗装置50(在图1中示意性地示出),其可以被定位在患者心脏8的外部(例如,皮下)并且可以可操作地耦合至患者心脏8以递送心脏疗法。在一个实例中,单独的医疗装置50可以是血管外icd。在一些实施例中,血管外icd可包括除颤引线,该除颤引线包括或携带除颤电极。治疗矢量可能存在于除颤引线上的除颤电极与icd的壳体电极之间。此外,icd的一个或多个电极也可以用于感测与患者心脏8有关的电信号。icd可被配置为递送包括一种或多种除颤或心脏复律电击的电击疗法。例如,如果感测到心律失常,则icd可以经由电导线发送脉冲,以电击心脏并恢复其正常节律。在一些实例中,icd可以递送电击疗法而无需将电导线放置在心脏内或将电线直接附接到心脏(皮下icd)。可以与本文所述的系统2一起使用的血管外、皮下icd的实例可以在2016年3月8日授权的美国专利第9,278,229号(reinke等人)中进行描述,该专利通过引用整体并入本文。
在电击疗法的情况下(例如,由除颤引线的除颤电极提供的除颤电击),单独的医疗装置50(例如血管外icd)可以包括控制电路,该控制电路使用治疗递送电路来产生具有以下任一波形特征的除颤电击:前沿电压、倾斜度、递送的能量、脉冲相位等。治疗递送电路可以例如产生单相、双相或多相波形。另外,治疗递送电路可以产生具有不同量的能量的除颤波形。例如,治疗递送电路可以产生除颤波形,其为皮下除颤递送总共约60-80焦耳(j)的能量。
单独的医疗装置50可以进一步包括感测电路。感测电路可以被配置为获得经由电极的一种或多种组合感测的电信号,并且处理所获得的信号。感测电路的组件可以包括模拟组件、数字组件或其组合。感测电路可以例如包括一个或多个感测放大器、滤波器、整流器、阈值检测器、模数转换器(adc)等。感测电路可以将所感测的信号转换为数字形式,并将数字信号提供给控制电路以进行处理和/或分析。例如,感测电路可以放大来自感测电极的信号,并且通过adc将所放大的信号转换为多位数字信号,然后将数字信号提供给控制电路。在一个或多个实施例中,感测电路还可以将所处理的信号与阈值进行比较,以检测房性或室性去极化(例如,p波或r波)的存在并对控制电路指示房性去极化(例如,p波)或室性去极化(例如r波)的存在。
装置10和单独的医疗装置50可以协作以向患者心脏8提供心脏治疗。例如,装置10和单独的医疗装置50可以用于检测心动过速、监测心动过速和/或提供心动过速相关的治疗。例如,装置10可以与单独的医疗装置50无线通信从而使用单独的医疗装置50触发电击疗法。如本文所使用的,“无线”是指在装置10与单独的医疗装置50之间不使用金属导体的可操作的耦合或连接。在一个实例中,无线通信可以使用由装置10提供的独特的、信令的或触发的电脉冲,该电脉冲通过患者的组织进行传导并且可以由单独的医疗装置50检测到。在另一个实例中,无线通信可以使用装置10的通信接口(例如,天线)来提供电磁辐射,该电磁辐射通过患者的组织传播并且例如可以使用单独的医疗装置50的通信接口(例如,天线)来检测。
参照图2,带引线医疗装置408包括一个或单个可植入的引线410,其具有组织穿刺电极组件12,该组织穿刺电极组件耦合至该引线的远端区域并植入患者心脏8内。带引线医疗装置408的壳体420可以被植入并定位在患者心脏8的外部,并且被配置为例如至少基于所测得的心率来校准起搏治疗和/或递送起搏治疗。引线410可以包括右心房电极,并且装置408可以用作具有双通道能力的装置(例如,在右心房和左心室中起搏和/或感测)。在一些实施例中,引线410可以不包括右心房电极。换句话说,带引线医疗装置408可以是单通道装置,其可以用于异步、触发或其他类型的单通道起搏。当植入组织穿刺电极组件12时,例如,以与图1所述相同或相似的方式,使用引线410的带引线医疗装置408可感测活动或将起搏递送到左心室(lv)。
参照图3,带引线医疗装置418类似于图2的带引线医疗装置408,但是装置418包括两个可植入引线410、412。特别地,可植入引线412可以包括耦合至引线412的远端区域的电极(例如,右心房电极),并且可以被植入在与引线410不同的位置。在一些实施例中,引线412被植入右心房的不同区域。在一些实施例中,每个引线410、412可以组成双通道装置418的一个通道。例如,当植入组织穿刺电极组件12的组织穿刺电极时,例如,以与和图1所描述的相同或相似的方式,引线410可以感测活动或将起搏递送到左心室(lv),并且引线412可以感测活动或将起搏递送到右心房(ra)。
参照图4,带引线医疗装置428类似于图3的带引线医疗装置418,但是装置428包括三个可植入引线410、412、414。特别地,可植入引线414可包括耦合至引线414的远端区域的电极(例如,右心室电极),并且可以被植入在与引线410、412不同的位置。在一些实施例中,引线414被植入右心室的区域中。在一些实施例中,每个引线410、412、414可以组成多通道装置428的一个通道。例如,当植入组织穿刺电极组件12时,例如,以与图1所述相同或相似的方式,引线410可感测活动或将起搏递送至左心室(lv),引线412可以感测活动的将起搏递送到右心房(ra),并且引线414可以感测活动或将起搏递送到右心室(rv)。
在一些实施例中,可以校准或优化引线414上用于起搏rv的rv电极与引线410上用于起搏lv的lv电极之间的起搏延迟(例如,rv-lv起搏延迟或更一般地,vv起搏延迟),例如,使用如电极设备(例如ecg皮带)的单独的医疗装置。可以使用各种方法来校准或优化vv延迟。在一些实施例中,医疗装置428可以用于以多个不同的vv延迟来测试起搏。例如,rv可以比lv提前约80、60、40和20毫秒(ms)起搏,lv也可以比rv提前约80、60、40和20ms起搏,或者rv-lv同时起搏(例如,约0ms的vv起搏延迟)。然后,医疗装置428可以例如被自动配置为选择vv起搏延迟,该vv起搏延迟在用于起搏时对应于使用电极设备测量的最小电不同步。可以基于患者特征使用特定的av延迟(如由医疗装置428设置的标称av延迟)或预定最佳av延迟来执行不同vv起搏延迟下的起搏测试。
图5是图1的心内医疗装置10的放大概念图和患者心脏8的解剖结构。特别地,装置10被配置为例如至少基于所测量的心率来进行起搏治疗和/或递送起搏治疗。心内装置10可包括壳体30。壳体30可以限定气密内部腔,装置10的内部组件位于该气密内部腔内,如结合图8一般描述的感测电路、治疗递送电路、控制电路、存储器、遥测电路、其他可选传感器以及电源。壳体30可以由包括钛或钛合金、不锈钢、mp35n(非磁性镍-钴-铬-钼合金)、铂合金或其他生物相容性金属或金属合金的导电材料形成。在其他实例中,壳体30可以由非导电材料形成,包括陶瓷、玻璃、蓝宝石、硅树脂、聚氨酯、环氧树脂、乙酰共聚物塑料、聚醚醚酮(peek)、液晶聚合物或其他生物相容性聚合物。
在至少一个实施例中,壳体30可以被描述为以大体上圆柱形的形状在远端区域32和近端区域34之间延伸,以便于导管输送。在其他实施例中,壳体30可以是棱柱形或任何其他形状以执行本文所述的功能和用途。壳体30,例如在近端区域34处,可包括递送工具接口构件26,用于在装置10的植入期间与递送工具接合。
壳体30的全部或一部分可以在心脏治疗期间例如在感测和/或起搏中用作电极。在所示的实例中,示出基于壳体的电极24外接于壳体30的近端部分(例如,比远端区域32更靠近近端区域34)。当壳体30由导电材料(如钛合金或上文所列出的其他实例)形成时,壳体30的一部分可以通过非导电材料(如聚对二甲苯、聚氨酯、硅树脂、环氧树脂或其他生物相容性聚合物的涂层)而电绝缘,使得一个或多个离散的导电材料区域暴露以限定基于近端壳体的电极24。当壳体30由如陶瓷、玻璃或聚合物材料的非导电材料形成时,可以将如钛、铂、不锈钢或其合金的导电涂层或层施加到壳体30的一个或多个离散区域以形成基于近端壳体的电极24。在其他实例中,基于近端壳体的电极24可以是安装或组装到壳体30上的部件,如环形电极。当壳体30是非导电材料时,基于近端壳体的电极24可以例如经由导电壳体30或电导体电耦合至装置10的内部电路系统。
在所示的实例中,基于近端壳体的电极24相对于壳体远端区域32更靠近壳体近端区域34,因此被称为“基于近端壳体的电极”24。然而,在其他实例中,基于壳体的电极24可以位于沿着壳体30的其他位置,例如,相对于所示位置更远。
在远端区域32处,装置10可以包括远端固定和电极组件36,该远端固定和电极组件可以包括一个或多个长度相等或不相等的固定构件20和一个或多个镖电极组件12。在一个实例中,单个镖电极组件12包括从壳体远端区域32向远侧延伸出的轴40和一个或多个电极元件,如位于或靠近轴40的自由远端区域的尖端电极42。尖端电极42可以具有圆锥形或半球形的远端尖端,其具有相对窄的尖端直径(例如,小于约1毫米(mm)),用于穿入并穿过组织层而无需使用具有锐化或倾斜边缘的尖锐的尖端或针状尖端。
镖电极组件12的轴40可以是通常笔直的构件并且可以是刚性的。在其他实施例中,轴40可以被描述为相对较硬,但在横向方向上仍具有有限的柔性。此外,轴40可以是非刚性的,以允许随着心脏运动而发生一些横向挠曲。然而,在松弛状态下,当未受到任何外力时,轴40可以保持如图所示的笔直位置,以将尖端电极42与壳体远端区域32间隔开至少轴40的高度47。换句话说,镖电极组件12可以描述为弹性的。
镖电极组件12可以被配置成穿刺一个或多个组织层,以将尖端电极42定位在期望的组织层例如心室心肌内。这样,轴40的高度47或长度可以对应于预期的起搏部位深度,并且轴40可以沿着其纵轴具有相对较高的抗压强度,以在被压向植入区域4时抵抗在横向或径向上的弯曲。如果采用第二镖电极组件12,则其长度可能不等于预期的起搏部位深度,并且可以被配置成用作无差异电极以用于将起搏能量递送至组织。可以例如通过向壳体30的近端34施加纵向推力而将纵向轴向力施加在尖端电极42上,以将镖电极组件12推进到目标植入区域内的组织中。当受到横向或径向力时,轴40可以被描述为在横向或径向上是纵向非压缩和/或可弹性变形的以允许例如伴随组织运动的暂时挠曲,但是当横向力减小时可以返回到其通常笔直的位置。当轴40未受到任何外力或仅受到沿其纵向中心轴的力时,轴40可以保持笔直的线性位置,如图所示。
一个或多个固定构件20可以被描述为具有正常弯曲位置的一个或多个“尖齿”。尖齿可以位于递送工具内的向远侧延伸的位置。在从递送工具释放时,尖齿的远侧尖端在向近侧弹性地弯曲回到正常弯曲位置(示出)之前可以穿透心脏组织至有限的深度。此外,固定构件20可以包括例如在2017年6月13日发布的美国专利第9,675,579号(grubac等人)和2015年9月1日发布的美国专利第9,119,959号(rys等人)中描述的一个或多个方面,其全部内容通过引用整体并入本文。
在一些实例中,远端固定和电极组件36包括基于远端壳体的电极22。在使用装置10作为起搏器进行多腔室起搏(例如,双腔室或三腔室起搏)和感测的情况下,尖端电极42可以用作阴极电极,该阴极电极与用作返回阳极电极的基于近端壳体的电极24配对。可替代地,基于远端壳体的电极22可以用作与尖端电极42配对的返回阳极电极,以感测心室信号并递送心室起搏脉冲。在其他实例中,基于远端壳体的电极22可以是阴极电极以用于感测心房信号并将起搏脉冲递送到目标植入区域4中的心房心肌。当基于远端壳体的电极22用作心房阴极电极时,基于近端壳体的电极24可以用作与尖端电极42配对的返回阳极以进行心室起搏和感测,并且可以用作与基于远端壳体的电极22配对的返回阳极以进行心房起搏和感测。
如此图所示,在一些起搏应用中,目标植入区域4沿着心房内膜18,通常次于av节点15和his束5。镖电极组件12可以至少部分地限定轴40的高度47或长度,以穿过目标植入区域4中的心房内膜18并穿过中心纤维体16进入心室心肌14而无需穿过心室内膜表面17。当镖电极组件12的高度47或长度完全前进到目标植入区域4中时,尖端电极42可置于心室心肌14内,并且基于远端壳体的电极22可紧密接触或靠近心房内膜18。在各种实例中,镖电极组件12可以具有尖端电极42和轴40的总的组合高度47或长度,约3mm至约8mm。轴40的直径可以小于约2mm,并且可以为约1mm或更小,或者甚至约0.6mm或更小。
装置10可以包括位于壳体30内的声学或运动检测器11。声学或运动检测器11可以可操作地耦合至一个或多个控制电路80(图8)、感测电路86(图8)或治疗递送电路84(图8)。在一些实施例中,声学或运动检测器11可以与图10-12所示方法600、650或800一起使用。声学或运动检测器11可用于监测机械活动,如心房机械活动(例如,心房收缩)和/或心室机械活动(例如,心室收缩)。在一些实施例中,声学或运动检测器11可以用于检测右心房机械活动。声学或运动检测器11的非限制性实例包括加速度计或麦克风。在一些实施例中,由声学或运动检测器11检测到的机械活动可以用于补充或替换由装置10的一个或多个电极检测到的电活动。例如,声学或运动检测器11可以与基于近端壳体的电极24一起使用或作为该近端壳体的电极的替代。
声学或运动检测器11也可以用于速率响应检测或提供速率响应imd。与速率响应有关的各种技术可以描述于1992年10月13日发布的美国专利第5,154,170号(bennett等人),名称为《速率响应性心脏起搏器的优化(optimizationforrateresponsivecardiacpacemaker)》,以及1996年10月8日发布的美国专利第5,562,711(yerich等人),名称为《用于速率响应性心脏起搏的方法和设备(methodandapparatusforrate-responsivecardiacpacing)》,两者均通过引用整体并入本文。
在各种实施例中,声学或运动传感器11可以用作hs传感器,并且可以被实现为麦克风或1轴、2轴或3轴加速度计。在一个实施例中,声学传感器被实现为压电晶体,该压电晶体安装在可植入医疗装置壳体内并且响应于与心音相关联的机械运动。压电晶体可以是专用的hs传感器,或者可以用于多种功能。在所示的说明性实施例中,声学传感器被实施为压电晶体,该压电晶体还用于以imd壳体的可察觉的振动的形式产生患者警报信号。在检测到警报状况时,控制电路80可以使患者警报控制电路系统通过激活该压电晶体来生成警报信号。
控制电路可以用于控制压电晶体是用于“监听模式”以通过hs感测电路系统感测hs信号,还是用于“输出模式”以产生患者警报。在患者警报产生期间,hs感测电路系统可以通过控制电路系统暂时与hs传感器解耦。
可以用本公开的技术来实现的声学传感器的其他实施例的实例可以总体上描述于美国专利第4,546,777号(groch等人)、美国专利第6,869,404号(schulhauser等人)、美国专利第5,554,177号(kieval等人)和美国专利第7,035,684号(lee等人),其每一个均通过引用整体并入本文。
可以使用各种类型的声学传感器。声学传感器可以是响应于如前所述产生的一个或多个心音的任何可植入的或外部的传感器,从而产生在时间和振幅上与心音相关的电模拟信号。然后,hs感测模块可以处理模拟信号,该处理可以包括数字转换,以获得由hs感测模块或控制电路80导出的hs参数,如振幅或相对时间间隔。声学传感器和hs感测模块可以并入能够递送crt的imd中或正在优化的其他心脏疗法中,或者可以实现在与imd进行有线或无线通信的单独装置中,或者在如本文所述的搏动参数优化过程中使用的外部编程器或计算机。
图6是患者心脏的二维(2d)心室图300(例如,俯视图),其以标准17段视图示出了左心室320,而且示出了右心室322。图300包括对应于人类心脏的不同区域的多个区域326。如图所示,区域326被数字标记为1-17(例如,其对应于人类心脏的标准17段模型、对应于人类心脏的左心室的17段等)。图300的区域326可以包括基底前区域1、基底前隔区域2、基底下隔区域3、基底下区域4、基底下外侧区域5、基底前外侧区域6、中前区域7、前隔中部区域8、下隔中部区域9、下中部区域10、下外侧中部区域11、前外侧中部区域12、顶前区域13、顶中隔区域14、顶下区域15、顶侧区域16和顶点区域17。还示出了右心室322的下隔和前隔区域,以及右束支(rbb)和左束支(lbb)。
在一些实施例中,本公开的任何组织穿刺电极可以植入到患者心脏的左心室心肌的基底和/或中隔区域中。特别地,组织穿刺电极可以从右心房的koch三角区通过右心房心内膜和中央纤维体植入。
一旦被植入,组织穿刺电极可定位在目标植入区域4(图1-5)中,如左心室心肌的基底和/或中隔区域。参照图300,基底区域包括基底前区域1、基底前隔区域2、基底下隔区域3、基底下区域4、中前区域7、前隔中部区域8、下隔中部区域9和下中部区域10中的一个或多个。参照图300,中隔区域包括基底前隔区域2、基底前隔区域3、前隔中部区域8、下隔中部区域9和顶中隔区域14中的一个或多个。
在一些实施例中,当植入时,组织穿刺电极可以定位在左心室心肌的基底中隔区域中。基底中隔区域可以包括基底前隔区域2、基底下隔区域3、前隔中部区域8和下隔中部区域9中的一个或多个。
在一些实施例中,当植入时,组织穿刺电极可以定位在左心室心肌的高下/后基底中隔区域中。左心室心肌的高下/后基底中隔区域可以包括基底下隔区域3和下隔中部区域9中的一个或多个的一部分(例如,仅基底下隔区域、仅下隔中部区域、或基底下隔区域和下隔中部区域两者)。例如,高下/后基底中隔区域可包括大体上示为虚线边界的区域324。如图所示,虚线边界表示高下/后基底中隔区域所在位置的近似值,根据特定的应用,其形状或大小可能有所不同。
图7是装置10的三维立体图,该装置能够例如至少基于所测的心率来校准起搏治疗和/或递送起搏治疗。如图所示,远端固定和电极组件36包括被实现为环形电极的基于远端壳体的电极22。当固定构件20的固定构件尖齿20a、20b和20c与心房组织接合时,基于远端壳体的电极22可与心房组织紧密接触或可操作地邻近心房组织定位。可以弹性变形的尖齿20a、20b和20c可以在将装置10递送到植入部位期间向远侧延伸。例如,当装置10从递送工具中推出时,尖齿20a、20b和20c可以穿刺心房内膜表面,并且当不再约束在递送工具内时,其弯曲回到其正常弯曲位置(如图所示)。当尖齿20a、20b和20c弯曲回到其正常位置时,固定构件20可以将远端固定构件和电极组件36拉向心房内膜表面。随着远端固定构件和电极组件36被拉向心房内膜,尖端电极42可以前进通过心房心肌和中央纤维体并进入心室心肌。然后可以将基于远端壳体的电极22抵靠心房内膜表面定位。
基于远端壳体的电极22可以包括由导电材料形成的环,该导电材料如钛、铂、铱或其合金。基于远端壳体的电极22可以是单个连续的环形电极。在其他实例中,环的部分可以涂覆有电绝缘涂层,例如聚对二甲苯、聚氨酯、硅树脂、环氧树脂或其他绝缘涂层,以减小环形电极的导电表面积。例如,可以涂覆环的一个或多个扇区以分离基于远端壳体的电极22的两个或更多个导电的暴露表面区域。减小基于远端壳体的电极22的导电表面积,例如通过绝缘涂层覆盖导电环的一部分,可以增加基于远端壳体的电极22的电阻抗,从而在捕获心肌(例如心房心肌组织)的起搏脉冲期间减少递送的电流。较小的电流消耗可以节省装置10的电源,例如一个或多个可再充电或不可再充电的电池。
如上所述,基于远端壳体的电极22可以被配置为心房阴极电极,用于与作为返回阳极的基于近端壳体的电极24结合,将起搏脉冲递送至植入部位处的心房组织。电极22和24可用于感测心房p波,以用于控制心房起搏脉冲(在没有所感测的p波的情况下递送)以及用于控制使用尖端电极42作为阴极和使用基于近端壳体的电极24作为返回阳极而递送的心房同步心室起搏脉冲。在其他实例中,基于远端壳体的电极22可以与阴极尖端电极42一起用作返回阳极,以用于心室起搏和感测。
图8是电路系统的框图,根据一个实例,该电路系统可以被封闭在壳体30(图7)中以利用装置10(例如至少基于所测量的心率)实现校准起搏治疗和/或递送起搏治疗的功能或封闭在本文所描述的任何其他医疗装置(例如,图2的装置408、图3的装置418、图4的装置428或图9的装置710)的壳体内。单独的医疗装置50(图1-4)可以包括一些或全部相同的部件,其可以以类似的方式配置。封闭在壳体30内的电子电路系统可以包括软件、固件和硬件,这些软件、固件和硬件协作地监测心房和心室的心电信号、确定何时需要心脏疗法、和/或根据编程的治疗模式和脉冲控制参数向患者心脏递送电脉冲。电子电路系统可以包括控制电路80(例如,包括处理电路系统)、存储器82、治疗递送电路84、感测电路86和/或遥测电路88。在一些实例中,装置10包括一个或多个传感器90,用于产生与患者的生理功能、状态或状况相关的信号,如患者活动传感器,以用于确定是否需要起搏治疗和/或控制起搏速度。例如,一个传感器90可以包括惯性测量单元(例如,加速度计)以测量运动。
电源98可以根据需要向包括每个组件80、82、84、86、88、90的装置10的电路系统提供电源。电源98可以包括一个或多个能量存储装置,如一个或多个可再充电或不可再充电电池。本领域的普通技术人员可以通过示出的一般性框图理解电源98和每个组件80、82、84、86、88、90之间的连接(未示出)。例如,电源98可以耦合至包括在治疗递送电路84中的一个或多个充电电路,以提供用于对包括在治疗递送电路84中的保持电容器进行充电的电源,该电容器由控制电路80控制在适当的时间放电,从而例如根据如ddi(r)的双腔室起搏模式来递送起搏脉冲。电源98还可以耦合至感测电路86的组件(例如感测放大器、模数转换器、开关电路系统等)、传感器90、遥测电路88和存储器82,以向各种电路提供电源。
所示的功能块表示装置10中包括的功能,并且可以包括任何分立和/或集成电子电路组件,其实现能够产生本文医疗装置10的功能的模拟和/或数字电路。各种组件可以包括处理电路系统,如执行一个或多个软件或固件程序的专用集成电路(asic)、电子电路、处理器(共享、专用或组)以及存储器,组合逻辑电路、状态机、或其他提供所描述功能的合适的组件或组件组合。用于实现本文公开的功能的软件、硬件和/或固件的特定形式将主要由医疗装置中采用的特定系统体系架构以及医疗装置所采用的特定检测和治疗递送方法来确定。
存储器82可以包括任何易失性、非易失性、磁性或电非暂时性计算机可读存储介质,如随机存取存储器(ram)、只读存储器(rom)、非易失性ram(nvram)、电可擦可编程rom(eeprom)、闪存或任何其他存储器装置。此外,存储器82可以包括存储指令的非暂时性计算机可读介质,在由一个或多个处理电路执行时,该指令使控制电路80和/或其他处理电路系统校准起搏治疗和/或执行单腔室、双腔室或三腔室校准起搏治疗(例如,单腔室或多腔室起搏),或装置10进行的其他心脏治疗功能(例如,感测或递送治疗)。存储指令的非暂时性计算机可读介质可以包括上文所列出的介质中的任何介质。
控制电路80可以例如经由数据总线与治疗递送电路84和感测电路86通信,以响应于感测到的心脏事件(例如,p波和r波,或者不存在p波和r波)感测心脏电信号并控制心脏电刺激疗法的递送。尖端电极42、基于远端壳体的电极22和基于近端壳体的电极24可以电耦合至治疗递送电路84,以将电刺激脉冲递送至患者的心脏和感测电路86,并且用于感测心脏电信号。
感测电路86可以包括心房(a)感测通道87和心室(v)感测通道89。基于远端壳体的电极22和基于近端壳体的电极24可以耦合至心房感测通道87以感测心房信号,例如伴随心房心肌去极化的p波。在包括两个或更多个可选的基于远端壳体的电极的实例中,感测电路86可以包括开关电路系统,该开关电路系统用于将一个或多个可用的基于远端壳体的电极选择性地耦合至包括在心房感测通道87中的心脏事件检测电路系统。开关电路系统可以包括开关阵列、开关矩阵、多路复用器或适合于将感测电路86的部件选择性地耦合至所选电极的任何其他类型的开关装置。尖端电极42和基于近端壳体的电极24可以耦合至心室感测通道89以感测心室信号,例如伴随心室心肌去极化的r波。
心房感测通道87和心室感测通道89中的每一个可以包括心脏事件检测电路系统,用于从各自的感测通道接收的心脏电信号中分别检测p波和r波。包括在每个通道87和89中的心脏事件检测电路系统可以被配置为放大、滤波、数字化和整流从所选电极接收的心脏电信号,以改善用于检测心脏电事件的信号质量。每个通道87和89内的心脏事件检测电路系统可以包括一个或多个感测放大器、滤波器、整流器、阈值检测器、比较器、模数转换器(adc)、计时器或其他模拟或数字组件。心脏事件感测阈值,例如p波感测阈值和r波感测阈值,可以在控制电路80的控制下(例如基于定时间隔和由控制电路80确定的感测阈值)由各自的感测通道87和89自动调整、存储在存储器82中和/或由控制电路80和/或感测电路86的硬件、固件和/或软件控制。
在基于感测阈值交叉检测到心脏电事件时,感测电路86可以产生被感测的事件信号,该信号传递到控制电路80。例如,心房感测通道87可以响应于p波感测阈值交叉而产生p波感测事件信号。心室感测通道89可响应于r波感测阈值交叉而产生r波感测事件信号。控制电路80可以使用感测到的事件信号来设置起搏逃逸间隔定时器,该定时器控制用于调度心脏起搏脉冲的基本时间间隔。取决于特定的编程起搏模式,感测到的事件信号可以触发或禁止起搏脉冲。例如,从心房感测通道87接收到的p波感测事件信号可以使控制电路80以编程的房室(av)起搏间隔来禁止调度的心房起搏脉冲并调度心室起搏脉冲。如果在av起搏间隔终止之前检测到r波,则可以禁止心室起搏脉冲。如果av起搏间隔在控制电路80从心室感测通道89接收到r波感测事件信号之前终止,则控制电路80可以使用治疗递送电路84来递送与感测到的p波同步的预定心室起搏脉冲。
在一些实例中,装置10可以被配置为递送各种起搏治疗,包括心动过缓起搏、心脏再同步治疗、休克后起搏和/或心动过速相关的治疗,如atp。例如,装置10可以被配置为检测非窦性心动过速并递送atp。控制电路80可以确定心脏事件时间间隔,例如,从心房感测通道87接收的连续的p波感测事件信号之间的p-p间隔、从心室感测通道89接收的连续的r波感测事件信号之间的r-r间隔、以及在p波感测事件信号和r波感测事件信号之间接收的p-r和/或r-p间隔。可以将这些间隔与心动过速检测间隔进行比较以检测非窦性心动过速。可以基于检测到的心动过速检测间隔的阈值数量,在给定的心腔中检测心动过速。
治疗递送电路84可以包括心房起搏电路83和心室起搏电路85。每个起搏电路83、85可以包括充电电路系统、一个或多个电荷存储装置(如一个或多个低压保持电容器)、输出电容器、和/或开关电路系统,其中当保持电容器横跨输出电容器被充电和放电时,该开关电路系统控制将起搏脉冲递送至耦合至相应的起搏电路83、85的起搏电极矢量。尖端电极42和基于近端壳体的电极24可以作为双极阴极和阳极对耦合至心室起搏电路85,以例如在由控制电路80设置的av或vv起搏间隔终止时递送心室起搏脉冲,从而提供心房同步的心室起搏和基本的较低的心室起搏率。
心房起搏电路83可以耦合至基于远端壳体的电极22和基于近端壳体的电极24以递送心房起搏脉冲。控制电路80可以根据编程的较低起搏率来设置一个或多个心房起搏间隔,或者可以根据速率响应型传感器指示的起搏率来设置临时的较低速率。如果在从心房感测通道87接收到p波感测事件信号之前心房起搏间隔终止,则可以控制心房起搏电路递送心房起搏脉冲。控制电路80响应于所递送的心房起搏脉冲而开始av起搏间隔,以提供同步的多腔室起搏(例如,双腔室或三腔室起搏)。
治疗递送电路84可以根据从控制电路80接收的控制信号将心房或心室起搏电路83、85的一个保持电容器充电到编程的起搏电压振幅,并将电容器放电到编程的起搏脉冲宽度。例如,包括在控制电路80中的起搏定时电路可以包括由控制电路80的微处理器设置的可编程数字计数器,用于控制与各种单腔室或多腔室起搏(例如,双腔室或三腔室起搏)模式或抗心动过速起搏顺序相关联的基本起搏时间间隔。控制电路80的微处理器还可基于存储在存储器82中的编程值来设置心脏起搏脉冲的振幅、脉冲宽度、极性或其他特性。
装置10可以包括用于感测来自患者的信号的其他传感器90,以用于确定对治疗递送电路84所递送的电刺激治疗的需要和/或控制。在一些实例中,指示需要增加心输出量的传感器可以包括患者活动传感器,如加速计。可以由控制电路80确定患者活动传感器所指示的活动增加所引起的患者的代谢需求的增加,以用于确定传感器指示的起搏率。控制电路80可以用于基于患者活动传感器(例如,测量的心率)来校准和/或递送起搏治疗。
用于感测心脏事件和控制起搏治疗递送的控制电路80所利用的控制参数可以经由遥测电路88被编程到存储器82中,该遥测电路也可以被描述为通信接口。遥测电路88包括收发器和天线,用于使用射频通信或其他通信协议与如编程器或家庭监控器的外部装置进行通信。控制电路80可以使用遥测电路88从外部装置接收下行链路遥测并将上行链路遥测发送到外部装置。在某些情况下,遥测电路88可以用于向/从植入患者体内的另一医疗装置发送和接收通信信号。
图9是根据另一实例的另一无引线心内医疗装置710的三维立体图,该无引线心内医疗装置可以被配置用于例如至少基于测量的心率来校准起搏治疗和/或递送起搏治疗,以用于单腔室或多腔室心脏治疗(例如,双腔室或三腔室心脏治疗)。装置710可以包括壳体730,该壳体具有示出为圆柱形外侧壁的外侧壁735,其从壳体远端区域732延伸到壳体近端区域734。壳体730可以包围被配置为执行单腔室或多腔室心脏治疗的电子电路系统,包括心房和心室的心电信号感测以及对心房和心室的起搏。示出的递送工具接口构件726位于壳体近端区域734上。
远端固定和电极组件736可以耦合至壳体远端区域732。远端固定和电极组件736可以包括耦合至壳体远端区域732的电绝缘远端构件772。组织穿刺电极组件712远离壳体远端区域732延伸,并且多个非组织穿刺电极722可以直接耦合至绝缘远端构件772。组织穿刺电极组件712在纵向上远离壳体远端区域732延伸,并且可以与壳体730的纵向中心轴731同轴。
远端组织穿刺电极组件712可以包括电绝缘轴740和尖端电极742(例如,组织穿刺电极)。在一些实例中,组织穿刺电极组件712是主动固定构件,其包括螺旋轴740和远侧阴极尖端电极742。螺旋轴740可以从轴远端区域743延伸到轴近端区域741,该螺旋轴可以直接耦合至绝缘远端构件772。螺旋轴740可以涂覆有电绝缘材料,例如聚对二甲苯或本文列出的其他实例,以避免沿轴长度感测或刺激心脏组织。尖端电极742在轴远端区域743处,并且可以用作阴极电极以用于在尖端电极742前进到心室组织中时使用基于近端壳体的电极724作为返回阳极来递送心室起搏脉冲并感测心室电信号。基于近端壳体的电极724可以是围绕壳体730的环形电极,并且可以由纵向侧壁735的未绝缘部分限定。壳体730的不用作电极的其他部分可以用电绝缘材料涂覆,如以上结合图7所述。
使用穿入lv心肌的两个或更多个组织穿刺电极(例如,任何类型的穿刺电极)可以用于更局部的起搏捕获,并且可以减轻影响心房组织捕获心室起搏尖峰。在一些实施例中,多个组织穿刺电极可以包括两个或更多个镖型电极组件(例如,图7的电极组件12)、螺旋型电极(例如,电极组件712)多个组织穿刺电极的非限制性实例包括两个镖电极组件、一个具有穿过其中(例如,穿过中心)延伸的镖电极组件的螺旋电极或双缠绕螺旋。多个组织穿刺电极也可以用于双极或多极起搏。
在一些实施例中,穿入lv心肌的一个或多个组织穿刺电极(例如,任何类型的穿刺电极)可以是多极组织穿刺电极。一种多极组织穿刺电极可以包括一个或多个电活性元件和电分离元件,其可以实现利用一个或多个组织穿刺电极的双极或多极起搏。
多个非组织穿刺电极722可以沿着绝缘远端构件772的外围设置,并位于组织穿刺电极组件712的周围。绝缘远端构件772可以限定装置710的面向远端的表面738和位于与壳体纵向侧壁735相邻的装置710外围的圆周表面739。非组织穿刺电极722可以由如钛、铂、铱或其合金的导电材料形成。在示出的实施例中,六个非组织穿刺电极722沿着绝缘远端构件772的外周以相等的距离径向地间隔开,然而,可以设置两个或更多个非组织穿刺电极722。
非组织穿刺电极722可以是分立的组件,每个组件都保持在绝缘构件772中的相应凹部774内,其中该凹部的尺寸和形状被设计为与非组织穿刺电极722配合。在其他实例中,每个非组织穿刺电极722可以是安装在绝缘远端构件772内或上的整体构件的未绝缘的暴露部分。整体构件的不用作电极的中间部分可以通过绝缘远端构件772来绝缘,或者,如果暴露于周围环境中,则可以涂覆有电绝缘涂层,例如聚对二甲苯、聚氨酯、硅树脂、环氧树脂或其他绝缘涂层。
当组织穿刺电极组件712被推进到心脏组织中时,至少一个非组织穿刺电极722可被放置成抵靠心脏组织表面、与心脏组织表面紧密接触或可操作地邻近于心脏组织表面以递送脉冲和/或感测由患者心脏产生的心脏电信号。例如,当组织穿刺电极组件712被推进到心房组织中并且穿过中央纤维体直到远侧尖端电极742与心室组织(例如心室心肌和/或心室传导系统的一部分)直接接触时,非组织穿刺电极722可以与右心房内膜组织接触以在心房中进行起搏和感测。
非组织穿刺电极722可以耦合至壳体730所包围治疗递送电路84和感测电路86(参见图8),从而共同作为阴极电极与作为返回阳极的基于近端壳体的电极724结合来递送心房起搏脉冲并感测心房电信号(例如p波)。感测电路86包括的开关电路系统可以在控制电路80的控制下被激活,以将一个或多个非组织穿刺电极耦合至心房感测通道87。远端的非组织穿刺电极722可以彼此电隔离,从而治疗递送电路84中包括的开关电路系统可以单独选择电极722中的每个单独的电极,以将单个或者两个或更多个电极722的组合用作心房阴极电极。可以在控制电路80的控制下激活包括在治疗递送电路84中包括的开关电路系统,以将一个或多个非组织穿刺电极722耦合至心房起搏电路83。一次可以选择两个或更多个非组织穿刺电极722作为多点心房阴极电极。
可以基于心房捕获阈值测试、电极阻抗、心电信号中的p波信号强度或其他因素来选择用于心房起搏和/或心房感测的某些非组织穿刺电极722。例如,可以选择单个或两个或更多个单独的非组织穿刺电极722的任意组合以利用来自电源98的最小电流消耗实现可靠的心房起搏,其中该非组织穿刺电极用作阴极电极,其提供低起搏捕获阈值振幅和相对高的电极阻抗的最佳组合。
在一些情况下,当组织穿刺电极组件712将壳体730锚定在植入部位处时,面向远端的表面738可以均匀地接触心房内膜表面。在那种情况下,可以一起选择所有电极722以形成心房阴极。可替代地,可以每隔一个选择电极722以形成具有较高电阻抗的多点心房阴极,该电阻抗仍然沿着面向远端的表面738均匀地分布。可替代地,可以选择沿着绝缘远端构件772的一侧的一个或多个电极722的子集以在期望的部位提供起搏,由于电极722相对于起搏的心房组织的相对位置,该期望的部位达到最低的起搏捕获阈值。
在其他情况下,根据组织穿刺电极组件712进入心脏组织的位置和方向,面向远端的表面738可以相对于相邻的心内膜表面朝向一角度。在这种情况下,与其他非组织穿刺电极722相比,一个或多个非组织穿刺电极722可以与心内膜表面呈角度地而与相邻的心内膜组织更紧密地接触。通过沿着绝缘远端构件772的外围设置多个非组织穿刺电极,组织穿刺电极组件712和壳体远端区域732可以不需要相对于心脏表面(例如,右心房内膜表面)基本平行。解剖学和位置的差异可能导致面向远端的表面738与心内膜表面成角度或倾斜,然而,沿着绝缘远端构件772的外围分布的多个非组织穿刺电极722增加了一个或多个电极722和相邻的心脏组织之间良好接触的可能性,从而促进使用至少多个电极722的一个子集上可接受的起搏阈值和可靠心脏事件感测。可以不需要沿着绝缘远端构件772的整个周边周向地接触或固定。
每个示出的非组织穿刺电极722包括沿着面向远端的表面738延伸的第一部分722a和沿着圆周表面739延伸的第二部分722b。第一部分722a和第二部分722b可以是连续的暴露表面,因此有源电极表面包裹在绝缘远端构件772的外周边缘776上,其中该外周边缘将面向远端的表面738和圆周表面739连接。非组织穿刺电极722可包括沿着面向远端的表面738的一个或多个电极722、沿着圆周表面739的一个或多个电极、沿着面向远端的表面738和圆周表面739延伸的一个或多个电极、或其任何组合。每个非组织穿刺电极722的暴露表面可以与相应的面向远端的表面738和/或圆周表面齐平。在其他实例中,每个非组织穿刺电极722可具有从绝缘远端构件772突出的凸起表面。然而,电极722的任何凸起表面可以限定光滑或圆形的非组织穿刺表面。
远端固定和电极组件736可以密封壳体730的远端区域,并且可以提供安装电极722的基础。电极722可以被称为基于壳体的电极。电极722可以不由将有源电极部分延伸远离壳体730的轴或其他延伸部承载,就像位于远离壳体730延伸的螺旋轴740的远端尖部处的远侧尖端电极742一样。本文提出的与绝缘远端构件的面向远端的表面和/或圆周表面耦合的非组织穿刺电极的其他实例包括基于远端壳体的环形电极22(图7)、在组件36(图7)周围周向延伸的基于远端壳体的环形电极、纽扣电极、其他基于壳体的电极和其他周向环形电极。可以提供直接耦合至远端绝缘构件、外围耦合至中央组织穿刺电极的任何非组织穿刺电极,从而单独地、共同地或以任何组合的方式用作将起搏脉冲递送到相邻心脏组织的阴极电极。当提供环形电极,例如远端环形电极22和/或周向环形电极时,环形电极的部分可以通过涂层电绝缘,以沿着绝缘远端构件的面向远端的表面和/或圆周表面提供多个分布的非组织穿刺电极。
与沿远端固定和电极组件736提供的组织穿刺电极相比,非组织穿刺电极722和上文所列出的其他实例有望提供更可靠和更有效的心房起搏和感测。与心室壁相比,心房壁相对较薄。组织穿刺心房阴极电极可能会在心房组织内延伸得太深,从而导致心室组织的意外持续或间歇性捕获。由于在经由物理上更靠近心室组织的组织穿刺心房阴极电极接收到的心电信号中,心室信号具有较大信号强度,因此组织穿刺心房阴极电极可能干扰感测心房信号。组织穿刺电极组件712可被牢固地锚定在心室组织中,以稳定装置710的植入位置,并提供合理的确定性,即尖端电极742在心室组织中感测和起搏,而非组织穿刺电极722在心房中可靠地起搏和感测。当装置710被植入目标植入区域4中时,例如,如图1所示的心室中隔内,尖端电极742可以到达左心室组织以对左心室起搏,而非组织穿刺电极722在右心房中起搏和感测。从面向远端的表面738到左心室组织,组织穿刺电极组件712的长度范围是约4mm至约8mm。在一些情况下,装置710可以通过以下方式实现四腔室起搏:通过经由目标植入区域4中的非组织穿刺电极722从心房起搏电路83递送心房起搏脉冲实现双心房(右心房和左心房)捕获,通过经由从目标植入区域4进入心室组织的尖端电极742从心室起搏电路85递送心室起搏脉冲实现双心室(右心室和左心室)捕获。
图10示出了例如使用图5的声学或运动检测器11来检测心房活动的说明性方法600,其可以用于表示生理响应信息。具体地,方法600可以包括基于对运动信号(例如,由运动检测器11提供)的分析来检测心房收缩,其可以由植入患者心脏中的imd来执行。在一些实施例中,该运动信号可以由植入在患者心脏的心室(例如右心室)内的imd提供。方法600可以包括在识别出心室激动事件之后开始心房收缩检测延迟周期630。方法600可以包括在心房收缩延迟周期终止时开启心房收缩检测窗口632。方法600可以包括分析心房收缩检测窗口内的运动信号。
方法600可以包括在心房收缩检测窗口内对运动信号进行滤波、对滤波后的信号进行整流、以及在心房收缩检测窗口内生成滤波和整流后的运动信号的衍生信号634。方法600可以包括确定心房收缩检测窗口内的衍生信号的振幅是否超过阈值636。响应于确定心房收缩检测窗口内的衍生信号的振幅超过阈值(636的“是”),方法600可以继续进行以检测心房收缩638。否则(636的“否”),方法600可以返回到滤波、整流和生成衍生信号634。利用提供运动信号的运动检测器的各种技术可参考2016年7月26日发布的名称为《通过用于心房同步心室起搏的心室无引线起搏装置进行心房收缩检测(atrialcontractiondetectionbyaventricularleadlesspacingdeviceforatrio-synchronousventricularpacing)》的美国专利第9,399,140号(cho等人),其全部内容通过引用并入本文。
参照图11,可以检测到心音(hs)并将其用于表示生理反应信息。如本文所述,s1至s4心音中的一种或多种的振幅和/或相对时间间隔可用于优化患者对crt或其他心脏疗法的血液动力学响应,包括用于实现血液动力学益处的心脏起搏和/或神经刺激。第一个心音s1对应于心室收缩的开始。当动作电位通过房室结点(av结点)传导并迅速使心室心肌去极化时,心室收缩开始。此事件的特征是ecg上的qrs波群。当心室收缩时,心室中的压力开始上升,当心室压力超过心房压力时,心室和心房之间的二尖瓣和三尖瓣突然关闭。此瓣关闭可能会产生s1。s1通常具有约150ms的持续时间和大约20至250hz的频率。s1的振幅可以可以替代lv收缩性的测量。因此,s1振幅的增加与lv收缩性的提高呈正相关。其他措施,如从qrs出现到s1之间测量的射血前期,也可以用作心肌收缩指数的替代指标。
在s1信号中的m1峰和t1峰分开时,可以观察到心室不同步导致二尖瓣和三尖瓣分开关闭。m1(二尖瓣关闭声音)和t1(三尖瓣关闭声音)的合并可以用作改善心室同步性的指标。
通常,在ecg的qrs波群和二尖瓣关闭后,左心室压力(lvp)急剧上升,并在心室收缩期间持续升高,直到主动脉和肺动脉瓣打开,将血液喷射到主动脉和肺动脉中。在射血期期间,心室收缩通常会继续导致心室、主动脉和肺动脉中的血压升高。随着收缩的减少,血压会降低直到主动脉和肺动脉瓣关闭。
第二个心音s2可能是通过在临近心室收缩末期和心室舒张开始时关闭主动脉和肺动脉瓣而产生的。因此,s2可以与主动脉和肺动脉中的舒张压相关。s2通常具有约120ms的持续时间和大约25至350hz的频率。s1和s2之间的时间间隔,即s1-s2时间间隔,可以代表对应于心动周期的心室等容性收缩(预射血)和射血期的心缩期间隔(sti)。该s1-s2时间间隔可以替代每搏输出量的测量。此外,射血前期(q-s1)与s1-s2时间的比率可用作心肌收缩性指标。
第三心音s3与心室的早期、被动舒张充盈有关,而第四心音s4与心房收缩引起的心室的晚期、主动充盈有关。通常,在普通患者中使用听诊器很难听到第三心音,而在普通患者中通常不会听到第四心音。在使用听诊器进行检查期间,第三和第四心音的存在可能表示病理状况。因为与心脏的舒张功能有关,s3和s4心音可用于优化起搏参数。通常,当确定最佳起搏参数时,这些心音将被最小化或消失。如本领域普通技术人员已知的,s1至s4心音的其他方面及其定时可用于心脏起搏参数优化。
图11是根据一个实施例的一种使用心音来优化起搏控制参数的方法的流程图800。本公开的方法可以包括流程图800中所示的一个或多个框。使用心音来优化心脏治疗的其他实例一般可参考在2017年5月9日授权的名称为《使用心音的起搏参数优化系统和方法(systemandmethodforpacingparameteroptimizationusingheartsounds)》的美国专利第9,643,0134,该专利在此通过引用整体并入本文。
起搏参数优化方法可以在框802处启动。可以响应于经由外部编程器接收到的用户命令来启动优化过程。在初始imd植入时或在办公室随访期间,或在远程患者监护期间,用户可以使用外部编程器或联网计算机启动基于hs的优化过程。另外地或可替代地,流程图800所示的过程可以是周期性开始的自动化过程或者响应于基于感测到的生理信号(包括感测到的hs信号)而感测对治疗递送或治疗调整的需要而开始的自动化过程。
在框804,选择要优化的起搏控制参数。控制参数可以是与时序有关的参数,例如av间隔或vv间隔。起搏矢量是可以在框804处选择用于优化的另一个控制参数。例如,当使用多极引线例如冠状窦引线时,可以选择多个双极或单极起搏矢量以在给定的心腔中起搏。与特定起搏矢量相关的起搏部位可能对起搏治疗的血液动力学益处具有显著作用。这样,起搏矢量是可以使用本文描述的方法来优化的一个起搏控制参数。
使用针对在框804处选择的测试参数的初始参数设置,在框806处启动起搏序列。在一个实施例中,优化av间隔时,以初始av间隔设置递送心室起搏。应当理解,可以在框806通过首先测量具有完整av传导(即,没有av块)的患者中的固有av间隔来选择初始av间隔设置。初始av间隔可以是默认起搏间隔、最后编程的av间隔或要测试的最小或最大av间隔。可替代地,如果选择vv间隔用于优化,则可以首先测量固有的心室间传导时间,并且可以以更长、更短或近似等于固有vv传导时间的vv间隔开始迭代地调整起搏的vv间隔。
执行将所选测试参数调整为至少两个不同设置的迭代过程。可以以任何期望的顺序(例如增加、减少、随机等)将参数调整为不同的设置。例如,在av间隔的调整期间,初始av间隔可以设置为刚好长于或近似等于所测量的固有av传导时间,然后迭代地降低至最小av间隔测试设置。在使用每个起搏参数设置进行起搏期间,在框808处获取hs信号。在框812处,迭代过程前进至下一个测试参数设置,直到如框810处所确定的已经应用了所有测试参数设置,并且已经针对每个设置记录了hs信号。
可以获取多个心动周期的hs信号,从而能够对从各个心动周期获取的hs参数测量值进行总体平均或平均。应当理解,放大、滤波、整流、噪声消除技术或其他信号处理步骤可以用于改善hs信号的信噪比,并且这些步骤对于所采集的每个心音(可包括任何或所有类型的心音)可以是不同的。
在框814处,针对每个测试参数设置,从记录的hs信号中确定至少一个hs参数测量值。例如,包括在编程器中的imd处理器或外部处理器或两者的组合可以执行本文所述的hs信号分析。在一个实施例中,在框814处,使用s1和s2信号记录s1和s2并测量hs参数。例如,测量s1的振幅、v-s2间隔(其中v事件可以是v起搏或感测到的r波)和s1-s2间隔。可以另外注意s3和/或s4的存在,或者可以对这些信号进行测量以确定相关参数。针对至少两个不同的测试参数设置确定hs信号参数,例如,至少两个不同的av间隔、两个或更多个不同的vv间隔或两个或更多个不同的起搏矢量。
在框818,确定在框810确定的每个hs参数的趋势作为起搏参数测试设置的函数。在一个实施例中,确定v-s2间隔、s1振幅和s1-s2间隔中的每一个的趋势。其他实施例可以包括确定在s1信号期间m1和t1声音的分离。基于hs参数相对于变化的起搏控制参数的趋势,在框820处,处理器可以自动识别最佳起搏参数设置。另外、可替代地和/或可选地,在框822处,在如编程器的外部装置上或在远程联网的计算机上报告和显示hs趋势。
如果将多极电极沿着心脏腔室放置时(例如,沿着lv的四极引线),要测试的起搏参数例如是起搏部位或起搏矢量,可以在最大化hs-基心室收缩性替代的基础上选择起搏部位或矢量。在一个实施例中,将s1的振幅用作心室收缩性的替代,并且在框820处将与最大s1相关联的起搏部位或矢量识别为最佳起搏矢量设置。
在框818处确定每个hs参数的趋势可以包括确定v-s2间隔趋势是否呈现突然的斜率变化,例如从基本上平坦的趋势到减小的趋势。可以将与v-s2间隔趋势的突然改变相关联的av间隔识别为最佳av间隔设置。可以基于其他hs趋势,例如最大s1振幅和/或最大s1-s2间隔,进一步识别最佳av间隔。
在一些实施例中,在框824处,也可以在imd中自动编程自动识别的最佳起搏参数设置。在其他实施例中,临床医生或用户检查报告的hs数据和推荐的起搏参数设置,并且可以接受推荐的设置或基于hs数据选择另一设置。
hs感测模块或电路系统可以可操作地耦合至控制电路80(图8),并且被配置为从用于感测一个或多个心音的hs传感器接收模拟信号。例如,hs感测模块可以包括一个或多个“通道”,其被配置为基于心音的频率、持续时间和时序来特别感测特定的心音。例如,控制电路80可以利用ecg/egm感测电路系统设置用于感测心音的hs感测模块所使用的hs感测窗。hs感测模块可以包括一个或多个感测放大器、滤波器和整流器,用于优化心音信号的信噪比。可以提供单独且独特的放大和滤波属性,以感测每一个s1至s4声音,从而根据需要改善信号质量。
可以测量生物阻抗或心内阻抗,并将其用于表示生理反应信息。例如,通过注入电流并测量电极矢量配置的电极(例如,选定的电极)之间的电压,本文所述的任何imd可测量心内阻抗信号。例如,通过在第一电极(例如,lv电极)和位于ra中的电极之间注入电流(例如,非起搏阈值电流)并测量第一和第二电极之间的电压,imd可以测量阻抗信号。将会认识到,其他矢量对配置可以用于刺激和测量。可以在围绕目标组织或心脏腔室的任何一组电极之间测量阻抗。因此,可以注入电流并测量电压以计算同两个电极(双极配置)上的阻抗,或者注入电流并测量分离的两对电极(例如,一对用于电流注入,一对用于电压感测)上的电压,因此是四极配置。对于四极电极配置,电流注入和电压感测电极可以彼此成一直线(或紧密平行),并且电压感测电极可以在电流感测场内。在这样的实施例中,vfa引线可以用于lv心脏治疗或感测。阻抗矢量可以被配置为涵盖目标的特定解剖区域,例如心房或心室。
本文描述的实例性方法和/或装置可以监测一个或多个电极矢量配置。此外,可以相对于另一个同时和/或周期性地测量多个阻抗矢量。在至少一个实施例中,实例性方法和/或装置可以使用阻抗波形来获取选择数据(例如,找到适用的基准点、允许从这样的波形中提取测量值等),以优化crt。
如本文所使用的,术语“阻抗信号”不限于原始阻抗信号。应该暗示可以对原始阻抗信号进行处理、标准化和/或滤波(例如,以去除伪影、噪声、静电、电磁干扰(emi)和/或外来信号)以提供阻抗信号。此外,术语“阻抗信号”可以包括其各种数学导数,包括阻抗信号的实部和虚部、基于阻抗的电导信号(即,阻抗的倒数或相反数)等。换句话说,可以将术语“阻抗信号”理解为包括电导信号,即作为阻抗信号的倒数的信号。
在本文描述的方法和/或装置的一个或多个实施例中,可以监测各种患者生理参数(例如,心内阻抗、心音、如r-r间隔的心动周期间隔等),以用于获取选择数据以优化crt(例如,设置av和/或vv延迟、例如通过使用和/或测量阻抗一阶导数来优化心脏收缩dz/dt、选择起搏部位、选择起搏矢量、引线放置或从电气和机械角度评估起搏捕获、选择有效的电极矢量配置用于起搏等),其中从电气和机械角度评估起搏捕获又例如,电捕获可能并不意味着机械捕获,并且通过从心音和阻抗中查看机械信息,心音和阻抗可能有助于评估电刺激是否捕获了心脏。例如,可以监测两个或更多个电极之间的心内阻抗信号,以用于提供这种优化。
图12示出了用于获取针对装置参数选项之一(例如,可以用于优化crt的可选装置参数之一,如可以是最优参数的潜在av延迟)的选择数据的方法850的一个实例。使用心音来优化心脏治疗的其他实例一般可参考2017年7月18日授权的名称为《基于心内阻抗和心音的心脏再同步治疗优化(cardiacresynchronizationtherapyoptimizationbasedonintracardiacimpedanceandheartsounds)》的美国专利第9,707,399号,其全部内容通过引用并入本文。
如图所示,使用多个装置选项之一来进行起搏治疗(框852)(例如,多个装置参数选项可以是选择的、确定的和/或计算出的av延迟,例如固有av延迟的百分比,例如40%的固有av延迟、50%的固有av延迟、60%的固有av延迟、70%的固有av延迟、80%的固有av延迟等)。对于用于起搏的装置参数选项(框852),在多个电极矢量配置中的每一个上获取选择数据(例如,在多个心动周期上监测心内阻抗,并使用这种阻抗信号提取选择数据)。如由判断框854所示,如果选择的数据还没有从所有期望的电极矢量配置获得,则重复获取选择数据的循环(例如,框858、860、862和864所示的循环)。如果已经从所有期望的电极向量配置中获取选择数据,则使用另一不同的装置参数选项来递送治疗(框856),并且重复图12的方法850(例如,针对不同的装置参数选项),直到已经为所有不同的装置参数选项获取选择数据(例如,针对每个不同的装置参数选项在多个电极矢量配置中的每一个处收集选择数据)。
如为每个所期望的电极矢量配置获取选择数据的重复循环中所示(例如,框858、860、862和864),选择多个电极矢量配置中的一个用于获取选择数据(框858)。对于选定的电极矢量配置,获取与至少一个心动周期的至少一部分收缩部相关的时间基准点和/或与至少一个心动周期的至少一部分舒张部相关的时间基准点(框860)(例如,如使用心音、分析阻抗信号的最小值和最大值、基于生理参数(例如r-r间隔)的算法的应用等)。例如,可以获取与心动周期的收缩和/或舒张部相关的时间基准点,可以获取与心动周期的收缩和/或舒张部内的一个或多个限定的段相关的时间基准点,和/或可以获取心动周期的收缩和/或舒张部的一个或多个点和/或部分内的或与之相关的时间基准点。更进一步地,例如,可以获取仅与心动周期的收缩部或舒张部相关的时间基准点,可以获取仅与心动周期的收缩部或舒张部内的一个或多个限定的段相关的时间基准点,和/或可以获取心动周期的仅收缩部或仅舒张部的一个或多个点和/或部分内的或与之相关的时间基准点。换句话说,可以获得与心动周期的收缩和舒张部都相关或仅与心动周期的这些部之一相关的基准点。此外,例如,这些基准点可以代表或指示测量窗口和/或时间段(例如,间隔、点等),在其上或其期间可以测量心内阻抗以用于本文所述的分析。
在大约相同的时间范围内(例如,大约与所获取的基准点同时),在选定的电极矢量配置处获取心内阻抗信号(框862)。利用所获取的基准点和所获取的心内阻抗信号,基于时间基准点来提取来自阻抗信号的测量值(框864)(例如,在基准点之间限定的测量窗口中的阻抗信号的积分、在基准点之间限定的测量窗口中的阻抗信号的最大斜率、基准点之间的时间、基准点处的最大阻抗等)。这些测量值中的一个或多个可以与用于这些测量的期望值相当,从而允许确定该测量值是否可以指示装置参数选项可以是用于优化治疗的有效装置参数(例如,如果装置参数选项可能是最优参数,可以基于多个这样的测量值是否满足某些标准或阈值,使用评分算法来确定。)
针对至少一个心动周期确定每个装置参数选项(例如,如图12所述而获得)的测量数据。在一个或多个实施例中,针对多个心动周期获取这些测量数据。获取测量数据的心动周期可以是任何合适的心动周期。在一个或多个实施例中,所选的获取测量数据的心动周期是基于呼吸周期的。在至少一个实施例中,在出现在呼吸周期结束时(例如,接近呼气末)的心动周期内获取测量数据。
图13描绘了用于与例如图1-5和7-9的说明性系统和装置一起使用的监测左心室捕获有效性的说明性方法200。特别地,该方法200可以与本文示出和描述的说明性vfa装置一起使用,该vfa装置将心脏再同步治疗递送给患者的心脏。例如,vfa装置可以递送ddd(r)、vvi(r)或vvi心脏疗法。因此,可以使用从右心房的koch三角区穿过右心房内膜和中央纤维体植入的组织穿刺电极来递送左心室搏动,以对位于患者心脏左心室心肌基底和/或中隔区的左心室递送心脏疗法和/或感测其电活动。
如图所示,方法200包括监测左心室捕获有效性210、确定有效或无效的左心室捕获是否退出220、以及在确定左心室起搏无效或低效的情况下调整左心室起搏230。如图所示,方法200可以继续循环或周期性地执行以连续监测左心室捕获有效性。例如,可以连续地监测有效性210,同时可以周期性地或间歇地确定有效或无效的左心室捕获是否退出220。此外,例如,可以连续地监测有效性210,并且可以在最新的所选时间段(例如,最近的10个心动周期)上确定有效或无效的左心室捕获是否退出220。
图15示出了图13描绘的方法200的一个实施例的更详细的流程图。如图所示,监测左心室捕获有效性210可以包括递送左心室搏动212。左心室搏动的时机以及是否递送左心室搏动(例如,在早期左心室激动的情况下)可能取决于所递送的疗法,但是,尽管如此,可以监测跟随搏动的电活动214。应当理解,在该实例中,当电活动被监测并用于确定左心室捕获时,可以获取任何其他形式的生理数据以确定和/或评估有效的左心室捕获,例如运动感测或阻抗感测。
特别地,可以使用近场信号来监测左心室搏动之后的选定时间段、选定时间、周期或时间窗口254。例如,可以使用vfa装置的两个或更多个电极监测近场信号。特别地,从右心房的koch三角区穿过右心房内膜和中央纤维体植入的组织穿刺电极可以是两个电极之一。另一个电极可以是位于患者右心房中的右心房电极。在一个实施例中,右心房电极可以与右心房中隔或其他心房组织接触,并且在另一实施例中,右心房电极可以位于右心房中而不接触右心房组织(例如,在右心房中“自由浮动”)。尽管如此,所监测的电信号可以被称为近场信号,这是因为,例如,不使用位于心脏外部或远离心脏的任何电极来监测该信号。
左心室搏动之后的选定时间段、选定时间、周期或时间窗口254可以在约40毫秒至约150毫秒之间。在一实施例中,所选择的时间段为约84毫秒。
可以使用一个或多个度量或比较来评估所选时间段内的近场信号的电描记图。例如,可以分析各种形态特征和这种形态特征的时间。特别地,可使用以下各项分析近场电描记图以确定有效的左心室捕获:紧接在起搏递送之前或之时基线处的一个或多个振幅、相对于基线振幅的振幅最小值、相对于基线振幅的最大值、最小值的出现时间、最先或最后出现的最小值或最大值、在选定的持续时间内或跟随其他事件出现的最小值或最大值、斜率(一阶导数)、二阶导数、绝对最小值或最大值等。
图14描绘了用于确定左心室捕获有效性的跟随心室搏动的说明性监测近场电描记图250的一部分。在该实例中,识别了多个形态学特征和形态学特征时间,其可以用于确定左心室起搏治疗的左心室捕获有效性216。
绝对基线振幅251可以用于确定左心室起搏治疗的左心室捕获有效性216。基线振幅251可以被定义为紧接在递送起搏之前或在递送起搏之时的振幅。可以将绝对基线振幅251与绝对基线阈值进行比较。绝对基线阈值可以在大约0毫伏与大约1毫伏之间。在一实施例中,绝对基线阈值为0.63毫伏。如果绝对基线振幅251小于绝对基线阈值,则可以确定正在发生有效的左心室捕获。
在选定的负偏差时间段内的最小负偏差252可用于确定左心室起搏治疗的左心室捕获有效性216。特别地,可以将最小负偏差252与最小阈值进行比较。最小阈值可以在大约1毫伏与大约10毫伏之间。在一实施例中,最小阈值为1毫伏。如果最小负偏差252小于最小阈值(换句话说,比最小阈值负),则可以确定正在发生有效的左心室捕获。
另外,如上所述,最小负偏差252在选定的负偏差时间段内或从中选取。所选择的负偏差时间段可以在左心室搏动之后的大约40毫秒至大约100毫秒之间。在一实施例中,选定的负偏差时间段为84毫秒。
左心室搏动和最小负偏差之间的时间段或最小负偏差的时间段253可以用于确定左心室起搏治疗的左心室捕获有效性216。特别地,可以将左心室搏动和最小负偏差之间的时间段253与间隔阈值进行比较。间隔阈值可以在约40毫秒与约60毫秒之间。在一实施例中,间隔阈值为45毫秒。如果左心室搏动和最小负偏差之间的时间段253小于间隔阈值,则可以确定正在发生有效的左心室捕获。
在所选时间段254内最大振幅和最小振幅的出现的相对顺序可以用于确定左心室起搏疗法的左心室捕获有效性216。例如,如果最小振幅在最大振幅之前发生,或最小振幅的时间在最大振幅的时间之前,则可以确定正在发生有效的左心室捕获。换句话说,如果在所监测的电活动的最大正偏差之前发生了所监测的电活动的最小负偏差,则可以确定正在发生有效的左心室捕获。在一个实施例中,可以将对应于最小负偏差或振幅的负或最小偏差时间戳与对应于最大正偏差或振幅的正或最大偏差时间戳进行比较。
这样,本文描述了四个说明性标准或度量,用于确定左心室搏动的左心室捕获有效性。这四个说明性标准或度量可以各自单独使用或彼此结合使用。例如,如果已经满足所有四个说明性标准,则可以确定已经有效捕获左心室的搏动。在其他实施例中,满足少于所有四个标准,例如四个标准中的两个或四个标准中的三个,可以指示有效捕获。
因此,可以确定左心室搏动的捕获有效性216,并且方法或过程210可以连续循环(如从过程216延伸到过程212的箭头所示),从而监测和评估每个左心室搏动的捕获。实际上,取决于所递送的特定心脏疗法,可以在多个起搏的和/或固有的(例如,无起搏的)心跳上计算有效的左心室搏动的量。可以在装置编程器界面上表示经过的时间段(例如,一天或更长时间、一周或更长时间、装置寿命、自上次装置询问以来的时间段等)的计数,作为对有效左心室起搏的诊断。
如果确定没有有效地捕获左心室起搏,则实例性方法200可以进一步调整左心室起搏230。这种调整的确定可以发生在多个搏动或心动周期上,以例如消除异常等。
此外,不同的疗法可以对左心室起搏疗法进行不同种类的调整,以随着时间的推移改善有效的捕获。如图15所示,在ddd(r)心脏治疗中,m个心动周期中的n个有效左心室搏动可用来确定是否正在发生有效左心室捕获222。换句话说,可以去确定在第二数量的心动周期内第一数量的左心室搏动是否尚未实现有效的左心室组织捕获。
因此,在多个心脏周期上对左心室起搏的有效性的评估可以用于确定是否在ddd(r)心脏治疗中调整起搏。可以将该度量描述为“滚动”,以便可以连续评估前m个心动周期。另外,可以根据过去m个心动周期中有效左心室搏动的选定百分比来描述过程222。例如,如果确定在过去的100个左心室起搏的心动周期中至少有90个左心室搏动是有效的,则可以确定ddd(r)心脏疗法具有有效的左心室捕获并且不需要调整。相反,如果确定在过去的100个左心室起搏的心动周期中少于90个左心室搏动是有效的,则可以确定ddd(r)心脏疗法没有足够的左心室捕获,应进行调整232。
例如,左心室起搏振幅可以增加232选定值或选定百分比。选定值可以在大约0.25毫伏与大约1毫伏之间。在一实施例中,选定值为0.5毫伏。另外,可以增加左心室起搏振幅,直到达到阈值、极限或边界。换句话说,可以使用上限阈值,使得可以增加振幅直到其达到上限阈值。上限阈值可以在4mv和10mv之间。在一实施例中,上限阈值为约6mv。
在其他实施例中,代替或结合增加起搏振幅,可以增加或调整一个或多个其他起搏设置,例如脉冲宽度、脉冲频率等。
此外,可以对a-v延迟进行调整232。如本文所使用的,术语“a-v延迟”或“av起搏间隔”是指心房激动(as或ap)和心室起搏(vp)的递送时间之间的确定的延迟,其中心房激动可以包括固有的心房激动(as)、或房感、或起搏的心房激动(ap)。具体地,可以将a-v延迟(其可以包括与多个不同心率相对应的多个不同a-v延迟)减小所选量或所选百分比。例如,a-v延迟可以减少10毫秒,直到捕获到有效的左心室或达到下限,例如,对于as为60毫秒,对于ap为70毫秒。此外,例如,a-v延迟可以减少5%,直到捕获到有效的左心室或达到下限为止。
在一些实施例中,可以调整振幅、a-v延迟和其他起搏设置232,直到获得左心室捕获,这可以使用与监测左心室捕获有效性210相同或相似的过程来确定。在已经调整了左心室起搏以实现有效捕获之后,该方法可以返回监测左心室捕获有效性210。另外,应当理解,即使在执行该方法的其他过程的同时,监测左心室捕获有效性210也可以正在连续发生。换句话说,监测左心室捕获有效性210可以是始终在运行的永久过程。
此外,如图15所示,在vvi(r)心脏疗法中,可以使用m个心动周期内的n个有效的左心室搏动和x个有效的固有左心室激动确定是否正在发生有效的左心室捕获224。换句话说,可以去确定在第二数量的心动周期内第一数量的左心室搏动是否尚未实现有效的左心室组织捕获,以及去确定在第二数量的心动周期内是否已经感测到第三数量的固有左心室激动。
因此,在多个心动周期中对左心室搏动和内在活动的有效性的评估可用于确定是否调整vvi(r)心脏治疗中的起搏。类似于ddd(r)治疗中使用的度量,该度量可以描述为“滚动”。
例如,如果确定在过去的100个心动周期(包括起搏的和固有心动周期)中至少有90个左心室搏动是有效的,则可以确定vvi(r)心脏疗法具有有效的左心室捕获功能并且不需要调整。相反,如果确定在过去的100个心动周期中小于90个左心室搏动且至少10个固有的左心室激动是有效的,则可以确定vvi(r)心脏治疗没有足够的左心室捕获并应进行调整234。此外,过程224可以根据过去的m个心动周期内的有效左心室搏动的选定百分比和过去的m个心动周期内的有效固有激动的选定百分比来描述。
vvi(r)心脏疗法的调整可包括使用例如心率延迟调整心率232。例如,可以减小心率延迟或lv-lv时间,以增加心率(例如每分钟10次心跳),直到获得有效的左心室捕获或达到极限,例如,每分钟130次。在其他实施例中,心率延迟可以减小选定的百分比,直到获得有效的左心室捕获或达到极限为止。在已经调整了左心室起搏以实现有效捕获之后,该方法可以返回监测左心室捕获有效性210。
更进一步,在vvi心脏治疗中,m个心动周期内的n个有效左心室搏动,以及在m个心动周期内是否感测到任何固有的左心室激动可以用于确定是否正在发生有效的左心室捕获226。换句话说,可以去确定226第一数量的左心室搏动是否尚未实现有效的左心室捕获以及去确定未感测到固有的左心室激动。
因此,在多个心动周期中左心室搏动和固有活动的有效性的评估可用于确定是否调整vvi心脏治疗中的起搏。类似于ddd(r)治疗中使用的度量,该度量可以描述为“滚动”。
例如,如果确定在过去的100个心动周期中至少有90个左心室搏动是有效的,则可以确定vvi心脏疗法具有有效的左心室捕获并且不需要调整。相反,如果确定在过去的100个心动周期中少于90个左心室搏动是有效的且未检测到固有的左心室激动,则可以确定vvi心脏疗法没有足够的左心室捕获而且应该调整236。vvi心脏疗法的调整236可包括调整起搏输出,包括起搏振幅和/或另一起搏设置,其可类似于本文关于ddd(r)起搏描述的调整过程232。在已经调整了左心室起搏以实现有效捕获之后,该方法可以返回监测左心室捕获有效性210。
另外,如果通过如图13和15所示的一个或多个过程确定无效的左心室组织捕获,则可以发出警报。例如,可植入医疗装置可以向如智能手机、其他医疗装置或阅读器之类的外部装置发出警报。此外,例如,可以从一个或多个装置发出声音,从而提醒用户。
说明性实施例
实施例1:一种可植入医疗装置,包含:
多个电极,包含:
组织穿刺电极,所述组织穿刺电极可从右心房的koch三角区穿过右心房内膜和中央纤维体而植入以对位于患者心脏左心室心肌基底和/或中隔区的左心室递送心脏疗法或感测其电活动,以及
右心房电极,所述右心房电极可定位在右心房内以对患者心脏的右心房递送心脏疗法或感测其电活动;
治疗递送电路,所述治疗递送电路可操作地耦合至所述多个电极以对患者心脏递送心脏疗法;
感测电路,所述感测电路可操作地耦合至所述多个电极以感测患者心脏的电活动;以及
控制器,所述控制器包含处理电路系统,所述处理电路可操作地耦合至所述治疗递送电路和所述感测电路,所述控制器被配置为通过以下方式监测左心室捕获有效性:
操作所述治疗递送电路,以使用所述组织穿刺电极递送左心室搏动;
通过所述感测电路,使用所述组织穿刺电极跟随所述左心室搏动监测左心室的电活动;以及
基于所监测的电活动确定左心室搏动的左心室组织捕获有效性。
实施例2:一种方法,包含:
提供组织穿刺电极,所述组织穿刺电极从右心房的koch三角区穿过右心房内膜和中央纤维体而植入以对位于患者心脏左心室心肌基底和/或中隔区的左心室递送心脏疗法或感测其电活动;
提供右心房电极,所述右心房电极可定位在右心房内以对患者心脏的右心房递送心脏疗法或感测其电活动;
使用所述组织穿刺电极递送左心室搏动;
跟随左心室搏动,使用所述组织穿刺电极监测所述左心室的电活动;以及
基于所监测的电活动确定左心室搏动的左心室组织捕获有效性。
实施例3:如实施例1至2中任一项所述的实施例,其中,跟随左心室搏动,使用所述组织穿刺电极监测所述左心室的电活动包含:使用所述组织穿刺电极和所述右心房电极监测所述左心室的电活动。
实施例4:如实施例1至3中任一项所述的实施例,其中,基于所监测的电活动确定左心室搏动的左心室组织捕获有效性包含:将所监测的电活动的绝对基线振幅与绝对基线振幅阈值进行比较。
实施例5:如实施例1至4中任一项所述的实施例,其中,基于所监测的电活动确定左心室搏动的左心室组织捕获有效性包含:将在左心室搏动之后的选定时间段内的最小负偏差与最低阈值进行比较。
实施例6:如实施例1至5中任一项所述的实施例,其中,基于所监测的电活动确定左心室搏动的左心室组织捕获有效性包含:将左心室搏动和最小负偏差之间的时间段与间隔阈值进行比较。
实施例7:如实施方式1至6中任一项所述的实施例,其中,基于所监测的电活动确定左心室搏动的左心室组织捕获有效性包含:确定所监测的电活动的最小负偏差是否发生在所监测的电活动的最大正偏差之前。
实施例8:如实施例1至7中任一项所述的实施例,其中,所述控制器还被配置为执行,或者所述方法还包含:
在多个心动周期中监测左心室捕获有效性;
基于在所述多个心动周期中监测到的左心室捕获有效性,确定未正在发生有效的左心室捕获;以及
响应于确定未正在发生有效的左心室捕获,调整左心室起搏。
实施例9:如实施例8所述的实施例,其中,基于在所述多个心动周期中监测到的左心室捕获有效性来确定未正在发生有效的左心室捕获包含:确定在第二数量的心动周期内第一数量的左心室搏动是否尚未实现有效的左心室组织捕获。
实施例10:如实施例8至9中任一项所述的实施例,其中,调整左心室起搏包含:调整所述左心室搏动的左心室起搏振幅和心房感测或搏动与所述左心室搏动之间的延迟中的一个或两个,直到确定所述左心室搏动的有效左心室组织捕获。
实施例11:如实施例8所述的实施例,其中,基于在所述多个心动周期中监测到的左心室捕获有效性来确定未正在发生有效的左心室捕获包含:
确定在第二数量的心动周期中第一数量的左心室搏动尚未实现有效的左心室组织捕获;以及
确定在第二数量的心动周期中已经感测到第三数量的固有的左心室激动。
实施例12:如实施例11所述的实施例,其中,响应于确定第一数量的左心室搏动未实现有效的左心室捕获并且已经感测到第三数量的固有的左心室激动,调整左心室起搏包含:
调整左心室感测或搏动与随后的左心室搏动之间的心率延迟,直到确定左心室搏动的有效左心室组织捕获。
实施例13:如实施例11所述的实施例,其中,响应于确定第一数量的左心室搏动尚未实现有效的左心室捕获并且尚未感测到固有的左心室激动,调整左心室起搏包含:
调整所述左心室搏动的左心室起搏振幅,直到确定所述左心室搏动的有效左心室组织捕获。
实施例14:如实施例1至13中任一项所述的实施例,其中,所述控制器还被配置为执行、所述方法还包含如果确定无效的左心室组织捕获,则发出警报。
实施例15:如实施例1至14中任一项所述的实施例,其中,监测左心室捕获有效性包含在选定数量的心动周期上周期性地监测左心室捕获有效性。
实施例16:一种可植入医疗装置,包含:
多个电极,包含:
组织穿刺电极,所述组织穿刺电极可从右心房的koch三角区穿过右心房内膜和中央纤维体而植入以对位于患者心脏左心室心肌基底和/或中隔区的左心室递送心脏疗法或感测其电活动,以及
右心房电极,所述右心房电极可定位在右心房内以对患者心脏的右心房递送心脏疗法或感测其电活动;
治疗递送电路,所述治疗递送电路可操作地耦合至所述多个电极以对患者心脏递送心脏疗法;
感测电路,所述感测电路可操作地耦合至所述多个电极以感测患者心脏的电活动;以及
控制器,所述控制器包含处理电路系统,所述处理电路可操作地耦合至所述治疗递送电路和所述感测电路,该控制器被配置为:
使用组织穿刺电极进行左心室搏动治疗;
基于至少使用所述组织穿刺电极监测的电激动,监测多个心动周期中左心室捕获有效性;
基于在所述多个心动周期中监测到的左心室捕获有效性,确定未正在发生有效的左心室捕获;以及
响应于确定未正在发生有效的左心室捕获,调整左心室起搏。
本文公开的各个方面可以以与说明书和附图中具体呈现的组合不同的组合进行组合。还应理解,取决于实例,本文所描述的工艺或方法中的任一者的某些动作或事件可以不同序列执行,可被添加、合并或完全省略(例如,所有描述的动作或事件对于执行这些技术可不为必需的)。另外,尽管为了清楚起见将本公开的某些方面描述为由单个模块或单元执行,但是本公开的技术可以由与例如医疗装置相关联的单元或模块的组合来执行。
在一个或多个实例中,所描述的技术可在硬件、软件、固件或其任何组合中实施。如果以软件实施,则功能可作为一个或多个指令或代码存储在计算机可读介质上且由基于硬件的处理单元执行。计算机可读介质可包括非暂时性计算机可读介质,其对应于有形介质,如数据存储介质(例如,ram、rom、eeprom、闪存或可用于存储呈指令或数据结构形式的期望程序代码且可由计算机访问的任何其他介质)。
指令可由一个或多个处理器执行,例如一个或多个数字信号处理器(dsp)、通用微处理器、专用集成电路(asic)、现场可编程逻辑阵列(fpga)或其他等效的集成或离散逻辑电路系统。因此,如本文所使用的术语“处理器”可指代任何前述结构或适合于实施所描述的技术的任何其他物理结构。而且,技术可完全实施于一个或多个电路或逻辑元件中。
出于所有目的,本文所引用的所有参考文献和出版物均通过引用全文明确地并入本文,除非并入的任何方面与本公开直接矛盾。
除非另有说明,否则本文中使用的所有科学和技术术语具有本领域中通常使用的含义。本文提供的定义是为了促进对本文中经常使用的某些术语的理解,并不意味着限制本公开的范围。
除非另有说明,否则在说明书和权利要求书中使用的所有表示特征尺寸、数量和物理性质的数字都可以理解为被术语“完全”或“大约”修饰。因此,除非有相反的指示,否则前述说明书和所附权利要求书中列出的数值参数是近似值,其可以根据本领域技术人员利用本文公开的教导或例如在实验误差的典型范围内寻求获得的所需特性而变化。
端点对数值范围的引用包括该范围内的所有数字(例如1至5包括1、1.5、2、2.75、3、3.80、4和5)以及该范围内的任何范围。在本文中,术语“最多”或“不大于”一个数字(例如,最多50)包括此数量(例如50),而术语“不小于”一个数字(例如,不小于5)包括此数字(例如5)。
术语“耦合”或“连接”是指元件彼此直接连接(彼此直接接触)或间接连接(在两个元件之间具有一个或多个元件并将其连接)。这两个术语都可以通过“可操作地”和“操作地”进行修改,它们可以互换使用,以描述耦合或连接配置为允许组件交互以执行至少某些功能(例如,可以将第一医疗装置可操作地耦合至另一医疗装置从而以数据形式发送信息或从中接收数据)。
与方向有关的术语,例如“顶部”、“底部”、“侧”和“端”,用于描述部件的相对位置,并不意味着限制所考虑的实施例的方向。例如,被描述为具有“顶部”和“底部”的实施例也包括其沿各种方向旋转的实施例,除非内容清楚地另外指出。
提及“一个实施例”、“一实施例”、“某些实施例”或“一些实施例”等意味着结合该实施例描述的特定特征、配置、组成或特性包括在本公开的至少一个实施例中。因此,这些短语在各个地方的出现不一定是指本公开的相同实施例。此外,在一个或多个实施例中,可以以任何合适的方式组合特定的特征、配置、组成或特性。
如本说明书和所附权利要求书中所使用的,单数形式“一”、“一个”和“该”涵盖具有多个指示物的实施例,除非内容另有明确规定。除非内容另外明确规定,否则如本说明书和所附权利要求书中所使用,术语“或”通常在其意义上用来包括“和/或”。
如本文中所使用的,“有”、“具有”、“包括”、“包含”等以其开放式含义使用,并且通常是指“包括但不限于”。将理解的是,“基本上由……组成”、“由……组成”等被包含在“包含”等中。
术语“和/或”是指一个或所有列出的元素或至少两个列出的元素的组合。
后面跟随列表的短语“至少一个”、“包含至少一个”和“一个或多个”指的是列表中的任何一项以及列表中两个或更多个项目的任意组合。
- 还没有人留言评论。精彩留言会获得点赞!