用于制备病原体灭活的全血的方法和套件与流程
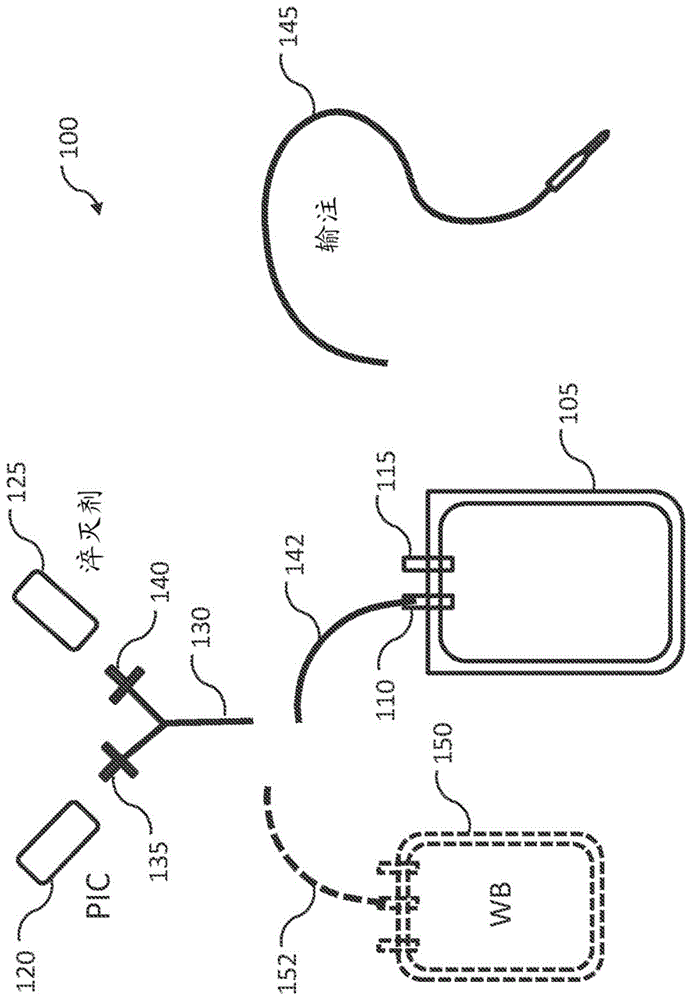
相关申请的交叉引用本申请要求2018年9月20日提交的美国临时申请62/734,117的优先权权益,其公开内容以引用方式全文并入本文。本公开涉及病原体灭活的全血以及用于制备病原体灭活的全血和其他血液制品组合物的改进的方法和套件。
背景技术:
:病原体灭活(pi)技术正越来越多地用于处理血液制品,以帮助降低输血传播感染和由供体白细胞引起并发症的风险。在某些国家可商购获得的至少三种pi技术在存在或不存在病原体灭活化合物(例如,光敏剂)的情况下利用紫外线处理一种或多种血液制品,诸如血浆、血小板、红细胞和/或全血(参见例如,schubert,2018;schlenke,2014;prowse2013)。此类pi技术包括,例如,基于氨托沙林/uv的系统(cerus)、基于核黄素/uv的系统(terumobct)以及仅基于uvc光的系统(macopharma)。处于后期临床开发中的用于处理红细胞(rbc)的至少一种其他pi技术也靶向核酸,其通过使用易碎的病原体灭活化合物(例如,s-303)实现,但不需要紫外线(henschler2011)。示例性的易碎pi化合物在美国专利6,093,725和6,514,987中有更详细的描述。用于rbc的血液系统利用易碎的靶向核酸的烷基化剂化合物s-303(例如,阿马他林(amustaline))进行病原体灭活。阿马他林是模块化合物,其包含吖啶锚定物(例如,靶向核酸的嵌入剂)、效应子(例如,与亲核物质诸如dna碱基反应的双烷基化剂基团)和接头(例如,含有可以在中性ph下水解的不稳定酯键的小的柔性碳链)。锚定物通过嵌入螺旋区域中而靶向病原体和细胞的核酸,并且效应子与核酸碱基快速(例如,几分钟)反应形成单加合物并随后交联,从而阻断复制。在数小时内,接头可以水解,从而导致锚定物与效应子解离。用于rbc的血液系统还包括淬灭剂,诸如谷胱甘肽(gsh),以减少阿马他林的非特异性结合(henschler2011;美国专利8,900,805)。在将供体rbc单位、阿马他林、gsh和处理溶液混合后,将掺和物转移至孵育袋,在室温下孵育18-24小时以进行病原体灭活和阿马他林水解,然后离心,随后除去含有残余的未水解阿马他林、gsh、处理溶液的溶液并用红细胞添加剂溶液替换,然后储存。还已经针对全血单位展示了使用病原体灭活化合物阿马他林和gsh进行的pi处理。然而,对于全血pi处理,不可执行与用于处理红细胞类似的离心和用新鲜添加剂溶液进行溶液替换的孵育后步骤,并且因此未通过这样的溶液替换步骤除去或减少残余的未水解阿马他林和gsh,如果残余的阿马他林在处理单位中保持高于某些浓度,那么这可能不允许将pi处理的全血单位用于输注到受试者体内。此外,与红细胞处理工艺相比,添加到全血中用于病原体灭活的阿马他林和gsh的体积限制可能影响投配,并从更好地促进化合物转移的处理套件改进中受益。最后,目前的病原体灭活技术(包括阿马他林/gsh系统)的使用可能受到某些限制,特别是在可能无法获得合适设施的地理区域以及血液组分不易获得或不易处理的战区。pi技术通常需要用于一个或多个处理步骤的合适的电源和设备,包括例如在处理过程中提供紫外线暴露的照明装置(例如,氨托沙林/uv和核黄素/uv系统)和/或用于其他处理步骤的装置,诸如使用无菌对接(例如,管焊接)装置将包含血液制品的袋子连接至pi系统(例如,连接至套件、处理装置)和/或离心机、孵育箱、摇杆、搅拌器或其他设备。因此,期望对pi技术和相关处理套件进行改进,从而可以进一步改善血液制品(例如,全血)的病原体灭活,诸如通过减少经过处理的制品中pi化合物的残余水平,改善pi化合物和淬灭剂在血液制品中的投配,和/或在不必需可能需要电源或仅需要适度电力供应(诸如来自便携式电池电源)的设备的情况下提供进行pi处理的机会。技术实现要素:为了满足这些和其他需要,本文所述的方法、套件和组合物尤其可用于制备病原体灭活的全血和其他病原体灭活的血液制品(例如,rbc、血浆、冷沉淀)组合物,包括例如在组合物中具有降低的病原体灭活化合物残余水平的病原体灭活的全血组合物,这对于后续输注(例如,pi处理的全血组合物的输注)可以是特别有益的。在一个方面,本公开提供了一种制备病原体灭活的全血组合物的方法,其包括:(a)在第一容器中混合(例如,合并、添加)(i)全血组合物,(ii)有效量的病原体灭活化合物(pic),以及任选的(iii)有效量的淬灭剂;(b)在第一容器中孵育全血组合物、pic和任选的淬灭剂的混合物(例如,掺和物),其条件和持续时间足以灭活病原体,如果存在的话;(c)在无菌条件下将混合物转移至第二容器;以及(d)在第二容器中孵育混合物,其条件和持续时间足以使(i)-(iii)中的至少一个适用:(i)在第二容器中孵育后pic的浓度比转移步骤(b)时混合物中pic的浓度小至少25%;(ii)在第二容器中孵育后pic的浓度比步骤(a)的混合物中pic的浓度(例如,初始浓度,即孵育步骤(b)之前的浓度)小(例如,低)至少105倍;或(iii)在第二容器中孵育后pic的浓度为约1nm或更少,从而产生病原体灭活的全血组合物。在一些实施方案中,所述方法包括:(a)在第一容器中混合(例如,合并、添加)(i)全血组合物和(ii)有效量的病原体灭活化合物(pic);(b)在第一容器中孵育全血组合物和pic的混合物,其条件和持续时间足以灭活病原体,如果存在的话;(c)在无菌条件下将混合物转移至第二容器;以及(d)在第二容器中孵育混合物,其条件和持续时间足以使(i)-(iii)中的至少一个适用:(i)在第二容器中孵育后pic的浓度比转移步骤(b)时混合物中pic的浓度小至少25%;(ii)在第二容器中孵育后pic的浓度比步骤(a)的混合物中pic的浓度小至少105倍;或(iii)在第二容器中孵育后pic的浓度为约1nm或更少,从而产生病原体灭活的全血组合物。在一些实施方案中,所述方法包括:(a)在第一容器中混合(例如,合并、添加)(i)全血组合物,(ii)有效量的病原体灭活化合物(pic),以及(iii)有效量的淬灭剂;(b)在第一容器中孵育全血组合物、pic和淬灭剂的混合物,其条件和持续时间足以灭活病原体,如果存在的话;(c)在无菌条件下将混合物转移至第二容器;以及(d)在第二容器中孵育混合物,其条件和持续时间足以使(i)-(iii)中的至少一个适用:(i)在第二容器中孵育后pic的浓度比转移步骤(b)时混合物中pic的浓度小至少25%;(ii)在第二容器中孵育后pic的浓度比步骤(a)的混合物中pic的浓度小至少105倍;或(iii)在第二容器中孵育后pic的浓度为约1nm或更少,从而产生病原体灭活的全血组合物。在一些实施方案中,所述方法还包括(例如,在孵育步骤(d)之后)将病原体灭活的全血组合物储存在冷藏条件下(例如,冷藏储存、储存在约2℃与约6℃之间)。在一些实施方案中,步骤(a)的混合物(例如,掺和物)中pic的浓度(例如,初始浓度,即孵育步骤(b)之前的浓度)为至少约0.1mm。在一些实施方案中,步骤(a)的混合物中pic的浓度为约0.1mm至约10mm。在一些实施方案中,步骤(a)的混合物中pic的浓度为约0.1mm至约1.0mm。在一些实施方案中,步骤(a)的混合物中pic的浓度为约0.2mm至约0.5mm。在一些实施方案中,步骤(a)的混合物中pic的浓度为约0.2mm。在一些实施方案中,在第二容器中孵育后pic的浓度比转移步骤(b)时混合物中pic的浓度小至少25%。在一些实施方案中,在第二容器中孵育后pic的浓度比转移步骤(b)时混合物中pic的浓度小至少50%。在一些实施方案中,步骤(d)之后pic的浓度比转移步骤(b)时混合物中pic的浓度小至少25%。在一些实施方案中,步骤(d)之后pic的浓度比转移步骤(b)时混合物中pic的浓度小至少50%。在一些实施方案中,在第二容器中孵育后pic的浓度比步骤(a)时混合物中pic的浓度小至少105倍。在一些实施方案中,步骤(d)之后pic的浓度比步骤(a)的混合物中pic的浓度小至少105倍。在一些实施方案中,在第二容器中孵育后pic的浓度为约1nm或更少。在一些实施方案中,在第二容器中孵育后pic的浓度小于约1nm。在一些实施方案中,在第二容器中孵育后pic的浓度为约0.75nm或更少。在一些实施方案中,在第二容器中孵育后pic的浓度小于约0.75nm。在一些实施方案中,步骤(d)之后pic的浓度小于约2nm。在一些实施方案中,步骤(d)之后pic的浓度小于约1nm。在一些实施方案中,步骤(d)之后pic的浓度小于约0.75nm。在一些实施方案中,pic包含作为或形成反应性亲电子基团的官能团。在一些实施方案中,官能团选自由以下组成的组:芥子(mustard)、芥子中间体和芥子等同物。在一些实施方案中,官能团是或能够形成吖丙啶鎓(aziridinium)离子。在一些实施方案中,反应性亲电子基团能够与核酸反应。在一些实施方案中,pic包含核酸结合配体。在一些实施方案中,核酸结合配体是嵌入剂。在一些实施方案中,嵌入剂是吖啶。在一些实施方案中,pic包含连接官能团和核酸结合配体的易碎接头。在一些实施方案中,pic是β-丙氨酸,n-(吖啶-9-基),2-[双(2-氯乙基)氨基]乙基酯。在一些实施方案中,步骤(a)包括在第一容器中混合(例如,合并、添加)全血组合物、有效量的pic和有效量的淬灭剂。在一些实施方案中,步骤(a)的混合物(例如,掺和物)中淬灭剂的浓度(例如,初始浓度,即孵育步骤(b)之前的浓度)为至少约1mm。在一些实施方案中,步骤(a)的混合物中淬灭剂的浓度为约1mm至约10mm。在一些实施方案中,步骤(a)的混合物中淬灭剂的浓度为约2mm。在一些实施方案中,步骤(a)的混合物中pic的浓度为约0.2mm并且步骤(a)的混合物中淬灭剂的浓度为约2mm。在一些实施方案中,步骤(a)的混合物中的淬灭剂浓度与pic浓度的摩尔比为约5:1至约20:1淬灭剂比pic。在一些实施方案中,步骤(a)的混合物中的淬灭剂浓度与pic浓度的摩尔比为约5:1、约6:1、约7:1、约8:1、约9:1、约10:1、约11:1、约12:1、约13:1、约14:1、约15:1、约16:1、约17:1、约18:1、约19:1或约20:1淬灭剂比pic。在一些实施方案中,步骤(a)的混合物中的淬灭剂浓度与pic浓度的摩尔比为约10:1淬灭剂比pic。在一些实施方案中,淬灭剂包含巯基,其中巯基能够与病原体灭活化合物的反应性亲电子基团反应。在一些实施方案中,淬灭剂包含半胱氨酸或半胱氨酸的衍生物。在一些实施方案中,淬灭剂是谷胱甘肽或其药学上可接受的盐。在一些实施方案中,淬灭剂是谷胱甘肽单钠盐。在一些实施方案中,步骤(a)的混合物还包含抗凝剂。在一些实施方案中,全血组合物还包含抗凝剂(例如,抗凝剂溶液)。在一些实施方案中,第一容器包含抗凝剂,并且全血组合物与抗凝剂在第一容器中混合(例如,在全血组合物与pic混合之前)。在一些实施方案中,全血组合物(例如,包括凝固剂)具有约250ml至约700ml的体积。在一些实施方案中,全血组合物具有约400ml至约600ml的体积。在一些实施方案中,抗凝剂与全血的比率(例如,在全血组合物中)为约1:5至约1:9。在一些实施方案中,抗凝剂与全血的比率为约1:7。在一些实施方案中,通过第一容器的第一入口将全血组合物添加(例如,引入、转移)到第一容器中。在一些实施方案中,将全血组合物从包含全血组合物的供体采集容器(例如,全血采集容器)添加到第一容器中。在一些实施方案中,将全血组合物从与第一容器(例如,第一容器中的第一入口)联接的包含全血组合物的供体采集容器添加到第一容器中。在一些实施方案中,通过供体采集容器与第一容器(例如,第一容器的第一入口)之间的导管(例如,在其间延伸、连接,从而提供流体连通路径的一个或多个管段)将全血组合物从包含全血组合物的供体采集容器添加到第一容器中。在一些实施方案中,通过将全血组合物从供体(例如,全血供体)采集到第一容器中(例如,直接采集到第一容器中,而不先采集到中间容器中,不先采集到供体采集容器中)来将全血组合物添加到第一容器中。在一些实施方案中,将全血组合物从全血供体收集到第一容器中。在一些实施方案中,全血组合物是从供体采集到第一容器中(例如,直接采集到第一容器中,而不先采集到不同容器中)的全血捐献物。在一些实施方案中,通过第一导管(例如,一个或多个管段)将全血组合物从供体采集到第一容器中。在一些实施方案中,全血组合物是使用血管接入装置(例如,针头、静脉穿刺针头)从供体采集到第一容器中的全血捐献物,所述血管接入装置诸如通过在血管接入装置与第一容器之间延伸(例如,并提供从或通过血管接入装置至第一容器的流体连通路径)的导管(例如,管、一个或多个管段)连接至容器(例如,第一容器)的血管接入装置。在一些实施方案中,通过在血管接入装置(例如,针头、静脉穿刺针头)与第一容器(例如,第一容器的第一入口)之间延伸并提供用于将全血组合物从供体(例如,从血管接入装置、通过血管接入装置)转移到第一容器中的流体连通路径的第一导管将全血组合物从全血供体采集到第一容器中。在一些实施方案中,血管接入装置(例如,针头)和从其延伸的导管构成针头组件。在一些实施方案中,通过第一容器的入口(例如,第一入口、第二入口)将pic和任选的淬灭剂(例如,pic和淬灭剂)添加到第一容器中。在一些实施方案中,在将全血组合物添加到第一容器中之后,将pic和任选的淬灭剂(例如,pic和淬灭剂)添加到第一容器中。在一些实施方案中,将pic和淬灭剂依次添加到第一容器中(例如,添加至全血组合物)。在一些实施方案中,在淬灭剂之前将pic添加到第一容器中(例如,添加至全血组合物)。在一些实施方案中,在pic之前将淬灭剂添加到第一容器中(例如,添加至全血组合物)。在一些实施方案中,在通过第一容器的第一入口将全血组合物添加到第一容器中之后,通过第一容器的第一入口将pic和任选的淬灭剂(例如,pic和淬灭剂)添加到第一容器中。在一些实施方案中,通过第一容器的第二入口将pic和任选的淬灭剂(例如,pic和淬灭剂)添加到第一容器中。在一些实施方案中,通过导管(例如,一个或多个管段)将pic和任选的淬灭剂(例如,pic和淬灭剂)添加到第一容器中,所述导管在包含pic的容器(pic容器)和任选的包含淬灭剂的容器(淬灭剂容器)与第一容器的入口之间延伸并提供用于将pic从pic容器转移到第一容器中并且任选地用于将淬灭剂从任选的淬灭剂容器转移到第一容器中的流体连通路径。在一些实施方案中,通过在pic容器与第一容器的入口(例如,第一入口、第二入口)之间延伸(例如,并提供用于将pic从pic容器转移到第一容器中的流体连通路径)的导管(例如,管、一个或多个管段)将pic添加到第一容器中。在一些实施方案中,导管在一端(例如,与第一容器连接端相对)包括:(a)用于将pic容器联接(例如,连接)至导管的第一适配器,以及任选的(b)适用于增加pic向第一容器中的转移(例如,通过导管并进入第一容器)的置换装置(例如,空气置换装置)。在一些实施方案中,通过导管(例如,管、一个或多个管段)将pic和淬灭剂添加到第一容器中,所述导管在pic容器和淬灭剂容器与第一容器的入口(例如,第一入口、第二入口)之间延伸,并且提供用于将pic从pic容器转移到第一容器中并将淬灭剂从淬灭剂容器转移到第一容器中的流体连通路径。在一些实施方案中,通过在pic容器和淬灭剂容器与第一容器的入口之间延伸的导管将pic和淬灭剂添加到第一容器中,并且其中导管在一端(例如,与第一容器连接端相对)包括:(a)用于将pic容器联接(例如,连接)至导管的第一适配器,(b)用于将淬灭剂容器联接(例如,连接)至导管的第二适配器,以及任选的(c)适用于增加pic和淬灭剂向第一容器中的转移(例如,通过导管并进入第一容器)的置换装置(例如,空气置换装置)。在一些实施方案中,通过在pic容器和淬灭剂容器与第一容器的入口之间延伸的导管将pic和淬灭剂添加到第一容器中,并且其中导管在一端(例如,与第一容器连接端相对)包括:(a)用于将pic容器联接(例如,连接)至导管的第一适配器,(b)用于将淬灭剂容器联接(例如,连接)至导管的第二适配器,以及(c)适用于增加pic和淬灭剂向第一容器中的转移(例如,通过导管并进入第一容器)的置换装置(例如,空气置换装置)。在一些实施方案中,pic容器和淬灭剂容器是同一容器(例如,具有用于pic和淬灭剂的独立腔室的容器)。在一些实施方案中,孵育步骤(b)为约2小时至约24小时。在一些实施方案中,孵育步骤(b)为约18小时至约22小时。在一些实施方案中,孵育步骤(b)为约20小时。在一些实施方案中,孵育步骤(b)处于室温(例如,20℃-25℃、22℃)下。在一些实施方案中,转移步骤(c)是通过在第一容器与第二容器之间延伸(例如,连接)的导管进行的。在一些实施方案中,导管将第一容器的第一出口连接至第二容器的第一入口(例如,在其间提供流体连通路径)。在一些实施方案中,孵育步骤(d)为约1小时至约8小时。在一些实施方案中,孵育步骤(d)为约2小时至约4小时。在一些实施方案中,孵育步骤(d)处于与孵育步骤(b)基本上相同的温度下。在一些实施方案中,孵育步骤(d)处于室温(例如,20℃-25℃、22℃)下。在一些实施方案中,所述方法还包括将病原体灭活的全血组合物从第二容器转移至第三容器。在一些实施方案中,所述方法还包括:(e)将病原体灭活的全血组合物储存在约2-6℃下(例如,在孵育步骤(d)之后,储存在第二容器、第三容器中)。在一些实施方案中,病原体灭活的全血组合物适用于输注(例如,输注到受试者体内)。在一些实施方案中,所述方法还包括由病原体灭活的全血组合物制备(例如,将病原体灭活的全血组合物分离为)红细胞组合物、血浆组合物或血小板组合物中的一种或多种。在一些实施方案中,所述方法还包括由病原体灭活的全血组合物制备冷沉淀组合物。在一些实施方案中,所述方法还包括由病原体灭活的全血组合物制备(例如,将病原体灭活的全血组合物分离为)血浆组合物,并且由血浆组合物制备冷沉淀组合物。在一些实施方案中,第一容器(例如,容器片材)包含聚氯乙烯(例如,增塑聚氯乙烯)。在一些实施方案中,第一容器包含聚乙烯(例如,乙烯-乙酸乙烯酯、乙烯-乙酸乙烯酯共聚物)。在一些实施方案中,第一容器包含聚烯烃(例如,聚烯烃共混物)。在一些实施方案中,第二容器(例如,容器片材)包含聚氯乙烯(例如,增塑聚氯乙烯)。在一些实施方案中,第二容器包含聚乙烯(例如,乙烯-乙酸乙烯酯、乙烯-乙酸乙烯酯共聚物)。在一些实施方案中,第二容器包含聚烯烃(例如,聚烯烃共混物)。在一些实施方案中,第一容器和/或第二容器不包含邻苯二甲酸二乙基己酯。在另一方面,本公开提供了一种通过任何前述方法制备的病原体灭活的全血组合物。在一些实施方案中,病原体灭活的全血组合物适用于输注。在一些实施方案中,病原体灭活的全血组合物是适用于输注的病原体灭活的全血单位。本公开的另一方面提供了一种通过任何前述方法制备的病原体灭活的红细胞组合物(例如,适用于输注的病原体灭活的红细胞组合物)。本公开的另一方面提供了一种通过任何前述方法制备的病原体灭活的血浆组合物(例如,适用于输注的病原体灭活的血浆组合物)。本公开的另一方面提供了一种通过任何前述方法制备的病原体灭活的血小板组合物(例如,适用于输注的病原体灭活的血小板组合物)。本公开的另一方面提供了一种通过任何前述方法制备的病原体灭活的冷沉淀组合物(例如,适用于输注的病原体灭活的冷沉淀组合物)。在另一方面,本公开提供了一种将病原体灭活的全血组合物输注到有需要的受试者体内的方法,所述方法包括将通过任何前述方法制备的病原体灭活的全血组合物或前述病原体灭活的全血组合物输注到受试者体内。在一些实施方案中,输注病原体灭活的全血组合物的方法是通过借由联接(例如,连接)至包含病原体灭活的全血组合物的容器(例如,第二容器、第三容器)的出口(例如,第一出口、尖嘴端口(spikeport))的导管(例如,输注管线、输注管线组件)输注病原体灭活的全血组合物实现的。在一些实施方案中,输注病原体灭活的全血组合物的方法包括通过联接至第二容器的输注管线组件输注病原体灭活的全血组合物。在一些实施方案中,输注病原体灭活的全血组合物的方法包括将输注管线(例如,输注管线组件)联接(例如,连接)至第二容器的出口(例如,第一出口、尖嘴端口)并且将病原体灭活的全血组合物输注到受试者体内。在一些实施方案中,输注病原体灭活的全血组合物的方法包括将输注管线组件联接至第二容器并且将病原体灭活的全血组合物输注到受试者体内。在一些实施方案中,输注病原体灭活的全血组合物的方法包括将输注管线组件联接至第三容器并且将病原体灭活的全血组合物输注到受试者体内。在一些实施方案中,输注病原体灭活的全血组合物的方法包括将通过本公开的任何方法和/或任何套件制备的病原体灭活的全血组合物输注到患有创伤的受试者体内(例如,用于创伤复苏)。在一些实施方案中,受试者由于创伤而急性出血。在一些实施方案中,受试者是表现出收缩压<100mmhg、<90mmhg或小于80mmhg的创伤患者。在一些实施方案中,病原体灭活的全血组合物是与受试者相容的abo。在一些实施方案中,病原体灭活的全血组合物是与受试者相容的rhd。在一些实施方案中,病原体灭活的全血组合物来自o型供体。在一些实施方案中,输注方法包括施用通过本公开的任何方法和/或使用本公开的任何套件制备的病原体灭活的全血组合物的两次或更多次输注(例如,两个或更多个单位)。在一些实施方案中,在受伤处将病原体灭活的全血组合物输注到有需要的受试者(诸如战场上的士兵)体内。在另一方面,本公开提供了一种用于制备病原体灭活的全血组合物的套件,其包括:(a)用于从供体中抽取全血(例如,通过静脉穿刺)的血管接入装置(例如,针头),(b)适用于混合(例如,合并、添加)全血和病原体灭活化合物(pic)的第一容器,其中第一容器包含(例如,包括)至少第一入口和第一出口;(c)在血管接入装置与第一容器(例如,第一容器的第一入口)之间延伸(例如,并提供用于将全血从供体(例如,通过血管接入装置)转移到第一容器中的流体连通路径)的第一导管(例如,管、一个或多个管段);以及(d)包含病原体灭活化合物的容器(pic容器)。在一些实施方案中,血管接入装置是用于在供体中实现血管接入的针头(例如,静脉穿刺针头)。在一些实施方案中,血管接入装置和第一导管构成针头组件。在一些实施方案中,pic容器被构造成联接(例如,通过流体连通路径(例如,导管、管))至第一容器(例如,第一容器的第一入口)。在一些实施方案中,pic容器被构造成联接至第一导管。在一些实施方案中,pic容器通过流体连通路径(例如,导管、管)联接至第一容器。在一些实施方案中,第一容器还包括第二入口。在一些实施方案中,第一容器还包括第二入口并且pic容器被构造成联接(例如,通过流体连通路径)至第一容器的第二入口。在一些实施方案中,pic容器联接(例如,通过流体连通路径(例如,导管、管))至第一容器的第二入口。在一些实施方案中,套件还包括第二pic容器。在一些实施方案中,第二pic容器适用于储存pic(例如,冻干的pic)。在一些实施方案中,第二pic容器适用于重构冻干的pic。在一些实施方案中,联接至或被构造成联接至套件的第一容器的pic容器适用于储存pic。在一些实施方案中,联接至或被构造成联接至套件的第一容器的pic容器适用于重构冻干的pic。在一些实施方案中,第二pic容器适用于将pic转移至联接至或被构造成联接至本文提供的套件的第一容器的pic容器。在一些实施方案中,第二pic容器适用于将pic转移至联接至或被构造成联接至本文提供的套件的第一容器的导管。在一些实施方案中,套件还包括包含淬灭剂的容器(淬灭剂容器)。在一些实施方案中,淬灭剂容器被构造成联接(例如,通过流体连通路径)至第一容器(例如,第一容器的第一入口)。在一些实施方案中,淬灭剂容器被构造成联接至第一导管。在一些实施方案中,淬灭剂容器通过流体连通路径(例如,导管、管)联接至第一容器。在一些实施方案中,淬灭剂容器被构造成联接(例如,通过流体连通路径)至第一容器的第二入口。在一些实施方案中,淬灭剂容器联接(例如,通过流体连通路径(例如,导管、管))至第一容器的第二入口。在一些实施方案中,套件还包括第二淬灭剂容器。在一些实施方案中,第二淬灭剂容器适用于储存淬灭剂(例如,冻干的淬灭剂)。在一些实施方案中,第二淬灭剂容器适用于重构冻干的淬灭剂。在一些实施方案中,联接至或被构造成联接至套件的第一容器的淬灭剂容器适用于储存淬灭剂。在一些实施方案中,联接至或被构造成联接至套件的第一容器的淬灭剂容器适用于重构冻干的淬灭剂。在一些实施方案中,第二pic容器适用于将淬灭剂转移至联接至或被构造成联接至本文提供的套件的第一容器的淬灭剂容器。在一些实施方案中,第二淬灭剂容器适用于将淬灭剂转移至联接至或被构造成联接至本文提供的套件的第一容器的导管。在一些实施方案中,pic容器和淬灭剂容器是同一容器(例如,同一容器的部分、同一容器的独立腔室)。在一些实施方案中,pic容器和淬灭剂容器是同一容器内的独立腔室。在一些实施方案中,套件还包括第二导管,其中第二导管在一端包括用于将pic容器和/或淬灭剂容器联接至第二导管的至少一个适配器。在一些实施方案中,套件还包括第二导管,其中第二导管在一端包括用于将pic容器联接至第二导管的至少一个适配器。在一些实施方案中,套件还包括第二导管,其中第二导管在一端包括用于将淬灭剂容器联接至第二导管的至少一个适配器。在一些实施方案中,第二导管在一端包括用于将pic容器联接至第二导管的第一适配器和用于将淬灭剂容器联接至第二导管的第二适配器。在一些实施方案中,套件还包括第二导管,其中第二导管在一端联接至pic容器和/或淬灭剂容器。在一些实施方案中,第二导管被构造成联接至第一容器(例如,在pic容器和/或淬灭剂容器与第一容器之间提供流体连通路径)。在一些实施方案中,第二导管被构造成联接至第一容器的第一入口。在一些实施方案中,第二导管被构造成联接至第一容器的第二入口。在一些实施方案中,第二导管联接至第一容器(例如,在pic容器和/或淬灭剂容器与第一容器之间提供流体连通路径)。在一些实施方案中,第二导管联接至第一容器的第一入口。在一些实施方案中,第二导管联接至第一容器的第二入口。在一些实施方案中,第二导管被构造成联接至第一导管(例如,在pic容器和/或淬灭剂容器与第一容器之间提供流体连通路径)。在一些实施方案中,流体连通路径是可打开的流体连通路径。在一些实施方案中,套件还包括适用于增加pic和/或淬灭剂向第一容器中的转移(例如,通过第二导管并进入第一容器)的置换装置(例如,空气置换装置)。在一些实施方案中,套件还包括适用于增加pic向第一容器中的转移的置换装置。在一些实施方案中,套件还包括适用于增加淬灭剂向第一容器中的转移的置换装置。在一些实施方案中,套件还包括适用于增加pic和淬灭剂向第一容器中的转移的置换装置。在一些实施方案中,置换装置是空气置换装置。在一些实施方案中,空气置换装置是样品旁路转移袋(diversionpouch)。在一些实施方案中,置换装置(例如,空气置换装置)联接至第二导管。在一些实施方案中,第一容器包含抗凝剂(例如,抗凝剂溶液)。在一些实施方案中,pic包含作为或形成反应性亲电子基团的官能团。在一些实施方案中,官能团选自由以下组成的组:芥子、芥子中间体和芥子等同物。在一些实施方案中,官能团是或能够形成吖丙啶鎓离子。在一些实施方案中,反应性亲电子基团能够与核酸反应。在一些实施方案中,pic包含核酸结合配体。在一些实施方案中,核酸结合配体是嵌入剂。在一些实施方案中,嵌入剂是吖啶。在一些实施方案中,pic包含连接官能团和核酸结合配体的易碎接头。在一些实施方案中,pic是β-丙氨酸,n-(吖啶-9-基),2-[双(2-氯乙基)氨基]乙基酯。在一些实施方案中,淬灭剂包含巯基,其中巯基能够与病原体灭活化合物的反应性亲电子基团反应。在一些实施方案中,淬灭剂包含半胱氨酸或半胱氨酸的衍生物。在一些实施方案中,淬灭剂是谷胱甘肽或其药学上可接受的盐。在一些实施方案中,淬灭剂是谷胱甘肽单钠盐。在一些实施方案中,套件还包括适用于储存病原体灭活的全血组合物的第二容器。在一些实施方案中,套件还包括适用于储存病原体灭活的全血组合物的第二容器,其中第二容器包含(例如,包括)至少第一入口和第一出口。在一些实施方案中,第二容器联接至第一容器。在一些实施方案中,套件还包括第三导管,其在第一容器(例如,第一容器的第一出口)与第二容器(例如,第二容器的第一入口)之间延伸(例如,并提供用于将包含全血组合物和pic的混合物(例如,病原体灭活的全血组合物)从第一容器转移(例如,在无菌条件下)到第二容器中的流体连通路径)。在一些实施方案中,套件还包括适用于储存病原体灭活的全血组合物的第三容器。在一些实施方案中,套件还包括适用于储存病原体灭活的全血组合物的第三容器,其中第三容器包含(例如,包括)至少第一入口和第一出口,以及第四导管,所述第四导管在第二容器(例如,第二容器的第一出口)与第三容器(例如,第三容器的第一入口)之间延伸并且提供用于将包含全血组合物和pic的混合物(例如,病原体灭活的全血组合物)从第二容器转移(例如,在无菌条件下)到第三容器中的流体连通路径。在一些实施方案中,流体连通路径是可打开的流体连通路径。在一些实施方案中,套件还包括用于将病原体灭活的全血组合物输注到受试者体内(例如,施用病原体灭活的全血)的输注管线组件。在一些实施方案中,输注管线组件被构造成联接(例如,通过尖嘴端口)至第一容器、第二容器或第三容器。在一些实施方案中,套件还包括用于将病原体灭活的全血组合物输注到受试者体内的输注管线组件,其中输注管线组件包括第二血管接入装置(例如,针头、输注针头)和在第一容器、第二容器或第三容器(例如,第一容器、第二容器或第三容器的出口)与第二血管接入装置之间延伸的输注管线导管(例如,其中输注管线导管提供用于将病原体灭活的全血组合物从容器(例如,第一容器、第二容器、第三容器)无菌转移至血管接入装置的流体连通路径)。在一些实施方案中,套件还包括用于将病原体灭活的全血组合物输注到受试者体内的输注管线组件,其中输注管线组件包括第二血管接入装置和在第二容器的第一出口与第二血管接入装置之间延伸的输注管线导管(例如,其中输注管线导管提供用于将病原体灭活的全血组合物从第二容器无菌转移至血管接入装置的流体连通路径)。在一些实施方案中,输注管线组件包括过滤器。在一些实施方案中,第一容器(例如,容器片材)包含聚氯乙烯(例如,增塑聚氯乙烯)。在一些实施方案中,第一容器包含聚乙烯(例如,乙烯-乙酸乙烯酯、乙烯-乙酸乙烯酯共聚物)。在一些实施方案中,第一容器包含聚烯烃(例如,聚烯烃共混物)。在一些实施方案中,第二容器(例如,容器片材)包含聚氯乙烯(例如,增塑聚氯乙烯)。在一些实施方案中,第二容器包含聚乙烯(例如,乙烯-乙酸乙烯酯、乙烯-乙酸乙烯酯共聚物)。在一些实施方案中,第二容器包含聚烯烃(例如,聚烯烃共混物)。在一些实施方案中,第一容器和/或第二容器不包含邻苯二甲酸二乙基己酯。在另一方面,本公开提供了一种用于制备病原体灭活的全血组合物的套件,其包括:(a)适用于混合(例如,合并、添加)全血组合物、病原体灭活化合物(pic)和淬灭剂的第一容器,其中第一容器包含(例如,包括)至少第一入口和第一出口,(b)适用于储存病原体灭活的全血组合物的第二容器,其中第二容器包含(例如,包括)至少第一入口和第一出口,并且其中第二容器联接至第一容器;(c)包含病原体灭活化合物的容器(pic容器),(d)包含淬灭剂的容器(淬灭剂容器),(e)第一导管,其中第一导管在一端联接至或被构造成联接至pic容器和淬灭剂容器,并且其中第一导管还包括适用于增加pic和淬灭剂向第一容器中的转移(例如,通过第一导管并进入第一容器)的置换装置(例如,空气置换装置)。在一些实施方案中,第一容器的第一出口联接至第二容器的第一入口。在一些实施方案中,第一容器通过第二导管(例如,管)联接至第二容器,所述第二导管提供用于将全血组合物(例如,病原体灭活的全血组合物)从第一容器转移至第二容器的流体连通路径。在一些实施方案中,本公开提供了一种用于制备病原体灭活的全血组合物的套件,其包括:(a)适用于混合(例如,合并、添加)全血组合物、病原体灭活化合物(pic)和淬灭剂的第一容器,其中第一容器包含(例如,包括)至少第一入口和第一出口,(b)适用于储存病原体灭活的全血组合物的第二容器,其中第二容器包含(例如,包括)至少第一入口和第一出口;(c)包含病原体灭活化合物的容器(pic容器),(d)包含淬灭剂的容器(淬灭剂容器),(e)第一导管,其中第一导管在一端联接至或被构造成联接至pic容器和淬灭剂容器,并且其中第一导管还包括适用于增加pic和淬灭剂向第一容器中的转移(例如,通过第一导管并进入第一容器)的置换装置(例如,空气置换装置);以及(f)在第一容器与第二容器之间延伸(例如,并提供用于将全血组合物(例如,病原体灭活的全血组合物)从第一容器转移至第二容器的流体连通路径)的第二导管。在一些实施方案中,第一导管提供从pic容器和淬灭剂容器的流体连通路径。在一些实施方案中,流体连通路径是可打开的流体连通路径。在一些实施方案中,第一容器还包含(例如,包括)第二入口。在一些实施方案中,第一导管还包括用于将第一导管联接至pic容器和淬灭剂容器的至少一个适配器。在一些实施方案中,第一导管包括用于将pic容器联接至第一导管的第一适配器和用于将淬灭剂容器联接至第一导管的第二适配器。在一些实施方案中,第一导管联接至pic容器和淬灭剂容器。在一些实施方案中,pic容器和淬灭剂容器是同一容器。在一些实施方案中,第一导管联接或被构造成联接至第一容器,从而在pic容器和淬灭剂容器与第一容器之间提供流体连通路径。在一些实施方案中,第一导管联接或被构造成联接至第一容器的入口(例如,第一入口、第二入口)。在一些实施方案中,套件还包括用于从供体中抽取全血(例如,通过静脉穿刺)的血管接入装置(例如,针头)。在一些实施方案中,套件还包括用于从供体中抽取全血的血管接入装置和在血管接入装置与第一容器(例如,第一容器的第一入口)之间延伸(例如,连接)并提供用于将全血从供体(例如,从血管接入装置、通过血管接入装置)转移到第一容器中的流体连通路径的第三导管。在一些实施方案中,pic容器被构造成联接(例如,通过流体连通路径(例如,导管、管))至第一导管。在一些实施方案中,pic容器被构造成联接至第一导管。在一些实施方案中,pic容器通过流体连通路径联接至第一导管。在一些实施方案中,套件还包括第二pic容器。在一些实施方案中,第二pic容器适用于储存pic(例如,冻干的pic)。在一些实施方案中,第二pic容器适用于重构冻干的pic。在一些实施方案中,联接或被构造成联接至第一导管的pic容器适用于储存pic。在一些实施方案中,联接或被构造成联接至第一导管的pic容器适用于重构冻干的pic。在一些实施方案中,第二pic容器适用于将pic转移至联接至或被构造成联接至第一导管的pic容器。在一些实施方案中,第二pic容器适用于将pic转移至联接至或被构造成联接至本文提供的套件的第一容器的导管。在一些实施方案中,套件还包括包含淬灭剂的容器(淬灭剂容器)。在一些实施方案中,淬灭剂容器被构造成联接(例如,通过流体连通路径(例如,导管、管))至第一导管。在一些实施方案中,淬灭剂容器被构造成联接至第一导管。在一些实施方案中,淬灭剂容器通过流体连通路径联接至第一导管。在一些实施方案中,套件还包括第二淬灭剂容器。在一些实施方案中,第二淬灭剂容器适用于储存淬灭剂(例如,冻干的淬灭剂)。在一些实施方案中,第二淬灭剂容器适用于重构冻干的淬灭剂。在一些实施方案中,联接或被构造成联接至第一导管的淬灭剂容器适用于储存淬灭剂。在一些实施方案中,联接或被构造成联接至第一导管的淬灭剂容器适用于重构冻干的淬灭剂。在一些实施方案中,第二pic容器适用于将淬灭剂转移至联接至或被构造成联接至第一导管的淬灭剂容器。在一些实施方案中,第二淬灭剂容器适用于将淬灭剂转移至联接至或被构造成联接至本文提供的套件的第一容器的导管。在一些实施方案中,pic容器和淬灭剂容器是同一容器(例如,同一容器的部分、同一容器的独立腔室)。在一些实施方案中,pic容器和淬灭剂容器是同一容器内的独立腔室。在一些实施方案中,第一容器还包含(例如,包括)第二入口,其中第一导管被构造成联接至第一容器的第二入口。在一些实施方案中,第一容器还包含(例如,包括)第二入口并且第一导管联接至第一容器的第二入口。在一些实施方案中,第一导管提供从pic容器和淬灭剂容器至第一容器的流体连通路径。在一些实施方案中,第一导管被构造成联接至第三导管,从而在pic容器和淬灭剂容器与第一容器之间提供流体连通路径。在一些实施方案中,流体连通路径是可打开的流体连通路径。在一些实施方案中,第一容器包含抗凝剂。在一些实施方案中,pic包含作为或形成反应性亲电子基团的官能团。在一些实施方案中,官能团选自由以下组成的组:芥子、芥子中间体和芥子等同物。在一些实施方案中,官能团是或能够形成吖丙啶鎓离子。在一些实施方案中,反应性亲电子基团能够与核酸反应。在一些实施方案中,pic包含核酸结合配体。在一些实施方案中,核酸结合配体是嵌入剂。在一些实施方案中,嵌入剂是吖啶。在一些实施方案中,pic包含连接官能团和核酸结合配体的易碎接头。在一些实施方案中,pic是β-丙氨酸,n-(吖啶-9-基),2-[双(2-氯乙基)氨基]乙基酯。在一些实施方案中,淬灭剂包含巯基,其中巯基能够与病原体灭活化合物的反应性亲电子基团反应。在一些实施方案中,淬灭剂包含半胱氨酸或半胱氨酸的衍生物。在一些实施方案中,淬灭剂是谷胱甘肽或其药学上可接受的盐。在一些实施方案中,淬灭剂是谷胱甘肽单钠盐。在一些实施方案中,套件包括适用于储存病原体灭活的全血组合物的第三容器,其中第三容器包含(例如,包括)至少第一入口和第一出口,并且其中第三容器联接至第二容器。在一些实施方案中,套件包括适用于储存病原体灭活的全血组合物的第三容器,其中第三容器包含(例如,包括)至少第一入口和第一出口,并且其中套件还包括第四导管,所述第四导管在第二容器(例如,第二容器的第一出口)与第三容器(例如,第三容器的第一入口)之间延伸(例如,并提供用于将全血组合物(例如,病原体灭活的全血组合物)从第二容器转移(例如,在无菌条件下)到第三容器中的流体连通路径)。在一些实施方案中,流体连通路径是可打开的流体连通路径。在一些实施方案中,套件还包括用于将病原体灭活的全血组合物输注到受试者体内(例如,施用病原体灭活的全血)的输注管线组件。在一些实施方案中,输注管线组件被构造成联接(例如,通过尖嘴端口)至第二容器或第三容器。在一些实施方案中,套件还包括用于将病原体灭活的全血组合物输注到受试者体内的输注管线组件,其中输注管线组件联接至第二容器。在一些实施方案中,套件还包括用于将病原体灭活的全血组合物输注到受试者体内的输注管线组件,其中输注管线组件联接至第三容器。在一些实施方案中,套件还包括用于将病原体灭活的全血组合物输注到受试者体内的输注管线组件,其中输注管线组件包括第二血管接入装置(例如,针头、输注针头)和在第二容器或第三容器(例如,第一容器、第二容器或第三容器的出口)与第二血管接入装置之间延伸的输注管线导管(例如,其中输注管线导管提供用于将病原体灭活的全血组合物从容器(例如,第二容器、第三容器)无菌转移至血管接入装置的流体连通路径)。在一些实施方案中,套件还包括用于将病原体灭活的全血组合物输注到受试者体内的输注管线组件,其中输注管线组件包括第二血管接入装置和在第二容器的第一出口(例如,尖嘴端口)与第二血管接入装置之间延伸的输注管线导管(例如,其中输注管线导管提供用于将病原体灭活的全血组合物从第二容器无菌转移至血管接入装置的流体连通路径)。在一些实施方案中,输注管线组件包括过滤器。在一些实施方案中,第一容器(例如,容器片材)包含聚氯乙烯(例如,增塑聚氯乙烯)。在一些实施方案中,第一容器包含聚乙烯(例如,乙烯-乙酸乙烯酯、乙烯-乙酸乙烯酯共聚物)。在一些实施方案中,第一容器包含聚烯烃(例如,聚烯烃共混物)。在一些实施方案中,第二容器(例如,容器片材)包含聚氯乙烯(例如,增塑聚氯乙烯)。在一些实施方案中,第二容器包含聚乙烯(例如,乙烯-乙酸乙烯酯、乙烯-乙酸乙烯酯共聚物)。在一些实施方案中,第二容器包含聚烯烃(例如,聚烯烃共混物)。在一些实施方案中,第一容器和/或第二容器不包含邻苯二甲酸二乙基己酯。应了解,本文所述的各种实施方案的一种、一些或所有特性可组合以形成其他实施方案。这些和其他方面对于本领域技术人员将变得显而易见。这些和其他实施方案通过随后的具体实施方式进一步描述。附图说明图1a示出根据一些实施方案用于制备病原体灭活的全血组合物的示例性套件。虚线部分示出具有全血(例如,全血组合物)的源容器,其用于连接至套件。还示出任选的输注管线组件(“输注”)。缩写:pic,病原体灭活化合物;wb,全血。未按比例绘图。图1b示出根据一些实施方案用于制备病原体灭活的全血组合物的示例性套件。虚线部分示出具有全血(例如,全血组合物)的源容器,其用于连接至套件。还示出任选的输注管线组件(“输注”)。缩写:pic,病原体灭活化合物;wb,全血。未按比例绘图。图1c示出根据一些实施方案用于制备病原体灭活的全血组合物的示例性套件。虚线部分示出具有全血(例如,全血组合物)的源容器,其用于连接至套件。还示出任选的输注管线组件(“输注”)。缩写:pic,病原体灭活化合物;wb,全血。未按比例绘图。图2a示出根据一些实施方案用于制备病原体灭活的全血组合物的示例性套件。虚线部分示出具有全血(例如,全血组合物)的源容器,其用于连接至套件。还示出任选的输注管线组件(“输注”)。缩写:pic,病原体灭活化合物;wb,全血。未按比例绘图。图2b示出根据一些实施方案用于制备病原体灭活的全血组合物的示例性套件。虚线部分示出具有全血(例如,全血组合物)的源容器,其用于连接至套件。还示出任选的输注管线组件(“输注”)。缩写:pic,病原体灭活化合物;wb,全血。未按比例绘图。图2c示出根据一些实施方案用于制备病原体灭活的全血组合物的示例性套件。虚线部分示出具有全血(例如,全血组合物)的源容器,其用于连接至套件。还示出任选的输注管线组件(“输注”)。缩写:pic,病原体灭活化合物;wb,全血。未按比例绘图。图2d示出根据一些实施方案用于制备病原体灭活的全血组合物的示例性套件。虚线部分示出具有全血(例如,全血组合物)的源容器,其用于连接至套件。缩写:pic,病原体灭活化合物;wb,全血。未按比例绘图。图2e示出根据一些实施方案用于制备病原体灭活的全血组合物的示例性套件。缩写:pic,病原体灭活化合物。未按比例绘图。图2f示出根据一些实施方案用于制备病原体灭活的全血组合物的示例性套件。缩写:pic,病原体灭活化合物;wb,全血。未按比例绘图。图2g示出根据一些实施方案用于制备病原体灭活的全血组合物的示例性套件。缩写:pic,病原体灭活化合物。未按比例绘图。图3a示出根据一些实施方案用于制备病原体灭活的全血组合物的示例性套件。虚线部分示出具有全血(例如,全血组合物)的源容器,其用于连接至套件。还示出任选的输注管线组件(“输注”)。缩写:pic,病原体灭活化合物;wb,全血。未按比例绘图。图3b示出根据一些实施方案用于制备病原体灭活的全血组合物的示例性套件。虚线部分示出具有全血(例如,全血组合物)的源容器,其用于连接至套件。还示出任选的输注管线组件(“输注”)。缩写:pic,病原体灭活化合物;wb,全血。未按比例绘图。图3c示出根据一些实施方案用于制备病原体灭活的全血组合物的示例性套件。虚线部分示出具有全血(例如,全血组合物)的源容器,其用于连接至套件。还示出任选的输注管线组件(“输注”)。缩写:pic,病原体灭活化合物;wb,全血。未按比例绘图。图4a示出根据一些实施方案用于制备病原体灭活的全血组合物的示例性套件。虚线部分示出具有全血(例如,全血组合物)的源容器,其用于连接至套件。还示出任选的输注管线组件(“输注”)。缩写:pic,病原体灭活化合物;wb,全血。未按比例绘图。图4b示出根据一些实施方案用于制备病原体灭活的全血组合物的示例性套件。虚线部分示出具有全血(例如,全血组合物)的源容器,其用于连接至套件。还示出任选的输注管线组件(“输注”)。缩写:pic,病原体灭活化合物;wb,全血。未按比例绘图。图4c示出根据一些实施方案用于制备病原体灭活的全血组合物的示例性套件。虚线部分示出具有全血(例如,全血组合物)的源容器,其用于连接至套件。还示出任选的输注管线组件(“输注”)。缩写:pic,病原体灭活化合物;wb,全血。未按比例绘图。图4d示出根据一些实施方案用于制备病原体灭活的全血组合物的示例性套件。虚线部分示出具有全血(例如,全血组合物)的源容器,其用于连接至套件。缩写:pic,病原体灭活化合物;wb,全血。未按比例绘图。图5a示出根据一些实施方案用于制备病原体灭活的全血组合物的示例性套件。还示出任选的输注管线组件(“输注”)。缩写:pic,病原体灭活化合物。未按比例绘图。图5b示出根据一些实施方案用于制备病原体灭活的全血组合物的示例性套件。还示出任选的输注管线组件(“输注”)。缩写:pic,病原体灭活化合物。未按比例绘图。图5c示出根据一些实施方案用于制备病原体灭活的全血组合物的示例性套件。还示出任选的输注管线组件(“输注”)。缩写:pic,病原体灭活化合物。未按比例绘图。图5d示出根据一些实施方案用于制备病原体灭活的全血组合物的示例性套件。缩写:pic,病原体灭活化合物。未按比例绘图。图5e示出根据一些实施方案用于制备病原体灭活的全血组合物的示例性套件。缩写:pic,病原体灭活化合物。未按比例绘图。图5f示出根据一些实施方案用于制备病原体灭活的全血组合物的示例性套件。缩写:pic,病原体灭活化合物。未按比例绘图。图5g示出根据一些实施方案用于制备病原体灭活的全血组合物的示例性套件。缩写:pic,病原体灭活化合物。未按比例绘图。具体实施方式在一些方面,本公开提供用于制备病原体灭活的全血和其他血液制品组合物,包括适用于输注的病原体灭活的全血和其他血液制品组合物的改进的方法和套件。已发现本文公开的套件和使用此类套件的相关方法提供改进的病原体灭活工艺,包括例如,产生在组合物中具有降低的病原体灭活化合物残余水平的病原体灭活的全血和其他血液制品组合物的工艺,这对于全血组合物的后续输注可以是特别有益的。改进的套件和相关方法还为在可能不易获得合适的设施和/或电源的条件下(诸如在战区)制备病原体灭活的全血组合物提供了新的机会。术语“病原体灭活”和“病原体灭活过程”是指可用于灭活可能存在于全血组合物(诸如全血捐献物)中的病原体的过程,其中应理解,该过程不必须完全灭活可能存在的所有病原体,但大大减少了病原体的量,从而显著降低输血相关疾病(例如,输血传播感染,tti)的风险。病原体的灭活可通过在病原体灭活过程之前和之后测量一定体积中的感染性病原体(例如,病毒颗粒、细菌)的数量来测定,并且灭活的水平通常以病原体感染性的对数减少,或滴度的对数减少来表示。测定滴度的对数减少的方法以及其针对病原体灭活的量度是本领域已知的。当针对多种病原体测试灭活过程时,特定活性病原体的减少为滴度的至少约1个对数减少、至少约2个对数减少、至少约3个对数减少、至少约4个对数减少,或至少约5个对数减少。多种病原体灭活工艺在本领域中是已知的并且用于展示使用各种可商购获得的病原体灭活工艺,诸如血液系统(ceruscorp)实现的病原体活化水平的方法在本领域中是已知的。在某些实施方案中,病原体灭活过程可包括用病原体灭活化合物进行处理。术语“适用于输注”是指根据医学判断能够用于输注(例如,输血)到受试者(例如,人患者)体内的全血组合物(例如,病原体灭活的全血组合物)或其他血液制品(例如,由全血组合物制备的血液制品)。其他血液制品的非限制性实例包括红细胞组合物、血浆组合物、血小板组合物、冷沉淀组合物以及冷沉淀减少的(cryo-reduced)血浆组合物。在一些实施方案中,适用性是指对于其预期用途,即对于其中指示全血或其他血液制品的输注(包括但不限于预防性和治疗性输注)的用途具有足够的生物学活性。在一些实施方案中,适用性是指具有足够的安全性,诸如满足关于施用经过处理的全血或血液制品组合物的安全性的适用法规和/或认证要求。在一些实施方案中,适用性是指病原体灭活化合物和/或其一种或多种副产物的浓度(例如,残余浓度)低于某一标准(例如,低于最大可接受浓度)的病原体灭活的全血组合物或其他血液制品。在一些实施方案中,适用性是指满足由管理输注实践的认证机构或监管机构(诸如aabb)制定的一个或多个标准(例如,具有合适的特征、具有一定水平的生物学活性或功能、具有至少最小剂量)。病原体灭活化合物术语“病原体灭活化合物(pathogeninactivationcompound或pathogeninactivatingcompound)”是指可以用于灭活可能存在于全血组合物中的病原体的任何合适的化合物。通过使全血组合物中的病原体与病原体灭活化合物(pic)接触来实现全血组合物中的病原体的灭活。在本文所述的任何实施方案中,pic(例如,本文所述的阿马他林、s-303)可以有效量(例如,灭活病原体的有效量,诸如足以灭活例如全血组合物中至少约1log、至少约2log、至少约3log、至少约4log、至少约5log或至少约6log或更多病原体(如果存在的话)的量)存在。可由本公开的方法使用的病原体灭活化合物包括,例如,包含作为或能够形成并且已经形成(例如,原位)反应性基团诸如亲电子基团的官能团的化合物。在一些实施方案中,本公开的pic无需光活化而成为反应性的。例如,官能团可以是芥子基团、芥子基团中间体、芥子基团等同物、环氧化物、甲醛或甲醛合成子。此类官能团能够在原位形成反应性基团,诸如亲电子吖丙啶、吖丙啶鎓、环硫乙烷或环硫乙烷鎓(thiiranium)离子。芥子基团可以是单-或双-(卤代乙基)胺基团或单(卤代乙基)硫化物基团。芥子等同物是通过与芥子类似的机制,例如通过形成反应性中间体,诸如吖丙啶鎓和吖丙啶基团或硫杂环丙烷和硫杂环丙烷鎓基团而反应的基团。实例包括吖丙啶衍生物、单或双-(甲磺酰基乙基)胺基团、单(甲磺酰基乙基)硫化物基团、单或双-(甲苯磺酰基乙基)胺基团和单-(甲苯磺酰基乙基)硫化物基团。甲醛合成子是分解成甲醛的任何化合物,包括羟基胺,诸如羟甲基甘氨酸。pic的反应性基团能够与病原体的核酸,例如与核酸上的亲核基团反应。反应性基团还能够与淬灭剂的亲核基团反应。pic还可包括使化合物靶向核酸的组分,诸如锚定部分。锚定部分包含能够与核酸生物聚合物,诸如dna或rna非共价结合的部分,并且也称为核酸结合配体、核酸结合基团或核酸结合部分。此类化合物的实例描述于美国专利5,691,132、6,410,219、6,136,586、6,617,157和6,709,810中,其中的每一个通过引用并入本文。可在本公开的方法中使用的另一类pic包含通过可水解接头与核酸结合基团连接的上述反应性基团,诸如美国专利6,514,987中所述,其通过引用并入本文。pic的锚定部分对核酸具有亲和力。这种亲和力可由非共价结合核酸的几种模式中的任一种造成,包括但不限于嵌入、小沟结合、大沟结合和静电结合(例如,磷酸骨架结合)。亲和力也可由混合结合模式(例如,嵌入和小沟结合)造成。结合可以是序列特异性的(即,对一种或多种特定核酸序列的结合亲和力高于其他核酸序列)或非序列特异性的。此类核酸结合部分的详细实例可以在上述专利中找到。在本文所述的各方法、套件和组合物的一些实施方案中,pic可包含作为或形成与所选淬灭剂的亲核物质反应的反应性亲电子基团的官能团。在一些实施方案中,灭活病原体的基团包含核酸结合配体和作为或形成亲电子基团的官能团。用于本公开的合适的pic的具体实例是β-丙氨酸,n-(吖啶-9-基),2-[双(2-氯乙基氨基]乙基酯(可替代地,在本文也称为“s-303”或“”阿马他林),其结构如下,包括其盐。淬灭剂在本公开的方法中使用的淬灭剂旨在减少用于灭活病原体的反应性亲电子物类的不想要的副反应(例如,病原体灭活化合物与全血组合物中的rbc表面的结合,这可能导致不期望的免疫反应)。在本文所述的任何实施方案中,淬灭剂(例如,谷胱甘肽)可以有效量(例如,减少不想要的副反应的有效量,诸如本文所述的量)存在。合适的淬灭剂可包含能够与pic的亲电子基团反应的亲核基团。非限制性实例详细描述于美国专利6,709,810,其通过引用整体并入本文。在一些实施方案中,淬灭剂能够显著减少全血组合物中不想要的副反应,同时使得pic充分灭活可能污染全血组合物的病原体。在一些实施方案中,本公开的方法在提供不想要的副反应(例如,pic的结合)的最佳减少与病原体的充分灭活的组合,而不显著改变全血组合物或全血的血液组分的特性(例如,不降低红细胞渗透脆性、不显著增加红细胞脱水、不显著降低止血所需的凝血因子水平、不显著降低一种或多种血小板功能)的条件下,提供了有效量的淬灭剂与有效量的pic的组合。可减少多种不想要的副反应,诸如pic与全血组合物中的蛋白质和/或红细胞的反应。在一些实施方案中,淬灭剂提供了全血组合物或其中的血液组分的修饰(诸如igg与红细胞的结合或pic与红细胞的结合)的最佳减少。虽然本公开的方法包括离体处理(例如,病原体灭活)全血组合物,但是在引入个体时一些淬灭剂可能仍然保留在组合物中。因此,在一些实施方案中,本公开的淬灭剂适用于输注。合适的淬灭剂包括但不限于包含巯基的化合物,诸如包含氨基酸半胱氨酸或合适的半胱氨酸衍生物诸如n-乙酰半胱氨酸的淬灭剂。此类淬灭剂的实例包括半胱氨酸和包含至少一个半胱氨酸的肽,诸如谷胱甘肽。在一些实施方案中,合适的淬灭剂包含可以在使用或不使用另外化学物质或添加的酶的情况下在原位形成巯基的半胱氨酸衍生物,诸如s-乙酰半胱氨酸或其他合适的巯基衍生的半胱氨酸前药,或包含s-乙酰半胱氨酸或其他合适的巯基衍生的半胱氨酸前药的肽。合适的半胱氨酸衍生物是包含或能够在原位形成能够与pic的亲电子基团反应的半胱氨酰巯基的那些。在一些实施方案中,淬灭剂是2至10个氨基酸的肽,其中至少一个氨基酸是半胱氨酸、n-乙酰半胱氨酸、s-乙酰半胱氨酸或其他合适的半胱氨酸衍生物。在一些实施方案中,淬灭剂是至少3个氨基酸的肽,诸如约3-10个氨基酸,以及约3-6个氨基酸,其中至少一个氨基酸是半胱氨酸、n-乙酰半胱氨酸、s-乙酰半胱氨酸或其他合适的半胱氨酸衍生物。在一些实施方案中,淬灭剂是至少3个氨基酸的肽,诸如约3-10个氨基酸,以及约3-6个氨基酸,其中至少一个氨基酸是半胱氨酸、n-乙酰半胱氨酸、s-乙酰半胱氨酸或其他合适的半胱氨酸衍生物,另外,其中至少2个或至少3个氨基酸是半胱氨酸、n-乙酰半胱氨酸、s-乙酰半胱氨酸或其他合适的半胱氨酸衍生物。在一个优选实施方案中,淬灭剂是中和的谷胱甘肽(也称为l-谷胱甘肽和γ-l-谷氨酰-l-半胱氨酰-甘氨酸)。谷胱甘肽具有许多能够使其特别可用作淬灭剂的特性。它通常存在于所有细胞类型中。据信它不能诸如通过穿过细菌和脂质包膜病毒的细胞膜或脂质外壳,或通过穿过无包膜病毒的病毒衣壳而被动渗透到病原体中。在接近中性ph时,加载谷胱甘肽并且在不存在主动转运的情况下,它无法渗透脂质双层至任何显著的程度。这与脂质包膜病毒诸如hiv和vsv的灭活基本上不受谷胱甘肽的影响,包括使用大于2mm的中和的谷胱甘肽浓度的结果相一致。谷胱甘肽的使用对例如小肠结肠炎耶尔森菌(yersiniaenterocolitica)、表皮葡萄球菌(staphylococcusepidermidis)和粘质沙雷氏菌(serratiamarcescens)的灭活的确具有一定作用。然而,这可以通过使用有效量的中和的谷胱甘肽和pic来管理。因此,提供了优选的淬灭方法,其中病毒或细菌病原体对全血组合物的污染被灭活至少约2log、至少约3log、至少约4log、至少约5log或至少6log或更多。在如本公开所描述的适当条件下,谷胱甘肽还与全血的体外储存相容并且所得的病原体灭活的全血组合物适用于引入体内。在一些实施方案中,淬灭剂是处于其还原形式的谷胱甘肽。也可使用谷胱甘肽二硫化物、谷胱甘肽的氧化形式,只要谷胱甘肽二硫化物在溶液添加到包含全血组合物的混合物中之前在溶液中被充分还原或在添加到包含全血组合物的混合物中之后被充分还原即可。在一些实施方案中,淬灭剂是谷胱甘肽的衍生物,诸如谷胱甘肽单烷基酯或二烷基酯,其中烷基是具有1至10个碳原子的直链或支链基团。烷基的具体实例包括但不限于甲基、乙基、丙基、异丙基、丁基、异丁基、叔丁基、戊基、异戊基、新戊基、叔戊基、1-甲基丁基、己基、异己基、2-甲基戊基、1-乙基丁基、庚基、辛基、壬基和癸基。例如,谷胱甘肽衍生物的非限制性实例包括谷胱甘肽甲基酯、谷胱甘肽单乙基酯和谷胱甘肽单异丙基酯。在一些实施方案中,使用谷胱甘肽氧化的二乙基酯(gssg-(甘氨酰)-二乙基-酯)。在一些实施方案中,在添加到全血组合物中之后水解谷胱甘肽的硫酯以形成巯基。应当理解,在一些实施方案中,淬灭剂将以游离酸或碱的形式提供,而在其他实施方案中,淬灭剂将以盐的形式提供。如果淬灭剂处于盐的形式,那么所述盐优选为药学上可接受的盐。化合物的药学上可接受的盐(处于水或油溶性或可分散的产物的形式)包括例如由无机或有机酸或碱形成的常规的无毒性盐或季铵盐。此类酸加成盐的实例包括乙酸盐、己二酸盐、藻酸盐、天冬氨酸盐、苯甲酸盐、苯磺酸盐、硫酸氢盐、丁酸盐、柠檬酸盐、樟脑酸盐、樟脑磺酸盐、环戊烷丙酸盐、二葡糖酸盐、十二烷基硫酸盐、乙磺酸盐、富马酸盐、葡糖庚酸盐、甘油磷酸盐、半硫酸盐、庚酸盐、己酸盐、盐酸盐、氢溴酸盐、氢碘酸盐、2-羟基乙磺酸盐、乳酸盐、马来酸盐、甲磺酸盐、2-萘磺酸盐、烟酸盐、草酸盐、双羟萘酸盐、果胶酸盐、过硫酸盐、3-苯基丙酸盐、磷酸盐、苦味酸盐、特戊酸盐、丙酸盐、琥珀酸盐、酒石酸盐、硫氰酸盐、甲苯磺酸盐和十一酸盐。碱式盐包括铵盐、碱金属盐诸如钠和钾盐、碱土金属盐诸如钙和镁盐、与有机碱形成的盐诸如二环己基胺盐、n-甲基-d-葡糖胺,以及与氨基酸诸如精氨酸、赖氨酸等形成的盐。此外,含碱性氮的基团可被诸如以下的试剂季铵化:低级烷基卤化物,诸如甲基、乙基、丙基和丁基氯化物、溴化物和碘化物;二烷基硫酸盐,如二甲基、二乙基、二丁基和二戊基硫酸盐;长链卤化物,诸如癸基、月桂基、肉豆蔻基和硬脂酰基氯化物、溴化物和碘化物;芳烷基卤化物,如苄基和苯乙基溴化物等。其他药学上可接受的盐包括硫酸盐乙醇酸盐和硫酸盐。例如,在一些实施方案中,淬灭剂为由谷胱甘肽形成的药学上可接受的盐的形式。在一些实施方案中,淬灭剂为由谷胱甘肽和一种或多种阳离子,诸如钠、铝、钙、锂、镁、锌或四甲基铵形成的药学上可接受的盐的形式。在一些实施方案中,淬灭剂是谷胱甘肽(还原的)并且以谷胱甘肽单钠盐的形式提供(例如,可购自biomedicafoscama,italy)。在一些其他实施方案中,谷胱甘肽(还原的)以谷胱甘肽盐酸盐的形式提供。在一些其他实施方案中,谷胱甘肽以谷胱甘肽(还原的)二钠盐的形式提供。在另外的实施方案中,使用谷胱甘肽单烷基酯硫酸盐。在一些实施方案中,谷胱甘肽以谷胱甘肽氧化的二钠盐的形式提供。碱在一些实施方案中,本公开的方法还包括提供合适的碱,诸如通过将碱与全血组合物、pic和淬灭剂混合(例如,合并)(例如,步骤(a))。在一些实施方案中,相对于不含碱的混合物,碱的量足以降低混合物中pic与红细胞的不想要的反应的水平。在一些实施方案中,pic与红细胞(rbc)的不想要的反应是pic对红细胞表面的修饰(参见,例如,美国专利8,900,805)。在一些实施方案中,步骤(a)还包括将合适的碱与全血组合物、pic和淬灭剂混合,并且相对于不含碱的混合物,碱的量足以将所得混合物中抗病原体灭活化合物抗体与经过处理的全血组合物中的rbc的结合水平降低至少约5%(或至少约10%、至少约25%、至少约50%、至少约75%或至少约90%)。在一些实施方案中,在将pic与全血组合物混合之前、同时或之后不超过约30分钟,将碱和淬灭剂与全血组合物混合。在一些实施方案中,在将碱或淬灭剂与全血组合物混合之前,将碱和淬灭剂混合在一起。在一些实施方案中,碱是naoh。在一些实施方案中,碱是碱性缓冲液。在一些实施方案中,碱包含约0.5至1.5当量的碱,其中当量是指与混合物中淬灭剂的摩尔量相等的摩尔量。在一些实施方案中,碱包含约0.75至1.25当量的碱。在一些实施方案中,碱包含约1当量的碱。在一些实施方案中,步骤(a)的所得混合物在37℃下的ph为约6.0至7.5。在一些实施方案中,ph为约6.5至7.1。在一些实施方案中,ph为约6.8或6.9。在一些实施方案中,在将pic和淬灭剂与全血组合物混合(例如,合并)时,混合物的ph处于合适的水平,以减少pic的不想要的副反应(例如,pic与rbc表面的结合,这可能导致不期望的免疫反应),并在全血的病原体灭活期间充分减少rbc的细胞脱水。在一些实施方案中,不想要的副反应是pic对rbc表面的修饰。在一些实施方案中,修饰是pic与rbc表面的共价结合。在其他实施方案中,修饰是pic与rbc表面的非共价结合。如本文所述,在每种方法的一些实施方案中,pic与全血中的rbc的不期望的(在本文中也称为“不想要的”)副反应减少。在一些实施方案中,被减少的不期望的副反应是pic对rbc表面的修饰。在一些实施方案中,副反应的水平降低至少约5%、至少约10%、至少约25%、至少约50%、至少约75%或至少约90%。副反应的减少可例如通过测量对pic具有特异性的抗体与经过处理的rbc的结合量和/或测量全血的经过处理的rbc在体内的寿命并将这些测量结果与通过第二种不同方法(例如,不向反应混合物中添加足够的淬灭剂和/或碱的方法,不向反应混合物中添加淬灭剂和/或碱的方法,和/或在较低ph下进行的处理)处理的rbc进行比较来证明。在一些实施方案中,在将pic和淬灭剂与全血组合物混合(例如,合并)时,混合物的ph在约6.0至8.5、约6.0至7.5、约6.5至7.1、约6.5至7.0、约6.6至6.8,或约6.6、6.7、6.8或6.9的范围内。虽然全血组合物中的ph可随时间变化,但是在向全血组合物中添加淬灭剂时,无论其是否已经含有pic,希望ph在期望范围内。在一些实施方案中,本公开的方法包括将pic和猝灭剂添加到全血组合物中。无论将pic和/或淬灭剂添加到全血组合物中的顺序如何,在添加pic和淬灭剂两者时,期望的ph范围都是必需的。换句话说,一旦已经将所有三种组分混合,ph就在期望范围内。在一些实施方案中,淬灭剂在pic之前添加。在一些实施方案中,pic在淬灭剂之前添加。在一些实施方案中,淬灭剂和pic基本上同时添加。因此,在添加pic和淬灭剂时是指淬灭剂和pic两者已与全血组合物混合的时间点。期望ph可以通过几种方式实现并且不限于调节全血组合物的ph时,或在一些实施方案中,不从血液制品的天然ph显著调节。例如,可以通过调节ph实现全血组合物的期望ph。例如,可在添加pic和淬灭剂之前,通过添加合适的溶液,诸如缓冲溶液进行ph调节。可替代地,可以在添加pic、淬灭剂或两者的同时调节红细胞组合物的ph。在一些实施方案中,在添加淬灭剂的同时调节ph。在一些实施方案中,淬灭剂是中和的,使得中和的淬灭剂的添加在全血组合物中提供期望ph范围。例如,可以将谷胱甘肽的中和用于实现必要的ph调节。在一些实施方案中,可以使用谷胱甘肽的适当水平的中和,例如通过添加1当量的碱,以便提供淬灭剂,所述淬灭剂在添加到全血组合物中时将提供组合物的必要ph调节。适当的中和将取决于所使用的淬灭剂。例如,当使用肽时,可取决于肽的氨基酸组分。在一些实施方案中,可以使用不显著影响红细胞组合物的ph的淬灭剂。例如,包含半胱氨酸的肽的使用导致天然分离的肽的溶液的ph更趋于中性,所述肽还可包含一种或多种氨基酸。在一些实施方案中,所述肽还包含至少一种碱性氨基酸,诸如精氨酸或赖氨酸。在本文所述方法的一些实施方案中,其中将碱与全血组合物连同pic和淬灭剂一起混合,以将混合物的ph增加至期望水平和/或改善不期望的副反应的淬灭,所述碱为碱式盐。可将碱式盐先溶解于水溶液中,然后再与全血组合物混合(例如,合并)。在其他实施方案中,可将盐以固体形式直接添加到全血组合物中。在一些实施方案中,碱式盐包含淬灭剂并且为混合物提供淬灭剂和碱。在一些实施方案中,所述方法中使用的碱是强碱,诸如naoh。通常,将把强碱如naoh先溶解于水溶液中,然后与全血组合物混合。在一些实施方案中,将强碱(例如,溶液或固体形式)与淬灭剂混合,然后将淬灭剂与全血组合物混合。在一些实施方案中,碱是碱性缓冲液(以足量添加并且具有适当的pka以使混合物达到期望的ph范围)。如果使用碱性缓冲液,那么在一些实施方案中,缓冲液将是药学上可接受的缓冲液。在一些实施方案中,缓冲液将具有可滴定的质子,其pka在约7至8的范围内。可以用作碱性缓冲液的缓冲液的实例包括但不限于n-(2-羟乙基)-哌嗪-n'-2-乙磺酸(hepes)、磷酸盐缓冲盐水(pbs)和磷酸钠缓冲液。其他合适的碱性缓冲液将易于由本领域普通技术人员鉴定。在本文所述的各方法和组合物的一些实施方案中,全血、淬灭剂、pic和任何添加的碱的混合物的ph大于约5.5、大于约5.7、大于约6.0、大于约6.3、大于约6.5、大于约6.7、大于约7.0或大于约7.2。在本文所述的各方法和组合物的一些实施方案中,全血、淬灭剂、pic和碱(如果添加的话)的混合物的ph在约6.0至8.5、约6.0至7.5、约6.5至7.1、约6.5至7.0,或约6.6至6.8,或约6.6、6.7、6.8或6.9的范围内。在一些实施方案中,所指示的ph是室温下的ph。在一些实施方案中,所指示的ph是37℃下的ph。例如,在一些实施方案中,在淬灭剂和任何添加的碱的存在下用pic处理包含全血的组合物,其中混合物的ph在37℃下在约6.5至约7.0(或7.1)的范围内。在一些实施方案中,全血、淬灭剂和碱(如果作为方法的一部分添加碱的话)的混合物的ph在约6.0至8.5、约6.0至7.5、约6.5至7.1、约6.5至7.0,或约6.6至6.8,或约6.5、6.7、6.8或6.9的范围内,之后将pic与全血组合物混合(例如,合并)。在一些其他实施方案中,所述ph在pic与包含全血的组合物混合的同时或约1小时内、约30分钟内、约20分钟内、约10分钟内、约5分钟内或约2分钟内实现。在其中调节ph的那些方法的一些实施方案中,在pic与包含全血的组合物混合之前、同时、约1小时内、约30分钟内、约20分钟内、约10分钟内、约5分钟内或约2分钟内将ph调节至期望的ph范围。在淬灭剂是谷胱甘肽并且pic是阿马他林(例如,s-303)的那些实施方案中,优选地在s-303与全血组合物混合之前,将包含全血组合物和淬灭剂的混合物的ph调节至期望的ph范围(例如,ph6.5至7.0)。在一些实施方案中,将全血、淬灭剂和碱混合(例如,合并)之后组合物的所得ph并不一定是对起始全血组合物的ph进行了调节。例如,全血组合物可具有在6.0-7.5的期望范围内的ph,并且组合物的ph在添加淬灭剂和随后添加pic时不显著改变。在此类实施方案中,淬灭剂自然提供期望ph,或被中和而因此提供期望ph。添加高初始量的淬灭剂,诸如约5mm至约40mm与所得ph在期望范围内的组合是重要的。因此,对于肽,不考虑肽淬灭剂,可以根据需要将其有效中和以在添加到全血组合物中时提供合适的ph范围,并且可进一步选择以便在期望ph范围内提供适当量的缓冲。因此,中和的淬灭剂是指根据需要用酸或碱适当滴定淬灭剂,使得在添加到全血组合物中时,所得混合物具有提供不想要的副反应(例如,pic与rbc表面的结合,这可导致不期望的免疫反应)的更好淬灭,同时避免灭活期间rbc的细胞脱水的ph,诸如在约6.0至8.5、约6.0至7.5、约6.5至7.0、约6.5至7.1,或约6.6至6.8,或约6.6、6.7、6.8或6.9范围内的ph。在一些实施方案中,肽在天然分离时是适当中和的,即不需要添加酸或碱以在最终混合物中提供期望ph。此外,优选的淬灭剂将提供将ph维持在期望范围内持续淬灭不想要的副反应所必需的时间的缓冲能力。在本文所述的各方法和组合物的一些实施方案中,淬灭剂是中和的。如果已将足量的碱与淬灭剂合并,使得在包括包含全血的组合物、pic和淬灭剂的混合物中pic与全血的rbc之间不想要的副反应的淬灭得到改善,那么认为淬灭剂被碱“中和”。“中和的淬灭剂”不一定具有中性ph,也不一定是不带电荷的。在一些实施方案中,中和的淬灭剂既不处于其最质子化形式,也不处于其最去质子化形式。在一些实施方案中,在淬灭剂酸性极强时,中和的淬灭剂的ph仍可低于7.0(例如,约6.6、6.7、6.8或6.9)。在一些实施方案中,中和的淬灭剂的溶液的ph可大于7.0。在一些实施方案中,中和的猝灭剂的溶液的ph将可检测地高于添加碱之前的猝灭剂。在一些实施方案中,使用至少约0.25当量、至少约0.5当量、至少约0.75当量、至少约1当量、至少约1.25当量、至少约1.5当量或至少约2当量的碱中和淬灭剂。在一些实施方案中,使用少于约2当量、少于约1.5当量、少于约1.25当量、少于约1当量或少于约0.75当量的碱中和淬灭剂。在一些实施方案中,使用约0.25至约2当量、约0.5至约1.5当量,或约0.75至约1.25当量的碱中和淬灭剂。在一些实施方案中,使用约0.75当量的碱中和淬灭剂。在其他实施方案中,使用约1当量的碱中和淬灭剂。在其他实施方案中,使用约1.25当量的碱中和淬灭剂。例如,在本公开的一些实施方案中,使用约1当量的合适的碱诸如氢氧化钠中和谷胱甘肽。在这种情况下,质子化谷胱甘肽溶液具有大约3的ph,使用1当量的氢氧化钠中和的溶液具有大约4.5的ph,并且使用2当量的氢氧化钠中和的溶液具有大约9.5的ph。可以适当调节包含至少一个半胱氨酸的任何适当的肽淬灭剂,以在添加到红细胞组合物中时提供期望ph。用于中和谷胱甘肽和其他淬灭剂的适当方法对于本领域普通技术人员将是显而易见的。在一些实施方案中,使用氢氧化钠中和或部分中和淬灭剂。在一些实施方案中,首先将naoh固体粒料溶解于水以产生碱的浓溶液,诸如1n、5n、10n或20nnaoh溶液。在一些实施方案中,在将淬灭剂添加到混合物中之前、同时或之后接着将适量的所述naoh溶液添加到淬灭剂中。可替代地,在将淬灭剂添加到混合物中之前,将naoh添加到全血组合物或pic或两者的组合中。除了提供经过适当ph调节或中和的淬灭剂之外,在一些实施方案中,一旦pic已经渗透到病原体内部,优选的淬灭剂不能大量进入病原体,使得它们最佳地淬灭细胞外环境中的不想要的反应,但不干扰病原体灭活。在本文所述的各方法的一些实施方案中,淬灭剂是酸性化合物。在一些实施方案中,淬灭剂以游离酸的形式提供。在一些实施方案中,淬灭剂是酸性的并且添加至少约1当量的碱以中和淬灭剂。在一些情况下,包含这种中和的淬灭剂的溶液可以是碱性的、中性的或甚至酸性的。在一些实施方案中,添加约1当量的碱以中和或部分中和淬灭剂。在一些实施方案中,添加约2当量的碱。在一些实施方案中,淬灭剂是酸性的并且使用约0.5至约1.5当量的碱来中和淬灭剂。在一些实施方案中,使用约0.75至约1.25当量的碱。在一些实施方案中,使用约1当量的碱。在一些实施方案中,在添加到全血组合物和/或pic中之前中和淬灭剂。在其他实施方案中,在将淬灭剂与全血组合物和/或pic合并之后中和淬灭剂。在一些实施方案中,在添加到全血组合物和/或pic中之前中和的淬灭剂的ph在约2.5至7.5、约3.0至6.5、约3.5至5.5、约4.0至5.0,或约4.3至4.5,或约4.4的范围内。在一些实施方案中,猝灭剂是谷胱甘肽,并且以谷胱甘肽单钠盐的形式提供,并用约1当量的碱中和,或不用碱中和。在一些其他实施方案中,淬灭剂是谷胱甘肽,并且以谷胱甘肽盐酸盐的形式提供,并用约1当量的碱中和。在本文所述的各方法的一些实施方案中,包含全血组合物、淬灭剂、pic和任何添加的碱的混合物中的初始淬灭剂浓度在灭活期期间升高,并且接着在灭活期之后减少至降低浓度。在一些实施方案中,初始淬灭剂浓度足以充分减少pic的不想要的副反应(例如,病原体灭活化合物与rbc表面的结合),接着减少至降低浓度,以充分减少在经过处理的全血组合物的储存期间对rbc的活力(例如,渗透脆性和脱水)和/或寿命的不利影响。病原体灭活的全血组合物和方法本公开的某些方面提供病原体灭活的全血组合物以及与其相关的方法(例如,制备方法)和套件。本文公开的改进所提供的具体益处尤其是制备(例如,产生)在组合物中具有降低的病原体灭活化合物(pic)残余水平的适用于输注的病原体灭活的全血组合物的机会。经过处理的全血组合物中降低的pic残余水平可提供改善的安全性特征和/或改善的病原体灭活工艺一致性,诸如以实现低于某个阈值的残余pic水平。改进的套件和相关方法还为在可能不易获得合适的设施和/或电源的条件下(诸如在战区)制备病原体灭活的全血组合物提供了机会。全血组合物,诸如用于使用本公开的病原体灭活方法处理的全血组合物,包括但不限于适用于人、哺乳动物和/或脊椎动物,诸如用于输注的任何全血组合物(全血制品)。在一些实施方案中,全血组合物包含来自人供体的全血。在一些实施方案中,此类全血细胞组合物可包括缓冲液、盐、营养物质和其他溶液,诸如抗凝剂。在一些实施方案中,病原体灭活的全血组合物可包括化学物质,诸如病原体灭活化合物和淬灭剂。合适的抗凝剂以及其使用在本领域中是众所周知的,并且可包括例如cpd(柠檬酸-磷酸-葡萄糖)、柠檬酸-磷酸-二葡萄糖(cp2d)或柠檬酸-磷酸-葡萄糖腺嘌呤(cpda-1)。抗凝剂与全血组合物可在从供体中采集时混合,例如将全血组合物和抗凝剂在血液采集容器(例如,独立于本文提供的套件)中混合,或可替代地,将全血组合物和抗凝剂在本公开的套件中混合。例如,在将全血组合物添加(例如,采集、转移)到第一容器中之前,本文提供的套件的第一容器可包含抗凝剂(例如,抗凝剂溶液)。本公开的全血组合物(例如,用于病原体灭活处理)通常可包含本领域已知的任何全血采集体积。在一些实施方案中,全血组合物中的全血体积为约200ml至约650ml、约250ml至约600ml、约300ml至约600ml、约300ml至约500ml、约400ml至约550ml、约400ml至约500ml,或约450ml至约500ml的全血(例如,约200ml、约250ml、约300ml、约325ml、约350ml、约375ml、约400ml、约425ml、约450ml、约475ml、约500ml、约525ml、约550ml、约575ml、约600ml或约650ml)。在一些实施方案中,全血的体积是上述体积±一定的变化,诸如±10%体积或±50ml。全血组合物在转移到本公开的套件中(例如,从供体采集袋中)之前还可包含抗凝剂溶液,或可替代地,可在本公开的套件中与抗凝剂混合。在一些实施方案中,本公开的套件的第一容器可包含抗凝剂,以用于在将全血组合物添加(例如,转移)到容器中时与全血组合物混合(例如,合并)。用于与全血(例如,全血组合物中的)混合的抗凝剂的合适体积在本领域中是众所周知的,并且在一些实施方案中可包括例如约30ml至约120ml、约50ml至约120ml、约60ml至约120ml、约50ml至约100ml、约50ml至约75ml、约60ml至约100ml、约60ml至约90ml、约60ml至约80ml,或约60ml至约70ml。在一些实施方案中,本公开的抗凝剂包含约30ml、约40ml、约45ml、约50ml、约55ml、约60ml、约65ml、约70ml、约75ml、约80ml、约85ml、约90ml、约95ml、约100ml、约105ml、约110ml或约120ml。抗凝剂的体积可以是本文提供的任何体积,当混合全血时,所述体积导致合适的抗凝剂与全血比(例如,体积比)。例如,在一些实施方案中,抗凝剂与全血(例如,在全血组合物中)的比率为约1:3至约1:10、约1:4至约1:10、约1:5至约1:9、约1:6至约1:8。在一些实施方案中,抗凝剂与全血的比率为约1:3、约1:4、约1:5或约1:6。在一些实施方案中,抗凝剂与全血的比率为约1:8、约1:9或约1:10。在一些实施方案中,抗凝剂与全血的比率为约1:7。在一些实施方案中,用于本公开的病原体灭活方法的全血组合物(例如,包含全血和抗凝剂)具有约200ml至约700ml、约250ml至约700ml、约300ml至约700ml、约200ml至约650ml、约250ml至约650ml、约250ml至约600ml、约300ml至约650ml、约300ml至约600ml、约300ml至约550ml、约300ml至约500ml、约400ml至约650ml、约400ml至约600ml、约400ml至约550ml、约450ml至约650ml、约450ml至约600ml、约450ml至约550ml、约450ml至约500ml、约450ml至约500ml、约500ml至约650ml、约500ml至约600ml,或约500ml至约550ml的全血体积(例如,约200ml、约250ml、约300ml、约325ml、约350ml、约375ml、约400ml、约425ml、约450ml、约475ml、约500ml、约525ml、约550ml、约575ml、约600ml、约625ml、约650ml、约675ml或约700ml。在一些实施方案中,全血组合物包含约400ml至500ml的全血和约50ml至约100ml的抗凝剂。在一些实施方案中,全血组合物包含约450ml至约500ml的全血和约60ml至约70ml的抗凝剂。全血组合物(例如,具有抗凝剂的全血)可从血液采集容器转移到本公开的套件中。在一些实施方案中,包含全血组合物的血液采集容器可通过与血液制品相容的导管(例如,血液相容性)联接(例如,连接)至套件,其中导管提供用于将全血组合物转移(例如无菌地)到套件的容器中的流体连通路径,所述容器例如血液相容性容器(例如,血液制品袋),其尺寸对于全血组合物、pic和任何淬灭剂、抗凝剂和/或其他期望添加物的合并体积来说是足够的。例如,柔性管在本领域中通常用于联接(例如,连接)(例如,处理装置或套件的)一个或多个血液制品容器。在一些实施方案中,导管可用于将包含全血组合物的血液采集容器与套件的容器(例如,第一容器)的入口(例如,第一入口)联接,诸如通过使用无菌连接装置(例如,scd、管焊机)将两个管段(例如,一个管段连接至血液采集容器,一个管段连接至套件的容器)无菌对接,以便提供流体连通路径。在将全血组合物转移到套件的容器中之后,可将导管密封并断开,从而使血液采集容器与套件断开连接。可替代地,可将全血组合物从供体直接采集到本公开的套件中。例如,在一些实施方案中,本公开的套件包括用于从供体中抽取全血(例如,通过静脉穿刺)的血管接入装置(例如,针头),以及在血管接入装置与套件的容器(诸如第一容器的第一入口)之间延伸的导管(例如,管、柔性管)。导管由此提供流体连通路径,以用于将正使用血管接入装置从供体中抽取的全血转移(例如无菌地)到套件的容器中。通常,对于将全血直接采集到套件的容器(例如,第一容器)中的实施方案,容器包含用于与全血混合(例如,合并)的抗凝剂(例如,在混合全血和pic之前)。在将全血组合物采集到套件的容器中之后,在一些实施方案中,可将导管密封并断开,从而使血液接入装置与套件断开连接。在一些实施方案中,在用于在本文所述的用于病原体灭活的处理方法中使用之前,已对本文所述的全血组合物进行白细胞减少(白细胞减少)。例如,可使用封闭(例如,功能封闭)系统进行全血的白细胞减少,诸如通过与本公开的全血采集装置或套件为一体或无菌连接的在线过滤器进行过滤。合适的白细胞减少过滤器是本领域已知的。在一些实施方案中,全血组合物尚未进行白细胞减少。可如本文所公开的那样处理将与活体的人、哺乳动物或脊椎动物接触或将引入其中的任何全血组合物,其中这种接触由于污染的病原体而具有传播疾病的风险。类似地,可如本文所公开的那样处理将用于制备将与活体的人、哺乳动物或脊椎动物接触或将引入其中的一种或多种其他血液制品(例如,红细胞、血浆、血小板、冷沉淀)的任何全血组合物,其中这种接触由于污染的病原体而具有传播疾病的风险。在一些实施方案中,用于制备病原体灭活的全血组合物的本公开的方法包括:(a)在第一容器中混合(例如,合并、添加)(i)全血组合物;(ii)有效量的病原体灭活化合物(pic);以及(iii)任选的有效量的淬灭剂;(b)在第一容器中孵育全血组合物、pic和任选的淬灭剂的混合物(例如,掺和物),其条件和持续时间足以灭活病原体,如果存在的话;(c)在无菌条件下将混合物转移至第二容器;以及(d)在第二容器中孵育混合物,其条件和持续时间足以使pic的浓度降低至(i)比转移步骤(b)时混合物中pic的浓度小至少25%的浓度;(ii)比步骤(a)的混合物中pic的浓度(例如,初始浓度,即孵育步骤(b)之前的浓度)小(例如,低)至少105倍的浓度;和/或(iii)为约1nm或更少的浓度,从而产生病原体灭活的全血组合物。本文还提供了通过本公开的任何方法制备的病原体灭活的全血组合物。在本文提供的方法的一些实施方案中,步骤(a)的混合物(例如,掺和物)(例如,全血组合物、抗凝剂、pic、任选的淬灭剂的混合物)中pic诸如阿马他林的浓度为至少约0.05mm、至少约0.1mm或至少约0.2mm或更大。在一些实施方案中,步骤(a)的混合物中pic的浓度为约0.1mm至约10mm。在一些实施方案中,步骤(a)的混合物中pic的浓度小于约10mm、小于约5mm、小于约4mm、小于约3mm、小于约2mm、小于约1.0mm或小于约0.5mm。步骤(a)的混合物中pic的浓度通常是指在步骤(a)的组分(诸如全血组合物、pic、任何抗凝剂以及任何淬灭剂)混合时(例如,合并,混合后立即)并且在孵育步骤(b)之前的初始pic浓度。在一些实施方案中,步骤(a)的混合物中pic的浓度为约0.05mm至约10.0mm、约0.05mm至约5.0mm、约0.05mm至约4.0mm、约0.05mm至约2.0mm、约0.05mm至约1.0mm、约0.05mm至约0.5mm、约0.1mm至约10mm、约0.1mm至约5mm、约0.1mm至约4mm、约0.1mm至约3mm、约0.1mm至约2mm、约0.1mm至约1.0mm、约0.1mm至约0.5mm,或约0.1mm至约0.3mm。在一些实施方案中,步骤(a)的混合物中pic的浓度为约0.05mm、约0.07mm、约0.08mm、约0.09mm、0.1mm、0.2mm、0.3mm、0.4mm、0.5mm、0.6mm、0.7mm、0.8mm、0.9mm、1.0mm、约2.0mm、约3.0mm、约4.0mm、约5mm、约6mm、约7mm、约8mm、约9mm或约10mm。在一些实施方案中,步骤(a)的混合物中pic的浓度为约0.2mm。在一些实施方案中,pic包含作为或形成反应性亲电子基团的官能团。在一些实施方案中,官能团选自由以下组成的组:芥子、芥子中间体和芥子等同物。在一些实施方案中,官能团是或能够形成吖丙啶鎓离子。在一些实施方案中,反应性亲电子基团能够与核酸反应。在一些实施方案中,pic包含核酸结合配体。在一些实施方案中,核酸结合配体是嵌入剂。在一些实施方案中,嵌入剂是吖啶。在一些实施方案中,pic包含连接官能团和核酸结合配体的易碎接头。在一些实施方案中,pic是β-丙氨酸,n-(吖啶-9-基),2-[双(2-氯乙基)氨基]乙基酯。在本文提供的方法的一些实施方案中,步骤(a)包括在第一容器中混合(例如,合并、添加)全血组合物、有效量的pic和有效量的淬灭剂。在一些实施方案中,步骤(a)的混合物(例如,掺和物)中淬灭剂的浓度(例如,初始浓度,即孵育步骤(b)之前的浓度)为至少约1mm、至少约2mm、至少约3mm、至少约4mm,或至少约5mm。在一些实施方案中,步骤(a)的混合物中淬灭剂的浓度小于约25mm、小于约20mm、小于约15mm,或小于约10mm。在一些实施方案中,步骤(a)的混合物中淬灭剂的浓度为约1mm至约25mm。在一些实施方案中,步骤(a)的混合物中淬灭剂的浓度为约1mm至约20mm。在一些实施方案中,步骤(a)的混合物中淬灭剂的浓度为约1mm至约15mm。在一些实施方案中,步骤(a)的混合物中淬灭剂的浓度为约1mm至约10mm。在一些实施方案中,步骤(a)的混合物中淬灭剂的浓度为约1mm至约5mm。在一些实施方案中,步骤(a)的所得混合物中淬灭剂的浓度为约1mm、约2mm、约3mm、约4mm、约5mm、约6mm、约7mm、约8mm、约9mm或约10mm。在一些实施方案中,步骤(a)的混合物中pic的浓度为约0.1mm,并且步骤(a)的掺和物中淬灭剂的浓度为约1mm、约2mm、约2mm、约4mm、约5mm、约6mm、约7mm、约8mm、约9mm或约10mm。在一些实施方案中,步骤(a)的混合物中pic的浓度为约0.2mm,并且步骤(a)的混合物中淬灭剂的浓度为约1mm、约2mm、约2mm、约4mm、约5mm、约6mm、约7mm、约8mm、约9mm或约10mm。在一些实施方案中,步骤(a)的混合物中pic的浓度为约0.2mm,并且步骤(a)的混合物中淬灭剂的浓度为约1mm、约2mm、约2mm、约4mm、约5mm、约6mm、约7mm、约8mm、约9mm或约10mm。在一些实施方案中,步骤(a)的混合物中pic的浓度为约0.2mm并且步骤(a)的混合物中淬灭剂的浓度为约1mm至约5mm。在一些实施方案中,步骤(a)的混合物中pic的浓度为约0.2mm并且步骤(a)的掺和物中淬灭剂的浓度为约2mm。在一些实施方案中,淬灭剂包含巯基,其中巯基能够与病原体灭活化合物的反应性亲电子基团反应。在一些实施方案中,淬灭剂包含半胱氨酸或半胱氨酸的衍生物。在一些实施方案中,淬灭剂是谷胱甘肽或其药学上可接受的盐。在一些实施方案中,淬灭剂是谷胱甘肽单钠盐。在一些实施方案中,一旦淬灭剂和病原体灭活化合物这两种组分已经与全血组合物混合,则所述淬灭剂与病原体灭活化合物的摩尔比为约5:1至约100:1、约5:1至约50:1、约5:1至约40:1、约5:1至约30:1、约5:1至约20:1、约5:1至约10:1、约10:1至约100:1、约10:1至约50:1、约10:1至约40:1、约10:1至约30:1,或约10:1至约20:1。在一些实施方案中,一旦淬灭剂和病原体灭活化合物这两种组分已经与全血组合物混合,则所述淬灭剂与病原体灭活化合物的摩尔比为约5:1、约6:1、约7:1、约8:1、约9:1、约10:1、约11:1、约12:1、约13:1、约14:1、约15:1或约20:1。可使用本公开的任何方法和套件将pic和任选的淬灭剂添加到套件的容器(例如,第一容器)中。在一些实施方案中,可将pic和任选的淬灭剂添加到本公开的套件的第一容器中。在一些实施方案中,通过第一容器的第一入口将pic和任选的淬灭剂添加到第一容器中。在一些实施方案中,通过第一容器的第一入口将pic和淬灭剂两者添加到第一容器中。在一些实施方案中,将pic从包含pic的容器(pic容器)添加到第一容器中,其中pic容器联接至第一容器。在一些实施方案中,pic容器联接至第一容器的第一入口。在一些实施方案中,pic容器联接至第一容器的第二入口。在一些实施方案中,将淬灭剂从包含淬灭剂的容器(淬灭剂容器)添加到第一容器中,其中淬灭剂容器联接至第一容器。在一些实施方案中,淬灭剂容器联接至第一容器的第一入口。在一些实施方案中,淬灭剂容器联接至第一容器的第二入口。在一些实施方案中,pic容器和淬灭剂容器两者均联接至第一容器的第一入口。在一些实施方案中,pic容器和淬灭剂容器两者均联接至第一容器的第二入口。在一些实施方案中,通过导管(例如,柔性管)将pic和任选的淬灭剂添加到第一容器中,所述导管在pic容器和任选的淬灭剂容器与第一容器之间延伸(例如,联接)并提供用于将pic从pic容器转移到第一容器中并且任选地用于将淬灭剂从任选的淬灭剂容器转移到第一容器中的流体连通路径。在一些实施方案中,通过导管将pic和淬灭剂添加到第一容器中,所述导管在pic容器和淬灭剂容器与第一容器的入口之间延伸,并且提供用于将pic从pic容器转移到第一容器中并将淬灭剂从任选的淬灭剂容器转移到第一容器中的流体连通路径。在一些实施方案中,通过在pic容器和淬灭剂容器与第一容器的第一入口之间延伸的导管将pic和淬灭剂添加到第一容器中。在一些实施方案中,通过在pic容器和淬灭剂容器与第一容器的第二入口之间延伸的导管将pic和淬灭剂添加到第一容器中。在一些实施方案中,pic容器和淬灭剂容器是同一容器。在一些实施方案中,通过在pic容器和淬灭剂容器与第一容器的入口之间延伸的导管将pic和淬灭剂添加到第一容器中,并且导管在一端包括:(a)用于将pic容器联接至导管的第一适配器,(b)用于将淬灭剂容器联接至导管的第二适配器,以及任选的(c)适用于增加pic和淬灭剂通过导管并进入第一容器的转移的置换装置(例如,空气置换装置)。在一些实施方案中,通过在pic容器和淬灭剂容器与第一容器的入口之间延伸的导管将pic和淬灭剂添加到第一容器中,并且导管在一端包括:(a)用于将pic容器联接至导管的第一适配器,(b)用于将淬灭剂容器联接至导管的第二适配器,以及(c)适用于增加pic和淬灭剂通过导管并进入第一容器的转移的置换装置(例如,空气置换装置)。在一些实施方案中,空气从置换装置(例如,空气置换装置)转移到导管中,从而增加pic和淬灭剂向第一容器中的转移(例如,转移的流体体积的百分比)。在一些实施方案中,流体(例如,盐水)从置换装置转移到导管中,从而增加pic和淬灭剂向第一容器中的转移(例如,转移的流体体积的百分比)。在一些实施方案中,在包括适配器的导管联接至第一容器之后,将pic容器联接至导管的第一适配器。在一些实施方案中,在包括适配器的导管联接至第一容器之后,将淬灭剂容器联接至导管的第二适配器。在一些实施方案中,在将全血组合物添加到第一容器中之后,将在pic容器和任选的淬灭剂容器与第一容器的入口之间延伸的导管联接至第一容器。在一些实施方案中,在将全血组合物添加到第一容器中之后,将在pic容器和淬灭剂容器与第一容器的入口之间延伸的导管联接至第一容器。在一些实施方案中,在通过第一容器的第一入口将全血组合物添加到第一容器中之后,将在pic容器和任选的淬灭剂容器与第一容器的入口之间延伸的导管联接至第一容器的第一入口。在一些实施方案中,在通过第一容器的第一入口将全血组合物添加到第一容器中之后,将在pic容器和任选的淬灭剂容器与第一容器的入口之间延伸的导管联接至第一容器的第一入口。在一些实施方案中,在通过第一容器的第一入口将全血组合物添加到第一容器中之后,将在pic容器和淬灭剂容器与第一容器的入口之间延伸的导管联接至第一容器的第一入口。例如,在通过将血液采集容器或血管接入装置联接至第一容器的第一入口的导管将全血组合物从血液采集容器或血管接入装置转移到第一容器中之后,可将导管密封并断开,从而将血液采集容器或血管接入装置与套件(例如,与第一容器)断开连接。然后,可将pic源(例如,pic容器)和淬灭剂源(例如,淬灭剂容器)联接至从套件的第一容器的第一入口延伸的其余密封且断开的导管。在一些实施方案中,pic容器和淬灭剂容器两者均联接至从套件的第一容器延伸的导管。在一些实施方案中,在将全血组合物添加到第一容器中之后(例如,并且在将导管联接至第一容器之后),将pic容器联接至导管的第一适配器并且将淬灭剂容器联接至导管的第二适配器。在一些实施方案中,通过第一容器的第一入口将全血组合物添加到第一容器中,并且通过第一容器的第二入口将pic和任选的淬灭剂添加到第一容器中。在一些实施方案中,将在pic容器和任选的淬灭剂容器与第一容器的入口之间延伸的导管联接至第一容器的第二入口。例如,在一些实施方案中,可将全血组合物从联接(例如,通过第一导管)至第一容器的第一入口的血液采集容器或血管接入装置转移到第一容器中,在转移全血组合物后,可任选地将导管密封并断开,从而使血液采集容器或血管接入装置与套件断开连接,并且接着可将pic和任选的淬灭剂从联接(例如,通过第二导管)至第一容器的第二入口的pic源(例如,pic容器)和任选的淬灭剂源(例如,淬灭剂容器)转移到第一容器中。在一些实施方案中,第二导管在一端包括用于将pic容器和/或淬灭剂容器联接至第二导管的至少一个适配器。在一些实施方案中,第二导管在一端包括用于将pic容器联接至导管的第一适配器和用于将淬灭剂容器联接至导管的第二适配器。在一些实施方案中,在将pic容器联接至导管的第一适配器或将淬灭剂容器联接至导管的第二适配器之前,将第二导管联接至第一容器的第二入口。在将全血组合物、有效量的pic和任选的有效量的淬灭剂添加(例如,转移)至套件的容器(例如,第一容器)(例如,并且在其中混合)后,将混合物(例如,掺和物)在第一容器中在足以灭活病原体(如果存在的话)的条件和持续时间下孵育。在一些实施方案中,孵育步骤(例如,步骤(b))为约2小时至约24小时。在一些实施方案中,孵育步骤(例如,步骤(b))为约6小时至约24小时、约12小时至约24小时,或约18至约24小时。在一些实施方案中,孵育步骤(例如,步骤(b))为约18小时至约22小时(例如,约18小时、约19小时、约20小时、约21小时、约22小时)。在一些实施方案中,孵育步骤(例如,步骤(b))为约20小时。在一些实施方案中,孵育步骤(b)处于约18℃至25℃下。在一些实施方案中,孵育步骤(例如,步骤(b))处于室温(例如,22℃)下。在一些实施方案中,在第一容器中的孵育步骤(例如,步骤(b))之后,将包含全血组合物、pic以及任选的淬灭剂的混合物转移(例如,在无菌条件下)至第二容器。在一些实施方案中,第二容器联接至第一容器。在一些实施方案中,通过在第一容器与第二容器之间延伸(例如,联接、连接)的导管(诸如柔性管)转移混合物(例如,转移步骤(c))。在一些实施方案中,导管在第一容器的第一出口与第二容器的第一入口之间延伸(例如,连接,提供流体连通路径)。在一些实施方案中,所述方法还包括在第二容器中孵育混合物(例如,持续足以减少pic的时间)。在一些实施方案中,第二容器中的孵育步骤(例如,步骤(d))为约1小时至约12小时、约1小时至约10小时、约1小时至约8小时、约1小时至约6小时。在一些实施方案中,孵育步骤(例如,步骤(d))为约2小时至约4小时。在一些实施方案中,孵育步骤(例如,步骤(d))为约1小时、约2小时、约3小时、约4小时、约5小时、约6小时、约7小时、约8小时、约9小时、约10小时、约11小时或约12小时或更多。在一些实施方案中,孵育步骤处于约18℃至25℃下。在一些实施方案中,孵育步骤处于室温(例如,22℃)下。在一些实施方案中,在孵育步骤之后,将病原体灭活的全血组合物储存在第二容器中。在一些实施方案中,将病原体灭活的全血组合物从第二容器转移至第三容器。在一些实施方案中,第三容器联接至第二容器。在一些实施方案中,通过在第二容器与第三容器之间延伸(例如,联接、连接)的导管(诸如柔性管)将病原体灭活的全血组合物从第二容器转移至第三容器。在一些实施方案中,导管在第二容器的第一出口与第三容器的第一入口之间延伸(例如,连接,提供流体连通路径)。在一些实施方案中,将病原体灭活的全血组合物储存在第三容器中。在一些实施方案中,病原体灭活的全血组合物储存在约2-6℃下(例如,储存在第二容器中、储存在第三容器中)。在一些实施方案中,病原体灭活的全血组合物适用于输注(例如,人受试者的输注)。在一些实施方案中,在第二容器中孵育混合物(例如,孵育步骤(d))之后,pic的浓度降低。在一些实施方案中,在第二容器中孵育混合物(例如,孵育步骤(d))之后,pic的浓度降低至:(i)比转移步骤(b)时混合物中pic的浓度小至少25%的浓度;(ii)比步骤(a)的混合物中pic的浓度(例如,初始浓度,即孵育步骤(b)之前的浓度)小(例如,低)至少105倍的浓度;和/或(iii)为约1nm或更少的浓度,从而产生病原体灭活的全血组合物。在一些实施方案中,在第二容器中孵育混合物(例如,孵育步骤(d))之后,pic的浓度降低至比转移至第二容器(例如,转移步骤(b))时混合物中pic的浓度小至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少60%、至少70%、至少80%或至少90%的浓度。在一些实施方案中,在第二容器中孵育混合物(例如,孵育步骤(d))之后,pic的浓度降低至比步骤(a)的混合物中pic的浓度(例如,初始浓度,即孵育步骤(b)之前的浓度)小至少104倍、至少104.5倍、至少105倍、至少105.5倍、至少106倍、至少106.5倍,或至少107倍的浓度。在一些实施方案中,在第二容器中孵育混合物(例如,孵育步骤(d))之后,pic的浓度降低至小于约2.0nm、小于约1.5nm、小于约1.25nm、小于约1.0nm、小于约0.9nm、小于约0.8nm、小于约0.75nm或小于约0.7nm的浓度。在一些实施方案中,在第二容器中孵育混合物(例如,孵育步骤(d))之后,pic的浓度降低至小于使用lcms获得的定量限的浓度。可针对多种参数表征本公开的病原体灭活的全血组合物和由其衍生的血液组分(例如,功能表征,使用本领域已知的分析方法进行)。非限制性实例包括溶血百分比、ph(例如,在37℃下)、po2、pco2、hco-3、总atp、细胞外k+/na+、细胞外葡萄糖和乳酸盐、血细胞比容、血红蛋白含量、白蛋白水平、凝血因子活性、校准的自动血栓图(calibratedautomatedthrombogram,cat)、凝血酶生成能力、凝血酶原时间(pt)活化的部分凝血活酶时间(aptt)、凝血酶时间(tt)、旋转血栓弹力分析(rotationalthromboelastometry,rotem)、p选择素、gpiib/iiia以及血小板聚集。在一些实施方案中,所述方法还包括将病原体灭活的全血组合物分离为红细胞组合物、血浆组合物或血小板组合物中的一种或多种(例如,病原体灭活的红细胞组合物、病原体灭活的血浆组合物、病原体灭活的血小板组合物)。在一些实施方案中,所述方法还包括将病原体灭活的全血组合物分离为红细胞组合物和血浆组合物。在一些实施方案中,所述方法还包括将病原体灭活的全血组合物分离为至少血浆组合物,并且由血浆组合物制备冷沉淀组合物(例如,病原体灭活的冷沉淀组合物)。在一些实施方案中,由血浆组合物制备冷沉淀组合物包括制备冷沉淀减少的(例如,缺少冷沉淀的(cryo-poor))血浆组合物(例如,病原体灭活的冷沉淀减少的血浆组合物)。将全血分离为红细胞组合物、血浆组合物和/或血小板组合物的方法在本领域中是众所周知的。在一些实施方案中,使用本领域已知的方法将根据本公开制备的病原体灭活的全血分离为红细胞组合物、血浆组合物和/或血小板组合物中的一种或多种。同样,由血浆制备冷沉淀组合物和冷沉淀减少的(例如,缺少冷沉淀的)血浆组合物的方法在本领域中是众所周知的。在一些实施方案中,使用本领域已知的方法由通过将根据本公开制备的病原体灭活的全血分离为血浆组合物而获得的血浆制备冷沉淀组合物和/或冷沉淀减少的血浆组合物。在另一方面,本公开提供了一种通过任何前述方法制备的病原体灭活的全血组合物。在一些实施方案中,病原体灭活的全血组合物适用于输注。在一些实施方案中,病原体灭活的全血组合物是适用于输注的病原体灭活的全血单位。在一些实施方案中,适用于输注的病原体灭活的全血组合物包含浓度小于约2.0nm、小于约1.5nm、小于约1.25nm、小于约1.0nm、小于约0.9nm、小于约0.8nm、小于约0.75nm或小于约0.7nm的pic。本公开的另一方面提供一种通过任何前述方法制备的病原体灭活的红细胞组合物。本公开的另一方面提供一种通过任何前述方法制备的病原体灭活的血浆组合物。本公开的另一方面提供一种通过任何前述方法制备的病原体灭活的血小板组合物。本公开的另一方面提供一种通过任何前述方法制备的病原体灭活的冷沉淀组合物。本公开的另一方面提供一种通过任何前述方法制备的病原体灭活的冷沉淀减少的血浆组合物。在一些实施方案中,本公开的方法包括离体使用病原体灭活化合物和猝灭剂。离体使用包括在活体的人、哺乳动物或脊椎动物的外部使用化合物处理全血组合物,其中经过处理的生物材料旨在在活体的人、哺乳动物或脊椎动物的内部使用。例如,如果旨在将血液重新引入人或另一个人体内,那么从所述人中取出血液并将化合物引入所述血液中以灭活病原体被定义为化合物的离体使用。将人的血液重新引入所述人或另一个人体内将是血液的体内使用,与化合物的离体使用相对。如果将血液重新引入人体内时化合物仍存在于所述血液中,那么除其离体使用之外,化合物还被引入体内。本公开的一些实施方案涉及淬灭剂的离体使用,其中全血组合物旨在体内使用。在一些情况下,一定水平的淬灭剂保留在全血组合物中,使得淬灭剂也被引入体内。材料或化合物的体外使用涉及在活体的人、哺乳动物或脊椎动物的外部使用所述材料或化合物,其中材料或化合物不旨在重新引入到活体的人、哺乳动物或脊椎动物体内。体外使用的实例将是全血样品的组分的诊断分析。本公开的方法可应用于全血组合物的体外使用,因为全血或其他成分的修饰可影响血液样品的组分的体外分析。因此,本公开的方法可通过充分地淬灭样品中原本可能干扰样品的诊断测试的修饰而提供处理此类体外样品的安全性。经过处理的全血组合物在一些实施方案中,本公开还提供了由本文所述的每种处理方法得到的全血组合物。在一些实施方案中,本公开还提供了由本文所述的每种处理方法可制备的全血组合物。在本文所述的各方法和组合物的一些实施方案中,全血组合物中的全血是哺乳动物血液。例如,全血可以是啮齿动物(例如,小鼠或大鼠)、犬科动物、兔形动物(例如,兔)、非人灵长类动物(例如,黑猩猩)或人的全血。例如,在一些实施方案中,全血是人的全血。在一些实施方案中,已对全血进行白细胞减少。在一些其他实施方案中,尚未对全血进行白细胞减少。在一些实施方案中,包含全血的组合物可能被病原体污染。在一些实施方案中,全血组合物被病原体污染。在一些实施方案中,如果存在,那么组合物中至少1log,或至少2log,或至少3log、至少4log、至少5log、至少6log或更多的病原体被灭活。本公开的套件尤其可用于由病原体灭活的全血组合物制备一种或多种病原体灭活的血液组分,诸如血浆组合物、红细胞组合物和/或血小板组合物,例如,如本文所述。可由此类血液组分制备另外的病原体灭活的血液制品,包括例如冷沉淀和/或冷沉淀减少的(例如,“缺少冷沉淀的”)血浆。本公开的病原体灭活的全血组合物可用于本领域已知的多种应用中。在某些方面,本文提供了将本公开的病原体灭活的全血组合物输注到有需要的受试者体内的方法。在一些实施方案中,受试者是人受试者。本公开的任何全血组合物均可用于输注方法。全血处理和试剂盒本公开的某些方面涉及套件(例如,病原体灭活套件)。本公开的套件和相关处理装置尤其可用于制备病原体灭活的全血组合物和其他病原体灭活的血液制品,例如,如本文所述。下文描述的任何示例性部件,诸如容器、袋子和导管(例如,管),均可在本公开的套件中使用。在一个方面,提供一种用于制备病原体灭活的全血组合物的套件,所述套件包括:用于从供体中抽取全血的血管接入装置(例如,针头、静脉穿刺针头);适用于混合(例如,合并、添加)全血和病原体灭活化合物(pic)的第一容器,其中第一容器包含(例如,包括)至少第一入口和第一出口,并且其中血管接入装置联接至第一容器的第一入口;以及包含病原体灭活化合物的容器(pic容器)。在一些实施方案中,提供了一种用于制备病原体灭活的全血组合物的套件,所述套件包括:(a)用于从供体中抽取全血的血管接入装置;(b)适用于混合(例如,合并、添加)全血和病原体灭活化合物(pic)的第一容器,其中第一容器包括至少第一入口和第一出口;(c)在血管接入装置与第一容器的第一入口之间延伸并提供用于将全血从血管接入装置转移到第一容器中的流体连通路径的第一导管;以及(d)包含病原体灭活化合物的容器(pic容器),其中pic容器被构造成通过流体连通路径联接至第一容器。本公开的套件中用于与全血组合物一起使用的容器对于全血和/或其他血液制品组合物的处理和/或储存是相容的(例如,血液相容性)。此类容器可包含本领域已知用于血液制品容器的任何片材(例如,pvc、eva),并且其尺寸足以包含期望体积的全血以及与全血组合物混合的任何另外的流体体积(例如,抗凝剂、pic、淬灭剂)。容器可包括用于接入的一个或多个入口(例如,端口、接入端口)和一个或多个出口(例如,端口、接入端口),从而将流体诸如全血和/或病原体灭活化合物转移进或转移出容器。在血液制品容器中使用的许多合适的端口在本领域中是已知的。在一些实施方案中,入口(例如,端口、接入端口、进入端口)可以是“打开的”,从而允许流体进入容器,诸如当导管(例如,管)联接至入口(例如,从而提供无菌连接和流体路径)时。可替代地或除此之外,入口可以是“可打开的”,诸如易碎或可刺穿的端口,其允许流体在屏障打开之后进入(例如,无菌流体路径)容器中。类似地,在一些实施方案中,出口(例如,端口、接入端口、尖嘴端口)可以是打开的或可打开的。在一些实施方案中,容器的入口和出口可具有基本上相似的构造。在一些实施方案中,本公开的一个或多个容器(例如,第一容器、第二容器)包含聚氯乙烯(例如,pvc、增塑聚氯乙烯)。在一些实施方案中,本公开的一个或多个容器(例如,第一容器、第二容器)包含聚乙烯(例如,乙烯-乙酸乙烯酯、乙烯-乙酸乙烯酯共聚物)。在一些实施方案中,本公开的一个或多个容器(例如,第一容器、第二容器)包含聚烯烃(例如,聚烯烃共混物)。在一些实施方案中,本公开的一个或多个容器(例如,第一容器、第二容器)包含聚偏二氟乙烯(pvdf)。本公开的套件中用于与全血组合物一起使用的导管(例如,管、柔性管)也与全血和/或其他血液制品组合物相容(例如,血液相容性)。在一些实施方案中,本公开的容器和/或导管不包含邻苯二甲酸二乙基己酯(例如,不含dehp)。诸如针头(例如,血管接入针头)的血管接入装置通常用于从供体中抽取全血(例如,通过静脉穿刺),以将其采集到诸如血液采集容器的容器中。在一些实施方案中,用血管接入装置将全血从供体采集到本公开的容器中(例如,从血管接入装置转移到套件的第一容器中)。在一些实施方案中,供体全血通过导管(诸如柔性的血液相容性管)从血管接入装置转移到本公开的套件的第一容器中,所述导管在血管接入装置与第一容器之间延伸,以提供用于无菌转移全血的流体连通路径。在一些实施方案中,血管接入装置和导管构成针头组件。可通过与导管联接(例如,连接、附接)的容器的入口(例如,开口、端口、接入端口)将全血转移(例如,无菌转移)到第一容器中。导管可包括一个连续管段,或多于一个管段,诸如具有维持流体连通路径的一个或多个居间部件(例如,连接器、过滤器、白细胞减少过滤器)的管段。导管还可包括内部易碎密封件或封闭件(例如,易碎套管),可通过管的外部操纵(诸如通过将管弯曲)使其破裂并打开。此类易碎封闭件在本领域中是众所周知的。在一些实施方案中,pic容器被构造成通过流体连通路径联接至第一容器的第一入口。在一些实施方案中,pic容器被构造成联接至第一导管。在一些实施方案中,第一容器包括第二入口并且pic容器被构造成通过流体连通路径联接至第一容器的第二入口。在一些实施方案中,套件还包括包含淬灭剂的容器(淬灭剂容器),其中淬灭剂容器被构造成通过流体连通路径联接至第一容器。在一些实施方案中,淬灭剂容器被构造成通过流体连通路径联接至第一容器的第一入口。在一些实施方案中,淬灭剂容器被构造成联接至第一导管。在一些实施方案中,淬灭剂容器被构造成通过流体连通路径联接至第一容器的第二入口。在一些实施方案中,pic容器和淬灭剂容器是同一容器(例如,具有多于一个腔室的容器)。本公开的pic和淬灭剂容器可包括套件的适用于储存pic或淬灭剂的任何容器,包括例如玻璃容器(例如,小瓶)、塑料容器(例如,注射器)、柔性袋等。在一些实施方案中,此类pic和/或淬灭剂容器可被构造成联接(例如,连接)至套件的部件(例如,容器、导管、处理装置),以允许流体连通和pic和/或淬灭剂的转移。在一些实施方案中,本公开的套件可包括第一pic容器和第二pic容器,其中第一pic容器和第二pic容器中的任一者或两者被构造成联接至套件的部件(例如,容器、导管、处理装置)。在一些实施方案中,本公开的套件可包括第一淬灭剂容器和第二淬灭剂容器,其中第一淬灭剂容器和第二淬灭剂容器中的任一者或两者被构造成联接至套件的部件(例如,容器、导管、处理装置)。例如,在一些实施方案中,套件(例如,处理装置)可包括作为玻璃小瓶的用于重构冻干的pic和冻干的淬灭剂的第一pic容器和第一淬灭剂容器,以及作为注射器的第二pic容器和第二淬灭剂容器,其被构造成联接至套件的导管或容器(例如,其中重构的pic和淬灭剂从其各自的第一容器转移(例如,无菌地)至其各自的第二容器,所述第二容器被构造成联接至套件的导管或容器)。在一些实施方案中,pic和/或淬灭剂容器与套件的部件(例如,导管、容器)的联接可以例如使用适配器(例如,鲁尔适配器)进行。在一些实施方案中,pic和/或淬灭剂容器与套件的部件(例如,容器、导管、处理装置)的联接可以例如使用导管进行(例如,使用管焊机进行无菌对接)。在一些实施方案中,pic和/或淬灭剂容器在制造过程中联接至套件的部件(例如,容器、导管、处理装置),以便一体地连接在套件内。在一些实施方案中,pic容器和淬灭剂容器是同一容器。例如,pic容器和淬灭剂容器可以是单个容器内的部分(例如,腔室、子容器),例如以提供仅需要单次联接(例如,联接至容器、导管)将pic和淬灭剂转移至容器(例如,第一容器)的构造。在一些实施方案中,套件还包括第二导管,其中第二导管在一端包括用于将pic容器(例如,第二pic容器)和/或淬灭剂容器(例如,第二淬灭剂容器)联接至第二导管的至少一个适配器。在一些实施方案中,第二导管在一端包括用于将pic容器联接至第二导管的第一适配器和用于将淬灭剂容器联接至第二导管的第二适配器。在一些实施方案中,第二导管在端部包括具有第一适配器和第二适配器的2通分支(2-waybranch)。在一些实施方案中,套件还包括第二导管,其中第二导管在一端联接至pic容器和/或淬灭剂容器。在一些实施方案中,套件还包括第二导管,其中第二导管在一端联接至pic容器和淬灭剂容器(例如,使用2通分支)。在一些实施方案中,第二导管(例如,第二导管的另一端)被构造成联接至第一容器,从而在pic容器和/或淬灭剂容器与第一容器之间提供流体连通路径。在一些实施方案中,第二导管被构造成联接至第一容器的第一入口。在一些实施方案中,第二导管联接至第一容器的第二入口。在一些实施方案中,第二导管被构造成联接至第一导管(例如,通过无菌对接),从而在pic容器和/或淬灭剂容器与第一容器之间提供流体连通路径。在一些实施方案中,套件还包括适用于增加pic和/或淬灭剂向本公开的容器(诸如第一容器)中的转移(例如,通过第二导管并进入第一容器)的置换装置(例如,空气置换装置)。通常,本公开的置换装置,诸如空气置换装置,是套件中可以以促进流体(例如,pic和/或淬灭剂)通过或自导管的移动或转移的方式从置换装置中置换空气和/或流体的任何装置或部件,诸如,在空气置换装置的情况下,通过压缩空气置换装置,使空气(例如,或合适的气体)推动流体通过与其联接的导管,以增加或最大化转移(例如,排出流体)并减少或最小化导管中的残留流体体积。当将较小体积的流体(诸如pic和/或淬灭剂)诸如从导管转移到容器中时(其中导管中的残留流体(例如,通过重力未排尽的流体)在与全血组合物混合时可能影响pic和/或淬灭剂的最终浓度),置换装置(例如,空气置换装置)可特别有用。预期用于本公开的套件的空气置换装置可包括但不限于样品旁路转移袋、注射器、橡胶球、柔性容器、药筒(例如,气体药筒)等。通常,空气置换装置的内部以及包含在其中的任何气体(例如,空气)是无菌的,例如,作为套件制造的一部分被灭菌。在一些优选实施方案中,空气置换装置是样品旁路转移袋(例如,空气枕、采样袋),其实例在血液采集领域是众所周知的。预期用于本公开的其他置换装置可包括例如含流体的置换装置,诸如容器中的无菌盐水溶液,其可用于促进pic和/或淬灭剂的转移。在一些实施方案中,置换装置(例如,空气置换装置)联接至导管(例如,第二导管)的一端,并且导管的端部还可联接或被构造成联接至pic容器和/或淬灭剂容器,诸如使用管分支连接器(例如,3通分支)。在一些实施方案中,pic(例如,在pic容器中)包含本公开提供的任何病原体灭活化合物。在一些实施方案中,pic包含作为或形成反应性亲电子基团的官能团。在一些实施方案中,官能团选自由以下组成的组:芥子、芥子中间体和芥子等同物。在一些实施方案中,官能团是或能够形成吖丙啶鎓离子。在一些实施方案中,反应性亲电子基团能够与核酸反应。在一些实施方案中,pic包含核酸结合配体。在一些实施方案中,核酸结合配体是嵌入剂。在一些实施方案中,嵌入剂是吖啶。在一些实施方案中,pic包含连接官能团和核酸结合配体的易碎接头。在一些实施方案中,pic是β-丙氨酸,n-(吖啶-9-基),2-[双(2-氯乙基)氨基]乙基酯。在一些实施方案中,淬灭剂(例如,在淬灭剂容器中)包含本公开提供的任何淬灭剂。在一些实施方案中,淬灭剂包含巯基,其中巯基能够与病原体灭活化合物的反应性亲电子基团反应。在一些实施方案中,淬灭剂包含半胱氨酸或半胱氨酸的衍生物。在一些实施方案中,淬灭剂是谷胱甘肽或其药学上可接受的盐。在一些实施方案中,淬灭剂是谷胱甘肽单钠盐。在一些实施方案中,套件的第一容器包含抗凝剂(例如,抗凝剂溶液),诸如本领域已知的(例如,并由一个或多个监管机构和/或认证组织批准的)用于与全血一起使用的任何合适的抗凝剂。在一些实施方案中,在将全血组合物转移到容器中之前(例如,在将全血从供体采集到第一容器中时),套件的第一容器包含抗凝剂。在一些实施方案中,抗凝剂是柠檬酸-磷酸-葡萄糖(cpd)、柠檬酸-磷酸-二葡萄糖(cp2d)或柠檬酸-磷酸-葡萄糖腺嘌呤(cpda-1)。用于与全血(例如,全血组合物中的)混合的抗凝剂的合适体积在本领域中是众所周知的,并且在一些实施方案中可包括例如约30ml至约120ml、约50ml至约120ml、约60ml至约120ml、约50ml至约100ml、约50ml至约75ml、约60ml至约100ml、约60ml至约90ml、约60ml至约80ml,或约60ml至约70ml。在一些实施方案中,本公开的抗凝剂包含约30ml、约40ml、约45ml、约50ml、约55ml、约60ml、约65ml、约70ml、约75ml、约80ml、约85ml、约90ml、约95ml、约100ml、约105ml、约110ml或约120ml。在一些实施方案中,套件还包括适用于储存病原体灭活的全血组合物的第二容器,其中第二容器包含(例如,包括)至少第一入口和第一出口。在一些实施方案中,套件还包括导管(例如,第三导管),其在第一容器的第一出口与第二容器的第一入口之间延伸(例如,并提供用于将包含全血组合物和pic(以及淬灭剂,如果存在的话)的混合物从第一容器转移(例如,在无菌条件下)到第二容器中的流体连通路径)。在一些实施方案中,套件包括适用于储存病原体灭活的全血组合物的第三容器,其中第三容器包含(例如,包括)至少第一入口和第一出口,并且套件还包括导管(例如,第四导管),其在第二容器的第一出口与第三容器的第一入口之间延伸(例如,并提供用于将包含全血组合物和pic(以及淬灭剂,如果存在的话)的混合物从第二容器转移(例如,在无菌条件下)到第三容器中的流体连通路径)。本公开的套件可与输注管线(例如,输注管线组件、静脉内施用装置)结合使用,以将病原体灭活的全血组合物输注到受试者体内。在一些实施方案中,套件包括被构造成联接(例如,连接)至套件容器的出口(例如,尖嘴端口)的输注管线组件。在一些实施方案中,套件包括联接(例如,连接)至套件容器的出口的输注管线组件。在一些实施方案中,在病原体灭活的全血组合物制备后和输注前,将输注管线组件联接(例如,连接)至套件容器的出口(例如,尖嘴端口)。在一些实施方案中,将输注管线连接至套件的容器(例如,第二容器、第三容器)的出口(例如,在制备病原体灭活的全血组合物之前)。在一些实施方案中,输注管线组件一体地连接至套件容器的出口(例如,在处理之前、在套件的制造期间)。在一些实施方案中,套件还包括用于将病原体灭活的全血组合物输注到受试者体内的输注管线组件,其中输注管线包括第二血管接入装置(例如,针头、输注针头)和在第一容器、第二容器或第三容器与第二血管接入装置之间延伸的输注管线导管,其中输注管线导管提供用于将病原体灭活的全血组合物从容器(例如,第一容器、第二容器、第三容器)无菌转移至血管接入装置(例如,并且无菌转移到通过血管接入装置接入的供体中)的流体连通路径。在一些实施方案中,套件还包括用于将病原体灭活的全血组合物输注到受试者体内的输注管线组件,其中输注管线组件包括第二血管接入装置和在第二容器的第一出口与第二血管接入装置之间延伸的输注管线导管,其中输注管线导管提供用于将病原体灭活的全血组合物从第二容器无菌转移至血管接入装置的流体连通路径。在一些实施方案中,输注管线组件在套件的容器(例如,第一、第二、第三)与第二血管接入装置之间提供可打开的流体连通路径。如本文所提供的输注管线组件通常适用于将病原体灭活的全血组合物从套件的容器施用或输注(例如,无菌转移)至需要全血输注的受试者。在另一方面,本公开提供了一种用于制备病原体灭活的全血组合物的套件,其包括:适用于混合全血组合物、病原体灭活化合物(pic)和淬灭剂的第一容器,其中第一容器包含(例如,包括)至少第一入口和第一出口;适用于储存病原体灭活的全血组合物的第二容器,其中第二容器包含(例如,包括)至少第一入口和第一出口,并且其中第二容器联接至第一容器;包含病原体灭活化合物的容器(pic容器);包含淬灭剂的容器(淬灭剂容器);导管,其中导管在一端联接至或被构造成联接至pic容器和淬灭剂容器,并且其中导管还包括适用于增加pic和淬灭剂通过第一导管的转移的置换装置(例如,空气置换装置)。在一些实施方案中,本公开提供了一种用于制备病原体灭活的全血组合物的套件,其包括:(a)适用于混合全血组合物、病原体灭活化合物(pic)和淬灭剂的第一容器,其中第一容器包含(例如,包括)至少第一入口和第一出口,(b)适用于储存病原体灭活的全血组合物的第二容器,其中第二容器包含(例如,包括)至少第一入口和第一出口;(c)包含病原体灭活化合物的容器(pic容器),(d)包含淬灭剂的容器(淬灭剂容器),(e)第一导管,其中第一导管在一端联接至或被构造成联接至pic容器和淬灭剂容器,并且其中第一导管还包括适用于增加pic和淬灭剂通过第一导管的转移的置换装置(例如,空气置换装置);以及(f)在第一容器与第二容器之间延伸并提供用于将全血组合物从第一容器转移至第二容器的流体连通路径(例如,可打开的流体连通路径)的第二导管。在一些实施方案中,第一导管还包括用于将第二导管联接至pic容器和淬灭剂容器的至少一个适配器。在一些实施方案中,第一导管包括用于将pic容器联接至第一导管的第一适配器和用于将淬灭剂容器联接至第一导管的第二适配器。在一些实施方案中,第一导管联接至pic容器和淬灭剂容器。在一些实施方案中,pic容器和淬灭剂容器是同一容器。在一些实施方案中,第一导管被构造成联接至第一容器(例如,在pic容器和淬灭剂容器与第一容器之间提供流体连通路径)。在一些实施方案中,第一导管被构造成联接至第一容器的入口。在一些实施方案中,套件还包括用于从供体中抽取全血(例如,通过静脉穿刺)的血管接入装置(例如,针头),其中血管接入装置联接至第一容器(例如,通过在血管接入装置与容器之间延伸的导管)。在一些实施方案中,套件包括在血管接入装置与第一容器,诸如第一容器的第一入口之间延伸(例如,并提供用于将全血从血管接入装置转移到第一容器中的流体连通路径)的导管(例如,第三导管)。在一些实施方案中,第一容器还包含(例如,包括)第二入口,其中第一导管被构造成联接至第一容器的第二入口。在一些实施方案中,第一容器还包含(例如,包括)第二入口并且第一导管联接至第一容器的第二入口。在一些实施方案中,第一导管被构造成联接至第三导管(例如,从而在pic容器和淬灭剂容器与第一容器之间提供流体连通路径)。在一些实施方案中,套件的第一容器包含抗凝剂(例如,抗凝剂溶液),诸如本领域已知的(例如,并由一个或多个监管机构和/或认证组织批准的)用于与全血一起使用的任何合适的抗凝剂。在一些实施方案中,在将全血组合物转移到容器中之前(例如,在将全血从供体采集到第一容器中时),套件的第一容器包含抗凝剂。在一些实施方案中,抗凝剂是柠檬酸-磷酸-葡萄糖(cpd)、柠檬酸-磷酸-二葡萄糖(cp2d)或柠檬酸-磷酸-葡萄糖腺嘌呤(cpda-1)。用于与全血(例如,全血组合物中的)混合的抗凝剂的合适体积在本领域中是众所周知的,并且在一些实施方案中可包括例如约30ml至约120ml、约50ml至约120ml、约60ml至约120ml、约50ml至约100ml、约50ml至约75ml、约60ml至约100ml、约60ml至约90ml、约60ml至约80ml,或约60ml至约70ml。在一些实施方案中,本公开的抗凝剂包含约30ml、约40ml、约45ml、约50ml、约55ml、约60ml、约65ml、约70ml、约75ml、约80ml、约85ml、约90ml、约95ml、约100ml、约105ml、约110ml或约120ml。在一些实施方案中,pic包含作为或形成反应性亲电子基团的官能团。在一些实施方案中,官能团选自由以下组成的组:芥子、芥子中间体和芥子等同物。在一些实施方案中,官能团是或能够形成吖丙啶鎓离子。在一些实施方案中,反应性亲电子基团能够与核酸反应。在一些实施方案中,pic包含核酸结合配体。在一些实施方案中,核酸结合配体是嵌入剂。在一些实施方案中,嵌入剂是吖啶。在一些实施方案中,pic包含连接官能团和核酸结合配体的易碎接头。在一些实施方案中,pic是β-丙氨酸,n-(吖啶-9-基),2-[双(2-氯乙基)氨基]乙基酯。在一些实施方案中,淬灭剂包含巯基,其中巯基能够与病原体灭活化合物的反应性亲电子基团反应。在一些实施方案中,淬灭剂包含半胱氨酸或半胱氨酸的衍生物。在一些实施方案中,淬灭剂是谷胱甘肽或其药学上可接受的盐。在一些实施方案中,淬灭剂是谷胱甘肽单钠盐。在一些实施方案中,套件包括适用于储存病原体灭活的全血组合物的第三容器,其中第三容器包含(例如,包括)至少第一入口和第一出口,并且其中第三容器联接至第二容器。在一些实施方案中,套件还包括在第二容器的第一出口与第三容器的第一入口之间延伸(例如,并提供用于将全血组合物从第二容器转移(例如,在无菌条件下)到第三容器中的流体连通路径)的第四导管。在一些实施方案中,套件还包括用于将病原体灭活的全血组合物输注到受试者体内的输注管线组件,其中输注管线组件包括第二血管接入装置和在第二容器的第一出口(例如,尖嘴端口)与第二血管接入装置之间延伸的输注管线导管(例如,其中输注管线导管提供用于将病原体灭活的全血组合物从第二容器无菌转移至血管接入装置的流体连通路径)。在一些实施方案中,套件还包括用于将病原体灭活的全血组合物输注到受试者体内的输注管线组件,其中输注管线组件包括第二血管接入装置和在第三容器的第一出口(例如,尖嘴端口)与第二血管接入装置之间延伸的输注管线导管(例如,其中输注管线导管提供用于将病原体灭活的全血组合物从第三容器无菌转移至血管接入装置的流体连通路径)。在一些实施方案中,本公开的套件还包括可拆卸夹具、易碎连接器、在线过滤器和或采样容器(例如,采样袋、旁路转移袋)中的任何一个或多个。用于根据本文公开的方法制备病原体灭活的全血组合物的示例性套件的非限制性实例在图1a-1c、2a-2g、3a-3c、4a-4d和5a-5g中示出。图1a所示的示例性套件100包含(例如,包括):适用于混合全血组合物、病原体灭活化合物(pic)和任选的淬灭剂的第一容器105,其中第一容器包括第一入口110和第一出口115;包含病原体灭活化合物的容器120(pic容器);包含淬灭剂的容器125(淬灭剂容器);导管130,其被构造用于将pic容器120和淬灭剂容器125联接至第一容器105;以及任选的输注管线组件145(例如,被构造成联接至第一容器105的第一出口115),其用于将病原体灭活的全血组合物输注到受试者体内。在一些实施方案中,导管130在一端包括(例如,通过2通导管分支):(a)第一适配器135,其用于将pic容器联接(例如,被构造成将其联接)至导管,以及(b)第二适配器140,其用于将淬灭剂容器联接(例如,被构造成将其联接)至导管,并且其中导管被构造成联接至第一容器的第一入口110。在一些实施方案中,导管130被构造成直接联接至第一入口110。在一些实施方案中,导管130被构造成通过联接至任选的导管142(例如,从第一入口110延伸的导管142)而联接至第一入口110。在一些实施方案中,任选的输注管线组件145被构造成联接至第一容器105(例如,第一容器的第一出口115;通过尖嘴端口)。虚线指示,在一些实施方案中,可将全血(wb)组合物从血液采集容器150或在其中提供至套件100,并且可通过将血液采集容器(例如,从血液采集容器延伸的管152)联接(例如,无菌对接)至第一容器105的第一入口110(例如,直接联接至第一入口110,通过从第一入口110延伸的导管142联接)而将其添加到套件100的第一容器105中。在一些实施方案中,血液采集容器(150)可联接至第一容器(105)(例如,直接联接或联接至导管142),以允许将全血转移到第一容器中,然后将血液采集容器(150)与第一容器(105)断开连接,诸如使用管焊机,并将导管(130)联接至第一容器(105)(例如,直接联接或联接至导管142),以允许将病原体灭活化合物和淬灭剂转移至第一容器(105)。本公开的示例性套件的替代构造在图1b中示出。类似于图1a,示例性套件100包括:第一容器105,其包括第一入口110和第一出口115;pic容器120;淬灭剂容器125;导管130,其被构造用于将pic容器120和淬灭剂容器125联接至第一容器105;任选的输注管线组件145;并且任选地在导管130的一端包括(例如,通过导管分支):(a)用于将pic容器联接至导管的第一适配器135,以及(b)用于将淬灭剂容器联接至导管的第二适配器140。此构造还包括置换装置(例如,空气置换装置)155,其适用于改善(例如,增加)pic和淬灭剂向容器105中的转移(例如,通过导管130并进入容器105)。在一些实施方案中,置换装置(例如,空气置换装置)155联接至导管130(例如,通过3通导管分支),所述导管130在导管的端部包括分别用于联接pic容器120和淬灭剂容器125的第一适配器135和第二适配器140。用于本公开的套件和方法的置换装置的非限制性实例包括采样袋、旁路转移袋、气垫、球、注射器筒、含流体(例如,盐水)的容器等。虚线指示可通过血液采集容器150将全血(wb)组合物提供至套件100。本公开的示例性套件的替代构造在图1c中示出。类似于图1b,示例性套件100包括:第一容器105,其包括第一入口110和第一出口115;pic容器120;淬灭剂容器125;置换装置(例如,空气置换装置)155;导管130,其被构造用于将pic容器120和淬灭剂容器125联接至第一容器105;以及任选的输注管线组件145。此构造在导管130的一端(例如,通过导管分支)包括联接至导管的pic容器120、联接至导管的淬灭剂容器125,以及联接至导管的置换装置(例如,空气置换装置)155,其适用于改善(例如,增加)pic和淬灭剂向容器105中的转移(例如,通过导管130并进入容器105)。虚线指示可通过血液采集容器150将全血(wb)组合物提供至套件100。图2a所示的示例性套件200包含(例如,包括):适用于混合全血组合物、病原体灭活化合物(pic)和任选的淬灭剂的第一容器205,其中第一容器205包括第一入口210、第二入口212和第一出口215;包含病原体灭活化合物的容器220(pic容器);包含淬灭剂的容器225(淬灭剂容器);导管230,其在一端联接至第一容器205(例如,第一容器205的第二入口212)并且在另一端被构造用于联接pic容器220和淬灭剂容器225(例如,以分别在第一容器与pic容器220和淬灭剂容器225之间提供流体连通路径);以及任选的输注管线组件245,其用于将病原体灭活的全血组合物输注到受试者体内。在一些实施方案中,导管230在一端包括(例如,通过2通导管分支):(a)第一适配器235,其用于将pic容器联接(例如,被构造成将其联接)至导管230,以及(b)第二适配器240,其用于将淬灭剂容器联接(例如,被构造成将其联接)至导管230,并且其中导管(例如,在另一端)联接至第一容器205的第二入口212。在一些实施方案中,输注管线组件245被构造成联接至第一容器205(例如,第一容器的第一出口215;通过尖嘴端口)。虚线指示,可将全血(wb)组合物从血液采集容器250或在其中提供至套件200,并且可通过将血液采集容器(例如,从血液采集容器延伸的管252)联接(例如,无菌对接)至第一容器205的第一入口210(例如,直接联接至第一入口210,通过从第一入口210延伸的导管242联接)而将其添加到套件200的第一容器205中。本公开的示例性套件的替代构造在图2b中示出。类似于图2a,示例性套件200包括:第一容器205,其包括第一入口210、第二入口212和第一出口215;pic容器220;淬灭剂容器225;导管230,其在一端联接至第一容器205并且在另一端被构造用于联接pic容器220和淬灭剂容器225;任选的输注管线组件245;并且任选地在导管230的一端包括(例如,通过导管分支):(a)用于将pic容器联接至导管的第一适配器235;以及(b)用于将淬灭剂容器联接至导管的第二适配器240。此构造还包括置换装置(例如,空气置换装置)255,其适用于改善(例如,增加)pic和淬灭剂向容器205中的转移(例如,通过导管230并进入容器205)。在一些实施方案中,置换装置(例如,空气置换装置)255联接至导管230(例如,通过3通导管分支),所述导管230在导管的端部包括分别用于联接pic容器220和淬灭剂容器225的第一适配器235和第二适配器240。虚线指示可通过血液采集容器250将全血(wb)组合物提供至套件200。本公开的示例性套件的替代构造在图2c中示出。类似于图2b,示例性套件200包括:第一容器205,其包括第一入口210、第二入口212和第一出口215;pic容器220;淬灭剂容器225;置换装置(例如,空气置换装置)255;导管230,其将第一容器205与pic容器220和淬灭剂容器225联接(例如,并且在其间提供流体连通路径);以及任选的输注管线组件245。此构造在导管230的一端(例如,通过导管分支)包括联接至导管的pic容器220、联接至导管的淬灭剂容器225,以及联接至导管的置换装置(例如,空气置换装置)255,其适用于改善(例如,增加)pic和淬灭剂向容器205中的转移(例如,通过导管230并进入容器205)。虚线指示可通过血液采集容器250将全血(wb)组合物提供至套件200。本公开的示例性套件的替代构造在图2d中示出。类似于图2c,示例性套件200包括:第一容器205,其包括第一入口210、第二入口212和第一出口215;pic容器220;淬灭剂容器225;置换装置255;以及导管230,其将第一容器205与pic容器220和淬灭剂容器225联接(例如,并且在其间提供流体连通路径)。此构造还包括输注管线组件245,其中输注管线组件联接至第一容器205(例如,联接至第一出口215)。虚线指示可通过血液采集容器250将全血(wb)组合物提供至套件200。本公开的示例性套件的替代构造在图2e中示出。类似于图2d,示例性套件200包括:第一容器205,其包括第一入口210、第二入口212和第一出口215;pic容器220;淬灭剂容器225;置换装置255;导管230,其将第一容器205与pic容器220和淬灭剂容器225联接(例如,并且在其间提供流体连通路径);以及输注管线组件245。此构造还包括用于从供体中抽取全血(例如,抽取到容器205中)的血管接入装置260;以及在血管接入装置260与第一容器的第一入口210之间延伸的导管261。在一些实施方案中,血管接入装置260和导管261一起构成针头组件。在一些实施方案中,容器205包含抗凝剂(例如,抗凝剂溶液)265。本公开的示例性套件的替代构造在图2f中示出。类似于图2e,示例性套件200包括:第一容器205,其包括第一入口210、第二入口212和第一出口215;pic容器220;置换装置255;导管230,其将第一容器205与pic容器220联接(例如,并且在其间提供流体连通路径);输注管线组件245;血管接入装置260;以及导管261。在一些实施方案中,容器205包含抗凝剂265。本公开的示例性套件的替代构造在图2g中示出。类似于图2f,示例性套件200包括:第一容器205,其包括第一入口210、第二入口212和第一出口215;pic容器220;导管230,其将第一容器205与pic容器220联接(例如,并且在其间提供流体连通路径);输注管线组件245;血管接入装置260;以及导管261。在一些实施方案中,容器205包含抗凝剂265。图3a所示的示例性套件300包含(例如,包括):适用于混合全血组合物、病原体灭活化合物(pic)和任选的淬灭剂的第一容器305,其中第一容器包括第一入口310和第一出口315;适用于储存病原体灭活的全血组合物的第二容器307,其中第二容器307包括第一入口316和第一出口317,以及任选的第二出口319(例如,联接至或被构造成联接至旁路转移袋);包含病原体灭活化合物的容器320(pic容器);包含淬灭剂的容器325(淬灭剂容器);导管330,其被构造用于将pic容器320和淬灭剂容器325联接至第一容器305;联接第一容器305和第二容器307的导管332;以及任选的输注管线组件345,其用于将病原体灭活的全血组合物输注到受试者体内。在一些实施方案中,导管330在一端包括(例如,通过2通导管分支):(a)第一适配器335,其用于将pic容器联接(例如,被构造成将其联接)至导管,(b)第二适配器340,其用于将淬灭剂容器联接(例如,被构造成将其联接)至导管,并且其中导管被构造成联接至第一容器的第一入口310。在一些实施方案中,导管330被构造成直接联接至容器305的第一入口310。在一些实施方案中,导管330被构造成通过联接至任选的导管342(例如,从容器305的第一入口310延伸的导管342)而联接至第一入口310。在一些实施方案中,任选的输注管线组件345被构造成联接至第二容器307(例如,第二容器的第一出口317;通过尖嘴端口)。虚线指示,可将全血(wb)组合物从血液采集容器350或在其中提供至套件300,并且可通过将血液采集容器(例如,从血液采集容器延伸的管352)联接(例如,无菌对接)至第一容器305的第一入口310(例如,直接联接至第一入口310,通过从第一入口310延伸的导管342联接)而将其添加到套件300的第一容器305中。在一些实施方案中,血液采集容器350可联接至第一容器305,以允许将全血转移到第一容器305中,然后将血液采集容器350与第一容器305断开连接,诸如使用管焊机,并将导管330联接至第一容器305(例如,直接联接至第一入口310,通过从第一入口310延伸的导管342联接),以允许将病原体灭活化合物和淬灭剂转移至第一容器305。本公开的示例性套件的替代构造在图3b中示出。类似于图3a,示例性套件300包括:第一容器305,其包括第一入口310和第一出口315;pic容器320;淬灭剂容器325;导管330,其被构造用于将pic容器320和淬灭剂容器325联接至第一容器305;第二容器307,其包括第一入口316、第一出口317和任选的第二出口319;导管332;任选的输注管线组件345;并且任选地在导管330的一端包括(例如,通过导管分支):(a)用于将pic容器联接至导管的第一适配器335;以及(b)用于将淬灭剂容器联接至导管的第二适配器340。此构造还包括置换装置(例如,空气置换装置)355,其适用于改善(例如,增加)pic和淬灭剂向容器305中的转移(例如,通过导管330并进入容器305)。在一些实施方案中,置换装置(例如,空气置换装置)355联接至导管330(例如,通过3通导管分支),所述导管330在导管的端部包括分别用于联接pic容器320和淬灭剂容器325的第一适配器335和第二适配器340。虚线指示可通过血液采集容器350将全血(wb)组合物提供至套件300。本公开的示例性套件的替代构造在图3c中示出。类似于图3b,示例性套件300包括:第一容器305,其包括第一入口310和第一出口315;pic容器320;淬灭剂容器325;导管330,其被构造用于将pic容器320和淬灭剂容器325联接至第一容器305;置换装置(例如,空气置换装置)355;第二容器307,其包括第一入口316、第一出口317和任选的第二出口319;导管332;以及任选的输注管线组件345。此构造在导管330的一端(例如,通过导管分支)包括联接至导管的pic容器320、联接至导管的淬灭剂容器325,以及联接至导管的置换装置(例如,空气置换装置)355,其适用于改善(例如,增加)pic和淬灭剂向容器305中的转移(例如,通过导管330并进入容器305)。虚线指示可通过血液采集容器350将全血(wb)组合物提供至套件300。图4a所示的示例性套件400包含(例如,包括):适用于混合全血组合物、病原体灭活化合物(pic)和任选的淬灭剂的第一容器405,其中第一容器405包括第一入口410、第二入口412和第一出口415;适用于储存病原体灭活的全血组合物的第二容器407,其中第二容器包括第一入口416和第一出口417,以及任选的第二出口419(例如,联接至或被构造成联接至旁路转移袋);包含病原体灭活化合物的容器420(pic容器);包含淬灭剂的容器425(淬灭剂容器);导管430,其在一端联接至第一容器405(例如,第一容器405的第二入口412)并且在另一端被构造用于联接pic容器420和淬灭剂容器425(例如,以分别在第一容器405与pic容器420和淬灭剂容器425之间提供流体连通路径);联接第一容器405和第二容器407的导管432;以及任选的输注管线组件445,其用于将病原体灭活的全血组合物输注到受试者体内。在一些实施方案中,导管430在一端包括(例如,通过2通导管分支):(a)第一适配器435,其用于将pic容器420联接(例如,被构造成将其联接)至导管,(b)第二适配器440,其用于将淬灭剂容器425联接(例如,被构造成将其联接)至导管,其中导管(例如,在另一端)联接至第一容器405的第二入口412。在一些实施方案中,输注管线组件445被构造成联接至第二容器407(例如,第二容器的第一出口417;通过尖嘴端口)。虚线指示,可将全血(wb)组合物从血液采集容器450或在其中提供至套件400,可通过将血液采集容器(例如,从血液采集容器延伸的管452)联接(例如,无菌对接)至第一容器405的第一入口410(例如,直接联接至第一入口410,通过从第一入口410延伸的导管442联接)而将其添加到套件400的第一容器405中。本公开的示例性套件的替代构造在图4b中示出。类似于图4a,示例性套件400包括:第一容器405,其包括第一入口410、第二入口412和第一出口415;pic容器420;淬灭剂容器425;导管430,其在一端联接至第一容器405并且在另一端被构造用于联接pic容器420和淬灭剂容器425;第二容器407,其包括第一入口416、第一出口417和任选的第二出口419;导管432;任选的输注管线组件445;并且任选地在导管430的一端包括(例如,通过导管分支):(a)用于将pic容器420联接至导管的第一适配器435;以及(b)用于将淬灭剂容器425联接至导管的第二适配器440。此构造还包括置换装置(例如,空气置换装置)455,其适用于改善(例如,增加)pic和淬灭剂向容器405中的转移(例如,通过导管430并进入容器405)。在一些实施方案中,置换装置(例如,空气置换装置)455联接至导管430(例如,通过3通导管分支),所述导管430在导管的端部包括分别用于联接pic容器420和淬灭剂容器425的第一适配器435和第二适配器440。虚线指示可通过血液采集容器450将全血(wb)组合物提供至套件400。本公开的示例性套件的替代构造在图4c中示出。类似于图4b,示例性套件400包括:第一容器405,其包括第一入口410、第二入口412和第一出口415;pic容器420;淬灭剂容器425;置换装置(例如,空气置换装置)455;导管430,其将第一容器405与pic容器420和淬灭剂容器425联接(例如,并且在其间提供流体连通路径);第二容器407,其包括第一入口416、第一出口417和任选的第二出口419;导管432;以及任选的输注管线组件445。此构造在导管430的一端(例如,通过导管分支)包括联接至导管的pic容器420、联接至导管的淬灭剂容器425,以及联接至导管的置换装置(例如,空气置换装置)455,其适用于改善(例如,增加)pic和淬灭剂向容器405中的转移(例如,通过导管430并进入容器405)。虚线指示可通过血液采集容器450将全血(wb)组合物提供至套件400。本公开的示例性套件的替代构造在图4d中示出。类似于图4c,示例性套件400包括:第一容器405,其包括第一入口410、第二入口412和第一出口415;pic容器420;淬灭剂容器425;置换装置455;导管430,其将第一容器405与pic容器420和淬灭剂容器425联接(例如,并且在其间提供流体连通路径);第二容器407,其包括第一入口416、第一出口417和任选的第二出口419;以及导管432。此构造还包括输注管线组件445,其中输注管线组件联接至第二容器407(例如,联接至第二容器的第一出口417)。虚线指示可通过血液采集容器450将全血(wb)组合物提供至套件400。图5a所示的示例性套件500包含(例如,包括):适用于混合全血组合物、病原体灭活化合物(pic)和任选的淬灭剂的第一容器505,其中第一容器505包括第一入口510、第二入口512和第一出口515;用于从供体中抽取全血的血管接入装置560;在血管接入装置560与第一容器的第一入口510之间延伸的导管561;适用于储存病原体灭活的全血组合物的第二容器507,其中第二容器507包括第一入口516和第一出口517,以及任选的第二出口519;在第一容器505(例如,第一容器的第一出口)与第二容器507(例如,第二容器的第一入口)之间延伸的导管532;包含病原体灭活化合物的容器520(pic容器);包含淬灭剂的容器525(淬灭剂容器);导管530,其在一端联接至第一容器505(例如,第一容器505的第二入口512)并且在另一端被构造用于联接pic容器520和淬灭剂容器525(例如,以分别在第一容器505与pic容器520和淬灭剂容器525之间提供流体连通路径);以及任选的输注管线组件545,其用于将病原体灭活的全血组合物输注到受试者体内。在一些实施方案中,导管530在一端包括(例如,通过2通导管分支):(a)用于将pic容器520联接(例如,被构造成将其联接)至导管的第一适配器535;以及(b)用于将淬灭剂容器525联接(例如,被构造成将其联接)至导管的第二适配器540。在一些实施方案中,血管接入装置560和导管561一起构成针头组件。在一些实施方案中,输注管线组件545被构造成联接至第二容器507(例如,第二容器的第一出口517;通过尖嘴端口)。在一些实施方案中,容器505包含抗凝剂(例如,抗凝剂溶液)565。本公开的示例性套件500的替代构造在图5b中示出。类似于图5a,示例性套件500包括:第一容器505,其包括第一入口510、第二入口512和第一出口515;pic容器520;淬灭剂容器525;导管530,其在一端联接至第一容器505并且在另一端被构造用于联接pic容器520和淬灭剂容器525;第二容器507,其包括第一入口516、第一出口517和任选的第二出口519;导管532;血管接入装置560;导管561;任选的输注管线组件545;并且任选地在导管530的一端包括(例如,通过导管分支):(a)用于将pic容器520联接至导管的第一适配器535;以及(b)用于将淬灭剂容器525联接至导管的第二适配器540。此构造还包括置换装置(例如,空气置换装置)555,其适用于改善(例如,增加)pic和淬灭剂向容器505中的转移(例如,通过导管530并进入容器505)。在一些实施方案中,置换装置(例如,空气置换装置)555联接至导管530(例如,通过3通导管分支),所述导管530在导管的端部包括分别用于联接pic容器520和淬灭剂容器525的第一适配器535和第二适配器540。在一些实施方案中,容器505包含抗凝剂565。本公开的示例性套件500的替代构造在图5c中示出。类似于图5b,示例性套件500包括:第一容器505,其包括第一入口510、第二入口512和第一出口515;pic容器520;淬灭剂容器525;置换装置(例如,空气置换装置)555;导管530,其将第一容器505与pic容器520和淬灭剂容器525联接(例如,并且在其间提供流体连通路径);第二容器507,其包括第一入口516、第一出口517和任选的第二出口519;导管532;血管接入装置560;导管561;以及任选的输注管线组件545。此构造在导管530的一端(例如,通过导管分支)包括联接至导管的pic容器520、联接至导管的淬灭剂容器525,以及联接至导管的置换装置(例如,空气置换装置)555,其适用于改善(例如,增加)pic和淬灭剂向容器505中的转移(例如,通过导管530并进入容器505)。在一些实施方案中,容器505包含抗凝剂565。本公开的示例性套件500的替代构造在图5d中示出。类似于图5b,示例性套件500包括:第一容器505,其包括第一入口510、第二入口512和第一出口515;pic容器520;淬灭剂容器525;导管530,其在一端联接至第一容器505并且在另一端被构造用于联接pic容器520和淬灭剂容器525;置换装置555;第二容器507,其包括第一入口516、第一出口517和任选的第二出口519;导管532;血管接入装置560;导管561;输注管线组件545;并且任选地在导管530的一端包括(例如,通过导管分支):(a)用于将pic容器520联接至导管的第一适配器535;以及(b)用于将淬灭剂容器525联接至导管的第二适配器540。此构造包括输注管线组件545,其中输注管线组件联接至第二容器507(例如,联接至第二容器的第一出口515)。在一些实施方案中,容器505包含抗凝剂565。本公开的示例性套件500的替代构造在图5e中示出。类似于图5c,示例性套件500包括:第一容器505,其包括第一入口510、第二入口512和第一出口515;pic容器520;淬灭剂容器525;置换装置555;导管530,其将第一容器505与pic容器520和淬灭剂容器525联接(例如,并且在其间提供流体连通路径);导管532;第二容器507,其包括第一入口516、第一出口517和任选的第二出口519;血管接入装置560;导管561;以及联接至容器507的输注管线545。在一些实施方案中,容器505包含抗凝剂565。本公开的示例性套件500的替代构造在图5f中示出。类似于图5e,示例性套件500包括:第一容器505,其包括第一入口510、第二入口512和第一出口515;pic容器520;置换装置555;导管530,其将第一容器505与pic容器520联接(例如,并且在其间提供流体连通路径);导管532;第二容器507,其包括第一入口516、第一出口517和任选的第二出口519;血管接入装置560;导管561;以及联接至容器507的输注管线组件545。在一些实施方案中,容器505包含抗凝剂565。本公开的示例性套件500的替代构造在图5g中示出。类似于图5f,示例性套件500包括:第一容器505,其包括第一入口510、第二入口512和第一出口515;pic容器520;导管530,其将第一容器505与pic容器520联接(例如,并且在其间提供流体连通路径);导管532;第二容器507,其包括第一入口516、第一出口517和任选的第二出口519;血管接入装置560;导管561;以及联接至容器507的输注管线组件545。在一些实施方案中,容器505包含抗凝剂565。如本文所述,在导管(例如,管)被描述为在例如套件(例如,套件的处理装置)的两个容器(例如,袋子)之间联接或延伸(例如,连接)时,应当理解,导管可通过两个容器(例如,袋子)之间的连接处的另一部件或连接器接合在它们之间的某个点处。例如,通过导管联接(例如,连接)至第一容器的血液采集容器包括其中导管在两个容器之间包括过滤器(例如,白细胞减少过滤器),即,管被过滤器分开,使得流体通过导管和过滤器从一个容器流动(例如,无菌转移)至另一个容器的情况。可替代地或除此之外,容器之间的导管允许流体从一个容器流动至另一个容器(例如,流体连通路径,无菌转移),其可以被阻塞,以防止流动,直到必要或期望为止,例如作为处理的一部分,可防止一个容器中的流体流动至下一个容器,直到方法中的下一步骤需要或期望(例如,可打开的流体连通路径)。由于这样的可打开密封件,诸如夹具、塞子、阀门等包括在连接容器的导管中或导管上,其中夹具、塞子、阀门等可以根据需要选择性地打开,例如以将流体从一个容器转移至下一个容器。在某些实施方案中,容器之间的导管包括可破裂密封件,诸如可破裂阀门或易碎连接器,由此可破裂密封件的破裂允许血液制品溶液通过导管在容器之间流动。应当理解,可破裂密封件包含在容器之间的连接处内,使得系统的无菌性得以维持。还应理解,包括过滤器或可破裂密封件的导管包括其中导管可被过滤器或密封件中断的情况,例如,导管从一个容器延伸并连接至过滤器或密封件(导管的流入部分(incomingportion)),并且导管从过滤器或密封件的另一部分继续延伸至另一容器(导管的流出部分(outgoingportion))。在这样的构造中,流体从第一容器流过导管的流入部分、流过过滤器或密封件,并流过导管的流出部分并流入另一容器中。在某些实施方案中,导管与容器的入口或出口(例如,端口)之间的联接或连接,或入口或出口本身,可包括可破裂或可刺穿的密封件,诸如可破裂阀门或易碎连接器或尖嘴端口,由此密封件的破裂或刺穿允许血液制品溶液在导管与容器之间流动(例如,无菌转移)。病原体灭活处理装置内的不同容器(例如,袋子)可以用于方法的不同步骤。例如,待用于全血组合物的病原体灭活的容器的系统可以包括其中包含病原体灭活化合物的容器、其中包含淬灭剂的容器、用于接收全血单位(例如,全血捐献物)以及病原体灭活化合物和淬灭剂的容器(例如,第一容器),以及用于包含最终全血制品的一个或多个容器(例如,称为制品袋、储存袋),所述最终全血制品即一个或多个病原体灭活的全血单位(例如,治疗剂量单位),其病原体灭活化合物和/或其副产物的浓度降低至低于期望浓度,随时可用或可以储存以用于后期使用。血液容器通常可以设计成容纳各种体积的流体,包括但不限于在50ml至2升范围内的体积,例如具有最高至约350ml容量、450ml容量、500ml容量、600ml容量、700ml容量、800ml容量、900ml容量、1升容量、最高至1.5升容量或最高至2升容量。系统中的每个袋子通常由塑料材料制成。例如,用于包含病原体灭活化合物溶液的容器可以由合适的塑料(诸如pl2411(baxterhealthcare))或其他塑料(诸如聚氯乙烯、聚烯烃、乙烯-乙酸乙烯酯、与其他塑料共混的乙烯-乙酸乙烯酯等)制成。合适的袋子材料例如在pct公布号wo2003078023和美国专利7025877中进行了讨论,所述专利涉及此类袋子材料和相关材料的公开内容据此以引用方式并入。在所有情况下,用于制备处理装置的材料应可通过已知方法灭菌,诸如用于确保处理装置无菌的蒸汽和伽马或电子束辐射。尽管这些是用于制造袋子的示例性材料,但是本文描述的方法适用于使用对于本领域技术人员来说将容易获得的任何合适的袋子材料的工艺,并且也可以与除袋子以外的容器一起使用。本文使用的袋子可设计成允许诸如氧气和二氧化碳的气体进出血袋,使得其中的血液制品在处理和储存期间具有足够的氧气供应和二氧化碳水平。本公开还提供了一种将全血输注到有需要的受试者(例如,人受试者)体内的方法,其包括将前述病原体灭活的全血组合物或前述治疗剂量单位的病原体灭活的全血输注到受试者体内。本领域技术人员还应理解,在不脱离本公开的范围的情况下,可对本文所述的具体实施的形式和细节做出改变。另外,尽管已经参考各种具体实施描述了各种优点、方面和目标,但是本公开的范围不应受到对此类优点、方面和目标的提及的限制。相反,本公开的范围应参考随附权利要求来确定。本发明通过以下实施例进一步说明,所述实施例不应解释为将本发明的范围或精神局限于它们所描述的具体程序。实施例实施例1:制备病原体灭活的全血在本公开的套件中,使用病原体灭活化合物阿马他林和淬灭剂谷胱甘肽制备病原体灭活的全血(henschler等人,2011,transfusmedhemother38:33–42),所述套件包括处理容器和具有3通分支以用于引入阿马他林/gsh(例如,“过滤器组”)的管,其包括两个用于联接(例如,连接)pic和淬灭剂的容器(例如,注射器)的在线过滤器,以及联接至(例如,连接至)样品旁路转移袋的第三分支(例如,图3b)。更具体地,将包含抗凝剂的四个abo匹配的全血单位汇集并分成8个半单位(225ml/半单位),通过借助管并使用管焊机将包含全血的汇集的供体血袋连接至处理容器而添加到八个处理袋中的每一个中。在将全血转移到处理容器中之后,通过密封并切断管将汇集的供体血袋移除,并且使用管焊机将过滤器组通过其余管无菌联接至处理容器的相同输入端口。分别添加阿马他林和gsh至0.2mm和2.0mm的最终浓度。首先添加gsh,然后在gsh添加的5分钟内或在至少15分钟的保持时间后添加阿马他林,如表1所示。将混合物在22℃(单位1-4)或25℃(单位5-8)下孵育,在所指示的时间取出样品,通过液相色谱-质谱法(lcms)进行分析,以确定残余的未反应阿马他林的水平。表1:病原体灭活的全血中的残余阿马他林水平(nm)单位gsh21hr24hr27hr30hr33hr36hr42hr1>15min3.502.622.272.112.611.621.302>15min4.092.663.072.952.291.381.353<5min3.453.043.292.672.161.731.664<5min3.853.533.72.842.221.411.575>15min2.912.442.552.041.761.891.626>15min3.212.582.712.491.471.871.227<5min3.432.862.742.341.642.281.118<5min4.153.393.302.592.831.972.96此外,在24hr时从单位2和8中的每一个中取出50ml混合物并且在独立容器中分成两份25ml样品,以比较在4℃相对于室温下的储存情况,并用于评估在那些条件下储存2、4、6和8小时时的残余阿马他林水平(表2)。表2:病原体灭活的全血中的残余阿马他林水平(nm)单位温度2hr4hr6hr8hr2室温bloqbloqbloqblo8室温bloqbloqbloqbloq24℃1.691.661.491.0984℃2.691.771.891.64bloq=低于定量限(例如,<0.75nm)如表1所示,在21hr时,残余阿马他林水平在2.91至4.15nm浓度的范围内,并且在最终42hr采样时间时进一步降低至1.11至2.96nm的范围。相比之下,令人惊讶地观察到,在21hr时将处理混合物从单位2和8转移至不同容器,然后在室温下进一步储存导致残余阿马他林减少至低于定量限(表2),这无法通过初始单位在处理容器中于22℃或25℃下继续孵育来实现(表1)。转移并在4℃下孵育不导致残余阿马他林的同等下降(表2)。这些结果表明转移步骤和在室温下进一步孵育对残余阿马他林水平的影响。实施例2:制备病原体灭活的全血在使用允许自初始(例如,第一)容器的一个或两个转移步骤的本公开的3容器套件和与实施例1类似的过滤器组进行全血的病原体灭活之后,进行另一项研究以评估容器转移对残余阿马他林水平的影响。将处于抗凝剂中的六个abo匹配的全血单位汇集并分成六个~450ml单位,将其转移到套件的包含transfufol3226pvc膜(renolit)的第一血袋容器中,然后断开并密封汇集的供体血袋,并且随后通过将过滤器组管焊接至第一容器的相同输入端口(例如,附接管)进行连接,以将阿马他林和gsh转移到全血中。将阿马他林和gsh添加至全血单位,最终浓度分别为0.2mm和2.0mm,然后将混合物转移至第二袋(transfufol3226pvc膜),并在22℃下孵育。在22hr时,获取样品进行分析,并将混合物转移至第三袋(transfufol3226pvc膜),然后在22℃下进一步孵育,并在24hr(即,最终转移后2hr)和26hr(即,最终转移后4hr)时获取另外的样品进行分析。表3:病原体灭活的全血中的残余阿马他林水平(nm)bloq=低于定量限(例如,<0.75nm)如先前所述,通过lcms分析样品以确定残余的未反应阿马他林的水平。如表3中所示,在将阿马他林/gsh添加至全血后立即将混合物转移至第二袋并随后在22℃下孵育22hr显示出1.35至1.96nm的残余阿马他林水平。在孵育至22hr之后将混合物转移至第三袋,随后在22℃下再进一步孵育2hr(24hr列)或4hr(26hr列)之后,所有样品的残余阿马他林水平降低至低于1nm并且在除一个样品之外的所有样品中降低至低于定量限。实施例3:制备病原体灭活的全血在另一项研究中,在本公开的1容器或3容器套件中,使用阿马他林和gsh制备病原体灭活的全血,其中3容器套件包括来自三种不同来源(例如,不同的塑料材料)的第二和第三袋(例如,转移/储存容器)。三个不同的转移/储存容器包括600ml容器(包含transfufol3226pvc膜(“pvc1”))、来自不同制造商的第二600ml容器(包含transfufol3226pvc膜(“pvc2”))和来自cerus的750ml容器(包含eva(乙烯-乙酸乙烯酯)1800膜(“eva”))。将处于抗凝剂中的六个abo匹配的全血单位汇集并分成七个单位,各自在容器之间没有转移步骤(例如,在1容器套件中执行的处理)或在所指示的储存/转移袋来源的容器之间存在两个转移步骤(例如,在3容器套件中执行的处理)的条件下,对七个全血单位进行病原体灭活(表4)。如先前所述,通过将过滤器组无菌对接至包含全血的第一容器的输入端口的管,将阿马他林和gsh添加至全血单位。在第一容器中,以最终浓度分别为0.2mm和2.0mm的阿马他林和gsh处理单位1,并在22℃下孵育,在18、20、22和24小时时获取样品,不存在容器转移。对于单位2-7,在第一容器中向全血中添加阿马他林和gsh(最终浓度分别为0.2mm和2.0mm),然后转移至第二容器并在22℃下孵育18小时。在18小时时,获取样品,并将混合物转移至第三容器,并在22℃下进一步孵育,以2小时的间隔(20、22和24hr)进行另外采样。表4:病原体灭活的全血中的残余阿马他林水平(nm)单位转移袋转移*18hr20hr22hr24hr1n/a无2.161.991.461.542pvc12x1.750.88bloqbloq3pvc12x1.520.78bloqbloq4pvc22x1.480.87bloqbloq5pvc22x1.450.85bloqbloq6eva2x3.111.14bloqbloq7eva2x3.511.22bloqbloq*无转移=1袋套件;2x转移=3袋套件bloq=低于定量限(例如,<0.75nm)如先前所述,通过lcms分析所有样品以确定残余的未反应阿马他林的水平。如表4所示,单位2-5的18hr时的残余阿马他林水平最低,其中在18hr孵育之前,已经将全血/阿马他林/gsh混合物转移至3容器套件中的两个容器类型中的一个,但对于第三容器类型(单位6-7)并非如此。在18hr时进行第二次转移(即,转移至第三容器)并在22℃下进一步孵育之后,对于具有两种不同容器类型的套件来说,20hr时间点(即,袋转移后2小时)的残余阿马他林小于1nm,并且对于具有第三容器类型的套件来说,其接近1nm。在22hr和24hr时(即,袋转移后孵育4或6小时),在3容器套件(具有三种不同容器类型中的每一种)中处理的所有样品的残余阿马他林水平均低于定量限。相比之下,在使用1容器装置且不存在转移的情况下处理之后,20、22和24hr时的阿马他林水平保持在1.54至1.99nm的范围内。实施例4:制备病原体灭活的全血进行另一项研究以评估在本公开的1容器、2容器或3容器套件中,使用阿马他林和gsh对病原体灭活的全血的制备。将处于抗凝剂中的六个abo匹配的全血单位汇集并分成七个的单位。在以下三种条件中的一种下对七个全血单位进行病原体灭活-容器之间没有转移步骤、在两个容器之间具有一个转移步骤,或在三个容器之间具有两个转移步骤(表5)。如先前所述,通过将过滤器组无菌对接至包含全血的第一容器的输入端口的管,将阿马他林和gsh添加至全血单位。在第一容器中,以最终浓度分别为0.2mm和2.0mm的阿马他林和gsh处理单位1,并在22℃下孵育,在20、22、24和26小时时获取样品,不存在进一步的容器转移。对于单位2-4,在第一容器中向全血中添加阿马他林和gsh(最终浓度分别为0.2mm和2.0mm)并在22℃下孵育20小时。在20小时时获取样品,并转移至第二袋,并且在22℃下进一步孵育,以2小时的间隔(22、24和26hr)进行另外采样。对于单位5-7,在第一容器中向全血中添加阿马他林和gsh(最终浓度分别为0.2mm和2.0mm),并且将混合物转移至第二容器,然后在22℃下孵育20小时。在20小时时获取样品,并转移至第三袋,并且在22℃下进一步孵育,以2小时的间隔(22、24和26hr)进行另外采样。表5:病原体灭活的全血中的残余阿马他林水平(nm)单位转移*20hr22hr24hr26hr1无1.471.541.391.3221x1.53bloqbloqbloq31x1.65bloqbloqbloq41x1.66bloqbloqbloq52x1.53bloqbloqbloq62x1.47bloqbloqbloq72x1.46bloqbloqbloq*无转移=1袋套件;1x转移=2袋套件;2x转移=3袋套件bloq=低于定量限(例如,<0.75nm)如先前所述,通过lcms分析样品以确定残余的未反应阿马他林的水平。如表5所示,使用2容器和3容器套件对全血进行pi处理后,阿马他林的水平低于定量限,而使用1容器套件时,处理后的阿马他林水平保持在1.32至1.54nm的范围内。实施例5:制备病原体灭活的全血进行另一项研究,以评估在本公开的2容器套件中使用阿马他林和gsh制备病原体灭活的全血的另外的条件(例如,图3b)。在第一容器中向全血单位中添加阿马他林和gsh,最终浓度分别为0.2mm和2.0mm。然后将混合物在第一容器(例如,处理容器)中在22℃下孵育18、20或22hr,然后转移至第二容器,其中如表6所指示的那样获取样品进行分析,直到转移至第二容器的时间点为止。转移至第二容器后,将混合物在22℃下进一步孵育,并以2hr的间隔采样进行分析,如表6所示。表6:病原体灭活的全血中的残余阿马他林水平(nm)单位转移时间18hr20hr22hr24hr26hr118hr1.512.512.012.220.98218hr1.211.060.910.75bloq318hr1.071.040.81bloqbloq418hr1.051.021.03bloqbloq518hr34.508.291.671.06bloq618hr3.451.641.790.95bloq718hr2.042.082.041.35bloq820hrn/a1.711.271.501.21920hrn/a1.290.79bloqbloq1020hrn/a1.480.890.91bloq1120hrn/a1.290.780.86bloq1220hrn/a1.920.910.86bloq1320hrn/a1.820.900.78bloq1420hrn/a**1.130.950.771522hrn/an/a1.52bloqbloq1622hrn/an/a1.63bloqbloq1722hrn/an/a1.78bloqbloq1822hrn/an/a2.21bloqbloq1922hrn/an/a4.29bloqbloq2022hrn/an/a2.76bloqbloq2122hrn/an/a3.27bloqbloqbloq=低于定量限(例如,<0.75nm)**样品不可用于分析如先前所述,通过lcms分析样品以确定残余的未反应阿马他林的水平。如表6所示,并且与对照单位1、8和14相比较,在20或22hr时通过转移步骤最一致地实现了在pi处理后阿马他林的水平降低至低于1nm或更低(例如,低于定量限)。实施例6:采集和制备病原体灭活的全血在一些实施方案中,本公开的全血病原体灭活套件被设计用于将全血从供体直接采集到套件的第一容器(例如,处理容器)中,从而消除了将全血采集到供体血袋中并且接着将包含全血的供体血袋连接至套件的需要。例如,如本文所提供的1容器、2容器或3容器套件还可包括通过一个或多个柔性管段与套件的处理容器(例如,包含抗凝剂)联接的一体血管接入装置,诸如静脉穿刺针头(例如,图5a-5d)。在此构造中,将全血从供体直接抽取到套件的处理容器中,添加病原体灭活化合物,与全血混合,并在同一容器中孵育。进行研究以展示直接在来自可商购获得的采集装置的血液采集容器中用阿马他林和gsh处理全血的可行性。更具体地,从供体采集全血单位,并在包含抗凝剂并集成到本公开的套件中的teruflex(terumo,bb*agd506a2)血液采集袋(单位2-7)或leucoflex(macopharma,lqe7230ld)血液采集袋(单位9-14)中进行处理。将六个abo匹配的全血单位汇集并分成对照单位和六个测试单位,各自~450ml。对照单位1和8使用先前实施例中描述的套件。将如先前所述的过滤器组无菌对接至已密封并断开的容器的全血转移管,然后添加阿马他林和gsh至分别为约0.2mm和2.0mm的最终浓度。首先添加gsh,然后在30分钟内添加阿马他林。然后将混合物在22℃下孵育20hr,获取样品进行分析并将混合物转移到第二一体连接的容器中(对于测试单位2-7和9-14),然后进一步孵育并以2hr的间隔(即,22hr、24hr)采样(对于所有单位),如表7所示。表7:病原体灭活的全血中的残余阿马他林水平(nm)单位采集袋20hr22hr24hr1t2.351.611.812t1.29bloqbloq3t1.62bloqbloq4t1.53bloqbloq5t1.92bloqbloq6t2.12bloqbloq7t2.32bloqbloq8m2.621.931.859m1.36bloqbloq10m1.32bloqbloq11m1.44bloqbloq12m1.34bloqbloq13m1.49bloqbloq14m1.40bloqbloqbloq=低于定量限(例如,<0.75nm)在20hr时通过lcms分析病原体灭活的全血制剂中的残余阿马他林水平并且发现转移至第二袋的每个单位的所述残余阿马他林水平均低于定量限。在另一个实例中,使用包括处理容器和用于引入阿马他林/gsh的过滤器组(例如,上文所述)的2容器套件(例如,图8c)将450ml全血通过第一入口端口从供体采集到包含63ml抗凝剂cpda-1的第一容器中(例如,血液:抗凝剂比为大约7:1)。然后使用医用管夹封闭采集管线,并将全血和抗凝剂溶液混合。接下来将病原体灭活化合物阿马他林和淬灭剂gsh通过第二端口添加到第一容器中的全血中,最终浓度分别为约0.2mm和2.0mm。将全血、pic和淬灭剂的混合物在22℃下孵育20小时,然后将混合物转移至第二容器,夹住第一容器与第二容器之间的管,并且将混合物在22℃下再孵育2-4小时,以提供病原体灭活的全血单位。通过从第二容器中采样并进行lcms分析来确定病原体灭活的全血制剂中的残余阿马他林水平,以证明其水平低于1nm(例如,低于0.75nm的定量限)。实施例7:输注病原体灭活的全血使用本领域已知的标准输血方法,将如本文所提供的所制备的病原体灭活的全血(例如,abo相容、rhd相容、o型)输注到有需要的受试者体内(例如,用于创伤复苏)。更具体地,在一个实例中,将可商购获得的输血管线(例如,具有一体过滤器的输血管线组件)通过尖嘴端口出口连接至套件的第二容器,所述第二容器包含如上所述制备的病原体灭活的全血。根据这种输注的公认医学实践,通过重力流动将病原体灭活的全血的单位从套件输注到由创伤引起急性出血的受试者体内。根据需要输注另外的病原体灭活的全血单位。实施例8:制备病原体灭活的rbc和冷沉淀病原体灭活的全血可用于生产血液制品,诸如病原体灭活的红细胞(rbc)、血浆和/或冷沉淀制剂。更具体地,在一个实例中,对如先前所述产生的病原体灭活的全血制剂在分离rbc和血浆的条件下进行离心。更具体地,将病原体灭活的全血单位在4℃下以4200g离心10分钟,以将血浆与rbc分离,然后使用吸取装置(expressiondevice)移除大部分血浆层,并将其转移到与浓厚rbc浓缩物(packedrbcconcentrate)分开的容器中。用rbc维持少量血浆,以产生具有期望血细胞比容(例如60%)的单位,并将rbc单位冷藏在1-6℃下。然后将病原体灭活的血浆单位冷冻在-30℃下,以用于制备冷沉淀。另外,进行研究以评估由病原体灭活的全血组合物制备的血浆和红细胞,这在制备血浆和红细胞组分之前,在全血pi处理过程之后不久,或在将病原体灭活的全血储存在4℃下之后进行。将供体全血单位汇集并分成七个单位(例如,以使单位之间标准化),并使其经受如下处理条件。单位1是对照并且仅用盐水处理,而单位2-7用浓度分别为约0.2mm和2.0mm的阿马他林和gsh处理。将阿马他林和gsh或盐水添加在第一容器(袋子)中之后,将所述单位在22℃下孵育22小时,然后转移至第二容器(袋子)。在转移时以及24小时和26小时(转移后2或4小时,也在22℃下孵育)时进行采样,以分析残余阿马他林、溶血和/或纤维蛋白原以及因子viii的水平。在转移后(并进一步孵育)4小时,接着将单位1-4储存在4℃,而通过在22℃下以3800rpm离心6分钟将单位5-7分离为血浆和红细胞组分,并且接着在与血浆分离后,向红细胞组分中添加sagm添加剂溶液。然后对来自单位5-7的血浆组分采样,以进行纤维蛋白原和因子viii分析(例如,使用标准分析方法),并将血浆组分储存在4℃。对来自单位5-7的红细胞组分采样,以进行残余阿马他林和溶血分析,并且将红细胞组分也储存在4℃。在第2天、第5天和第7天也进行血浆和红细胞组分的采样。此外,在第2天、第5天和第7天,从储存的病原体灭活的全血中取出样品、离心以获得血浆和红细胞,并进行类似分析。残余阿马他林浓度(nm)在下表8中示出,并且纤维蛋白原和因子viii的水平在表9a和9b中示出。溶血水平在可接受范围内并且未示出。用于分析的其他血浆凝固因子和/或特性可包括例如因子ii、因子v、因子vii、因子ix、因子x、因子xi、pt、ptt和/或tt。表8:病原体灭活的全血中的残余阿马他林水平(nm)单位22hr24hr26hr21.39bloqbloq31.350.75bloq41.96bloqbloq51.84bloqbloq61.55bloqbloq71.46bloqbloqbloq=低于定量限(例如,<0.75nm)表9a:来自病原体灭活的全血的血浆中的纤维蛋白原和因子viii表9b:来自病原体灭活的全血的血浆中的纤维蛋白原和因子viii为了制备冷沉淀,将由病原体灭活的全血制备的冷冻血浆的单位在温度控制为4℃的水浴中解冻,总解冻时间大约为4小时30分钟。然后将解冻的单位在4℃下以4200rcf离心12分钟,并缓慢减速。从冷沉淀中移除冷沉淀减少的血浆上清液,同时维持少量血浆以用于冷沉淀的重悬。重悬后,可将冷沉淀单位用于输注或冷冻以储存于-30℃。所公开的实例和本文公开的实施方案进一步描述了用于制备病原体灭活的全血组合物和其他病原体灭活的血液制品组合物(包括例如病原体灭活的全血和其他适用于输注到个体体内的血液制品组合物)的方法、套件和组合物。阐述了所例示的部件和步骤以解释所示出的示例性实施方案,并且应该预料到,正在进行的技术开发将改变执行特定功能的方式。这些实例在本文中出于说明而非限制的目的给出。此外,为了便于描述,本文已对功能构建区块的边界进行了任意限定。可以限定替代边界,只要适当地执行特定功能及其关系即可。基于本文包含的教导,替代方案(包括本文描述的那些的等同物、扩展、变型、偏差等)对于相关领域的技术人员将是显而易见的。此类替代方案落入所公开实施方案的范围和精神内。尽管已经参考附图充分描述了实施方案,但是应当注意,各种改变和修改对于本领域技术人员将是显而易见的。此类改变和修改应理解为包括在如随附权利要求所限定的各种实施方案的范围内。本文引用的所有参考文献,包括出版物、专利申请和专利据此以引用方式并入,其程度如同每个参考文献单独且具体地被指明以引用方式并入并且以其全文在本文阐述的那样。除非本文另外指明或与上下文明显矛盾,否则术语“一个/种(a/an)”和“所述”以及类似指称(尤其在以下权利要求的上下文中)的使用应理解为涵盖单数和复数。除非另外指出,否则术语“包含(comprising)”、“具有(having)”、“包括(including)”以及“含有(containing)”应理解为开放性术语(即,意指“包括但不限于”)。无论在何处使用开放性术语描述特征或元件,都特别考虑了可以使用封闭性术语代替开放性术语,而不背离本公开的精神和范围。除非本文另外指明,否则在本文中值的范围的叙述仅旨在用作单独指代落入该范围内的各独立值的速记方法,并且各独立值如同其在本文单独叙述一样并入本说明书中。本文中对“约”一个值或参数的提及包括(并且描述)针对所述值或参数本身的变型。例如,提及“约x”的描述包括对“x”的描述。本文所述的所有方法可以任何合适的顺序执行,除非本文另外指明或以其他方式与上下文明显矛盾。本文提供的任何和所有实例或示例性语言(例如,“诸如”)的使用仅旨在更好地阐明本说明书并且不对本说明书的范围产生限制,除非另外要求保护。本说明书中的语言不应解释为指示任何非要求保护的元素对于本文所公开的方法、系统和组合物的实践是必要的。本文描述了优选实施方案。在阅读上述描述后,那些优选实施方案的变型可对本领域技术人员变得显而易见。预期熟练技术人员将能够适当地采用此类变型,以及除本文所具体描述的之外的本文所述方法、系统和组合物的实践。因此,本文所述的方法、系统和组合物包括适用法律所允许的在此所附权利要求中所引用的主题的所有修改和等同物。此外,本说明书涵盖了其所有可能变型中的上述元素的任何组合,除非本文另外指明或以其他方式与上下文明显矛盾。以下是本公开的具体实施方案的列表。列表是示例性的,并且不旨在限制本文提供的公开内容。实施方案1.一种制备病原体灭活的全血组合物的方法,其包括:(a)在第一容器中混合(i)全血组合物;(ii)有效量的病原体灭活化合物(pic);以及(iii)任选的有效量的淬灭剂;(b)在所述第一容器中孵育所述全血组合物、所述pic和任选的所述淬灭剂的混合物,其条件和持续时间足以灭活病原体,如果存在的话;(c)在无菌条件下将所述混合物转移至第二容器;以及(d)在所述第二容器中孵育所述混合物,其条件和持续时间足以使所述pic的浓度降低至(i)比转移步骤(b)时所述混合物中所述pic的浓度小至少25%的浓度;(ii)比步骤(a)的所述混合物中所述pic的浓度小至少105倍的浓度;和/或(iii)为约1nm或更少的浓度,从而产生所述病原体灭活的全血组合物。实施方案2.如实施方案1所述的方法,其中步骤(a)的所述混合物中所述pic的浓度为至少约0.1mm。实施方案3.如实施方案1或实施方案2所述的方法,其中步骤(a)的所述混合物中所述pic的浓度为约0.1mm至约1.0mm。实施方案4.如实施方案1-3中任一项所述的方法,其中步骤(a)的所述混合物中所述pic的浓度为约0.2mm。实施方案5.如实施方案1-4中任一项所述的方法,其中步骤(d)之后所述pic的浓度小于约2nm。实施方案6.如实施方案1-5中任一项所述的方法,其中步骤(d)之后所述pic的浓度小于约1nm。实施方案7.如实施方案1-6中任一项所述的方法,其中所述pic包含作为或形成反应性亲电子基团的官能团。实施方案8.如实施方案7所述的方法,其中所述官能团选自由以下组成的组:芥子、芥子中间体和芥子等同物。实施方案9.如实施方案7或实施方案8所述的方法,其中所述官能团是或能够形成吖丙啶鎓离子。实施方案10.如实施方案1-9中任一项所述的方法,其中所述反应性亲电子基团能够与核酸反应。实施方案11.如实施方案1-10中任一项所述的方法,其中所述pic包含核酸结合配体。实施方案12.如实施方案11所述的方法,其中所述核酸结合配体是嵌入剂。实施方案13.如实施方案12所述的方法,其中所述嵌入剂是吖啶。实施方案14.如实施方案11-13中任一项所述的方法,其中所述pic包含连接所述官能团和所述核酸结合配体的易碎接头。实施方案15.如实施方案1-14中任一项所述的方法,其中所述pic是β-丙氨酸,n-(吖啶-9-基),2-[双(2-氯乙基)氨基]乙基酯。实施方案16.如实施方案1-15中任一项所述的方法,其中步骤(a)包括在所述第一容器中混合全血组合物、有效量的pic和有效量的淬灭剂。实施方案17.如实施方案16所述的方法,其中步骤(a)的所述混合物中所述淬灭剂的浓度为至少约1mm。实施方案18.如实施方案16或实施方案17所述的方法,其中步骤(a)的所述混合物中所述淬灭剂的浓度为约1mm至约10mm。实施方案19.如实施方案16-18中任一项所述的方法,其中步骤(a)的所述混合物中所述淬灭剂的浓度为约2mm。实施方案20.如实施方案16-19中任一项所述的方法,其中步骤(a)的所述混合物中所述pic的浓度为约0.2mm并且步骤(a)的所述混合物中所述淬灭剂的浓度为约2mm。实施方案21.如实施方案16-20中任一项所述的方法,其中所述淬灭剂包含巯基,其中所述巯基能够与所述病原体灭活化合物的所述反应性亲电子基团反应。实施方案22.如实施方案16-21中任一项所述的方法,其中所述淬灭剂包含半胱氨酸或半胱氨酸的衍生物。实施方案23.如实施方案16-22中任一项所述的方法,其中所述淬灭剂是谷胱甘肽或其药学上可接受的盐。实施方案24.如实施方案16-23中任一项所述的方法,其中所述淬灭剂是谷胱甘肽单钠盐。实施方案25.如实施方案1-24中任一项所述的方法,其中步骤(a)的所述混合物还包含抗凝剂。实施方案26.如实施方案1-25中任一项所述的方法,其中所述全血组合物还包含抗凝剂。实施方案27.如实施方案1-25中任一项所述的方法,其中所述第一容器包含抗凝剂并且所述全血组合物与所述抗凝剂在所述第一容器中混合。实施方案28.如实施方案1-27中任一项所述的方法,其中所述全血组合物具有约250ml至约700ml的体积。实施方案29.如实施方案25-28中任一项所述的方法,其中所述全血组合物中抗凝剂与全血的比率为约1:5至约1:9。实施方案30.如实施方案1-29中任一项所述的方法,其中通过所述第一容器的第一入口将所述全血组合物添加到所述第一容器中。实施方案31.如实施方案1-30中任一项所述的方法,其中将所述全血组合物从包含所述全血组合物的供体采集容器添加到所述第一容器中。实施方案32.如实施方案1-30中任一项所述的方法,其中通过将所述全血组合物从全血供体采集到所述第一容器中来将所述全血组合物添加到所述第一容器中。实施方案33.如实施方案32所述的方法,其中通过在血管接入装置与所述第一容器的第一入口之间延伸并提供用于将所述全血组合物从所述血管接入装置转移到所述第一容器中的流体连通路径的第一导管将所述全血组合物从全血供体采集到所述第一容器中。实施方案34.如实施方案1-33中任一项所述的方法,其中通过所述第一容器的第一入口将所述pic和任选的所述淬灭剂添加到所述第一容器中。实施方案35.如实施方案1-33中任一项所述的方法,其中通过所述第一容器的第二入口将所述pic和任选的所述淬灭剂添加到所述第一容器中。实施方案36.如实施方案34或实施方案35所述的方法,其中通过导管将所述pic和任选的所述淬灭剂添加到所述第一容器中,所述导管在包含所述pic的容器(pic容器)和任选的包含所述淬灭剂的容器(淬灭剂容器)与所述第一容器的入口之间延伸并提供用于将所述pic从所述pic容器转移到所述第一容器中并且任选地用于将所述淬灭剂从所述任选的淬灭剂容器转移到所述第一容器中的流体连通路径。实施方案37.如实施方案36所述的方法,其中通过在所述pic容器和所述淬灭剂容器与所述第一容器的入口之间延伸的导管将所述pic和所述淬灭剂添加到所述第一容器中,并且其中所述导管在一端包括:(a)用于将所述pic容器联接至所述导管的第一适配器,(b)用于将所述淬灭剂容器联接至所述导管的第二适配器,以及任选的(c)用于增加所述pic和所述淬灭剂通过所述导管并进入所述第一容器的转移的空气置换装置。实施方案38.如实施方案1-37中任一项所述的方法,其中所述孵育步骤(b)为约2小时至约24小时。实施方案39.如实施方案38所述的方法,其中所述孵育步骤(b)为约18小时至约22小时。实施方案40.如实施方案1-39中任一项所述的方法,其中所述孵育步骤(b)处于室温下。实施方案41.如实施方案1-40中任一项所述的方法,其中所述转移步骤(c)是通过在所述第一容器与所述第二容器之间延伸的导管进行的。实施方案42.如实施方案41所述的方法,其中所述导管将所述第一容器的第一出口连接至所述第二容器的第一入口。实施方案43.如实施方案1-42中任一项所述的方法,其中所述孵育步骤(d)为约1小时至约8小时。实施方案44.如实施方案43所述的方法,其中所述孵育步骤(d)为约2小时至约4小时。实施方案45.如实施方案1-44中任一项所述的方法,其中所述孵育步骤(d)处于室温下。实施方案46.如实施方案1-45中任一项所述的方法,其还包括将所述病原体灭活的全血组合物从所述第二容器转移至第三容器。实施方案47.如实施方案1-46中任一项所述的方法,其还包括(e)将所述病原体灭活的全血组合物储存在约2-6℃下。实施方案48.如实施方案1-47中任一项所述的方法,其中所述病原体灭活的全血组合物适用于输注。实施方案49.如实施方案1-48中任一项所述的方法,其还包括将所述病原体灭活的全血组合物分离为红细胞组合物、血浆组合物或血小板组合物中的一种或多种。实施方案50.如实施方案1-49中任一项所述的方法,其还包括将所述病原体灭活的全血组合物分离为血浆组合物,并且由所述血浆组合物制备冷沉淀组合物。实施方案51.一种通过如实施方案1-48中任一项所述的方法制备的病原体灭活的全血组合物。实施方案52.如实施方案51所述的病原体灭活的全血组合物,其中所述病原体灭活的全血组合物适用于输注。实施方案53.一种通过如实施方案49所述的方法制备的红细胞组合物。实施方案54.一种通过如实施方案50所述的方法制备的冷沉淀组合物。实施方案55.一种将病原体灭活的全血组合物输注到有需要的受试者体内的方法,所述方法包括将通过如实施方案1-48中任一项所述的方法制备的病原体灭活的全血组合物或如实施方案51或实施方案52所述的病原体灭活的全血组合物输注到所述受试者体内。实施方案56.如实施方案55所述的方法,其中所述方法包括将输注管线联接至所述第二容器的第一出口并且将所述病原体灭活的全血组合物输注到所述受试者体内。实施方案57.一种用于制备病原体灭活的全血组合物的套件,其包括:(a)用于从供体中抽取全血的血管接入装置;(b)适用于混合所述全血和病原体灭活化合物(pic)的第一容器,其中所述第一容器包括至少第一入口和第一出口;(c)在所述血管接入装置与所述第一容器的所述第一入口之间延伸并提供用于将所述全血从所述血管接入装置转移到所述第一容器中的流体连通路径的第一导管;以及(d)包含病原体灭活化合物的容器(pic容器)。实施方案58.如实施方案57所述的套件,其中所述pic容器被构造成通过流体连通路径联接至所述第一容器的所述第一入口。实施方案59.如实施方案58所述的套件,其中所述pic容器被构造成联接至所述第一导管。实施方案60.如实施方案57所述的套件,其中所述第一容器包括第二入口并且所述pic容器被构造成通过流体连通路径联接至所述第一容器的所述第二入口。实施方案61.如实施方案57-60中任一项所述的套件,其还包括包含淬灭剂的容器(淬灭剂容器)。实施方案62.如实施方案61所述的套件,其中所述淬灭剂容器被构造成通过流体连通路径联接至所述第一容器的所述第一入口。实施方案63.如实施方案62所述的套件,其中所述淬灭剂容器被构造成联接至所述第一导管。实施方案64.如实施方案61所述的套件,其中所述淬灭剂容器被构造成通过流体连通路径联接至所述第一容器的所述第二入口。实施方案65.如实施方案60-64中任一项所述的套件,其中所述pic容器和所述淬灭剂容器是同一容器。实施方案66.如实施方案60-65中任一项所述的套件,其还包括第二导管,其中所述第二导管在一端包括用于将所述pic容器和/或所述淬灭剂容器联接至所述第二导管的至少一个适配器。实施方案67.如实施方案66所述的套件,其中所述第二导管在一端包括用于将所述pic容器联接至所述第二导管的第一适配器和用于将所述淬灭剂容器联接至所述第二导管的第二适配器。实施方案68.如实施方案60-65中任一项所述的套件,其还包括第二导管,其中所述第二导管在一端联接至所述pic容器和/或所述淬灭剂容器。实施方案69.如实施方案66-68中任一项所述的套件,其中所述第二导管被构造成联接至所述第一容器,从而在所述pic容器和/或淬灭剂容器与所述第一容器之间提供流体连通路径。实施方案70.如实施方案69所述的套件,其中所述第二导管被构造成联接至所述第一容器的所述第一入口。实施方案71.如实施方案69或实施方案70所述的套件,其中所述第二导管联接至所述第一容器的所述第二入口。实施方案72.如实施方案66-68中任一项所述的套件,其中所述第二导管被构造成联接至所述第一导管,从而在所述pic容器和/或淬灭剂容器与所述第一容器之间提供流体连通路径。实施方案73.如实施方案66-72中任一项所述的套件,其还包括用于增加所述pic和/或所述淬灭剂通过所述第二导管并进入所述第一容器的转移的空气置换装置。实施方案74.如实施方案57-73中任一项所述的套件,其中所述第一容器包含抗凝剂。实施方案75.如实施方案57-74中任一项所述的套件,其还包括适用于储存病原体灭活的全血组合物的第二容器,其中所述第二容器包括至少第一入口和第一出口。实施方案76.如实施方案75所述的套件,其还包括第三导管,所述第三导管在所述第一容器的所述第一出口与所述第二容器的所述第一入口之间延伸并提供用于将包含全血组合物和pic的混合物从所述第一容器转移到所述第二容器中的流体连通路径。实施方案77.如实施方案75或实施方案76所述的套件,其中所述套件包括适用于储存病原体灭活的全血组合物的第三容器,其中所述第三容器包括至少第一入口和第一出口,并且其中所述套件还包括第四导管,所述第四导管在所述第二容器的所述第一出口与所述第三容器的所述第一入口之间延伸并提供用于将包含全血组合物和pic的混合物从所述第二容器转移到所述第三容器中的流体连通路径。实施方案78.如实施方案1-77中任一项所述的套件,其还包括用于将所述病原体灭活的全血组合物输注到受试者体内的输注管线,其中所述输注管线包括第二血管接入装置和在所述第二容器的所述第一出口与所述第二血管接入装置之间延伸的输注管线导管,其中所述输注管线导管提供用于将所述病原体灭活的全血组合物从所述第二容器无菌转移至所述血管接入装置的流体连通路径。实施方案79.一种用于制备病原体灭活的全血组合物的套件,其包括:(a)适用于混合全血组合物、病原体灭活化合物(pic)和淬灭剂的第一容器,其中所述第一容器包括至少第一入口和第一出口;(b)适用于储存病原体灭活的全血组合物的第二容器,其中所述第二容器包括至少第一入口和第一出口;(c)包含病原体灭活化合物的容器(pic容器);(d)包含淬灭剂的容器(淬灭剂容器);(e)第一导管,其中所述第一导管在一端联接至或被构造成联接至pic容器和淬灭剂容器,并且其中所述第一导管还包括用于增加所述pic和所述淬灭剂通过所述第一导管的转移的空气置换装置;以及(f)第二导管,其在所述第一容器与所述第二容器之间延伸并提供用于将所述全血组合物从所述第一容器转移至所述第二容器的流体连通路径。实施方案80.如实施方案79所述的套件,其中所述第一导管还包括用于将所述第二导管联接至pic容器和淬灭剂容器的至少一个适配器。实施方案81.如实施方案80所述的套件,其中所述第一导管包括用于将pic容器联接至所述第一导管的第一适配器和用于将淬灭剂容器联接至所述第一导管的第二适配器。实施方案82.如实施方案79-81中任一项所述的套件,其中所述第一导管联接至pic容器和淬灭剂容器。实施方案83.如实施方案79-82中任一项所述的套件,其中所述pic容器和所述淬灭剂容器是同一容器。实施方案84.如实施方案79-83中任一项所述的套件,其中所述第一导管被构造成联接至所述第一容器,从而在所述pic容器和淬灭剂容器与所述第一容器之间提供流体连通路径。实施方案85.如实施方案83所述的套件,其中所述第一导管被构造成联接至所述第一容器的入口。实施方案86.如实施方案79-85中任一项所述的套件,其还包括用于从供体中抽取全血的血管接入装置和在所述血管接入装置与所述第一容器的所述第一入口之间延伸并提供用于将所述全血从所述血管接入装置转移到所述第一容器中的流体连通路径的第三导管。实施方案87.如实施方案86所述的套件,其中所述第一容器还包括第二入口,并且其中所述第一导管被构造成联接至所述第一容器的所述第二入口。实施方案88.如实施方案86所述的套件,其中所述第一导管被构造成联接至所述第三导管,从而在所述pic容器和淬灭剂容器与所述第一容器之间提供流体连通路径。实施方案89.如实施方案79-88中任一项所述的套件,其中所述第一容器包含抗凝剂。实施方案90.如实施方案79-89中任一项所述的套件,其中所述套件包括适用于储存病原体灭活的全血组合物的第三容器,其中所述第三容器包含(例如,包括)至少第一入口和第一出口,并且其中所述套件还包括第四导管,所述第四导管在所述第二容器的所述第一出口与所述第三容器的所述第一入口之间延伸并提供用于将所述全血组合物从所述第二容器转移(例如,在无菌条件下)到所述第三容器中的流体连通路径。实施方案91.如实施方案79-90中任一项所述的套件,其还包括用于将所述病原体灭活的全血组合物输注到受试者体内的输注管线,其中所述输注管线包括第二血管接入装置和在所述第二容器的所述第一出口与所述第二血管接入装置之间延伸的输注管线导管,其中所述输注管线导管提供用于将所述病原体灭活的全血组合物从所述第二容器无菌转移至所述血管接入装置的流体连通路径。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1