治疗失智症的组合物及方法与流程
1.本技术依据35u.s.c.
§
119,主张于2018年11月28日提申的美国暂时专利申请号62/722,211的权益,其揭示内容在此并入本技术以作为参考数据。
2.本发明涉及治疗失智症的方法。
背景技术:
3.阿兹海默症(alzheimer’s disease,ad)的特征是渐进的认知能力下降、神经纤维缠结、类淀粉蛋白斑块、神经发炎,以及成人神经生成能力下降(1
‑
3)。类淀粉蛋白β(amyloidβ,aβ)是由类淀粉蛋白前体蛋白(amyloid precursor protein,app)加工形成的胜肽,被认为是阿兹海默症(ad)病理学的主要起始因子之一。类淀粉蛋白假说认为阿兹海默症(ad)是由于aβ的产生及清除之间的不平衡所引起的(1),导致中枢神经系统(central nervous system,cns)中单体、寡聚以及不溶性原纤维形式的aβ数量增加,随后诱导aβ斑块形成、神经发炎,以及氧化压力(4)。
4.越来越多的证据显示,成人海马回神经生成在认知功能中扮演主要的角色(5)。已发现类淀粉蛋白前体蛋白(app)代谢产物,包括寡聚aβ、可溶性appα(sapp)α以及app细胞内结构域(app intracellular domain,aicd),可调节影响成人海马回神经生成的人类神经干细胞的特性(6,7)。另一方面,活化的神经胶质细胞产生的促发炎细胞激素如il
‑
1β、tnf
‑
γ,以及il
‑
6也可能调节成人海马回神经生成的过程(8
‑
10)。
5.appswe/ps1de9小鼠模型(app/ps1),共表现瑞典突变的人类app695以及人类突变的早老素1(presenilin 1,ps1),其中外显子9被删除(11),表现出类似阿兹海默症(ad)的病理与行为变化,包括在脑中累积的类淀粉蛋白斑块、胆碱系统退化,以及探索行为与空间记忆受损(12)。早在3到5个月大时,app/ps1小鼠中的aβ产生及斑块形成就增加了(13),在6个月大时观察到空间学习与记忆力的下降(14
‑
15)。此外,在3至6个月大的app/ps1小鼠中也发现神经生成受损(16)。
6.仍需要开发无副作用且低毒性的用于治疗阿兹海默症(ad)的药物。
技术实现要素:
7.本发明的一目的为提供一种治疗失智症的方法,该方法包含对一有此需要的个体投予一樟芝子实体的萃取物作为一活性成分。
8.于另一目的中,本发明提供一种一樟芝子实体萃取物用于制备治疗失智症的药物的用途。
9.具体而言,该樟芝子实体的萃取物为皿培式的樟芝子实体的萃取物,以下称为arh003,或椴木培养的樟芝子实体的萃取物,以下称为arh004。
10.于本发明的一实施例中,该樟芝子实体的萃取物通过以水或一有机溶剂萃取樟芝子实体所制备。
11.于本发明的一特定实施例中,该樟芝子实体的萃取物包含一或多种化合物作为活
性成分,其选自由下列所组成的群组:
[0012][0013][0014]
其中r1为o、α
‑
oh,或β
‑
h;r2为h或oh;r3为o、α
‑
h、β
‑
oac或h2;r4为h或oh;r5为h或oh;r6为cooh或coo(ch2)n
‑
ch3;n为一0至3的整数;r7为h、oh或oac;r8为ch3或cooh;虚线表示一单键或一双键。
[0015]
于本发明的某些特定实施例中,该化合物选自由下列所组成的群组:
[0016]
具有以下结构的去氢齿孔酸(dehydroeburicoic acid):
[0017][0018]
具有以下结构的去氢硫色多孔菌酸[dehydrosulphurenic acid,亦称为去氢磺尿酸(dehydrosulfurenic acid)]:
[0019][0020]
具有以下结构的15α
‑
乙酰去氢硫色多孔菌酸(15α
‑
acetyldehydrosulphurenic acid):
[0021]
以及
[0022]
具有以下结构的樟芝酸k(antcin k):
[0023][0024]
另一方面,本发明提供一种治疗失智症的方法,该方法包含对一有此需要的个体投予一或多种上述活性化合物。
[0025]
本发明亦提供上述化合物用于制备治疗失智症的药物的用途。
[0026]
于本发明的一具体实施例中,该失智症为阿兹海默症(ad)。
[0027]
于另一方面,本发明提供一种抑制aβ斑块形成以及神经胶质细胞活化的方法,该方法包含对一有此需要的个体投予上述樟芝子实体的萃取物。
[0028]
另外,本发明提供一种樟芝子实体萃取物用于制备抑制aβ斑块形成以及神经胶质细胞活化的药物的用途。
[0029]
于另一方面,本发明提供一种抑制aβ斑块形成以及神经胶质细胞活化的方法,该
方法包含对一有此需要的个体投予一或多种上述化合物。
[0030]
另外,本发明提供一种上述化合物在制备用于抑制aβ斑块形成以及神经胶质细胞活化的药物中的用途。
[0031]
于另一方面,本发明提供一种用于改善记忆力的方法,包含对一有此需要的个体投予该樟芝子实体的萃取物。
[0032]
另外,本发明提供一种上述化合物用于制备改善记忆力的药物的用途。
[0033]
于本发明中,根据本发明的萃取物或化合物提供治疗失智症、改善记忆力缺损,及/或改善记忆力的功效。
[0034]
应当理解的是,以上的一般描述与以下的详细描述皆仅为示例性及说明性的,并非限制本发明。
附图说明
[0035]
当结合附图阅读时,将更好地理解前述发明内容以及以下对本发明的详细描述。为了说明本发明,于图式中显示了目前较佳的具体实施例。
[0036]
于图式中:
[0037]
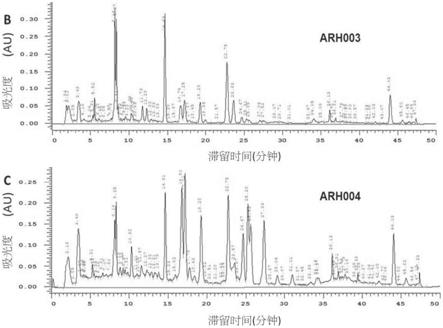
图1所示分别为樟芝的皿培式的子实体(arh003)以及椴木培养的子实体(arh004)的主要成分的结构的代表性化学指纹图;其中,将皿培式的子实体(arh003)或椴木培养的子实体(arh004)的乙醇(95%)萃取物转移至hplc分析中,并在uv 220nm波长下记录曲线。arh003(上图)以及arh004(下图)的hplc层析图如图1所示。
[0038]
图2所示为具有不同性别及投予方式(载剂或arh003)的app/ps1小鼠的体重(g)测量值。app/ps1雄性(m)或雌性(f)小鼠(3个月大)口服投予载剂(veh)或100mg/kg/天arh003(a)4个月。每天在arh003投予期间检查体重变化,在雄性小鼠投予的最后一个月arh003显著增加体重,而雌性小鼠则无。veh组与arh003组之间的显著差异由*表示,p<0.05。
[0039]
图3a所示为amylo
‑
glo(白色或蓝色)、iba
‑
1(红色),以及gfap(绿色)的代表性荧光图像。口服投予app/ps1转基因小鼠载剂以及arh003 4个月,然后以amylo
‑
glo对类淀粉斑块进行染色,并分别以iba
‑
1与gfap抗体对小神经胶质细胞与星状神经胶细胞进行免疫染色。比例尺:1mm。
[0040]
图3b所示为典型斑块的放大率。比例尺:50μm。
[0041]
图3c所示为在投予4个月后,比较未投予arh003(载剂组,veh)以及投予arh003(arh003组)的脑半球中amylo
‑
glo染色的斑块的数目。结果为平均值
±
s.e.m。veh组与arh003组之间的显著差异由*表示,p<0.05。
[0042]
图3d所示为在投予4个月后,比较未投予arh003(veh组)以及投予arh003(arh003组)的斑块周围的活化星状神经胶细胞的数目。以gfap抗体对星状神经胶细胞进行免疫染色。结果为平均值
±
s.e.m。
[0043]
图3e所示为在投予4个月后,比较未投予arh003(veh组)以及投予arh003(arh003组)的斑块周围的活化小神经胶质细胞的数目。以iba
‑
1抗体对小神经胶质细胞进行免疫染色。结果为平均值
±
s.e.m。veh组与arh003组之间的显著差异以***表示,p<0.001。
[0044]
图4a所示为2小时与16小时挖掘任务的结果。口服投予app/ps1转基因小鼠载剂(veh组)或arh003(n分别为17及15)。在投予后第84天进行挖掘任务。结果为平均值
±
s.e.m。veh组与arh003组之间的显著差异由**表示,p<0.01;***,p<0.001。
[0045]
图4b所示为筑巢任务的筑巢得分与筑巢任务中未切碎的小巢的比较。口服投予app/ps1转基因小鼠载剂(veh组)或arh003(n分别为17及15)。在投予后第86天进行筑巢任务。结果为平均值
±
s.e.m。veh组与arh003组之间的显著差异由**表示,p<0.01;***,p<0.001。
[0046]
图5a所示为在第一次及最后一次试验的隐藏平台测试中的代表性游泳路径。口服投予app/ps1转基因小鼠载剂(veh组)或arh003(n分别为17及14)。进行莫里斯水迷宫试验。
[0047]
图5b所示为训练阶段中逃脱时间的比较。口服投予app/ps1转基因小鼠载剂(veh组)或arh003(n分别为17及14)。进行莫里斯水迷宫试验(morris water maze,mwm)。结果为平均值
±
s.e.m。veh组与arh003组之间的显著差异以*表示,p<0.01;**,p<0.01;***,p<0.001。
[0048]
图6a所示为探针试验中的代表性游泳路径。口服投予app/ps1转基因小鼠载剂(veh组)或arh003(n分别为17及14)。进行莫里斯水迷宫试验。
[0049]
图6b所示为比较到目标区域探视的等待时间。口服投予app/ps1转基因小鼠载剂(veh组)或arh003(n分别为17及14)。进行莫里斯水迷宫试验。结果为平均值
±
s.e.m。veh组与arh003组之间的显著差异以***表示,p<0.001。
[0050]
图6c所示为比较前平台的穿越时间。口服投予app/ps1转基因小鼠载剂(veh组)或arh003(n分别为17及14)。进行莫里斯水迷宫试验。结果为平均值
±
s.e.m。
具体实施方式
[0051]
除非另有定义,否则本文使用的所有技术及科学术语具有与本发明所属领域的技术人员通常理解的相同含义。
[0052]
本发明提供一种治疗失智症的方法,包含对一有此需要的个体投予一樟芝子实体的萃取物作为一活性成分。
[0053]
樟芝(antrodia camphorate,ac)在中国台湾被称为「牛樟芝」或「牛樟菇」,为一种中国台湾特有的菇类(17)。樟芝(ac)早在1773年之前就已广泛用于民俗医学,治疗肌腱及肌肉扭曲、惊恐的精神状态、流感以及感冒、头痛、发烧,以及许多内在相关的疾病(18)。已发现樟芝(ac)的不同萃取物及化合物具有多种生物学活性,包括保护神经(19,20)、保护肝脏、抗高血压、抗高血脂、抗遗传毒性、抗血管生成、抗微生物、抗癌、抗发炎、抗氧化、抗病毒,以及免疫调节活性(21、22)。
[0054]
具体而言,樟芝子实体的萃取物为皿培式的樟芝子实体的萃取物(arh003)或椴木培养的樟芝子实体的萃取物(arh004)。
[0055]
于本发明中,该组合物被证明对治疗失智症特别是阿兹海默症(ad)有效。
[0056]
因此,本发明提供一种该萃取物用于制备治疗失智症,特别是阿兹海默症(ad)的药物的用途,特别是皿培式的樟芝子实体的萃取物,亦即arh003,及/或arh004。
[0057]
于本发明中,该萃取物arh003/arh004包含一或多种化合物作为活性成分,该化合物选自由下列所组成的群组:
[0058][0059]
(去氢松二酸,dehydrotumolosaeure),
[0060][0061]
(去氢土莫酸,dehydrotumulosic acid),
[0062][0063]
(3
‑
表
‑
去氢土莫酸,3
‑
epi
‑
dehydrotumulosic acid),
[0064][0065]
(去氢硫色多孔菌酸,dehydrosulphurenic acid),
[0066][0067]
(去氢松二酸
‑
甲酯,dehydrotumolosaeure
‑
methylester),
[0068][0069]
[(20ξ)
‑
3β,15α,16α
‑
三羟基
‑
24
‑
甲基羊毛脂
‑
7,9(11),24(241)
‑
三烯
‑
21
‑
油酸;15α
‑
羟基去氢土莫酸,(20ξ)
‑
3β,15α,16α
‑
trihydroxy
‑
24
‑
methyllanosta
‑
7,9(11),24(241)
‑
trien
‑
21
‑
oic acid;15α
‑
hydroxydehydrotumulosic acid],
[0070][0071]
[甲基25
‑
羟基
‑3‑
表去氢土莫盐(甲基),methyl25
‑
hydroxy
‑3‑
epidehydrotumulosate(methyl)],
[0072][0073]
(去氢茯苓酸,dehydropachymic acid),
[0074][0075]
(15α
‑
乙酰去氢磺尿酸,15α
‑
acetyldehydrosulfurenic acid),
[0076][0077]
(15α
‑
乙酰去氢硫色多孔菌酸,15α
‑
acetyldehydrosulphurenic acid),
[0078][0079]
[(29
‑
羟基去氢茯苓酸;(3β,16β)
‑3‑
(乙酰氧基)
‑
16,29
‑
二羟基
‑
24
‑
甲基亚胺基
‑
7,9(11)
‑
二烯
‑
21
‑
油酸,29
‑
hydroxydehydropachymic acid;(3β,16β)
‑3‑
(acetyloxy)
‑
16,29
‑
dihydroxy
‑
24
‑
methylidenelanosta
‑
7,9(11)
‑
dien
‑
21
‑
oic acid],以及
[0080][0081]
(去氢齿孔酸,dehydroeburicoic acid),
[0082][0083]
(樟芝酸a,antcin a),
[0084][0085]
(樟芝酸b,antcin b),
[0086][0087]
(樟芝酸c,antcin c),
[0088]
(樟芝酸h,antcin h),
[0089][0090]
(樟芝酸k,antcin k),以及
[0091][0092]
(4,7
‑
二甲氧基
‑5‑
甲基
‑
1,3
‑
苯并二恶唑,4,7
‑
dimethoxy
‑5‑
methyl
‑
1,3
‑
benzodioxole)。
[0093]
于本发明的较佳具体实施例中,该活性化合物为:
[0094]
具有以下结构的去氢齿孔酸:
[0095][0096]
具有以下结构的去氢硫色多孔菌酸(亦称为去氢磺尿酸)
[0097][0098]
具有以下结构的15α
‑
乙酰去氢硫色多孔菌酸
[0099]
或
[0100]
具有以下结构的樟芝酸k
[0101][0102]
据此,本发明提供一种治疗失智症的方法,该方法包含对一有此需要的个体投予一有效量的上述活性化合物。
[0103]
如本文所用,「治疗有效量」一词是指,相较于没有接受该量的相应个体,在治疗、治愈、预防或改善一疾病、障碍,或副作用,或降低一疾病或障碍的进展速度方面有作用的一药剂的量。该术语在其范围内还包括有效增强正常生理功能的量。
[0104]
为了用于治疗,将该治疗有效量的该化合物配制为用于投予的一医药组合物。因此,本发明进一步提供一医药组合物,其包含一治疗有效量的arh003及/或arh004以及一或多种医药上可接受的载剂。
[0105]
本文所用的「医药上可接受的载剂」一词是指与制剂的其他成分兼容且对要与医药组合物一起投予的个体无害的可接受的载剂、稀释剂或赋形剂。根据医药制剂的要求,本领域中通常已知或使用的任何载剂、稀释剂或赋形剂均可用于本发明。根据本发明,该医药组合物可适于通过任何适当的途径投予,包括但不限于口服、直肠、鼻部、局部、阴道,或肠胃外途径。于本发明的一特定实施例中,将医药组合物配制为用于口服投予。这样的制剂可通过药学领域中已知的任何方法来制备。
[0106]
通过以下实施例进一步说明本发明,提供这些实施例是为说明而非限制。
[0107]
实施例
[0108]
材料与方法
[0109]
1.材料
[0110]
brdu、甲酸以及硫黄素s购自sigma
‑
aldrich公司(圣路易斯市,密苏里州,美国)。一般化学品购自sigma
‑
aldrich公司(圣路易斯市,密苏里州,美国)或merck公司(达姆施塔
特市,德国)。
[0111]
2.樟芝子实体的萃取(arh003与arh004的制备)
[0112]
arh003系自皿培式的樟芝子实体(300g)中制备,且arh004系自椴木培养的樟芝(arh004)制备。将子实体与95%乙醇热回流。真空浓缩乙醇溶液,得到一褐色萃取物(60g)。
[0113]
3.管理与投予
[0114]
国家中医药研究所的实验动物照护及使用委员会所核准的动物规程(iacuc编号:106
‑
417
‑
4)。所有涉及动物及其照护的实验程序均按照美国国家卫生研究院(national institutes of health,nih)出版的「实验动物的照护及使用指导手册」进行。app/ps1购自jackson实验室(编号005864)。繁殖性别比为一笼中一只雄性配有两只雌性。使用野生型同窝小鼠以及阿兹海默症(ad)转基因雌性c57bl/6j小鼠进行实验。将动物圈养在控制室温(24
±
1℃)与湿度(55
‑
65%),且为12:12小时(07:00
‑
19:00)的日夜周期的环境下。所有动物实验程序均根据「实验动物的照护暨使用指导手册」(nih出版)进行。app/ps1购自jackson实验室(编号005864)。使用雌性转基因小鼠以及雄性野生型同窝小鼠进行育种。将动物圈养在温度(24
±
1℃)与湿度(55
‑
65%)的环境下。日夜周期为12:12小时(07:00
‑
19:00)。提供所有小鼠市售的囓齿动物正常饲料及随意饮水。为了研究治疗效果,三个月大的雄性与雌性app/ps1小鼠均经口管喂饲载剂(雄性与雌性的n值分别为7与8)或arh003或arh004(100mg/kg/天,雄性与雌性的n值分别为7与10)持续4个月。
[0115]
4.组织处理
[0116]
麻醉后的小鼠通过经心盐水灌注而牺牲。取出小鼠大脑,在4℃下浸入4%甲醛中整夜,然后冷冻保护。然后将脑组织切成30μm厚。在每个大脑中,大约横跨前囱
‑
1.58至
‑
1.82的三个切片用于染色及分析。
[0117]
5.amylo
‑
glo染色
[0118]
如制造商(biosensis公司,非百敦,南澳大利亚)所述,使用amylo
‑
glo进行原纤维类淀粉蛋白的染色。
[0119]
6.免疫组织化学
[0120]
如先前所述进行免疫组织化学(39)。简言之,将切片在含1%牛血清白蛋白(bovine serum albumin,bsa)、3%正常驴血清,以及0.3%triton x
‑
100的磷酸盐缓冲液(phosphate buffered saline,pbs)中阻隔1小时。然后,在含有1%bsa、1%正常驴血清、0.3%triton x
‑
100,以及一级抗体,包括抗aβ1
‑
16的小鼠单株抗体(ab10,millipore公司,mab5208,2757889),以及抗神经胶质纤维酸性蛋白的小鼠单株抗体(glial fibrillary acidic protein,gfap,millipore公司,mab5804,1990686);以及抗离子钙结合转接分子1(ionized calcium
‑
binding adaptor molecule
‑
1,iba
‑
1)山羊多株抗体(abcam公司,ab5076,gr268568
‑
3)的pbs中于4℃下作用整夜。然后将切片在含有hoechst33258(invitrogen公司,2μg/ml),异硫氰酸荧光素或若丹明红x(rhodamine red x,rrx)偶联的驴抗小鼠igg、rrx偶联的驴抗兔igg,或alexa fluor 647偶联的驴抗山羊igg(jackson immunoresearch公司,705
‑
605
‑
147)的抗体稀释缓冲液中,于室温下作用2小时。以含有0.01%triton x
‑
100的pbs洗涤后,将切片埋入aqua poly/mount(polyscience公司,沃灵顿市,宾州,美国),以使用zeiss lsm 780共聚焦显微镜(耶拿市,德国)进行显微镜分析。代表性的共聚焦图像为最大投影的10μm深度。使用imagej软件进行类淀粉蛋白斑的定量。通
过ab10反应性或ths阳性面积与总面积的比计算类淀粉蛋白斑负荷。
[0121]
7.挖掘试验与筑巢试验
[0122]
口管喂饲投予70天后,如先前所述(46)对小鼠进行挖掘试验,并作了些微修改。简言之,在第70天在小组笼中进行练习,并在第77天及第80天进行两次单独测试。将小鼠饲养在铺有薄垫的新笼子中,然后于次日16:00将装有230g饲料颗粒的圆筒放入笼子内。最后,在2小时及隔夜后将圆筒中剩余的饲料颗粒称重。在第二次单独测试中挖掘饲料颗粒的2小时测量显示为结果。
[0123]
挖掘试验后一天,按照先前的描述进行筑巢试验(35)。简言之,在夜间周期之前的1小时,将两个小巢(5g)放入笼中,然后在过夜后测定其筑巢得分以及未切碎的小巢重量。使用六等级量表(40)对巢穴结构进行评分。分数0表示小巢未被破坏;1,小巢被破坏,但筑巢材料尚未被收集到笼子中的筑巢位置;2,平窝;3,杯窝;4,不完整的圆顶,以及5,完整的封闭圆顶。
[0124]
8.莫里斯水迷宫试验
[0125]
经过90天的处理后,如先前所述(41,42)进行莫里斯水迷宫(mwm)试验,并作了些微修改,以评估空间记忆的表现。简言之,水迷宫装置由直径为120cm,深40cm的圆形水池组成,并以水(温度22
‑
24℃)填至20cm的高度以覆盖平台(直径10cm)。通过添加无毒白色涂料,将平台浸没在浑浊水面以下1cm处。针对描述性数据的收集,将水池划分为四个相等的象限。使用计算机视讯影像分析系统(ethovision,noldus information technology公司,美国)以记录迷宫白色背景中黑老鼠的游泳路径。
[0126]
进行空间记忆试验以研究小鼠的空间记忆表现。将所有小鼠在莫里斯水迷宫(mwm)中训练6天。该平台始终放置在西南象限的中心。每天以四次试验训练每只小鼠找到该平台,试验间隔为20分钟。在每个试验中,根据半随机时间表,将小鼠轻轻地放入面向池壁的水中的三个固定位置之一。如果小鼠在60秒内未成功,则协助其到该平台上。每次试验结束时,无论是否找到平台,皆允许小鼠在平台上停留30秒。在每个试验都测量找到平台的逃脱时间,且取四个试验的平均值。
[0127]
进行空间探针试验,其中评估记忆的程度(43)。在目标象限中花费的时间表示在训练期间学习后获得的记忆程度。在为期6天的获取训练之后的隔天,评估90秒探针试验(一次试验没有平台)。将小鼠从起始位置放到池中,该位置与前平台象限相反。记录90秒内小鼠越过平台先前位置的次数以及在前平台象限中花费的时间。检视在莫里斯水迷宫(mwm)的探针试验版本中,在中心区域与外围区域中花费的时间百分比。外围区域定义为池壁与距离该池壁10cm的圆之间的区域。
[0128]
9.统计分析
[0129]
结果表示为平均值
±
平均值的标准偏差(standard error of the mean,sem),并使用graphpad prism 5软件进行统计分析处理。通过不成对的双尾学生氏t检定或单因子变异数分析(one
‑
way analysis of variance,anova)以及事后bonferroni氏的多重比较检定来分析参数数据。使用kruskal
‑
wallis anova以及事后dunnett氏多重比较检定分析非参数数据,包括莫里斯水迷宫(mwm)试验中平台的穿越时间、挖掘试验中饲料颗粒的数量以及筑巢试验中的筑巢得分。
[0130]
实施例1
[0131]
使用hplc色层分析法对arh003与arh004进行分子定性
[0132]
本研究中使用的樟芝子实体为皿培式的(arh003),与在肉桂木上培育的樟芝子实体具有很高的植物相似性指数(chung等人,2016年)。为了证实这种相似性,以hplc色层分析法比较皿培式的樟芝(arh003)与椴木培养的樟芝(arh004)的成分(图1)。
[0133]
实施例2
[0134]
arh003减少了app/ps1小鼠大脑中aβ斑块负荷
[0135]
在6个月大的app/ps1小鼠中可见斑块是众所周知的(23)。因此,以3个月大的app/ps1雄性或雌性小鼠口服载剂或100mg/kg/天的arh003,持续4个月,以研究arh003对aβ斑块沉积以及神经胶质细胞活化的影响。在投予arh003期间检查了体重变化,且在投予的最后一个月中,arh003在雄性小鼠中显著增加了体重,但是在雌性小鼠中则无显著增加(图2)。
[0136]
实施例3
[0137]
arh003减少了app/ps1小鼠大脑中具有神经胶质簇的斑块数量。
[0138]
我们评估了arh003对具有神经胶质簇的斑块数量的影响。为了确定app/ps1转基因小鼠大脑中具有神经胶质簇的斑块,分别通过amylo
‑
glo染色以及iba
‑1‑
与gfap免疫染色检查aβ斑块、小神经胶质细胞,以及星状神经胶细胞。我们发现在以arh003处理后,具有神经胶质簇的斑块数量减少了(图3a
‑
3e)。
[0139]
实施例4
[0140]
arh003恢复app/ps1小鼠下降的认知能力
[0141]
挖掘与筑巢行为涉及广泛的大脑区域网络,以前已被用于评估阿兹海默症(ad)转基因小鼠的adl技能。在本研究中,口服投予三个月大的app/ps1转基因小鼠arh003(100mg/kg/天),持续114天。然后分别在口服后第84天及第86天开始挖掘与筑巢的任务(图4a)。app/ps1小鼠表现出自发的挖掘行为缺陷,并且通过投予arh003可明显恢复。app/ps1小鼠还表现出筑巢行为的缺陷,该筑巢行为由筑巢得分以及未切碎的小巢所评估。投予arh003可明显恢复受损的筑巢行为(图4b)。
[0142]
在莫里斯水迷宫(mwm)任务中,app/ps1小鼠在训练阶段表现出更长的逃脱时间以找到隐藏的平台,这表示app/ps1小鼠在7个月大时表现出空间学习障碍。通过arh003的治疗,这种明显的缺损得到了显著的恢复(图5a
‑
5b)。双向重复测量anova分析证实了各组之间与找到该平台的逃脱时间训练天数之间的相互作用。在训练天数、小组之间,以及个体上皆存在显著差异。在bonferroni后测中,在训练的第3天到第6天,载剂组与arh003组之间存在显著差异。
[0143]
在探针试验中,app/ps1小鼠显示出到目标区域探视的等待时间以及目标区域内的穿越时间的减少(图6a
‑
6c),而不会影响摆动速度(数据未显示)。再次地,通过arh003的治疗,该缺损得以显著恢复。
[0144]
引用文件
[0145]
1.hardy,j.;selkoe,d.j.the amyloid hypothesis of alzheimer's disease:progress and problems on the road to therapeutics.science.2002,297,353
‑
356.
[0146]
2.fuster
‑
matanzo,a.;llorens
‑
mart
í
n,m.;hern
á
ndez,f.;avila,j.role of neuroinflammation in adult neurogenesis and alzheimer disease:therapeutic approaches.mediators inflamm.2013,2013,260925.
spatial learning in the appswe+psen1deltae9 bigenic mouse model of alzheimer's disease.genes brain behav.2007,6,54
‑
65.
[0159]
15.xiong,h.;callaghan,d.;wodzinska,j.;xu,j.;premyslova,m.;liu,q.y.;connelly,j.;zhang,w.biochemical and behavioral characterization of the double transgenic mouse model(appswe/ps1de9)of alzheimer's disease.neurosci.bull.2011,27,221
‑
232.
[0160]
16.hamilton,a.;holscher,c.the effect of ageing on neurogenesis and oxidative stress in the app(swe)/ps1(deltae9)mouse model of alzheimer's disease.brain res.2012,1449,83
‑
93.
[0161]
17.wu,sh.;ryvarden l,;chang,t.t.antrodia camphorata("niu
‑
chang
‑
chih"),new combination of a medicinal fungus in taiwan.bot.bull.acad.sin.1997,38,273
‑
275.
[0162]
18.peng,c.c.,;chen,k.c.;peng,r.y.;chyau,c.c.;su,c.h.,;hsieh
‑
li,h.m.antrodia camphorata extract induces replicative senescence in superficial tcc,and inhibits the absolute migration capability in invasive bladder carcinoma cells.j.ethnopharmacol.2007,109,93
‑
103.
[0163]
19.chen,c.c.;shiao,y.j.;lin,r.d.;shao,y.y.;lai,m.n.;lin,c.c.;et al.,neuroprotective diterpenes from the fruiting body of antrodia camphorata.j.nat.prod.2006,69,689
–
691.
[0164]
20.phan,c.w.;david,p.;naidu,m.;wong,k.h.;sabaratnam,v.therapeutic potential of culinary
‑
medicinal mushrooms for the management of neurodegenerative diseases:diversity,metabolite,and mechanism.crit.rev.biotechnol.2015,35,355
‑
368.
[0165]
21.yue,p.y.;wong,y.y.;wong,k.y.;tsoi,y.k.;leung,k.s.current evidence for the hepatoprotective activities of the medicinal mushroom antrodia cinnamomea.chin.med.2013,8,21.
[0166]
22.geethangili,m.;tzeng,y.m.review of pharmacological effects of antrodia camphorata and its bioactive compounds.evid.based complement.alternat.med.2011,2011,212641.
[0167]
23.yan,p.;hu,x.;song,h.;yin,k.;bateman,r.j.;cirrito,j.r.;hsu,f.f.;turk,j.w.;xu,j.;hsu,c.y.;holtzman,d.m.;lee,j.m.matrix metalloproteinase
‑
9 degrades amyloid
‑
beta fibrils in vitro and compact plaques in situ.j.biol.chem.2006,281,24566
‑
24574.
[0168]
24.s.;koivisto,h.;pekkarinen,e.;p.;dobson,g.;mcdougall,g.j.;stewart,d.;haapasalo,a.;karjalainen,r.o.;tanila,h.;hiltunen,m.anthocyanin
‑
enriched bilberry and blackcurrant extracts modulate amyloid precursor protein processing and alleviate behavioral abnormalities in the app/ps1 mouse model of alzheimer's disease.j.nutr.biochem.2013,24,360
‑
370.
[0169]
25.mawuenyega,k.g.;sigurdson,w.;ovod,v.;munsell,l.;kasten,t.;morris,
j.c.;yarasheski,k.e.;bateman,r.j.decreased clearance of cns beta
‑
amyloid in alzheimer's disease.science.2010,330,1774.
[0170]
26.qiu,w.q.;folstein,m.f.insulin,insulin
‑
degrading enzyme and amyloid
‑
beta peptide in alzheimer's disease:review and hypothesis.neurobiol.aging.2006,27,190
‑
198.
[0171]
27.baranello,r.j.;bharani,k.l.;padmaraju,v.;chopra,n.;lahiri,d.k.;greig,n.h.;pappolla,m.a.;sambamurti,k.amyloid
‑
beta protein clearance and degradation(abcd)pathways and their role in alzheimer's disease.curr.alzheimer res.2015,12,32
‑
46.
[0172]
28.serrano
‑
pozo,a.;muzikansky,a.;g
ó
mez
‑
isla,t.;growdon,j.h.;betensky,r.a.;frosch,m.p.;hyman,b.t.differential relationships of reactive astrocytes and microglia to fibrillar amyloid deposits in alzheimer disease.j.neuropathol.exp.neurol.2013,72,462
‑
471.
[0173]
29.fu,a.k.;hung,k.w.;yuen,m.y.;zhou,x.;mak,d.s.;chan,i.c.;cheung,t.h.;zhang,b.;fu,w.y.;liew,f.y.;ip,n.y.il
‑
33 ameliorates alzheimer's disease
‑
like pathology and cognitive decline.proc.natl.acad.sci.usa.2016,113,e2705
‑
e2713.
[0174]
30.el khoury,j.;toft,m.;hickman,s.e.;means,t.k.;terada,k.;geula,c.;luster,a.d.ccr2 deficiency impairs microglial accumulation and accelerates progression of alzheimer
‑
like disease.nat.med.2007,13,432
‑
438.
[0175]
31.goto,y.;niidome,t.;hongo,h.;akaike,a.;kihara,t.;sugimoto,h.impaired muscarinic regulation of excitatory synaptic transmission in the appswe/ps1de9 mouse model of alzheimer's disease.eur.j.pharmacol.2008,583,84
‑
91.
[0176]
32.yeh,c.w.;yeh,s.h.;shie,f.s.;lai,w.s.;liu,h.k.;tzeng,t.t.;tsay,h.j.;shiao,y.j.impaired cognition and cerebral glucose regulation are associated with astrocyte activation in the parenchyma of metabolically stressed appswe/ps1de9 mice.neurobiol.aging 2015,36,2984
‑
2994.
[0177]
33.duan,s.;guan,x.;lin,r.;liu,x.;yan,y.;lin,r.;zhang,t.;chen,x.;huang,j.;sun,x.;li,q.;fang,s.;xu,j.;yao,z.;gu,h.silibinin inhibits acetylcholinesterase activity and amyloidβpeptide aggregation:a dual
‑
target drug for the treatment of alzheimer's disease.neurobiol.aging 2015,36,1792
‑
1807.
[0178]
34.deacon,r.m.burrowing in rodents:a sensitive method for detecting behavioral dysfunction.nat.protoc.2006,1,118
‑
121.
[0179]
35.deacon,r.m.assessing nest building in mice.nat.protoc.2006,1,1117
‑
1119.
[0180]
36.jirkof,p.burrowing and nest building behavior as indicators of well
‑
being in mice.j.neurosci.meth.2014,234,139
‑
146.
[0181]
37.woodbridge,r.;sullivan,m.p.;harding,e.;crutch,s.;gilhooly,k.j.;gilhooly,m.;mcintyre,a.;wilson,l.use of the physical environment to support everyday activities for people with dementia:a systematic review.dementia(london).2016,pii:1471301216648670.
[0182]
38.janus,c.;flores,a.y.;xu,g.;borchelt,d.r.behavioral abnormalities in appswe/ps1de9 mouse model of ad
‑
like pathology:comparative analysis across multiple behavioral domains.neurobiol.aging.2015,36,2519
‑
2532.
[0183]
39.tsai
‑
teng,t.;chin
‑
chu,c.;li
‑
ya,l.;wan
‑
ping,c.;chung
‑
kuang,l.;chien
‑
chang,s.;chi
‑
ying,h.f.;chien
‑
chih,c.;shiao,y.j.erinacine a
‑
enriched hericium erinaceus mycelium ameliorates alzheimer's disease
‑
related pathologies in appswe/ps1de9 transgenic mice.j.biomed.sci.2016,23,49.
[0184]
40.hess,s.e.;rohr,s.;dufour,b.d.;gaskill,b.n.;pajor,e.a.;garner,j.p.home improvement:c57bl/6j mice given more naturalistic nesting materials build better nests.j.am.assoc.lab.anim.sci.2008,47,25
‑
31.41.morris,r.developments of a water
‑
maze procedure for studying spatial learning in the rat.j.neurosci.methods.1984,11,47
‑
60.
[0185]
42.chao,h.w.;tsai,l.y.;lu,y.l.;lin,p.y.;huang,w.h.;chou,h.j.;lu,w.h.;lin,h.c.;lee,p.t.;huang,y.s.deletion of cpeb3 enhances hippocampus
‑
dependent memory via increasing expressions of psd95 and nmda receptors.j.neurosci.2013,33,17008
‑
17022.
[0186]
43.wang,l.s.;zhou,j.;shao,x.m.;tang,x.c.huperzine a attenuates cognitive deficits and brain injury in neonatal rats after hypoxia
‑
ischemia.brain res.2002,949,162
‑
170.
[0187]
44.kim,t.k.;han,h.e.;kim,h.;lee,j.e.;choi,d.;park,w.j.;han,p.l.expression of the plant viral protease nia in the brain of a mouse model of alzheimer's disease mitigates abeta pathology and improves cognitive function.exp.mol.med.2012,44,740
‑
748.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1