多模式放射设备和方法与流程
相关申请的交叉引用
本申请要求以下11件美国临时专利申请的权益,该11件美国临时专利申请包括:2018年11月30日提交的序列号为62/773,712的美国临时专利申请(代理人案卷号为38935/04001);2018年11月30日提交的序列号为62/773,700的美国临时专利申请(代理人案卷号为38935/04002);2019年1月25日提交的序列号为62/796,831的美国临时专利申请(代理人案卷号为38935/04004);2019年2月1日提交的序列号为62/800,287的美国临时专利申请(代理人案卷号为38935/04003);2019年2月5日提交的序列号为62/801,260的美国临时专利申请(代理人案卷号为38935/04006);2019年3月4日提交的序列号为62/813,335的美国临时专利申请(代理人案卷号为38935/04007);2019年3月20日提交的序列号为62/821,116的美国临时专利申请(代理人案卷号为38935/04009);2019年4月19日提交的序列号为62/836,357的美国临时专利申请(代理人案卷号为38935/04016);2019年4月19日提交的序列号为62/836,352的美国临时专利申请(代理人案卷号为38935/04017);2019年5月6日提交的序列号为62/843,796的美国临时专利申请(代理人案卷号为38935/04005);以及2019年7月25日提交的序列号为62/878,364的美国临时专利申请(代理人案卷号为38935/04008)。本申请还与同一天提交的十件非临时美国专利申请有关,该十件非临时美国专利申请包括:代理人案卷号为38935/04020的题为“apparatusandmethodsforscalablefieldofviewimagingusingamulti-sourcesystem(使用多源系统进行可缩放视场成像的装置和方法)”的非临时美国专利申请;代理人案卷号为38935/04011的题为“integratedhelicalfan-beamcomputedtomographyinimage-guidedradiationtreatmentdevice(图像引导放射治疗设备中的集成螺旋扇形射束计算机断层扫描)”的非临时美国专利申请;代理人案卷号为38935/04010的题为“computedtomographysystemandmethodforimageimprovementusingpriorimage(使用先前图像进行图像改进的计算机断层扫描系统和方法)”的非临时美国专利申请;代理人案卷号为38935/04013的题为“optimizedscanningmethodsandtomographysystemusingregionofinterestdata(使用关注区域数据的最佳扫描方法和断层扫描系统)”的非临时美国专利申请;代理人案卷号为38935/04015的题为“helicalcone-beamcomputedtomographyimagingwithanoff-centereddetector(使用偏心检测器的螺旋锥形射束计算机断层扫描成像)”的非临时美国专利申请;代理人案卷号为38935/04021的题为“multi-passcomputedtomographyscansforimprovedworkflowandperformance(提高工作流程和性能的多通道计算机断层成像扫描)”的非临时美国专利申请;代理人案卷号为38935/04012的题为“methodandapparatusforscatterestimationincone-beamcomputedtomography(用于锥形射束计算机断层扫描中的散射估计的方法和装置)”的非临时美国专利申请;代理人案卷号为38935/04014的题为“asymmetricscatterfittingforoptimalpanelreadoutincone-beamcomputedtomography(锥形束计算机断层扫描中用于优化面板读取的非对称散射拟合)”的非临时美国专利申请;代理人案卷号为38935/04018的题为“methodandapparatusforimprovingscatterestimationandcorrectioninimaging(用于改善成像中的散射估计和校正的方法和装置)”的非临时美国专利申请;以及代理人案卷号为38935/04022的题为“methodandapparatusforimagereconstructionandcorrectionusinginter-fractionalinformation(利用段间信息进行图像重建和校正的方法和装置)”的非临时美国专利申请。以上提到的所有(一个或多个)专利申请和(一个或多个)专利的内容通过引用的方式全部并入本文。
公开的技术的各方面涉及利用多模式放射进行成像,并且更具体地,涉及将低能量放射(例如,千伏(kv))和高能量放射(例如,兆伏(mv))组合用于改进的成像,包括用于计算机断层成像(ct)扫描的低能量放射(例如,千伏(kv))和高能量放射(例如,兆伏(mv))组合。
背景技术:
诸如肿瘤和病变等病理解剖可以通过诸如手术之类的侵入性操作来治疗,这对于患者而言可能是有伤害的并且充满了风险。用于治疗病理解剖(例如,肿瘤、病变、血管畸形、神经紊乱等)的非侵入性方法是外部束放射疗法,其通常使用诸如线性加速器(linac)之类的治疗性放射源来生成放射束(例如,x射线)。在一种类型的外部束放射疗法中,在患者位于射束的视场中的情况下,治疗性放射源从多个角度将一系列的x射线束引导到肿瘤部位处。随着治疗性放射源的角度变化,每个射束穿过肿瘤部位,但在其通往肿瘤以及来自于肿瘤的路径上穿过健康组织的不同区域。结果是,肿瘤处的累积放射剂量高,而对健康组织的累积放射剂量相对较低。
术语“放射外科治疗(radiosurgery)”是指在其中与在更多治疗阶段或分割(fraction)中以每个分割较低剂量的施照(delivery)相比,在较少治疗阶段或分割中以足以使病状坏死的剂量向靶区域施加放射的操作。与放射疗法(radiotherapy)不同,放射外科治疗的特征通常在于每次分割相对较高的放射剂量(例如,500-2000厘戈瑞(centigray))和大剂量少分割(例如,1-5个分割或治疗天数)。放射疗法通常的特征在于每次分割低剂量(例如,100-200厘戈瑞)和超分割放射治疗(例如,30-45个分割)。为方便起见,除非另有说明,否则术语“放射治疗”和“放射疗法”在本文中可互换使用,以表示放射外科治疗和/或放射疗法。
图像引导放射治疗(igrt)系统包括基于门架(gantry)的系统和基于机械臂的系统。在基于门架的系统中,门架使治疗性放射源围绕通过等中心点的轴进行旋转。基于门架的系统包括c形臂门架,在该c形臂门架中,治疗性放射源以悬臂式方式安装在通过等中心点的轴上并围绕通过等中心点的轴进行旋转。基于门架的系统还包括环形门架,其具有通常为环形的形状,在该环形门架中患者的身体延伸通过环/环面的孔,并且治疗性放射源被安装在环的周边上并且围绕通过等中心点的轴旋转。传统的门架系统(环形或c形臂)以设定的角度来施照治疗性放射,该设定的角度由放射源的旋转轨迹限定。在基于机械臂的系统中,治疗性放射源被安装在铰接式机械臂上,该铰接式机械臂在患者上方和周围延伸,该机械臂被配置为提供至少五个自由度。基于机械臂的系统提供从多个平面外方向施照治疗性放射的能力,即,能够非共面施照。
与每个放射治疗系统相关联的是成像系统,其提供用于建立并且在一些示例中用于指导放射施照过程并跟踪治疗中目标运动的治疗中图像。为了进行设置并为了治疗中的图像,mv成像系统可以将检测器放置在治疗源的对面,以对患者进行成像,而其他方法则为了进行患者设置并为了治疗中的图像,利用(一个或多个)独特且独立的图像放射源和/或(一个或多个)检测器。治疗期间的目标或目标体积跟踪通过将治疗中的图像与先前的治疗图像信息或治疗前的图像信息进行比较来完成。治疗前的图像信息可以包括例如ct数据、锥形束ct(cbct)数据、磁共振成像(mri)数据、正电子发射断层扫描(pet)数据或3d旋转血管造影(3dra)数据和/或任何从这些成像模式获得的信息(例如但不限于,数字重建的放射影像(drr))。
在一种常见的情景下,治疗源是产生治疗性放射的linac(其可以是例如mv源),并且成像系统包括一个或多个独立的x射线成像源(每个可以是例如kv源),其产生较低能量的成像放射。治疗中的图像可以包括在一个或多个不同的视点(pointsofview)采集的一个或多个(优选地,至少两个)二维图像(通常x射线)(例如,立体x射线图像),并且可以例如与从三维治疗前的图像信息导出的二维drr进行比较。drr是通过将假设的x射线投射通过3d成像数据而生成的合成x射线图像,其中,假设的x射线的方向和定向模拟治疗中的x射线成像系统的几何形状。结果所得到的drr则具有与治疗中的x射线成像系统几乎相同的缩放(scale)和视点,并且可以与治疗中的x射线图像进行比较以确定目标的位置和定向,然后它们可以被用于指导到目标的放射的施照。
在另一种常见的情景下,安装在门架上的治疗性放射源或独立的x射线成像源(例如kv源)被用于获取多个视图并重建体积图像-ct图像。获取针对至少180度加上成像束扇形角度的视图(也称为投射图),以便为重建3d体积或各个轴向切片提供完全的数学支持。与x射线源相对安装的成像检测器可以是用于一次获取单个切片的数据的单行检测器,也可以是用于一次获取多个切片的数据的多行检测器或全二维平板检测器。
放射治疗中通常有两个总体目标:(i)将高度适形的剂量分布施照给目标体积(通过利用ct成像使放射的施照/剂量符合目标的形状;尽可能地保留正常组织);以及(ii)在每个治疗分割的整个过程中都以高准确度施照放疗束。第三个目标可以是在每分割的尽可能少的时间内完成两个总体目标。施照更适形的剂量分布可能需要例如施照非共面射束的能力。更准确地施照治疗射束可能需要跟踪分割治疗内的目标体积的位置的能力。提高施照速度的能力要求准确、精确和快速地移动放射源而不会撞击房间或患者体内的其他对象和/或违反监管机构的速度限制的能力。
基于环形门架的系统表现出相对高的机械稳定性,并且可以可以重复且准确地定位放射源,包括以相对高的机械驱动速度进行定位,从而避免了基于机械臂和/或c形臂门架的系统所表现出的某些局限性。
关于治疗中的成像,已经提出了x射线断层融合(tomosynthesis)作为与放射治疗系统结合使用的治疗中的kv成像模式。x射线断层融合是指使用以许多不同角度入射到目标体积上的x射线来获取目标体积的相应数量的二维x射线投射图像,然后对二维x射线投射图像进行数学处理以产生表示目标体积的一个或多个相应切片的一个或多个断层融合重建图像的集合的过程,其中,x射线投射图像的数量少于ct图像重建所需的该集合中的重建图像的数量,和/或入射的放射角度的数量或范围小于ct成像过程中所使用的角度的数量或范围。通常,生成多个断层融合重建图像,每个断层融合重建图像表示目标体积的不同切片,并且因此有时断层融合重建图像的集合被称为断层融合体积。如本文所使用的,术语断层融合投射图像是指在断层融合成像过程期间获取的二维x射线投射图像中的一个。
为了上述术语的目的,对于一些优选实施例,ct图像重建所需的图像的集合被认为包括在至少180度加上扇形射束角度的源角度的范围上生成的图像(例如,300个或更多)。对于一些优选实施例,用于构造断层融合成图像的x射线投射图像是在1度与小于用于ct成像的完整的投射集所需的角度范围值(例如,180度加上扇形角度)的角度范围值之间的角度范围上采集的,其中,在此角度范围内生成的投射图像的数量是在2到1000之间的值。在其他优选实施例中,用于构造断层融合图像的x射线投射图像是在5度和45度之间的角度范围上采集的,其中,在此范围内生成的投射图像的数量在5到100之间。
第6,778,850号美国专利(其通过引用并入本文)公开了将x射线断层融合图像用作治疗中的kv成像模式(更具体地,使用从以不同角度获取的多个二维诊断图像合成的目标区域的相对低清晰度的处理内的3d图像)。
还已经提出cbct作为与放射治疗系统结合使用的治疗中的成像模式,在某些情况下作为kv成像模式,而在其他情况下作为mv(射野)成像模式。尽管常规的ct成像从1d投射图通过目标体积重建2d切片,然后堆叠2d切片以形成3d体积图像,但是cbct成像直接从目标体积的2d投射图构建3d体积图像。cbct提供了从围绕目标体积的单次门架旋转(更具体地,至少180度加上扇形射束角度的旋转)形成3d图像体积的能力,而常规的ct要求更多的旋转才能形成相同的图像体积,包括例如每个切片一次旋转(对于单行检测器)或每个切片1/m次旋转(对于具有m行的准线性多行检测器)。cbct还提供了更各向同性的空间分辨率,而常规的ct将纵向方向上的空间分辨率限制为切片厚度。但是,由于常规的ct系统通常在其线性或准线性行检测器附近提供的准直度要比cbct系统通常可以在其二维检测器附近提供的准直度高得多,因此,相比于常规的ct系统,散射噪声和伪影对于cbct系统来说更成问题。另外,单旋转cbct(除了散射之外)的主要问题是除了中心切片(包含旋转的一个切片)之外,所有切片上的采样均不充足。
在治疗之前,可以获取计划图像以进行治疗规划。随后,在每个治疗分割之前,可以采集cbct图像并将其与治疗前的计划图像进行比较,比较的结果用于修改该治疗分割的治疗计划,例如以补偿分次放疗间(interfraction)设置误差和/或分次放疗间器官运动。由于允许的c形臂门架旋转速度(例如,每分钟一次旋转)的限制(其导致cbct采集时间比患者的呼吸(或其他生理周期)慢),所以可以在cbct采集期间使用与患者呼吸(或其他生理周期)同步的门控方案(gatingscheme),以减少重建图像中器官运动的有害影响。而且,由于相对慢的cbct采集时间,cbct体积数据通常仅对每个放疗分割之前的患者设置有用,而对分割治疗内的运动校正无用。
第9,687,200号美国专利(其通过引用并入本文)公开了可平移的环形门架用于放射治疗。提供了一种igrt设备,其包括具有中心开口的环形门架和耦接到该环形门架的放射治疗头,该放射治疗头可围绕该中心开口以至少180度的弧度旋转。
关于已知的医学成像和/或放射治疗系统已出现一个或多个问题,下文中进一步描述的一个或多个实施例至少部分解决了这些问题。例如,提高相应的图像集之间的空间配准的精度以允许更精确的放射放疗施照,减少图像伪影(例如,散射、金属和射束硬化、图像模糊、运动等),以及利用双能量成像(例如,用于材料分离和定量成像、患者设置、在线自适应igrt等)。
技术实现要素:
在一个实施例中,一种多模式成像设备包括:可旋转的门架系统,其被定位成至少部分地围绕患者支撑物;第一放射源,耦接到可旋转的门架系统,该第一放射源被配置用于成像放射(imagingradiation);第二放射源,耦接到可旋转的门架系统,该第二放射源被配置用于成像放射或治疗性放射中的至少一个,其中,该第二放射源具有超过第一放射源的能量水平;以及第一放射检测器,耦接到可旋转的门架系统,并且定位成从第一放射源或第二放射源中的至少一个接收放射;其中,来自第一放射源的第一测得的投射数据比来自第二放射源的第二测得的投射数据具有更大的衰减,并且其中,与第一测得的投射数据相关联的第一衰减估计基于第二测得的投射数据。
相对于一个实施例所描述和/或示出的特征可以在一个或多个其他实施例中以相同的方式或以类似的方式使用,和/或与其他实施例的特征组合使用或替代其他实施例的特征使用。
本发明的描述不以任何方式限制权利要求中使用的词语或者权利要求或本发明的范围。权利要求中使用的词语具有其全部普通含义。
附图说明
在附图中,示出了本发明的实施例,附图被并入说明书中并构成说明书的一部分,附图与以上给出的本发明的总体描述以及以下给出的详细描述一起用于举例说明本发明的实施例。应当理解,图中所示的元素边界(例如,盒子、成组的盒子或其他形状)表示边界的一种实施例。在一些实施例中,一个元素可以被设计为多个元素,或者多个元素可以被设计为一个元素。在一些实施例中,被示为另一个元素的内部组件的元素可以被实现为外部组件,并且反之亦然。此外,元素可能未按比例绘制。
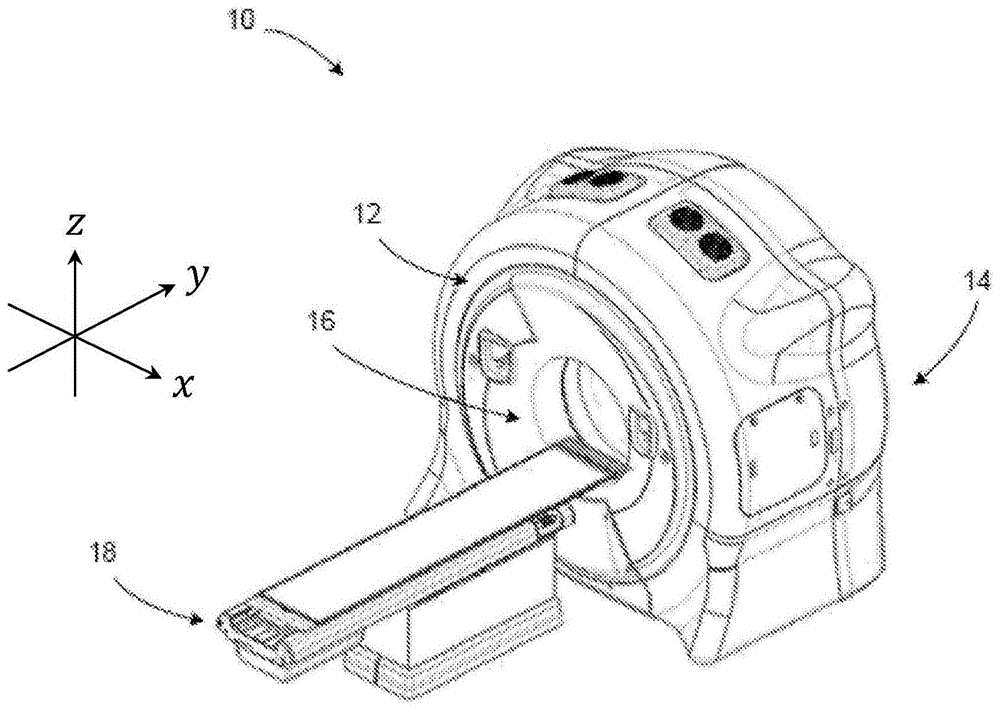
图1是根据公开的技术的一个方面的示例性多模式放射疗法设备的透视图。
图2是根据公开的技术的一个方面的示例性多模式放射疗法装置的示意图。
图3示出了示例性放射治疗环境。
图4示出了示例性多模式扫描配置的图示。
图5示出了另一个示例性多模式扫描配置的图示。
图6以叠加视图示出了多模式扫描配置的示例性模式的图示。
图7示出了图6中所示的目标的放大部分的图示。
图8是描绘组合来自多个放射模式的扫描数据的示例性方法的流程图。
图9是描绘组合来自多个放射模式的扫描数据以进行散射校正的示例性方法的流程图。
图10是描绘组合来自多个放射模式的扫描数据以减少金属和射束硬化伪影的示例性方法的流程图。
图11是描绘组合来自多个放射模式的扫描数据以进行时间分辨率校正的示例性方法的流程图。
图12是描绘组合来自多个放射模式的扫描数据以进行运动伪影校正的示例性方法的流程图。
图13是描绘组合来自多个放射模式的扫描数据以进行材料分离和/或定量成像的示例性方法的流程图。
图14是描绘组合来自多个放射模式的扫描数据以进行患者设置的示例性方法的流程图。
图15是描绘组合来自多个放射模式的扫描数据以进行在线自适应igrt的示例性方法的流程图。
图16是描绘使用放射疗法装置的igrt的示例性方法的流程图。
图17是描绘示例性的基于图像的施照前步骤/选项的框图。
图18是描绘可以在成像和/或随后的基于图像的施照前步骤期间使用的示例性数据源的框图。
图19是描绘使用放射疗法装置的包括患者设置或对准的示例性方法的流程图。
图20是描绘使用放射疗法装置的包括自适应igrt的示例性方法的流程图。
具体实施方式
以下包括可以在整个公开中使用的示例性术语的定义。所有术语的单数形式和复数形式均落入每种含义内。
如本文中所使用的,“组件”可以被定义为硬件的一部分、软件的一部分或其组合。硬件的一部分可以至少包括处理器和存储器的一部分,其中,存储器包括要执行的指令。组件可以与装置相关联。
如本文中所使用的,与“电路”同义的“逻辑”包括但不限于硬件、固件、软件和/或每一个的组合以执行功能或动作。例如,基于期望的应用或需求,逻辑可以包括软件控制的微处理器、诸如专用集成电路(asic)之类的离散逻辑、或其他编程的逻辑装置和/或控制器。逻辑也可以完全体现为软件。
如本文中所使用的,“处理器”包括但不限于实际上任何数量的处理器系统或独立处理器中的一个或多个,例如,以任何组合的微处理器、微控制器、中央处理单元(cpu)和数字信号处理器(dsp)。处理器可以与支持处理器的操作的各种其他电路相关联,例如随机存取存储器(ram)、只读存储器(rom)、可编程只读存储器(prom)、可擦可编程只读存储器(eprom)、时钟、解码器、存储器控制器或中断控制器等。这些支持电路可以在处理器或其关联的电子封装的内部或外部。支持电路与处理器可操作地通信。支持电路不必在框图或其他附图中与处理器分开示出。
如本文所使用的,“信号”包括但不限于一个或多个电信号(包括模拟或数字信号)、一个或多个计算机指令、比特或比特流等。
如本文所使用的,“软件”包括但不限于使计算机、处理器、逻辑和/或其他电子装置执行功能、动作和/或以期望的方式行动的一个或多个计算机可读和/或可执行指令。指令可以以各种形式来体现,例如例程、算法、模块或程序,包括来自动态链接的源或库的单独的应用或代码。
尽管已经提供了上述示例性限定,但是申请人的意图是将与本说明书一致的最广泛的合理解释用于这些和其他术语。
如下面更详细地讨论的,公开的技术的实施例涉及多模式成像/放射疗法装置和方法。在一些实施例中,放射疗法施照装置和方法可以与igrt结合使用或作为igrt的一部分使用用于成像的集成的低能量放射源以及用于成像和/或治疗的高能量放射源。特别地,例如,放射疗法施照装置和方法可以将低能量准直放射源与高能量放射源组合起来,该低能量准直放射源用于使用旋转(例如,螺旋或步进拍摄)的图像采集在门架中进行成像,该高能量放射源用于成像和/或治疗性处理。可以利用来自低能量放射源(例如,kv)和高能量放射源(例如,mv)的互补信息和优势。例如,在低能量下,软组织的固有对比度可能更高,而在高能量下,不存在通过宽的或密的结构的初级光子的匮乏。kv和mv成像数据可用于相互补充以产生更高质量的图像。对于目标对象和高危器官(oars)的可视化、自适应疗法监测以及治疗规划/重新计划,可能需要高质量的体成像(volumeimaging)。在一些实施例中,多模式系统还可以用于定位、运动跟踪和/或表征或校正能力。
图像采集方法可以包括或以其他方式利用多次旋转扫描,该多次旋转扫描可以是例如连续扫描(例如,具有围绕中心轴的螺旋源轨迹以及患者支撑物通过门架孔的纵向移动)、具有患者支撑物的增量纵向移动的非连续圆形止动回动扫描、步进拍摄环形扫描等。
根据各种实施例,多模式设备使用例如射束成形器(其可以包括准直器)来限制射束从而对放射源进行准直成,包括例如准直成锥形射束或扇形射束。在一个实施例中,准直射束可以与在患者移动的同时连续旋转的门架组合,从而产生螺旋图像采集。
在一些实施例中,与增加的扫描旋转相关联以用于完成高质量体积图像的时间可以通过高门架速率/速度(例如,使用快速滑环旋转,包括例如高达10rpm(rpm指每分钟转数)、高达20rpm、高达60rpm或更高的rpm)、高帧速率和/或稀疏数据重建技术来减轻,以在放射疗法施照平台上提供ct质量成像。检测器(具有各种行/切片大小、配置、动态范围等)、扫描间距和/或动态准直是各种实施例中的附加特征,包括用于选择性地暴露检测器的各部分并选择性地限定有效的读取区。
多模式设备和方法可以提供由放射源发出的放射束的选择性和可变的准直,包括调整放射束的形状以暴露小于关联的放射检测器(例如,定位成从x射线放射源接收放射的放射检测器)的整个有效区。而且,仅使检测器的主要区域暴露于直接放射可以允许检测器的阴影区域仅接收散射。在一些实施例中,检测器的阴影区域中的散射测量结果(并且在一些实施例中,为半影区域中的测量结果)可以用于估计接收投射数据的检测器的主要区域中的散射。
多模式设备和方法可以提供选择性和可变的检测器读取区和范围,包括调整检测器读取范围以限制检测器的有效区从而提高读取速度。例如,少于可用的阴影区域数据可以被读取并用于散射估计。将选择性读取与射束成形相结合允许对散射拟合技术进行各种优化。
参考图1和图2,示出了多模式设备10。应当理解,多模式设备10可以与放射疗法装置(如图2所示)相关联和/或集成到放射疗法装置中,该放射疗法装置可以用于多种应用,包括但不限于igrt,例如作为igrt施照系统(例如,图3中所示的并在下面详细讨论的igrt施照系统104)。多模式设备10包括可旋转门架系统,称为门架12,其由支撑单元或壳体14支撑或以其他方式容纳在支撑单元或壳体14中。本文中的门架是指包括一个或多个门架(例如,环形或c形臂)的门架系统,这些门架在它们围绕目标对象旋转时,能够支撑一个或多个放射源和/或关联的检测器。例如,在一个实施例中,第一放射源及其关联的检测器可以安装到门架系统的第一门架,并且第二放射源及其关联的检测器可以安装到门架系统的第二门架。在另一个实施例中,多于一个的放射源及关联的(一个或多个)检测器可以安装到门架系统的相同门架,包括例如门架系统仅由一个门架组成的情况。门架、放射源和放射检测器的各种组合可以被组合成各种门架系统配置,以在相同设备内对相同体积进行成像和/或治疗。例如,kv放射源和mv放射源可以安装在门架系统的相同或不同的门架上,并作为igrt系统的一部分选择性地用于成像和/或治疗。如果安装到不同的门架,则放射源能够独立旋转,但仍然能够同时对相同(或近乎相同)的体积进行成像。如上所述,可旋转的环形门架12可以能够为10rpm或更高。可旋转门架12限定门架孔16,患者可以移动进入并穿过门架孔16并且定位,以进行成像和/或治疗。根据一个实施例,可旋转门架12被配置为滑环门架,用于提供放射源和关联的(一个或多个)放射检测器的连续旋转,同时提供足够的带宽用于由检测器接收的高质量成像数据。滑环门架可以消除门架在交替方向上的旋转,以便缠绕和解绕承载与装置关联的功率和信号的电缆。即使在被集成到igrt系统中时,这种配置也可以进行连续的螺旋计算机断层扫描,包括cbct。如上所述,单旋转cbct的主要问题在于,除中心切片(包含旋转的切片)以外的所有切片上的采样均不足。这可以通过螺旋轨迹锥形射束成像来克服。
患者支撑物18定位成与可旋转门架12相邻,并被配置为通常在水平位置支撑患者,以纵向移动进入可旋转门架12并移动到可旋转门架12内部。患者支撑物18可以例如在垂直于门架12的旋转平面(沿着或平行于门架12的旋转轴线)的方向上移动患者。患者支撑物18可以可操作地耦接到患者支撑控制器,该控制器用于控制患者和患者支撑物18的移动。患者支撑控制器可以与可旋转门架12以及安装到旋转门架的放射源同步,以用于根据命令的成像和/或治疗计划来围绕患者的纵轴旋转。一旦患者支撑物位于孔16中,它也可以在有限的范围内上下、左右移动,以调整患者位置来获得最佳治疗。示出了轴x、y和z,其中,从门架12的正面来看,x轴是水平的并且指向右边,y轴指向门架平面中,并且z轴是竖直的并指向顶部。x、y和z轴遵循右手定则。
如图2所示,多模式设备10包括低能量放射源(例如,kv)30,其耦接到可旋转门架12或以其他方式由可旋转门架12支撑。在该实施例中,低能量放射源30是成像放射的源并发出用于生成高质量图像的放射束(通常表示为32)。在该实施例中,成像放射的源是x射线源30,其被配置为千伏(kv)源(例如,能量水平在大约20kv至大约150kv的范围内的临床x射线源)。在一个实施例中,低能量放射源包括高达150kev的千电子伏特峰值光子能量(kev)。成像放射源可以是适用于成像的任何类型的透射源。例如,成像放射源可以是例如x射线生成源(包括用于ct的x射线生成源)或产生具有足够能量和通量的光子的任何其他方式(例如,伽马源(例如,钴57,能量峰值在122kev)、x射线荧光源(例如,通过pbk线的荧光源,在@约70kev和@约82kev处具有两个峰)等)。对于特定实施例,本文中对x射线、x射线成像、x射线成像源等的引用是示例性的。在其他各种实施例中,其他成像透射源可以互换使用。x射线检测器34(例如,二维平板检测器或弯曲的检测器)可以耦接到可旋转门架12或以其他方式由可旋转门架12支撑。x射线检测器34定位成从x射线源30接收放射,并且可以与x射线源30一起旋转。
应当理解,在不脱离公开的技术的范围的情况下,x射线检测器34可以采取多种配置。如图2所示,x射线检测器34可以被配置为平板检测器(例如,多行平板检测器)。根据另一个示例性实施例,x射线检测器34可以被配置为弯曲的检测器。检测器34可以检测或以其他方式测量未衰减的放射量,并因此推断出实际上由于患者或关联的患者roi而衰减的放射量(与最初生成的放射量进行比较)。随着低能量放射源30围绕患者旋转并朝向患者发出放射,检测器34可以从不同角度检测或以其他方式收集衰减数据。
尽管图1和图2描绘了具有安装到环形门架12的放射源30的多模式设备10,但是其他实施例可以包括其他类型的可旋转成像设备,包括例如基于c形臂门架的系统和基于机械臂的系统。在基于门架的系统中,门架使成像放射源30围绕通过等中心点的轴进行旋转。基于门架的系统包括c形臂门架,在该c形臂门架中,成像放射源30以悬臂式方式安装在通过等中心点的轴上方并围绕该轴旋转。基于门架的系统还包括环形门架,例如可旋转门架12,其具有通常为环形的形状,在其中患者的身体延伸通过环/环面的孔,并且成像放射源30安装在环的周界上并且围绕通过等中心点的轴旋转。在一些实施例中,门架12连续旋转。在其他实施例中,门架12利用基于电缆的系统,该系统反复地旋转和反转。
相对于x射线源30来对准直器或射束成形器组件(通常表示为36)进行定位,以选择性地控制和调整由x射线源30发出的放射束32的形状,从而选择性地暴露x射线检测器34的有效区的一部分或一个区域。射束成形器还可以控制放射束32如何定位在x射线检测器34上。在一个实施例中,射束成形器36可以具有一个度/维度的运动(例如,以形成较细或较宽的狭缝)。在另一个实施例中,射束成形器36可以具有两个度/维度的运动(例如,以形成各种尺寸的矩形)。在其他实施例中,射束成形器36可以具有各种其他动态控制的形状,包括例如平行四边形。所有这些形状都可以在扫描期间中动态地调整。在一些实施例中,可以旋转和/或平移射束成形器的阻挡部分。
可以控制射束成形器36以按照许多几何形状动态地调整由x射线源30发出的放射束32的形状,包括但不限于扇形射束或锥形射束,其具有低至一个检测器行宽度的射束厚度(宽度)或包括多个检测器行,多个检测器行可以仅是该检测器的有效区的一部分。在各种实施例中,射束的厚度可以暴露几厘米的较大的检测器有效区。例如,5-6厘米检测器的(在检测器平面中在纵向方向上测得的)3-4厘米可以被选择性地暴露于成像放射32。在该实施例中,每次读取时可以捕获3-4厘米的投射图像数据,在一侧或每侧大约有1-2厘米的未暴露的检测器区,其可用于捕获散射数据,如下所述。
在其他实施例中,有效检测器的或多或少的一部分可以选择性地暴露于成像放射。例如,在一些实施例中,射束厚度可以减小到大约两厘米、一厘米、小于一厘米或相似大小的范围,包括利用更小的检测器。在其他实施例中,射束厚度可以增加到大约4厘米、5厘米、大于5厘米或类似大小的范围,包括利用更大的检测器。在各种实施例中,暴露的检测器区与有效的检测器区的比率(ratioofexposed-to-activedetectorarea)可以是30-90%或50-75%。在其他实施例中,暴露的检测器区与有效的检测器区的比率可以是60-70%。然而,在其他实施例中,各种其他的暴露区大小和有效区大小或暴露的检测器区与有效的检测器区的比率可能是合适的。射束和检测器可以被配置为使得检测器的阴影区域(有效的但未暴露于直接放射)足以捕获半影区域以外的散射数据。
各种实施例可以包括控制检测器的选择性暴露的特征的优化(例如,射束大小、射束/孔径中心、准直、间距、检测器读取范围,检测器读取中心等),使得测得的数据对于主要(暴露的)区域和阴影区域而言是足够的,但还针对速度和剂量控制进行了优化。可以控制射束成形器36的形状/位置和检测器34的读取范围,使得基于正在执行的特定成像任务和散射估计过程,来自x射线源30的放射束32尽可能多地或尽可能少地覆盖x射线检测器34,例如,包括窄和宽轴向视场(afov)扫描的组合。设备10具有采集单旋转锥形射束以及宽束角和窄束角图像、螺旋图像或其他图像的能力。
可以以各种方式配置射束成形器36,以允许其调整由x射线源30发出的放射束32的形状。例如,射束成形器36可以被配置为包括一组钳口(jaw)或其他合适的构件,其限定并选择性地调整孔径的尺寸,来自x射线源30的放射束可以以准直的方式穿过该孔径。根据一个示例性配置,射束成形器36可包括上钳口和下钳口,其中,上钳口和下钳口可在不同方向(例如,平行方向)上移动,以调整来自x射线源30的放射束穿过的孔径的尺寸,并且还调整相对于患者的射束32位置,以仅照射要成像的患者的部分,从而优化成像并最小化患者剂量。
根据一个实施例,来自x射线源30的放射束32的形状可以在图像采集期间改变。换句话说,根据一种示例性实现方式,可以在扫描之前或期间调整射束成形器36的叶片位置和/或孔径宽度。例如,根据一个实施例,可以在x射线源30的旋转期间选择性地控制和动态地调整射束成形器36,使得放射束32的形状具有足够的主要/阴影区域,并且被调整为仅包括成像期间关注的对象(例如,前列腺)。由x射线源30发出的放射束32的形状可以在扫描期间或之后根据期望的图像采集而改变,期望的图像采集可以基于成像和/或治疗反馈,如下面更详细地讨论。
如图2所示,多模式设备10可与包括高能量放射源(例如,mv)20的放射疗法装置集成在一起,该高能量放射源20耦接到可旋转门架12或以其他方式由可旋转门架12支撑。根据一个实施例,高能量放射源20被配置为治疗性放射源,例如,用于治疗关注区域中的患者体内的肿瘤的高能量放射源。在其他实施例中,高能量放射源20也被配置为成像放射的源,或至少被这样利用。将理解的是,治疗性放射的源可以是高能量x射线束(例如,mvx射线束)和/或高能量粒子束(例如,电子束、质子束或重离子(例如,碳)束)或另一个合适形式的高能量放射。在一个实施例中,高能量放射源20包括1mev或更大的兆电子伏特峰值光子能量(mev)。在一个实施例中,高能量x射线束具有大于0.8mev的平均能量。在另一个实施例中,高能量x射线束具有大于0.2mev的平均能量。在另一个实施例中,高能量x射线束具有大于150kev的平均能量。通常,高能量放射源20具有比低能量放射源30更高的能量水平(峰值和/或平均值等)。
在一个实施例中,高能量放射源20是产生治疗性放射(例如,mv)的linac,并且成像系统包括独立的低能量放射源30,其产生相对低强度和较低能量的成像放射(例如,kv)。在其他实施例中,治疗性放射源20可以是放射性同位素,例如,钴-60,其通常可以具有大于1mev的能量。高能量放射源20可以根据治疗计划向被支撑在患者支撑物18上的患者内的关注区域(roi)发出一个或多个放射束(通常由22表示)。
在各种实施例中,高能量放射源20被利用作为治疗性放射的源和成像放射的源。如下面详细讨论的,放射源20、30可以彼此结合使用以提供更高质量和被更好地利用的图像。本文中对治疗性放射源20的引用是为了将高能量放射源20与低能量放射源30区分开,低能量放射源30可以仅用于成像。然而,对治疗性放射源20的引用包括其中治疗性放射源20(高能量放射源)可以用于治疗和/或成像的实施例。在其他实施例中,至少一个另外的放射源可以耦接到可旋转门架12,并且被操作以在与放射源20、30的峰值光子能量不同的峰值光子能量下获取投射数据。
检测器24可以耦接到可旋转门架12或以其他方式由可旋转门架12支撑,并且被定位成接收来自治疗性放射源20的放射22。检测器24可以检测或以其他方式测量未衰减的放射量,并因此推断出实际上由于患者或关联的患者roi而衰减的放射量(与最初生成的放射量进行比较)。随着治疗性放射源20围绕患者旋转并朝向患者发出放射,检测器24可以从不同角度检测或以其他方式收集衰减数据。
将进一步理解到,治疗性放射源20可以包括射束成形器或准直器或以其他方式与之相关联。与治疗性放射源20相关联的射束成形器可以以多种方式配置,类似于与成像源30相关联的射束成形器36。例如,射束成形器可以被配置为多叶准直器(mlc),其可以包括多个交错的叶片,这些叶片是可操作的以移动到最小打开或关闭位置与最大打开位置之间的一个或多个位置。应当理解,叶片可以移动到期望的位置,以实现由放射源发出的放射束的期望形状。在一个实施例中,mlc能够达到亚毫米级的瞄准准确度。
治疗性放射源20可以被安装、配置和/或移动到与成像源30相同的平面或不同的平面(偏移)中。在一些实施例中,由放射源20、30的同时激活引起的散射可以通过使放射平面偏移而减小。
在其他实施例中,可以通过交错激活来避免散射。例如,在同时多模式成像的情况下,采集可以在没有并发的各个脉冲的情况下是并发的。在另一个实施例中,基于阴影的散射校正的使用可以用于例如解决kv检测器上的mv散射的问题。
当与放射疗法装置集成在一起时,多模式设备10可以提供图像,这些图像用于设置(例如,对准和/或配准)、计划和/或指导放射施照程序(治疗)。通过将当前(治疗中的)图像与治疗前的图像信息进行比较来完成典型的设置。治疗前的图像信息可以包括例如ct数据、锥形束ct数据、mri数据、pet数据或3d旋转血管造影(3dra)数据和/或任何从这些或其他成像模式获得的信息。在一些实施例中,多模式设备10可以跟踪治疗中的患者、目标对象或roi运动。
重建处理器40可以可操作地耦接到检测器24和/或检测器34。在一个实施例中,重建处理器40被配置为基于检测器24、34从放射源20、30接收到的放射来生成患者图像。应当理解,重建处理器40可以被配置为用于执行以下更全面描述的方法。设备10还可包括适合于存储信息的存储器44,该信息包括但不限于处理和重建的算法和软件、成像参数、来自先前的或以其他方式先前采集的图像(例如,计划图像)的图像数据、治疗计划等。
多模式设备10可以包括操作者/用户接口48,在接口处,设备10的操作者可以与设备10交互或以其他方式控制设备10,以提供与扫描或成像参数等有关的输入。操作者接口48可以包括任何合适的输入装置,例如键盘、鼠标、声音激活的控制器等。设备10还可以包括显示器52或其他人类可读元件,用于向设备10的操作者提供输出。例如,显示器52可以允许操作者观察重建的患者图像和其他信息,例如与设备10的操作有关的成像或扫描参数。
如图2所示,多模式设备10包括控制器(通常表示为60),其可操作地耦接到设备10的一个或多个组件。控制器60控制设备10的整体运转和操作,包括向x射线源30和/或治疗性放射源20以及控制可旋转门架12的旋转速度和位置的门架马达控制器提供功率和时序信号。应当理解,控制器60可以涵盖以下中的一个或多个:患者支撑控制器、门架控制器、耦接到治疗性放射源20和/或x射线源30的控制器、射束成形器控制器、耦接到检测器24和/或x射线检测器34的控制器等。在一个实施例中,控制器60是可以控制其他组件、装置和/或控制器的系统控制器。
在各种实施例中,重建处理器40、操作者接口48、显示器52、控制器60和/或其他组件可以组合成一个或多个组件或装置。
设备10可以包括各种组件、逻辑和软件。在一个实施例中,控制器60包括处理器、存储器和软件。通过示例而非限制的方式,多模式设备和/或放射疗法系统可以包括各种其他装置和组件(例如,门架、放射源、准直器、检测器、控制器、电源、患者支撑物等),其可以针对特定应用实现与成像和/或igrt相关的一个或多个例程或步骤,其中,例程可以包括成像、基于图像的施照前步骤和/或放疗施照,包括可以存储在存储器中的相应的装置设置、配置和/或位置(例如,路径/轨迹)。此外,控制器可以根据存储在存储器中的一个或多个例程或过程来直接或间接地控制一个或多个装置和/或组件。直接控制的示例是与成像或治疗相关联的各种放射源或准直器参数(功率、速度、位置、定时、调制等)的设置。间接控制的示例是将位置、路径、速度等传达到患者支撑控制器或其他外围装置。可以与设备相关联的各种控制器的层级结构可以以任何合适的方式布置,以将合适的命令和/或信息传达到期望的装置和组件。
此外,本领域技术人员将理解到,可以利用其他计算机系统配置来实现系统和方法。可以在分布式计算环境中实践本发明的所示方面,在分布式计算环境中,某些任务由通过通信网络链接的本地或远程处理装置执行。例如,在一个实施例中,重建处理器40可以与单独的系统相关联。在分布式计算环境中,程序模块可以位于本地和远程的存储装置中。例如,可以将远程数据库、本地数据库、云计算平台、云数据库或其组合与设备10一起使用。
多模式设备10可以利用示例性环境来实现本发明的各个方面,该示例性环境包括计算机,其中,该计算机包括控制器60(例如,包括处理器和存储器(其可以是存储器44))和系统总线。系统总线可以将系统组件(包括但不限于存储器)耦接到处理器,并且可以与其他系统、控制器、组件、装置和处理器进行通信。存储器可以包括只读存储器(rom)、随机存取存储器(ram)、硬盘驱动器、闪存驱动器以及任何其他形式的计算机可读介质。存储器可以存储各种软件和数据,包括例程和参数,其可以包括例如治疗计划。
治疗性放射源20和/或x射线源30可以可操作地耦接到控制器60,该控制器60被配置为控制治疗性放射源20和x射线源30的相对操作。例如,可以控制x射线源30,并且x射线源30可以与治疗性放射源20同时操作。附加地或替代地,取决于正在实现的特定治疗和/或成像计划,可以控制x射线源30,并且x射线源30可以与治疗性放射源20顺序地操作。例如,在各种实施例中,可以操作放射源20、30,使得来自放射源20、30的测得的投射数据被同时(或基本上/接近(准)同时,例如,彼此之间约50毫秒内)或顺序地(例如,以秒、分钟等分隔开)获取。
将会理解到,放射源20、30和检测器24、34可以被配置为在成像和/或治疗扫描期间以多种方式提供围绕患者的旋转。在一个实施例中,使源20、30的运动和曝光与患者支撑物18的纵向运动同步可以在手术期间提供对患者图像的连续螺旋采集或扫描。除了放射源20、30和检测器24、34的连续旋转(例如,门架以恒定的患者运动速度连续且恒定地旋转)之外,应当理解,在不脱离公开的技术的范围的情况下,可以采用其他变型。例如,可以控制可旋转门架12和患者支撑物,使得在将支撑物控制为(以恒定或可变的速度)相对于可旋转门架12移动时,门架12围绕支撑在患者支撑物上的患者以“来回”方式(例如,交替地进行顺时针旋转和逆时针旋转)进行旋转(与如上文所述的连续的方式相反)。在另一个实施例中,在连续的步进拍摄环形扫描的情况下,患者支撑物18在纵向方向上的移动(步进)与通过可旋转门架12的扫描绕转(revolution)(拍摄)交替,直到捕获到期望的体积为止。多模式设备10能够进行基于体积和基于平面的成像采集。例如,在各种实施例中,多模式设备10可以用于获取体积图像和/或平面图像并执行相关联的处理,包括下面描述的散射估计/校正方法。
可以利用各种其他类型的放射源和/或患者支撑物移动来实现放射源和患者的相对运动以生成投射数据。可以使用放射源和/或患者支撑物的非连续运动、连续但可变/非恒定(包括线性和非线性)的移动、速度和/或轨迹等、以及它们的组合,包括结合上述设备10的各种实施例。
在一个实施例中,门架12的旋转速度、患者支撑物18的速度、射束成形器的形状和/或检测器的读取在图像采集期间可以全部保持恒定。在其他实施例中,这些变量中的一个或多个可以在图像采集和/或治疗期间动态地改变。
在其他实施例中,这些特征可以与一个或多个其他基于图像的活动或程序相结合,包括例如患者设置、自适应疗法监测、治疗计划等。
图3示出了示例性放射治疗环境300。放射治疗环境300包括参考成像系统102和igrt系统104。igrt系统104可以包括例如如上所述的多模式设备10及其各种组件和装置。
在一个实施例中,参考成像系统102可以包括高精度体积成像系统,例如,诸如ct系统或mri系统等系统。鉴于许多临床环境中的成本和工作流程的考虑,参考成像系统102通常是在诊所或医院环境中用于各种不同目的的通用工具,并且不专门特定于igrt系统104或环境300。相反,参考成像系统102可以位于其自己的单独房间或库(vault)中,并且在与igrt系统104相比单独且更广义的基础上进行购买、安装和/或维护。因此,对于图3的实施例,参考成像系统102被示为与igrt系统104不同。在其他实施例中,参考成像系统102可以被认为是igrt系统104的整体组件。例如,多模式设备10具有充当参考成像系统102和igrt系统104的能力。
在该实施例中,igrt系统104包括高能放射治疗(mv)源108,其将高能量x射线治疗性放射选择性地施加到位于患者支撑物或治疗床架tc上的患者p的目标体积。mv源108在系统控制器114(在一个实施例中,更具体地,是治疗性放射控制子系统128)的控制下施加治疗放射。系统控制器114还包括处理电路120、检测器控制器122、床位位置控制器124和kv放射控制器126,每一个都被编程和配置为实现本文进一步描述的一个或多个功能。一个或多个成像(kv)放射源110在kv放射控制器126的控制下选择性地发出相对低能量的x射线成像放射,该成像放射被一个或多个检测器112捕获到。一个或多个检测器112可以捕获来自mv源108的高能量x射线治疗放射,该放射已通过目标体积传播。
每个kv放射源110和mv放射源108相对于igrt系统104和/或治疗室的(x,y,z)坐标系具有可精确测量和/或可精确确定的几何形状,因为它们是动态可移动的。
床位定位器130可以由床位位置控制器124致动以定位床位tc的位置。在一些实施例中,基于非x射线的位置感测系统134使用一种或多种不涉及电离放射的方法(例如,基于光学或基于超声波的方法)感测战略性地附贴到患者的(一个或多个)外部标记的位置和/或移动,和/或感测患者皮肤表面本身的位置和/或移动。igrt系统104还包括操作者工作站116和治疗计划系统118。
在通常的临床实践中,对由参考成像系统102生成的采集之前的治疗计划图像或先前的图像数据106执行治疗计划。采集之前的治疗计划图像106通常是高分辨率三维ct图像,其基本上是在患者将经受的一个或多个放射治疗分割之前(例如,提前一到两天)采集的。如图3中通过用于采集之前的治疗计划图像106的(i,j,k)坐标系(其与为igrt系统104的治疗室示出的(x,y,z)治疗室坐标系不同)的图示所指示的,在治疗计划图像106坐标系和治疗室坐标系之间通常没有预存在的或固有的对准或配准。在治疗计划过程中,医生通常在治疗计划图像内建立坐标系(例如,治疗计划图像106中的i,j,k),该坐标系在本文中也可以称为计划图像坐标系或计划图像参考系。在计划图像坐标系中制定了放射治疗计划,该计划指定在每个治疗分割期间由mv源108施加的高能量治疗放射束的各种定向、大小、持续时间等。当整个施照和跟踪系统(如果存在的话)校准到治疗室坐标系时,将治疗性放射准确地施照到目标需要将计划图像坐标系与治疗室坐标系对准。将理解的是,该对准不需要是精确的,并且还可以理解的是,床位调整或射束施照调整可以用于解决两个坐标系之间的对准中的偏移。
在一个实施例中,紧接在每个治疗分割之前,在经由kv成像放射源110的图像引导下,包括根据下文进一步描述的一个或多个实施例,可以执行基于图像的施照前步骤。例如,患者可以被物理定位或对准,使得计划图像坐标系(例如并且不通过限制的方式,由医生在ct图像或计划图像上创建治疗计划的同时限定)定位到与治疗室坐标系的初始对准中,以下称为初始治疗对准或初始治疗位置。这种对准通常称为患者设置或患者对准。取决于目标体积的位置,目标体积可以在位置和定向上变化和/或由于患者的移动和/或诸如呼吸等生理周期而经历体积变形。如本文中所使用的,术语治疗中的对准变化或治疗中的位置变化用于指代目标体积的当前状态不同于初始治疗对准的位置、定向和/或体积形状的变化。借助治疗计划坐标系和治疗室坐标系之间的已知关系,术语治疗中的对准变化也可以用于指代目标体积的当前状态不同于治疗计划坐标系中的位置、定向或体积形状的变化。更一般地,术语初始治疗对准或初始治疗位置在本文中是指在治疗分割开始时处于患者设置的患者身体部位的特定物理姿势或部署(disposition)(包括位置、定向和体积形状)。
还可以提供基于非x射线的位置感测系统134。该基于非x射线的位置感测系统134可以包括例如以某种方式附贴到患者胸部上的外部标记,该外部标记响应于呼吸而移动,从而可以精确地确定目标位置。也可以使用其他监测呼吸的机制。还可以使用其他非呼吸位置感测系统134,包括例如准静态定位、用于心脏门控的ekg等。系统134可以将外部标记的运动与目标运动相关联,如从例如单x射线投射或立体x射线投射确定的目标运动。因此,基于非x射线的位置感测系统134可以允许系统控制器114监测外部标记运动,使用关联模型来精确地实时(例如,~60hz)预测目标将被定位在何处,并将治疗束定向到目标。随着移动目标的治疗的进展,可以获得另外的x射线图像,并将其用于验证和更新关联模型。
如本文中所使用的,医学图像的“配准”是指确定出现在那些医学图像中的对应的解剖特征或其他(例如,基准)特征之间的数学关系。配准可以包括但不限于确定一个或多个空间变换,当将其应用于医学图像之一或两者时,将引起对应的解剖特征的重叠。空间变换可以包括刚性体变换和/或可变形变换,并且如果医学图像来自不同的坐标系或参考系,则空间变换可以考虑那些坐标系或参考系中的差异。对于没有使用同一成像系统而采集医学图像并且没有同时采集医学图像的情况,配准过程可以包括但不限于确定第一变换以及确定第二变换,该第一变换可以考虑不同成像系统的成像模式、成像几何形状和/或参考系之间的差异,该第二变换考虑采集时间之间可能在身体部位中发生的潜在的解剖差异(例如,定位差异、整体移动、身体部位内的不同结构之间的相对移动、整体变形、身体部分内的局部变形等)。
图像的配准可以在参考成像系统102和igrt施照系统104之间和/或在从多模式igrt施照系统104的各种模式得出的数据和/或图像之间实现,该系统104包括(一个或多个)低能量源110和(一个或多个)高能量源108(以及它们关联的检测器112)。特别地,返回参考设备10,配准可以在从放射源20、30和检测器24、34得出的数据和/或图像之间实现。
在一个实施例中,图4示出了示例性多模式扫描配置400的图示。观察环形门架410的正面,图4示出了安装到环形门架410的高能量放射源420(例如,mv)和低能量放射源430(例如,kv)。放射源420、430被示出为彼此正交地安装,但是其他实施例可以包括其他角度关系以及附加的放射源和/或检测器。高能量放射源420被示为经过射束成形器426投射放射,以产生投射到检测器424的一部分上的放射束422。在这种配置中,高能量放射源420具有经轴视场(fov)428。低能量放射源430被示为经过射束成形器436投射放射,以产生投射到检测器434的一部分上的放射束432。在这种配置中,低能量放射源430具有经轴视场(fov)438。检测器434被示为在其范围435内居中。以这种方式,放射源420、430将使放射投射经过重叠的经轴fov。在该实施例中,多模式扫描配置400示出了,与低能量fov438相比,高能量fov428具有更大的经轴fov。
在另一个实施例中,图5示出了另一个示例性多模式扫描配置500的图示。观察环形门架410的正面,图5还示出了正交地安装到环形门架410的高能量放射源420和低能量放射源430。高能量放射源420被示为经过射束成形器526投射放射,以产生投射到检测器524上的放射束522。在这种配置中,高能量放射源420具有经轴fov528。低能量放射源430被示为经过射束成形器536投射放射,以产生投射到偏移检测器534上的放射束532。在这种配置中,在至少180度旋转的情况下,低能量放射源430具有经轴fov538。以这种方式,放射源420、430还将使放射投射经过重叠的经轴fov。在该实施例中,多模式扫描配置500示出了,与高能量fov528相比,低能量fov538具有更大的经轴fov。
各种因素,包括例如射束成形器配置、放射源角度、检测器位置等,可用于控制放射源的相应的fov(例如,经轴fov和轴向fov)。在一些实施例中,放射源420、430可以沿纵向方向(沿y轴)物理偏移,并且可以在不同时间扫描患者(时间上的偏移)。
在另一个实施例中,图6通过叠加视图示出了多模式扫描配置600的示例性模式的图示。观察环形门架(未示出)的侧面,图6示出了叠加在目标615的同一平面中的高能量放射源620(例如,mv)和低能量放射源630(例如,kv)的位置。放射源620、630通常不会彼此相抵靠地安装,而是可以相隔90度安装到门架,但是在图6中被示出为叠加的,以示出它们各自的视图和特征的示例性重叠。其他实施例可以包括其他角度关系和附加的放射源。高能量放射源620被示为经过射束成形器626投射放射,以产生投射到检测器624上的放射束622。在这种配置中,高能量放射源620具有轴向fov628。低能量放射源630被示为经过射束成形器636投射放射,以产生投射到检测器634的一部分上的放射束632。在这种配置中,低能量放射源630具有轴向fov638。检测器634被示出为具有有效区域634a和阴影区域634b,该有效区域634a接收直接投射,该阴影区域634b被射束成形器636阻挡以免受直接放射。以这种方式,放射源620、630将使放射投射经过重叠的轴向fov。在该实施例中,多模式扫描配置600示出了具有比高能量fov628更大的轴向fov的低能量fov638。
图7示出了图6中所示的目标615的放大部分700。放射束622、632被示为穿过目标615。高能量fov628和低能量fov638提供重叠的成像数据。此处,低能量fov638提供超出高能量fov628的成像数据,如区域740所示。但是,在其他实施例中,如上所述,高能量fov628可以提供超出低能量fov638的成像数据。在一些实施例中,fov628、fov638可以是相同的(例如,经轴地和/或轴向地相同)。在另外的实施例中,fov628、fov638可以是相邻的但不重叠,在它们之间可以具有空间,它们可以被联合为使得一个fov在另一个fov之内而没有重叠等,以及它们的组合。
在一些实施例中,一个或多个放射源可以被用于稀疏数据,可以利用不同的分辨率、速度、轨迹、频率、功率水平、剂量、fov等。在任何情况下,来自两个或更多个放射模式的数据可以结合使用以改善图像质量、速度、剂量、工作流程、治疗准确度/精度等。
在各种实施例中,示例性扫描配置400、500、600可以使用多模式设备10来实现,包括通过放射治疗环境300。
以下流程图和框图示出了与上述多模式放射系统相关联的示例性配置和方法。可以以逻辑、软件、硬件或其组合来执行示例性方法。另外,尽管程序和方法是按顺序给出的,但是这些框可以以不同的顺序执行,包括串行和/或并行。此外,可以使用附加的步骤或更少的步骤。
图8是描绘组合来自多个放射模式(诸如上述那些)的扫描数据的示例性方法800的流程图。在步骤805处,可以提供先前的图像数据805。在步骤810处,方法800确定扫描配置,包括针对多模式系统的每个模式的扫描设计。然后,在步骤820处,如上所述,执行扫描,包括例如低能量kv扫描和高能量mv扫描。扫描产生低能量扫描数据830和高能量扫描数据832。接下来,在步骤840处,方法400利用或组合低能量扫描数据830和高能量扫描数据832。然后在步骤850处,该方法800处理组合的数据集例如以重建图像。以这种方式,一般而言,扫描配置和关联的扫描设计可以被配置为使得扫描数据830、832中的至少一个互补或补充来自不同模式的扫描数据830、832中的另一个,以产生本文讨论的改进中的至少一个。
在一些实施例中,扫描配置包括螺旋扫描轨迹。螺旋扇形射束mv(高能量)ct(mvct)采集几何结构可以提供几个优点,包括例如宽的横向视图(例如,等中心点处约40cm),关注体积的完整的傅里叶采样,以及降低投射图像中的散射分率(scatterfraction)。这些特征可以提高临床最先进的锥形束mvct上重建的图像的质量。特别地,例如,这些优点的来源是扇形准直的mv治疗/成像射束,以及mv源和检测器被安装在能够从所有方向成像的连续旋转滑环系统上的事实,如上所述。在操作中,该系统(例如,设备10)可以在超过2π的弧度上连续成像,从而相对于平移床位上的患者在螺旋轨迹中移动源和检测器,而无需停下来解绕线缆或依靠非典型成像轨迹。
在各种实施例中,除了螺旋扇形射束mvct系统之外,kv(低能量)x射线源和平板检测器还允许系统以以下几何形状获取kvct(kvct)图像:螺旋扇形射束;螺旋窄锥形角锥形射束;以及固定床位,圆形轨迹扇形射束等,如上所述。因为kv成像硬件与mv成像/治疗硬件安装在同一滑环门架上(例如,如图2和4-6所示),所以kv成像系统也可以利用滑环安装的成像系统的优势,如上所述,从而允许kv成像系统作为诊断ct进行操作,而不是像在传统c形臂系统中发现的那样作为定位cbct来操作。
多模式(例如,双kv/mv)滑环安装的成像系统(例如,设备10)的另一个独特的优点是,安装在一起(例如,彼此正交)的系统可以用于获取在时间和空间上完全同步的图像数据。mv系统和kv系统二者都可以同时对同一解剖结构进行成像,从而产生患者的解剖结构的同时采集(例如,如图6-7所示),包括随时间变化的3-d信息。尽管每个系统的投射角度可能不同,但这不会给对象进行完整的ct成像以及ct重建中固有的对称性带来问题。结合由于滑环安装带来的快速成像速度,该系统可以在较长的轴向范围上快速地获取高时间分辨率的kv/mv扇形射束图像。
在各种实施例中,多模式设备10可以包括n元组源和检测器ct系统(其中,n个源和n个或其他数量的检测器被定位成使得它们相应的投射图像数据可以同时被获取),其中,源提供多个-有能量的(例如,低能量和高能量)投射数据。将扇形射束成像几何形状(例如,使用螺旋扫描轨迹)与同时的多个有能量的kv/mv成像装置结合使用产生了本文所述的优点。如上所述,典型的现有系统限于单独地用于kv源或mv源的锥形射束成像几何结构,与扇形射束成像几何结构相比,它们具有明显的缺点。
在各种实施例中,可以在同时的ct重建中使用高能量mv扇形射束投射和低能量kv扇形射束或锥形射束投射。在一些实施例中,mv投射可用作修正kvct的伪影的先验信息,或在用于定量成像和材料分离的双能量ct重建中使用。此外,mlc调制的mv投射数据在治疗过程中可用,并且可以在放疗施照的同时或之后在kvct重建中被利用。kv采集可以在治疗的同时和/或之前进行。从双能量重建获得的电子密度图像可以被用于在线和离线剂量测定应用两者中。
本文中描述的一个或多个实施例至少部分地解决了在已知医学成像和/或放射治疗系统中出现的几个问题。例如,提高相应的图像集之间的空间配准的精度以允许更精确的放射放疗施照,减少图像伪影(例如,散射、金属和射束硬化、图像模糊、运动等),以及利用双能量成像(例如,用于材料分离和定量成像、患者设置、在线自适应igrt等)。
i.a.
在一些实施例中,多模式设备可以用于散射校正。参考图2的多模式设备10,在一个实施例中,平板kv检测器34和(例如,氙气)mv检测器24对kv能量和mv能量二者均敏感。因此,每个检测器24、34均能够在被另一个源20、30曝光的期间测量正交的体散射。例如,mv检测器24可以通过检测器中的单行但为宽行的检测器来测量kv散射,而kv检测器34可以测量例如40厘米乘40厘米的面积上的对象散射场。在其他实施例中,mv检测器24不需要是单行的,也不需要是宽的。
在一些实施例中,可以使用一个检测器来代替单独的检测器24、34。例如,kv和mv放射源可以在环形门架上彼此相邻定位。然后,对kv和mv放射均敏感的检测器可以位于门架的相对侧上。检测器可以被致动以在至少两个位置之间移动以根据检测器的位置来接收穿过系统的等中心点的kv或mv放射。或者,可以使用足够宽以至于能够同时测量来自kv和mv射束二者整体的放射的宽检测器。也可以使用宽度较小的检测器,但可能仅具有来自每个放射束的有限的视场。
这些散射测量结果(可能在添加来自已知对象的训练数据的情况下)可以用于改善对应图像中的散射校正。例如,尽管mv散射足够低以至于能够在mvct图像链中被忽略,但是mvct图像中不可忽略的ct不准确度和不均匀性可能归因于未校正的散射信号。kvct,特别是kv锥形射束ct,可能受到测得的投射中更大的散射信号的影响。正交kv散射的mv检测器的测量结果可以被用于更好地估计和区分来自孔中对象的散射贡献,从而提高kvct图像中的均匀性和低对比度分辨率。
例如,图9是描绘组合来自多个放射模式的扫描数据以进行散射校正的示例性方法900的流程图。可以提供来自已知对象、模型等的训练数据905以改善过程。在一些实施例中,可以确定扫描配置(包括对于多模式系统的每个模式的扫描设计),并且根据方法800的方法步骤810和820执行扫描以生成扫描数据930、932。低能量扫描数据930例如可以来自低能量kv扫描并且具有相对高的散射比。高能量扫描数据932例如可以来自高能量宽场mv扇形射束扫描并且具有相对低的散射比。两个投射均在同一对象场景的(一个或多个)同一横向平面中。在步骤940处,方法900通过基于对应的高能量mv扫描数据932估计低能量kv扫描数据930中的散射来利用或组合低能量扫描数据930和高能量扫描数据932。在其他实施例中,mv检测器还可以提供“空白(blank)”投射或扫描,在其中,在不存在mvx射线的情况下测量kv散射信号。然后在步骤950处,方法900使用散射估计来重建低能量kv图像。
在一些实施例中,mv和kv投射被同时或在短间隔(例如,小于50ms)之内获取。在一些实施例中,形成mv图像的mv射束22具有相对低的散射相互作用的可能性。在一些实施例中,形成kv图像的kv射束32具有相对高的散射相互作用的可能性。相对概率可以与从根本上区分低能量放射和高能量放射(例如,光电+康普顿(compton)与仅康普顿)的散射机制相关联。仅compton可以适用于高能量放射源(例如,mv)。低能量放射源(例如,kv)也可能经受光电相互作用。
i.b.
在一些实施例中,多模式设备可以用于减少金属和射束硬化伪影。参照图2的多模式设备10,在一个实施例中,在来自kv源30的kv暴露下,穿过金属(例如,诸如牙科或其他外科植入物等)或其他高度衰减对象(例如,诸如致密的骨骼或钙化等)的来自射束32的射线可能阻挡所有或几乎所有信号沿着穿过高衰减材料的射线到达检测器34(相对于较高能量的光子,优先衰减较低能量的光子)。这可能导致检测器34对沿着那些射线的衰减的未限定的、高度不确定的或以其他方式人工的测量结果,从而导致穿过对象的条纹伪影。这些伪影是能量相关的,使得当通过例如来自mv源20的较高能量光子来成像时,这些伪影较不明显。例如,高度衰减对象可能阻挡大约70%的kv信号,但只能阻挡大约7%的mv信号,大约是十倍的差异。但是,与较低能量的光子(来自kv源30)相比,较高能量的光子(来自mv源20)在生物组织中产生的固有衰减对比度较小。为了在保持软组织对比度的同时校正这些伪影,可以使用来自mvct系统(包括mv源20和检测器24)的稀疏投射数据或重建图像来填充丢失的信息并减少kvct系统(包括kv源30和检测器34)中的伪影。
例如,图10是描绘组合来自多个放射模式的扫描数据以减少金属和射束硬化伪影的示例性方法1000的流程图。可以提供来自已知对象、模型等的训练数据1005以改善过程。在一些实施例中,可以确定扫描配置(包括用于多模式系统的每个模式的扫描设计),并且根据方法800的方法步骤810和820执行扫描以生成扫描数据1030、1032。低能量扫描数据1030例如可以来自低能量kv扫描并且具有例如以光电吸收为主的相对高的衰减。高能量扫描数据1032例如可以来自高能量宽场mv扇形射束扫描并且具有以不同的物理机制(康普顿散射)为主的相对低的已知衰减。两个投射均在同一对象场景的(一个或多个)同一横向平面中。在步骤1040处,方法1000通过基于对应的高能量mv扫描数据1032估计低能量kv扫描数据1030中的穿过以光电吸收为主的致密结构的kv投射的衰减来利用或组合低能量扫描数据1030和高能量扫描数据1032。然后在步骤1050处,方法1000使用衰减估计来重建低能量kv图像。
在一些实施例中,mv和kv投射被同时或在短间隔(例如,小于50ms)之内获取。在一些实施例中,形成mv图像的mv射束22具有约3mev的峰值能量和约1mev的平均能量。在一些实施例中,形成kv图像的kv射束32具有小于或等于150kev的峰值能量。
i.c.
在一些实施例中,多模式设备可以被用于时间分辨率校正(例如,图像模糊校正)。参照图2的多模式设备10,在一个实施例中,与来自kv源30的kv投射相比(例如,大约10ms),来自mv源20的mv投射被锐利地时间分辨(例如,约5μs),并且因此以门架角度被锐利地分辨。此外,与kv-cbct系统的kv射束32的典型脉冲率(例如,约15hz)相比,mv射束22的可实现的脉冲率更高(例如,高达300hz)。无论是连续曝光还是脉冲曝光,kv投射中的模糊均会随着曝光时间和门架速率而增加。在一个实施例中,基于几何形状和kv操作,检测器34上的模糊程度可以是例如大约10个像素,并且可能需要2d校正或3d建模。例如,在基于模型的3d方案中,mv投射可以提供时间分辨的信息,以提高基于模型的重建的一致性,或对2d去模糊运算符进行正则化。
例如,图11是描绘组合来自多个放射模式的扫描数据以进行时间分辨率校正的示例性方法1100的流程图(例如,用于肺或心脏成像的图像模糊校正)。可以提供来自已知对象、模型等的训练数据1105以改善过程。在一些实施例中,可以确定扫描配置(包括用于多模式系统的每个模式的扫描设计),并且根据方法800的方法步骤810和820执行扫描以生成扫描数据1130、1132。低能量扫描数据1130例如可以来自低能量kv扫描并且具有相对低的脉冲率(例如,慢积分)。例如,典型的kv积分时间可以是5-20ms。但是,由于脉冲率是1/周期时段(该周期时段包括检测器的读出时间),因此其可能具有10-100ms的范围。高能量扫描数据1132例如可以来自高能量mv扫描并且具有相对高的脉冲率(例如,快积分)。例如,典型的mv积分时间可以是1-10us。mv系统的周期时间不受积分时间限制。在一个实施例中,使用高达300hz的速率,其中周期时间为3.3ms。在步骤1140处,方法1100通过使用具有较高时间辨别力的mv扫描数据1132以在具有较少的时间点估计的更好空间图像的情况下辅助kv扫描数据1130的插值来利用或组合低能量扫描数据1130和高能量扫描数据1132,以进行图像模糊校正。然后在步骤1150处,方法1100例如针对清晰的时间分辨率运动去模糊图像,使用图像模糊校正来重建低能量kv图像。
在一些实施例中,高能量扫描是mv扇形射束ct,而低能量扫描是kv窄射束ct。在一些实施例中,高能量扫描是mv扇形射束ct,而低能量扫描是kv锥形射束ct。
i.d.
在一些实施例中,多模式设备可以被用于运动伪影校正。参考图2的多模式设备10,在一个实施例中,如上所述,与来自kv源30的kv投射相比,来自mv源20的mv投射是时间分辨上更加锐利的。
例如,图12是描绘组合来自多个放射模式的扫描数据以进行运动伪影校正的示例性方法1200的流程图。可以提供来自已知对象、模型等的训练数据1205以改善过程。在一些实施例中,可以确定扫描配置(包括用于多模式系统的每个模式的扫描设计),并且根据方法800的方法步骤810和820执行扫描以生成扫描数据1230、1232。低能量扫描数据1230例如可以来自低能量kv扫描并且时间分辨不那么锐利(例如,低频率)。高能量扫描数据1232例如可以来自高能量mv扫描并且时间分辨更加锐利(例如,高频率)。在步骤1240处,方法1200通过使用具有更加锐利的时间分辨投影的mv扫描数据1232以估计用于具有运动伪影的kv扫描数据1230的运动校正中的运动来利用或组合低能量扫描数据1230和高能量扫描数据1232。例如,在步骤1240的一个实施例中,方法1200组合低频率kv扫描数据1230和高频率mv扫描数据1232以建立高频率mv扫描数据1232和组合的图像数据之间的关联模型,然后使用高频率mv扫描数据1232来基于关联模型1240对包括在低频kv投射数据1230中的高频运动进行插值。然后在步骤1250处,方法1200使用运动校正来重建低能量kv图像。在另一个实施例中,步骤1250可以以其他方式包括重建高频率运动轨迹。在其他实施例中,除了对于低能量扫描数据1230和高能量扫描数据1232具有不同的投射频率之外,投射积分时间可以是不同的。例如,低能量扫描数据1230(例如,kv投射)可以具有较长的积分时间(例如5-30ms),而高能量扫描数据1232(例如,mv投射)可以具有较短的积分时间(例如,~0.001ms)。在这些实施例中,高能量扫描数据1232可以被用于去除低能量扫描数据1230中固有的旋转或运动模糊。
在各种实施例中,高能量扫描是mv扫描(例如,mv扇形射束ct),而低能量扫描是kv扫描(例如,kv窄射束ct或kv锥形射束ct)。在各种实施例中,高能量源20和低能量源30之间的视角角度是正交的。在一个实施例中,运动校正基于运动估计(其基于3d重建),并且在同时使用第二放射源以施照治疗性放射的情况下被作为实时调整应用于第二放射源(例如,定向、准直和/或针对不受控制的运动的门控等)。
ii.a.
在一些实施例中,多模式设备可以被用于材料分离和/或定量成像。参考图2的多模式设备10,在各种实施例中,来自mv源20的mv投射和来自kv源30的kv投射可以以同时、交错或串行的方式来获取。从不同的能量谱(例如,高能量源20和低能量源30)得出的图像提供了材料特性的线性独立测量。一般而言,相比于从kv图像获得的质量/电子密度估计,可以从mv图像获得更准确的质量/电子密度估计,但是kv-kv配准可能比kv/mv配准更准确。在各种实施例中,这些差异可以被用于将投射图和体素分解成两种基础材料(basismaterials)(例如,“软组织”和“骨骼”)的线性组合。通过改变基础材料的贡献,可以在增强另一种材料的同时抑制一种材料,从而提高图像质量。
例如,图13是描绘组合来自多个放射模式的扫描数据以进行材料分离和/或定量成像的示例性方法1300的流程图。可以提供来自已知对象、模型等的训练数据1305以改善过程。在一些实施例中,可以确定扫描配置(包括用于多模式系统的每个模式的扫描设计),并且根据方法800的方法步骤810和820执行扫描以生成扫描数据1330、1332。低能量扫描数据1330例如可以来自低能量kv扫描。高能量扫描数据1332例如可以来自高能量mv扫描,其中,mv扫描数据1332和低能量扫描数据1330提供对象的至少一个材料特性的线性独立的测量结果。在步骤1340处,方法1300根据扫描数据1330、1332中的至少一个来改变至少一个基础材料的贡献。然后在步骤1350处,方法1300使用至少一个基础材料的改变后的贡献来重建图像。
在一个实施例中,改变来自扫描数据1330、1332中的至少一个的至少一个基础材料的贡献提供了电子密度的定量图像。在一些实施例中,低能量扫描数据1330包括与至少两个光谱分离的kev能量相关联的投射数据。
ii.b.
在一些实施例中,多模式设备可以被用于患者设置。参考图2的多模式设备10,在一个实施例中,可以在2d图像配准工作流程中使用2d双能量图像(例如,来自高能量源20和低能量源30),例如以切换骨骼或软组织。在一个实施例中,配准扫描可以是低剂量、两个角度、两个能量的侦察(scout)扫描,其中返回扫描处于90度门架移位以使得mv投射和kv投射对可从每个平面中的两个角度获得。由于mv和kv源的示例性固定的90度偏移,这些角度中只有一个具有匹配的射线角度。第二角度将仅从门架12的相对侧获得非互补扇形数据。
例如,图14是描绘组合来自多个放射模式的扫描数据以进行患者设置的示例性方法1400的流程图。先前的数据1405可以来自已知的先前图像、对象、模型等的。在一些实施例中,可以确定扫描配置(包括用于多模式系统的每个模式的扫描设计),并且根据方法800的方法步骤810和820执行扫描以生成扫描数据1430、1432。低能量扫描数据1430例如可以来自低能量kv扫描。高能量扫描数据1432例如可以来自高能量mv扫描。在该实施例中,高能量扫描和低能量扫描是同时进行的,并且高能量源20和低能量源30是正交的,以作为侦察扫描工作流程的一部分。在步骤1440处,方法1400利用或组合低能量扫描数据1430和高能量扫描数据1432以生成(一个或多个)配准图像。然后在步骤1450处,方法1400基于低能量和高能量图像来配准患者。
在一些实施例中,侦查扫描是双向的,以从同一门架角度获取双能量投射。在一些实施例中,几何重合的双能量投射被用于配准工作流程中的材料分离。
ii.c
在一些实施例中,多模式设备可以被用于在线自适应igrt,以及离线自适应igrt和施照质量保证。参考图2的多模式设备10,在一个实施例中,在线3dkvct使用kv子系统(包括例如低能量源30、射束成形器36和检测器34)用于在线3d运动自适应。该实施例还包括使用mv放疗束22的投射数据来既提高计划目标体积(ptv)处的图像质量,又将其用作对电子密度的定量图像的约束。在此,通过对mvct几何结构中的mlc孔径进行向前投射并加强投射数据的一致性,在双能量迭代重建中利用mv出口检测器24的数据。例如,每次旋转可以存在51个mlc孔径,并且高能量mv源20可以以300hz发脉冲,从而导致大量的检测器计数,其中,图像信息集中在治疗结构上。该数据可被用于实现治疗区域的低噪声定量图像。低噪声视图除了能够进行刚性运动跟踪外,还能够进行可变形的ptv跟踪,使得计划可以在线适应ptv的形状和位置。
例如,图15是描绘组合来自多个放射模式的扫描数据以进行在线自适应igrt的示例性方法1500的流程图。先前的数据1505可以来自已知的先前图像、治疗计划、对象、模型等。在一些实施例中,可以确定扫描配置(包括用于多模式系统的每个模式的扫描设计),并且根据方法800的方法步骤810和820执行扫描以生成扫描数据1530、1532。低能量扫描数据1530例如可以来自低能量kv扫描。高能量扫描数据1532例如可以来自高能量mv扫描。在步骤1540处,方法1500利用或组合低能量扫描数据1530和高能量扫描数据1532以补充和/或约束另一个扫描数据1530、1532。然后在步骤1550处,方法1500基于补充和/或约束的其他扫描数据来调整治疗计划。
在一些实施例中,注量场(fluencefield)调制成像包括通过正交的kv投射来补充丢失的mv视图信息。在涉及在线3dkv成像的一些实施例中,mv治疗投射被用作对电子密度的定量图像的约束。在一个实施例中,在线定量图像用于在线剂量计算。在另一个实施例中,计算的剂量用于离线自适应工作流程中。在另一个实施例中,计算的剂量用于质量保证工作流程中。
在一些实施例中,可以基于优选的工作流程同时或以交错的方式执行以上方法。例如,可以执行多模式扫描,并且将所得到的扫描数据用于上述各种特征和益处中的两个或更多个。
当在投射领域中使用上述设备和方法时,可以将其应用于每个投射视图,其中,每个投射视图是平面图像。各种实施例可以利用不同的扫描几何形状、检测器定位(包括偏移检测器)和/或射束成形器窗口形状。
如上所述,公开的技术的各方面可以在利用多模式放射源的放射疗法装置和方法中使用,该多模式放射源包括集成的低能量(例如,kv)源和高能量(例如,mv)源,以与igrt结合使用或作为igrt的一部分使用。根据一个实施例,图像采集方法可以包括或以其他方式利用螺旋源轨迹(例如,围绕中心轴的连续源旋转以及患者支撑物通过门架孔的纵向移动)或圆形扫描,以及快速滑环旋转,例如以在放射疗法施照平台上提供kvct成像。
在一些实施例中,将理解到,与多次射束旋转相关联以完成体积图像的任何潜在的增加的扫描时间可以通过高kv帧速率、高门架速率和/或稀疏数据重建技术来减轻或以其他方式抵消。还将认识到,上述提供的可选择性地控制的准直器/射束成形器允许在其中用户可以根据特定的应用和/或临床需要进行权衡或以其他方式改变图像采集时间与图像质量的关系的系统。还应当理解,放射疗法施照装置可以被控制以提供具有快速图像采集时间(例如,用于运动跟踪)的半旋转或单旋转锥形束ct扫描(由于散射而可能降低图像质量),以及通过窄/狭缝扇形射束的圆形或连续螺旋采集,其具有更长的采集时间但由于散射减少而提高了图像质量。一个或多个优化过程也可应用于所有上述实施例以确定扫描设计、确定射束定位、确定读取范围、估计散射等。
图16是描绘使用放射疗法装置(包括例如多模式设备10)的igrt的示例性方法1600的流程图。先前的数据1605可以包括患者的图像(例如,先前的图像,其可以是先前采集的计划图像,包括先前的ct图像,如上所述)、治疗计划、体模信息、模型、先验信息等。在一些实施例中,先前的数据1605由相同的放射疗法装置但是在更早的时间生成。在步骤1610处,使用放射源(例如,来自多模式设备10的源30的kv放射和/或来自多模式设备10的源20的mv放射)执行患者的成像。在各种实施例中,成像包括具有扇形射束或锥形射束几何形状的螺旋或圆形扫描。步骤1610可以使用上述技术产生(一个或多个)高质量(hq)图像或成像/扫描数据1615。在一些实施例中,可以调整图像质量以优化图像质量/分辨率与剂量之间的平衡。换句话说,并非所有图像都需要具有最高质量,或者可以调整图像质量以优化或权衡图像质量/分辨率与图像采集时间之间的平衡。成像步骤1610还包括图像处理1620,以基于成像/扫描数据1615(例如,根据上面描述的方法)生成患者图像。尽管图像处理步骤1620被示出为成像步骤1610的一部分,但是在一些实施例中,图像处理步骤1620是单独的步骤,包括由单独的装置执行图像处理。
接下来,在步骤1630处,至少部分地基于来自步骤1610的成像/扫描数据1615,来执行下面讨论的一个或多个基于图像的施照前步骤。如下面更详细地讨论,步骤1630可以包括:确定与治疗性处理和(随后的)成像计划相关联的各种参数。在一些实施例中,基于图像的施照前步骤(1630)在放疗施照(1640)之前可能需要更多的成像(1610)。步骤1630可以包括作为自适应放射疗法例程的一部分的基于成像数据1615来适应治疗计划。在一些实施例中,基于图像的施照前步骤1630可以包括实时治疗计划。如上所述,实施例还可以包括成像和治疗性放射源的同时、重叠和/或交替激活。实时治疗计划可能涉及这些类型的成像和治疗性放射激活技术(同时、重叠和/或交替)中的任何一种或全部。
接下来,在步骤1640处,使用高能量放射源(例如,来自放射源20的mv放射)执行治疗性放疗施照。步骤1640根据治疗计划向患者施照放疗剂量1645。在一些实施例中,igrt方法1600可以包括返回到步骤1610,从而以各种间隔(例如,各分割之间的间隔)进行附加的成像,随后根据需要进行基于图像的施照前步骤(1630)和/或放疗施照(1640)。以这种方式,可以在igrt期间使用能够进行自适应疗法的一个设备10来产生和利用高质量的成像数据1615。如上所述,步骤1610、1630和/或1640可以同时、重叠和/或交替地执行。
如上所述,igrt可以包括至少两个总体目标:(i)将高度适形的剂量分布施照给目标体积;(ii)在每个治疗分割的整个过程中都以高准确度施照放疗束。第三个目标可以是在每分割的尽可能少的时间内完成两个总体目标。准确地施照放疗束需要通过高质量图像标识和/或跟踪分割治疗内目标体积的位置的能力。提高施照速度的能力要求具有根据治疗计划准确、精确和快速地移动放射源的能力。
图17是描绘了可以与以上步骤1630相关联的示例性的基于图像的施照前步骤/选项的框图1700。将理解的是,在不脱离本发明的范围的情况下,上述多模式设备10(例如,作为放射疗法装置的一部分)可以生成可按照多种方式使用的低能量图像和高能量图像,包括用于基于图像的施照前步骤(1630)的图像。例如,由放射疗法装置生成的图像1615可以用于在治疗之前设置或对准患者(1710)。患者对准可以包括将当前的成像数据1615和与较早的治疗前的扫描和/或计划(包括治疗计划)相关联的成像数据相关或配准。患者对准还可以包括关于患者相对于放射源的物理位置的反馈,以验证患者是否物理地在施照系统的范围内。如有必要,可以对患者进行相应的调整。在一些实施例中,患者对准成像可以有目的地具有较低的质量,以最小化剂量但是提供足够的对准信息。下面描述示例性的患者对准过程。
由多模式设备10生成的图像也可以用于治疗规划或重新计划(1720)。在各种实施例中,步骤1720可以包括确认治疗计划,修改治疗计划,生成新的治疗计划和/或从治疗计划的集合中选择治疗计划(有时称为“每日计划”)。例如,如果成像数据1615表明目标体积或roi与制定治疗计划时相同,则可以确认治疗计划。但是,如果目标体积或roi不同,则可能需要重新计划治疗性处理。在重新计划的情况下,由于成像数据1615的高质量(由多模式设备10在步骤2010处生成),所以成像数据2015可以用于治疗规划或重新计划(例如,生成新的或修改后的治疗计划)。以这种方式,不需要经由不同的装置进行治疗前的ct成像。在一些实施例中,确认和/或重新计划可以是各种治疗之前和/或之后正在进行的程序。
根据另一个示例性用例,由多模式设备10生成的图像可以用于计算成像剂量(1730),其可以用于正在进行的对患者的总剂量的确定和/或用于随后的成像计划。也可以作为治疗计划的一部分来确定后续成像的质量,例如以平衡质量和剂量。根据另一个示例性用例,由多模式设备10生成的图像可以用于计算放疗剂量(1740),该放疗剂量可以用于正在进行的对患者的总剂量的确定和/或可以被包括作为治疗规划或重新计划的一部分。
根据其他示例性用例,可以与计划或调整其他成像(1750)和/或其他治疗(1760)参数或计划相结合地使用由多模式设备10生成的图像,例如包括作为自适应疗法和/或治疗计划生成的一部分。根据另一个示例性用例,由多模式设备10生成的图像可以与自适应疗法监测(1770)结合使用,该自适应治疗监测可以包括监测放疗施照并根据需要自适应调整,包括重新计划。
应当理解,基于图像的施照前步骤(1630)并非互斥的。例如,在各种实施例中,计算放疗剂量(1740)本身可以是一个步骤和/或可以是自适应治疗监测(1770)和/或治疗计划(1720)的一部分。在各种实施例中,基于图像的施照前步骤(1630)可以自动地和/或在人类的参与下人工地执行。
图18是描绘了可在成像(1610)和/或随后的基于图像的施照前步骤(1630)期间使用的示例性数据源的框图1800。检测器数据1810表示由放射检测器24、34接收到的数据。投射数据1820是由入射在准直射束区(上文称为有效区)中的放射生成的数据。半影数据1830是由入射在半影区中的放射生成的数据。散射数据1840是由入射在如上所述的半影区外部的外围区中的放射和/或如上所述所确定的散射生成的数据。在另一个实施例中,散射数据1740可用于确定在两个源20、30同时或以交错方式操作时,来自治疗性放射源20(例如,mv)的散射的残留效应。
以这种方式,半影数据1830和/或散射数据1840可以被用来改善由成像步骤1610生成的图像的质量。在一些实施例中,半影数据1830和/或散射数据1840可以与投射数据1820组合和/或可以根据适用的成像设置1850、治疗设置1860(例如,如果同时成像和治疗性放射的话)以及在检测器24、34处收集数据时与多模式设备10相关联的任何其它数据1870而被分析。在其他实施例中,该数据可以用于治疗计划步骤1630。
图19和图20描绘了成像1610、基于图像的施照前步骤1630和放疗施照1640用例的示例性实施例,包括与在igrt期间使用多模式设备10进行机载成像(on-boardimaging)相关联的各种前向和反馈序列的示例,包括使用上述方法。
图19是描绘使用放射疗法装置(包括例如,多模式设备10)的包括患者设置或对准的示例性方法1900的流程图。先前的数据1905可以包括患者的图像(例如,先前的图像,其可以是先前采集的计划图像,包括如上所述的先前的ct图像)。在一些实施例中,先前的数据1905由相同的放射疗法装置但是在更早的时间生成。在步骤1910处,可以执行患者的初始或初步对准。然后,在步骤1920处,使用多模式设备10的低能量和/或高能量放射源(例如,来自源30的kv放射和/或来自源20的mv放射)执行机载成像扫描,包括例如如上述步骤1610中所描述的。在各种实施例中,机载成像包括利用扇形射束或锥形射束几何形状的螺旋或圆形扫描。步骤1920使用上述技术产生在线成像/扫描数据1930。成像步骤1920还可以包括图像处理以基于成像/扫描数据1930(例如,根据上述方法)来生成患者图像,包括例如上面的框1620中所描述的。
接下来,步骤1940至少部分地基于在线扫描数据1930来确定是否需要对准校正,包括例如上面的框1710中所描述的。如果需要对准校正或调整,则方法1900进行到至少部分地基于在线扫描数据1930进行对准校正的步骤1950。然后,在对准校正之后,该方法可以返回到进行附加的成像以作为确认或进一步细化循环的步骤1920。如果从步骤1940开始不需要对准校正或调整,则方法1900进行到进行放疗施照的步骤1960。然后,在治疗之后,方法1900可以返回到进行附加的成像作为确认或进一步细化循环的步骤1920。
图20是描绘了使用放射疗法装置(包括例如多模式设备10)包括自适应igrt的示例性方法2000的流程图。先前的治疗计划2005可以包括治疗计划以及患者的图像(例如,先前的图像,其可以是先前采集的计划图像,包括先前的ct图像,如上所讨论的)、体模信息、模型、先验信息等。在一些实施例中,先前的数据2005由相同的放射疗法装置但是在更早的时间生成。在步骤2010处,例如基于先前的治疗计划和任何附加信息可以采用初始或初步的治疗计划。然后,在步骤2020处,使用多模式设备10的低能量和/或高能量放射源(例如,来自源30的kv放射和/或来自源20的mv放射)执行机载成像扫描,包括例如如上述步骤1610中所述的。在各种实施例中,机载成像包括具有扇形射束或锥形射束几何形状的螺旋或圆形扫描。步骤2020使用上述技术产生在线成像/扫描数据2030。成像步骤2020还可以包括图像处理以基于成像/扫描数据2030(例如,根据上述方法)来生成患者图像,包括例如以上框1620中所描述的。
接下来,步骤2040至少部分地基于在线扫描数据2030来确定是否需要重新计划或调整治疗计划,包括例如上面框1720中所描述的。如果不需要调整或重新计划治疗计划,则方法2000进行到用于放疗施照的步骤2050。如果确实需要调整或重新计划治疗计划,则方法2000进行到至少部分地基于在线扫描数据2030来调整治疗计划的步骤2060。然后,在调整治疗计划之后,该方法可以进行到用于放疗施照的步骤2050。然后,在治疗之后,方法2000可以返回到进行附加的成像以作为确认或进一步细化循环的步骤2020。
在一些实施例中,方法1900、2000和其他方法可以基于优选的工作流程同时或以交错的方式执行。例如,可以执行机载成像扫描并将其用作1920和2020扫描两者,以使用相同的数据同时确认治疗和继续的对准。在其他实施例中,基于优选的工作流程,可以同时或以交错的方式执行两个或更多个基于图像的施照前步骤1630,包括相同的成像数据1615和/或图像处理1620被用于基于图像的施照前步骤1630中的多于一个步骤的情况。
尽管已经针对某个方面、一个或多个实施例示出和描述了公开的技术,但是显而易见的,在阅读和理解了本说明书和所附附图之后,本领域的其他技术人员将想到等同的变型和修改。特别是关于由上述元素(部件、组件、装置、构件、组成等)执行的各种功能,除非另有说明,否则用于描述此类元素的术语(包括对“装置”的引用)旨在对应于执行所述元素的指定功能的任何元素(即,功能上是等同的),即使在结构上不等同于执行本文所示的公开的技术的示例性方面或实施例中的功能的公开的结构。另外,虽然以上可能已经针对几个示出的方面或实施例中的仅一个或多个描述了公开的技术的特定特征,但是可以根据需要将该特征与其他实施例的一个或多个其他特征组合,并且这对于任何给定的或特定的应用是有利的。
尽管本文所讨论的实施例已经与上文所讨论的系统和方法相关,但是这些实施例旨在为示例性的,并不旨在将这些实施例的适用性仅限制于本文所阐述的那些讨论。尽管已经通过对其实施例的描述说明了本发明,并且尽管已经对实施例进行了详细描述,但是申请人的意图不是将所附权利要求的范围限制或以任何方式限制为这些细节。其他优点和修改对本领域技术人员将是显而易见的。因此,本发明在其更广泛的方面不限于所示出和描述的具体细节、表示性的设备和方法以及说明性的示例。因此,在不脱离申请人的总体发明构思的精神或范围的情况下,可以偏离这些细节。
- 还没有人留言评论。精彩留言会获得点赞!