靶向巨噬细胞的RIPK1及其抑制剂在筛选和制备肝损伤诊疗药物中的应用
本发明属于基因的功能与应用技术领域,涉及一种受体相互作用的丝氨酸/苏氨酸激酶1(receptorinteractingserine/threoninekinase1,ripk1)及其抑制剂在筛选和制备肝损伤诊疗药物中的应用。
背景技术:
非酒精性脂肪肝病(nonalcoholicfattyliverdisease,nafld)是一种无过量饮酒史,以肝实质细胞脂肪变性和脂肪储积为特征的临床病理综合症,病谱随病程的进展而表现不一,包括单纯性脂肪肝、非酒精性肝炎(nonalcoholicsteatohepatitis,nash)、肝硬化甚至肝细胞癌。nafld与肥胖症、代谢综合征和2型糖尿病密切相关,被认为是终末期肝衰竭的主要原因。
许多患有nafld的患者发展为更具炎症性的亚型-非酒精性脂肪性肝炎(nash)和晚期肝纤维化或肝硬化。nash的病理生理学是多因素的,尚未完全了解。然而,肝驻留巨噬细胞(库弗细胞)和巨噬细胞的募集在肝疾病进展中起着主要作用。
在肝病的不同阶段,常驻库弗细胞(kupffercells)和新近募集的单核细胞衍生的巨噬细胞在炎症、纤维生成和纤维溶解的调节中起着关键作用。肝损伤后,库弗细胞会募集更多的免疫细胞,包括中性粒细胞和炎性血液单核细胞,这些细胞会分化为具有吞噬活性并分泌促炎细胞因子和活性氧(ros)的cd11b+f4/80+经典活化的巨噬细胞(m1型)(tackeandzimmermann,2014)。
在疾病模型中,已经在小鼠饮食模型中证明了肝巨噬细胞浸润,例如高脂肪饮食(hfd)和蛋氨酸-胆碱缺乏饮食(mcd),并且还与小鼠年龄增长相关。在高脂肪和高胆固醇(hfhc)饮食nash模型中,该模型复制了人类nash的许多病理生理特征,观察到f4/80+巨噬细胞的浸润以及激活了kupffer细胞,并增加促炎性细胞因子的表达(tacke,2017)。
除了nafld和nash之外,巨噬细胞在肝免疫稳态和其他肝病的发展中也起着重要作用,例如慢性病毒性肝炎和酒精性肝病。
受体相互作用蛋白1(receptor-interactingprotein1,rip1,亦称为ripk1)是细胞死亡的关键调控分子,在调控细胞存活、细胞死亡以及炎症反应的发生等过程中发挥了重要作用,是一个决定细胞命运的重要传感器分子。1995年stanger等通过酵母双杂交实验发现了rip家族中第一个成员ripk1,其c末端为死亡结构域,能够与死亡受体家族成员fas相互作用,因而命名为受体相互作用蛋白。ripk1对机体的正常发育起着不可或缺的作用。研究发现敲除ripk1基因的小鼠会因淋巴细胞和脂肪组织过量凋亡而在出生后的1~3d死亡(xuetal.,2018,liuetal.,2017,kaiseretal.,2014)。一方面,ripk1是tnf信号通路的重要组成部分,在tnfα激活的信号通路中,ripk1通过发生泛素化,作为支架蛋白招募并结合下游信号分子从而介导nf-κb的活化以及细胞存活(kondylisetal.,2017,dondelingeretal.,2015)。另一方面,当ripk1去泛素化后,通过与caspase-8和fadd蛋白结合,介导细胞凋亡的发生;但当caspase-8被化学抑制剂抑制或者遗传性缺失时,ripk1则通过与rip3之间的相互作用,促进细胞执行程序性坏死(necrosis)(newtonetal.,2019,dillonetal.,2014,wangetal.,2008)。因此,ripk1处于决定细胞命运的关键交叉点。ripk1的表达水平、蛋白质修饰状态以及与其他蛋白分子的相互作用等因素决定了细胞命运的选择,是继续存活还是走向死亡(newton,2015,christoffersonetal.,2014,ofengeimandyuan,2013)。
ripk1激酶作为决定细胞命运走向的关键分子,参与调控了包括nf-κb信号通路、细胞凋亡和坏死、炎症小体活化和细胞焦亡等多条重要的信号通路和细胞效应,因此其很可能参与多种疾病尤其是与细胞死亡和炎症反应密切相关的疾病的发生和发展。目前针对ripk1激酶已经开发出一些小分子抑制剂,包括nec-1、nec-1s、gsk547和gsk963等。已有研究证实使用nec-1抑制ripk1激酶活性能够降低细胞的死亡和炎症,在一些炎症和坏死性疾病中发挥重要作用(takahashinetal.2012),但在非酒精性脂肪肝、肝纤维化和肝硬化疾病中尚未见相关研究。
技术实现要素:
本发明的目的在于提供靶向巨噬细胞的ripk1及其抑制剂在筛选和制备肝损伤诊疗药物中的应用。
一方面,本发明提供靶向巨噬细胞的ripk1作为药物靶标在筛选预防、缓解和/或治疗肝损伤疾病的药物中的应用。
另一方面,本发明提供靶向巨噬细胞的ripk1抑制剂在制备肝损伤治疗药物中的应用。
具体地,本发明中,所述的肝损伤疾病为本领域技术人员知晓的疾病,包括但不限于脂肪肝、肝硬化和肝纤维化等。
具体地,本发明中,所述的靶向巨噬细胞的ripk1抑制剂,包括但不限于能够使ripk1激酶失活的小分子化合物抑制剂,或能够抑制ripk1基因表达和/或ripk1激酶失活的sirna。
更具体地,所述的sirna为以ripk1为靶基因、干扰ripk1表达和激酶失活的双链sirna,注射入人体通过rna干扰的方法使ripk1激酶失活来治疗脂肪肝、肝硬化和肝纤维化等肝损伤疾病。
更具体地,所述的小分子化合物抑制剂为以ripk1为靶点,能够特异性抑制ripk1激酶活化,实现治疗脂肪肝、肝硬化和肝纤维化等肝损伤疾病的治疗。包括但不限于nec-1、nec-1s、gsk547和gsk963等。
发明人发现移植ripk1激酶失活骨髓的小鼠的肝功能显著优于移植c57小鼠骨髓的小鼠,其血清中谷丙转氨酶(alt)的含量明显下降,且从脂质成分病理染色结果等均说明移植ripk1激酶失活骨髓的小鼠能够明显缓解脂肪肝病变,显著降低脂质蓄积。体外实验通过分离培养ripk1激酶失活小鼠和c57小鼠的原代骨髓巨噬细胞,发现ripk1激酶失活可以显著降低棕榈酸诱导的骨髓巨噬细胞的炎症和死亡。
附图说明
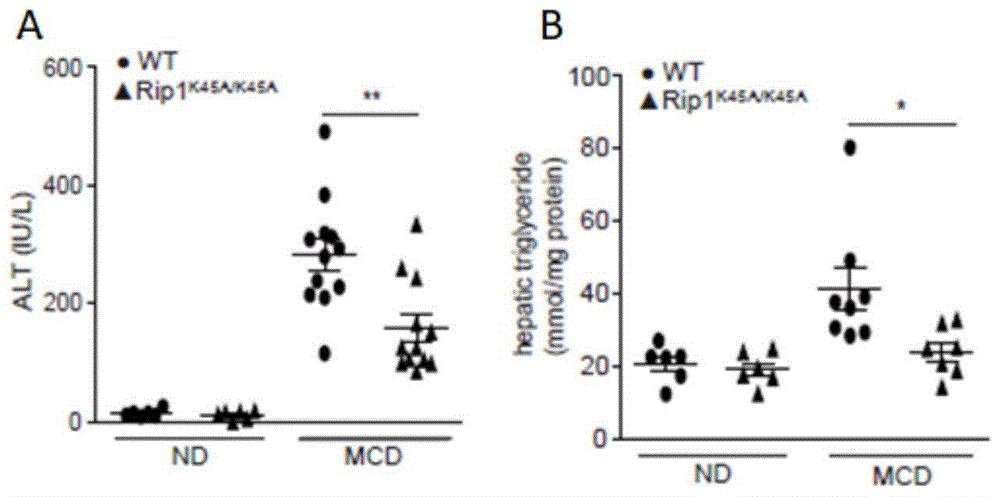
图1为小鼠血清中谷丙转氨酶(alt)和甘油三酯(tg)的含量图,a为血清中谷丙转氨酶(alt)的含量;b为血清中甘油三酯(tg)的含量。
图2为小鼠的肝组织苏木精和伊红(he)染色图,a为移植c57小鼠和ripk1激酶敲除小鼠在mcd饮食诱导模型的肝组织染色;b为骨髓移植小鼠在mcd饮食诱导模型的肝组织染色。
图3为小鼠的肝组织天狼星染色图,a为移植c57小鼠和ripk1激酶敲除小鼠在mcd饮食诱导模型的肝组织染色;b为骨髓移植小鼠在mcd饮食诱导模型的肝组织染色。
图4为棕榈酸(pa)诱导小鼠原代骨髓巨噬细胞的炎症和死亡结果图,a为棕榈酸诱导的骨髓巨噬细胞炎症因子il-1β的表达;b为棕榈酸诱导的骨髓巨噬细胞死亡率测定。
具体实施方式
下面通过实施例和附图对本发明作进一步详述。
实施例1
本发明以c57野生型小鼠和ripk1基因敲除(激酶失活)小鼠为实验对象,通过高脂饮食(hfd)喂养或蛋氨酸-胆碱缺乏饲料(mcd)喂养来构建脂肪肝、脂肪肝炎、肝纤维化、肝硬化模型,并通过骨髓移植来研究巨噬细胞及ripk1基因在脂肪肝炎等相关炎症疾病中的功能。
本发明通过crisprcas9技术敲除ripk1基因的磷酸化位点,构建ripk1激酶失活小鼠。将正常的c57小鼠移植ripk1激酶失活小鼠骨髓,并喂食高脂饲料(hfd)或蛋氨酸胆碱缺乏饲料(mcd),构建非酒精性脂肪肝、肝硬化和肝纤维模型。
1.构建骨髓移植小鼠
8周大的野生型c57bl/6小鼠接受致死性辐照(9gy),分别取c57和ripk1激酶失活小鼠的骨髓,然后通过尾静脉注射将从野生型或ripk1激酶失活供体小鼠中收获的骨髓细胞注入接受辐照的c57受体小鼠(5x106个细胞)。辐照和骨髓移植(bmt)后6周,获得了嵌合小鼠的血液,并通过dna测序进行了分析,以验证骨髓重构的效率。
2.构建非酒精性脂肪肝模型
将8周大的小鼠喂食高脂饮食16周或者蛋氨酸-胆碱缺乏饲料4周构建非酒精性脂肪肝模型。
3.检测方法
(3.1)苏木精和伊红染色
(1)肝组织切片
将小鼠处死后取小块肝组织放入4%多聚甲醛溶液中固定24小时,取出肝组织用石蜡包埋,使用全自动切片机切出单张切片置于载玻片上,用酒精灯略烤,使切片展平,将贴好的切片置于60度烘箱干燥2小时,保存。
(2)石蜡切片脱蜡至水
依次将切片放入二甲苯ⅰ10min-二甲苯ⅱ10min-无水乙醇ⅰ5min-无水乙醇ⅱ5min-95%酒精5min-90%酒精5min-80%酒精5min-70%酒精5min-蒸馏水洗。
(3)苏木素染细胞核
切片入harris苏木素染3-8min,自来水洗,1%的盐酸酒精分化数秒,自来水冲洗,0.6%氨水返蓝,流水冲洗。
(4)伊红染细胞质
切片入伊红染液中染色1-3min。
(5)脱水封片
将切片依次放入95%酒精i5min-95%酒精ii5min-无水乙醇ⅰ5min-无水乙醇ⅱ5min-二甲苯ⅰ5min-二甲苯ⅱ5min中脱水透明,将切片从二甲苯拿出来稍晾干,中性树胶封片。显微镜镜检,图像采集分析。
(3.2)酶联免疫吸附法(elisa)
(1)拿出新的elisa96孔板,按比例将il-1β一抗加入到缓冲液中,混匀,每孔加50μl,贴膜,将板子震一震,使液体铺满孔,放入4℃冰箱中过夜孵育。
(2)将一抗拿出,倒掉,pbst洗3次(250μl)。配elisa稀释液(20ml水+5ml稀释液(5xelisa/elisptdiluert)),每孔100μl,贴膜静置封闭1h。
(3)倒掉elisa稀释液,pbst洗1次,将细胞悬浮液依次加入新板中(50μl每孔)
(4)制作标样:将140μlelisa稀释液和10μlil-1β(蛋白)加入到1.5ml离心管中,混匀。第2-8孔先加入每孔50μlelisa稀释液,第一孔和第二孔加入50μl蛋白稀释液,第二孔打匀10次后吸50μl加入到第三孔,以此类推,最后第八孔吸掉50μl丢掉。贴膜等2h。
(5)倒掉,pbst洗3次。
(6)稀释二抗,将二抗加入到elisa稀释液中按比例稀释,每孔50μl,贴膜,等1h。
(7)倒掉,pbst洗3次。
(8)加入辣根过氧化物酶,每孔50μl,贴膜,室温放置30min。
(9)倒掉,pbst洗5次,每孔加入50μl显色剂(1xtmbelisasubstratesolution)室温放置15min。
(10)加1m磷酸(终止液)25μl每孔,用针把气泡弄破,酶标仪450nm读数。
(3.3)细胞死亡检测
根据细胞的大小和生长速度将适量细胞接种到96孔细胞培养孔板中,使待检测时细胞密度不超过80-90%满。加入不同药物进行处理,并设置适当对照。药物刺激完毕后,将细胞培养板用多孔板离心机400g离心5min。尽量吸除上清,加入150μl用pbs稀释了10倍的试剂盒提供的ldh释放试剂(10体积pbs中加入1体积ldh释放试剂并混匀),适当摇晃培养板混匀,然后继续在细胞培养箱中孵育1小时。随后将细胞培养板用多孔板离心机400g离心5min。分别取各孔的上清液120μl,加入到一新的96孔板相应孔中,随即进行样品测定。
a.各孔分别加入60μlldh检测工作液。
b.混匀,室温(约25℃)避光孵育30min(可用铝箔包裹后置于水平摇床或侧摆摇床上缓慢摇动)。然后在490nm处测定吸光度。使用600nm或大于600nm的任一波长作为参考波长进行双波长测定。
c.计算(测得的各组吸光度均应减去背景空白对照孔吸光度)。
d.细胞毒性或死亡率(%)=(处理样品吸光度-样品对照孔吸光度)/(细胞最大酶活性的吸光度-样品对照孔吸光度)×100。
e.可绘制细胞毒性曲线:纵坐标为实际吸光度,横坐标为药物浓度;据此可计算该药物作用特定时间的半致死剂量ld50。
4.结果说明
本发明使用ripk1k45a基因敲除小鼠以及野生型c57小鼠移植ripk1k45a基因敲除小鼠骨髓来构建非酒精性脂肪肝和肝纤维化模型。结果表明ripk1激酶失活能够显著改善小鼠的肝功能,降低脂肪肝水平,其血清中的谷丙转氨酶和甘油三酯水平均显著下降(如图1所示)。
通过mcd饲料喂养小鼠四周成功构建脂肪肝和肝纤维化模型,取小鼠肝组织进行he染色和天狼星染色,观察小鼠肝脏的脂肪肝和纤维化程度。结果表明,ripk1k45a基因敲除小鼠以及移植ripk1k45a基因敲除小鼠骨髓的野生型c57小鼠较正常小鼠的脂肪肝和肝纤维化程度明显减轻,其中骨髓移植小鼠对脂肪肝和纤维化的改善效果优于全身性ripk1敲除小鼠(如图2、图3所示),因此可针对单核细胞/巨噬细胞中的ripk1激酶活性开发其抑制剂来治疗脂肪肝、肝硬化和肝纤维化等肝损伤疾病。
分别提取c57小鼠和ripk1k45a基因敲除小鼠的骨髓,在体外诱导分化为骨髓巨噬细胞,使用棕榈酸(pa300、pa400)处理24小时,检测细胞死亡和炎症。发现ripk1k45a基因敲除的骨髓巨噬细胞能够明显降低棕榈酸诱导的死亡和炎症(如图4所示)。
- 还没有人留言评论。精彩留言会获得点赞!