一种细胞外囊泡—白介素-10纳米靶向药物及其制备方法和应用与流程
本发明属于生物医药领域,具体涉及一种细胞外囊泡—白介素-10纳米靶向药物及制备方法和应用。
背景技术:
炎症是多种肾脏病共有的病理现象,以炎症细胞浸润和炎症介质释放为特征,其本质是机体对损伤刺激的防御反应,具有清除感染、修复损伤等作用。但是,紊乱的炎症反应反而会加重肾组织损伤,促进肾脏纤维化。因此,如何防治肾脏炎症一直是肾脏病研究领域的热点及难点。
白细胞介素-10(il-10)最初于1989年发现并报道,具有抗炎、免疫调节等作用。基础研究发现,在多种肾脏病如肾毒血清性肾炎、肾脏缺血再灌注损伤、单侧输尿管梗阻模型中,il-10均能显著抑制促炎因子的产生和炎症细胞的浸润,提示其在肾脏病抗炎治疗中有着广阔的应用前景。然而,il-10在循环中极不稳定,且易激活循环中的炎症细胞,影响其疗效,甚至产生致命的毒副作用。所以,il-10必须通过具有保护作用的运输载体给药于病变肾脏。
细胞外囊泡是活细胞分泌的具有双层脂质膜结构的囊泡,根据其产生方式的不同,主要分为三类:外泌体,微囊泡和凋亡小体。研究表明,细胞外囊泡内包含丰富的蛋白、脂质、核酸以及来自于亲代细胞的膜受体,在多种生理和病理过程中发挥着至关重要的作用。近年来发现,细胞外囊泡作为天然稳定的纳米级膜囊泡,能够穿透生物屏障,保护其内容物不被降解,并被受体细胞高效摄取。同时与其他常用的治疗载体如病毒、脂质体等相比,细胞外囊泡还具有低免疫原性、无细胞毒性等优点。显然,细胞外囊泡作为一种新型天然的药物载体为疾病的治疗提供了新的策略。现有研究证实,细胞外囊泡可以作为多种药物的运输载体,如核酸类药物(sirna、microrna),抗炎药物(姜黄素),抗癌药(多柔比星、紫杉醇)等。然而,目前将il-10载入细胞外囊泡实现肾脏病抗炎治疗还未有行之有效的方法。
技术实现要素:
发明目的:针对现有技术存在的问题,本发明提供一种细胞外囊泡—白介素-10纳米靶向药物。本发明的纳米靶向药物包括源自raw264.7巨噬细胞的细胞外囊泡和被包裹在所述细胞外囊泡内作为有效成分的白介素-10,作为靶向药,更利于到达肾脏病变部位,通过抑制炎症因子的表达和炎症细胞的浸润达到改善肾脏炎症的目的。
本发明还提供所述细胞外囊泡—白介素-10纳米靶向药物的制备方法和应用。
技术方案:为了实现上述目的,如本发明所述一种细胞外囊泡—白介素-10纳米靶向药物,包括源自raw264.7巨噬细胞的细胞外囊泡和被包裹在所述细胞外囊泡内作为有效成分的il-10。
本发明所述的细胞外囊泡—白介素-10纳米靶向药物的制备方法,包括以下步骤:
(1)通过il-10过表达质粒转染raw264.7巨噬细胞,得到il-10表达上调的raw264.7巨噬细胞;
(2)通过地塞米松干预上述转染后的raw264.7巨噬细胞,进一步刺激il-10的表达和释放;
(3)收集步骤(2)中地塞米松干预后的raw264.7巨噬细胞的细胞培养液,对细胞外囊泡进行分离提取,提取细胞外囊泡,即得细胞外囊泡—白介素-10纳米靶向药物。
其中,步骤(1)所述通过il-10过表达质粒转染raw264.7巨噬细胞的具体方法为:用含有cmv-mcs-sv40-neomycinil-10质粒和lipofectamine2000的opti-mem混合液转染raw264.7巨噬细胞。
进一步地,将raw264.7巨噬细胞培养于含10%胎牛血清的ripm1640培养基中,置于37℃、饱和湿度、5%co2培养箱中培养,当细胞融合达到70%-80%时,用含有cmv-mcs-sv40-neomycinil-10质粒和lipofectamine2000的opti-mem混合液转染raw264.7巨噬细胞8-12小时。
作为优选,所述转染1×106个raw264.7巨噬细胞需要5-8μgcmv-mcs-sv40-neomycinil-10质粒和10-15μllipofectamine2000。
更优选地,所述转染1×106个raw264.7巨噬细胞需要5μgcmv-mcs-sv40-neomycinil-10质粒和10μllipofectamine2000。
其中,步骤(2)所述通过地塞米松干预raw264.7巨噬细胞的具体方法为:用含有200nmol/l地塞米松的ripm1640培养基干预raw264.7巨噬细胞36-48小时。优选,干预raw264.7巨噬细胞48小时。
进一步地,当步骤(1)中raw264.7巨噬细胞转染8-12小时后,用pbs(ph7.4)清洗细胞,并更换为ripm1640培养基,加入地塞米松使其终浓度为200nmol/l,继续培养raw264.7巨噬细胞36-48小时。
其中,步骤(3)所述细胞外囊泡分离提取的方法为超速离心法,通过2000g离心20分钟,10000离心5分钟,收集上清200000g离心2小时获得沉淀,用无菌pbs重悬清洗,再次200000g离心2小时获得负载il-10的细胞外囊泡,即为细胞外囊泡—白介素-10纳米靶向药物。用无菌pbs(ph7.4)或无菌生理盐水重悬,-80℃保存。
本发明所述的细胞外囊泡—白介素-10纳米靶向药物在制备肾脏抗炎药物或制剂中的应用。
进一步地,所述的细胞外囊泡—白介素-10纳米靶向药物显著提高了il-10的稳定性,并使il-10选择性的在肾脏病变部位释放,通过抑制炎症因子的表达和炎症细胞的浸润在制备达到改善肾脏炎症目的的肾脏抗炎药物或制剂中的应用。
本发明所述的用于预防和治疗肾脏炎症的药物组合物,其中含有细胞外囊泡—白介素-10纳米靶向药物作为活性成分和药学上可接受的载体。
作为优选,所述药物组合物是胶囊剂、散剂、片剂、颗粒剂、丸剂、注射剂、糖浆剂、口服液、吸入剂、软膏剂、栓剂或贴剂。
有益效果:与现有技术相比,本发明具有如下优点:
1、将源自raw264.7巨噬细胞的细胞外囊泡首次作为有效成分il-10的运输载体,不仅提高了il-10的稳定性,还可使其在肾脏病变部位富集,从而获得良好的靶向抗炎效果,在肾脏病的治疗中具有非常可观的应用前景。
2、本发明以源自raw264.7巨噬细胞的细胞外囊泡作为运输载体,包裹il-10形成制剂,作为靶向药,更利于到达肾脏病变部位。本发明细胞外囊泡—白介素-10纳米靶向药物显著提高了il-10的稳定性,并使il-10选择性的在肾脏炎症部位释放,通过抑制炎症因子的表达和炎症细胞的浸润达到改善肾脏炎症的目的;同时对其他器官无明显毒副作用。
3、本发明提供的细胞外囊泡—白介素-10纳米靶向药物的制备方法使所述细胞外囊泡良好的包裹了il-10,为其他基于细胞因子的治疗提供了新的给药策略。
4、本发明的制备方法简单、方便、高效,raw264.7细胞数量充足、来源广泛,可以进行规模化生产。
附图说明
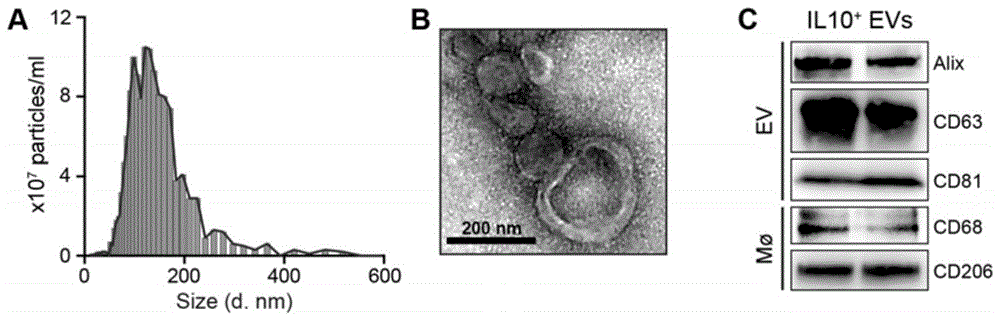
图1为细胞外囊泡—白介素-10纳米靶向药物(缩写:il-10+evs)的一般鉴定示意图:(a)il-10+evs的粒径分布图;(b)透射电镜观察il-10+evs的形态;(c)westernblot检测il-10+evs上细胞外囊泡和巨噬细胞的标志蛋白;
图2为细胞外囊泡—白介素-10纳米靶向药物(il-10+evs)中il-10的测定图:(a)抗体芯片筛查il-10+evs中的il-10;(b)elisa和westernblot检测il-10+evs中的il-10;
图3为细胞外囊泡—白介素-10纳米靶向药物(il-10+evs)的稳定性评估示意图:(a)elisa检测温度对il-10的影响;(b)elisa检测酸溶液对il-10的影响;
图4为细胞外囊泡—白介素-10纳米靶向药物(il-10+evs)的靶向性评估示意图:(a)lc-ms/ms筛查,westernblot验证il-10+evs上的整合素蛋白;(b)肾脏离体成像;
图5为细胞外囊泡—白介素-10纳米靶向药物(il-10+evs)对缺血再灌注损伤诱导的肾脏炎症的治疗作用示意图:(a)he染色观察肾脏病理改变;(b)rt-pcr检测肾组织中促炎因子的mrna水平;(c)免疫荧光染色检测肾间质巨噬细胞(cd68+)浸润;
图6为pas染色评估细胞外囊泡—白介素-10纳米靶向药物(il-10+evs)的安全性示意图。
具体实施方式
以下结合附图和实施例对本发明作进一步说明。
实施例1
细胞外囊泡—白介素-10纳米靶向药物(il-10+evs)的制备与鉴定
1、细胞外囊泡—白介素-10纳米靶向药物的制备
体外培养raw264.7巨噬细胞(购自中国科学院细胞库)于完全培养基中[ripm1640基础培养基(美国gibco)含体积分数10%胎牛血清(美国gibco)]。待培养皿中细胞达到70%融合时,用pbs(ph7.4,美国gibco)清洗细胞两次,然后加入含有cmv-mcs-sv40-neomycinil-10质粒(中国吉凯基因)和lipofectamine2000(美国invitrogen)的opti-mem(美国gibco)混合液。转染1×106个raw264.7巨噬细胞需5μgcmv-mcs-sv40-neomycinil-10质粒、10μllipofectamine2000。待转染8时后,用pbs(ph7.4)清洗细胞两次,更换为ripm1640基础培养基,并加入地塞米松(美国sigma)使其终浓度为200nmol/l。待地塞米松干预48小时后,收集细胞培养液于无菌离心管中,通过超速离心法提取细胞外囊泡,于4℃、2000g离心20分钟以去除细胞和碎片;小心将上清转移到新的无菌离心管中,于4℃、10000g离心5分钟以去除小碎片;小心将上清转移到100kd超滤离心管中,于4℃、4000g离心20分钟以浓缩上清;小心将浓缩后的上清转移到无菌离心管中,于4℃、200000g离心2小时获得沉淀,再用无菌pbs(ph7.4)重悬清洗一次,于4℃、200000g离心2小时获得沉淀即为细胞外囊泡—白介素-10纳米靶向药物,用无菌pbs(ph7.4)或无菌生理盐水重悬用于后续实验。
2、细胞外囊泡的一般鉴定
(1)粒径检测:将上述步骤1中所得细胞外囊泡重悬液(细胞外囊泡—白介素-10纳米靶向药物的重悬液)送上海逍鹏生物科技有限公司检测粒径分布,所用仪器是德国pmx纳米颗粒跟踪分析仪zetaview。结果如图1a所示,细胞外囊泡的平均直径为134nm。
(2)形态检测:通过透射电镜观察细胞外囊泡的形态,用移液枪将所制备的细胞外囊泡悬液充分吹打均匀,吸取10μl滴到200目的载样铜网上,室温静止1h,用滤纸小心吸掉多余液体,干燥后于透射电镜成像拍照。结果如图1b所示,可见双层膜结构,符合细胞外囊泡的特征。
(3)标志物检测:通过westernblot检测细胞外囊泡的表面标志蛋白,结果如图1c所示,所制备的细胞外囊泡表达囊泡标志物alix、cd63和cd81,也表达巨噬细胞标志物cd68和cd206,证明其是来源于巨噬细胞的细胞外囊泡。
3、细胞外囊泡中il-10的测定
(1)通过抗体芯片(美国r&d)筛查所制备细胞外囊泡中细胞因子的表达。将细胞外囊泡沉淀用ripa裂解液(美国invitrogen)裂解,并用bca蛋白定量试剂盒(美国invitrogen)对其进行浓度测定,取300μg裂解后囊泡进行抗体芯片检测。结果如图2a所示,所制备的细胞外囊泡中含有丰富的il-10。
(2)通过il-10quantikineelisa试剂盒(美国r&d)定量细胞外囊泡中的il-10。细胞外囊泡沉淀同样用ripa裂解液裂解后进行浓度测定,取10μg裂解后囊泡进行elisa检测。结果如图2b所示,在10μg所制备的细胞外囊泡中含有110ng的il-10。
(3)通过westernblot检测细胞外囊泡中的il-10,结果如图2b所示,所制备的细胞外囊泡中可以检测到il-10条带。
本实施例结果说明,本发明所制备的细胞外囊泡—白介素-10纳米靶向药物(il-10+evs)符合细胞外囊泡的一般特征,并且提供的制备方法使所述细胞外囊泡高效的包裹了il-10。
实施例2
实施例2与实施例1的制备方法相同,不同之处在于,转染1×106个raw264.7巨噬细胞需8μgcmv-mcs-sv40-neomycinil-10质粒、15μllipofectamine2000。待转染12小时后,用pbs(ph7.4)清洗细胞两次,更换为ripm1640基础培养基,并加入地塞米松(美国sigma)使其终浓度为200nmol/l。待地塞米松干预36小时后,收集细胞培养液于无菌离心管中,通过超速离心法提取细胞外囊泡。
实施例3
细胞外囊泡—白介素-10纳米靶向药物(il-10+evs)的稳定性和靶向性
1、细胞外囊泡—白介素-10纳米靶向药物的稳定性
将细胞外囊泡—白介素-10纳米靶向药物(实施例1)和游离il-10(美国r&d公司,用pbs(ph7.4)配成的溶液)(按两者中il-10起始浓度均为60ng/ml计算,具体根据实施例1中的3(2)方法检测)分别储存于-80℃、37℃,分别于12小时、1天、2天、3天、7天后,再次通过elisa检测其中il-10的浓度,结果如图3a所示,-80℃保存对纳米靶向药物中的il-10浓度无明显影响;并且与游离的il-10相比,细胞外囊泡的包裹使得il-10在37℃中更为稳定。
同样将il-10起始浓度均为60ng/ml的细胞外囊泡—白介素-10纳米靶向药物和游离il-10储存于ph为5.5的酸溶液中,4℃,12小时后再次通过elisa检测il-10的浓度,结果如图3b所示,细胞外囊泡的包裹使得il-10在酸溶液中更为稳定。
2、细胞外囊泡—白介素-10纳米靶向药物的靶向性
通常,细胞外囊泡的表面组分和膜蛋白决定了他们与特定细胞的相互作用。有研究观察到巨噬细胞释放的胞外囊泡可以通过表面的粘附分子靶向到炎症部位。因此,本发明将实施例1所制备的负载il-10的细胞外囊泡送上海吉凯基因化学技术有限公司行lc-ms/ms检测,所用仪器是美国赛默飞世尔科技公司的easy-nlccoupledtoqexactiveplus。结果如图4a所示,所制备的细胞外囊泡上含有丰富的整合素分子,并且通过westernblot验证了整合素α4、α5、αl、αm、β1、β2在细胞外囊泡上的表达。
然后,为了观察细胞外囊泡—白介素-10纳米靶向药物的在体分布,对照组(sham)小鼠和缺血再灌注损伤组(iri)小鼠(构建方法同实施例4)分别通过尾静脉注射了100μg荧光染料did(美国sigma)标记的细胞外囊泡—白介素-10纳米靶向药物,于注射24小时后,处死动物,留取肾脏进行荧光成像(ivisspectrumimagingsystem,perkinelmer),结果如图4b所示,did标记的细胞外囊泡—白介素-10纳米靶向药物在对照组小鼠肾脏只有少量沉积,而在缺血再灌注损伤的肾脏中有大量沉积,表明所制备的细胞外囊泡—白介素-10纳米靶向药物能够靶向至损伤肾脏。
本实施例结果说明,本发明所制备的细胞外囊泡—白介素-10纳米靶向药物,能够显著提高il-10的稳定性,并且能有效的靶向病变肾脏,使其在肾脏病变部位富集,从而获得良好的靶向抗炎效果。
实施例4
细胞外囊泡—白介素-10纳米靶向药物(il-10+evs)对缺血再灌注损伤诱导的肾脏炎症的治疗作用
实验所用c57bl/6小鼠,8-10周龄,购于北京维通利华实验动物技术有限公司。肾脏缺血再灌注损伤模型(iri)的构建:小鼠经质量分数4%水合氯醛腹腔注射麻醉,背部去毛,消毒备皮。在背部脊柱旁0.5cm、肋骨下缘0.5cm处剪开皮肤,钝性分离肌肉,清理周边的脂肪组织和结缔组织,小心暴露肾脏和肾蒂;用微型动脉夹夹闭肾蒂,可见肾脏由鲜红变紫黑色,表示夹闭成功。夹闭35分钟后去除动脉夹,恢复血流灌注,可见肾脏迅速恢复原来颜色。分两层缝合开口,待小鼠清醒后,将其放回洁净笼具饲养。对照组(sham)不做缺血处理,其他操作一样。细胞外囊泡—白介素-10纳米靶向药物的治疗:在肾脏恢复血流后,即通过尾静脉注射不同剂量的实施例1制备纳米靶向药物(100μg、200μg,细胞外囊泡—白介素-10纳米靶向药物),每隔24小时治疗一次,共3次。对照组通过尾静脉注射相同体积的生理盐水。所有小鼠在造模后3天处死。
通过he染色观察肾脏病理改变,结果如图5a所示,所制备的细胞外囊泡—白介素-10纳米靶向药物的治疗能剂量依赖性的改善肾小管损伤。
通过rt-pcr检测肾组织中炎症因子tnf-α、il-6、il-1β、ccl-2、ccl-5的mrna水平,结果如图5b所示,所制备的细胞外囊泡—白介素-10纳米靶向药物的治疗能剂量依赖性的降低促炎因子的表达。
通过免疫荧光染色检测肾间质中巨噬细胞(cd68+)浸润情况,结果如图5c所示,所制备的细胞外囊泡—白介素-10纳米靶向药物的治疗能够显著抑制巨噬细胞的浸润。
此外,通过pas染色对其他器官如心脏、肝脏、脾脏、肺脏进行安全性评估,结果如图6所示,未见所制备的细胞外囊泡—白介素-10纳米靶向药物对其他器官的毒副作用。
本实施例结果说明,本发明所制备的细胞外囊泡—白介素-10纳米靶向药物能够显著改善缺血再灌注损伤诱导的肾脏炎症反应,表现为炎症因子的降低和巨噬细胞浸润减少,同时未观察到该纳米靶向药物对其他器官的毒副作用。
统计学分析
统计数据以平均值±标准误的形式给出,spss13.0统计软件处理数据,组件比较采用单因素方差分析,两组比较采用t检验,p<0.05为具有显著差异。实验结果均重复3次以上。
- 还没有人留言评论。精彩留言会获得点赞!