一种兔球虫病减毒活疫苗助悬剂及悬浮液的制作方法
本发明涉及兽医寄生虫学及免疫生物学,具体涉及一种兔球虫病减毒活疫苗助悬剂及悬浮液。
背景技术:
兔球虫病是由艾美耳属球虫寄生于胆管或肠道而引起的寄生虫病,该病与兔瘟、兔巴氏杆菌、兔疥癣病被列为四大兔病。其中兔球虫病是最常见且危害最严重的寄生虫病。兔艾美耳属球虫种类繁多,目前国际公认的为11种,而我国主要流行种为大型艾美耳(eimeriamagna)、中型艾美耳(eimeriamedia)、肠艾美耳(eimeriaintestinalis)等,各品种兔对艾美耳球虫都易感,1-4月龄的兔最易感。幼兔感染后死亡率高,耐过后成为长期带虫者,不断向环境中排出卵囊,污染笼舍、料槽饮水等设备,并感染幼兔。该循环是兔球虫病不能得到有效控制的重要原因。
而动物疫病会制约养兔产业的发展,如上所述,兔球虫病是其中一个亟待解决的主要问题。由于目前尚无相关疫苗上市,仅依靠抗球虫药物来预防。但药物的使用带来了很多负面影响,如造成动物性食品中药物残留、引发抗药虫株的出现等。因此,在实际养殖中迫切需要更加安全有效的方法进行兔球虫病的防控。
球虫病疫苗在鸡球虫防控领域的巨大成功表明了使用活卵囊疫苗是预防球虫病的最佳手段。目前,本领域已经存在一些具有良好的安全性和有效性的兔球虫减毒活疫苗,通过接种兔球虫减毒活疫苗可以取得不错的免疫效果。然而这种接种疫苗的免疫方式在应用于实际养殖时,需要花费大量的时间资源和人力资源,不利于控制生产成本。
与之相对的,饮水免疫法是现阶段规模化养殖场免疫的最佳方法,适合于复杂的饲养环境和生产条件需要。但由于卵囊的密度大于水,因此静置长时间后疫苗中的卵囊容易下沉,影响卵囊在水中的均匀分布导致疫苗免疫不均从而免疫失败。
现有的鸡球虫病疫苗主要由柔嫩艾美耳球虫、堆型艾美耳球虫、巨型艾美耳球虫、毒害艾美耳球虫早熟株的一种或一种以上组成,其卵囊平均大小分别为22μm×19μm、18μm×15μm、31μm×21μm、20μm×17μm。兔球虫生活史与鸡球虫相似,但其卵囊大小存在一定的差异。比如,兔球虫病减毒活疫苗中大型艾美耳球虫卵囊平均大小为37.3μm×24.1μm,中型艾美耳球虫为25.4μm×15.3μm、肠艾美耳球虫为27μm×18μm,因此将现有技术中应用于鸡的球虫疫苗助悬剂应用于兔球虫病减毒活疫苗时,由于卵囊的大小不同、密度不同,在悬浮稳定性上会有一定差异,因此需针对不同种的兔球虫的卵囊特征制备出适用于兔球虫病减毒活疫苗的助悬剂。同时,目前应用于鸡的球虫疫苗助悬剂在组分上相对复杂,所需的生产成本较高。此外,现有的应用于鸡的助悬剂还存在助悬剂溶解性较差的问题,由于大多数的胶体都比较难溶,在生产应用中将浪费大量的时间用于溶解助悬剂。
技术实现要素:
(一)要解决的技术问题
为了寻找一种合适的助悬剂将球虫病疫苗制成稳定的混悬液,延长兔的饮水时间,并减少兔的应激反应,使其获得均匀有效的球虫免疫保护力。
(二)技术方案
第一方面,本发明提供了一种兔球虫病减毒活疫苗助悬剂,含有质量分数为0.15-0.3‰(更优选为0.25‰)的助悬复合剂,所述助悬复合剂由质量比为1:(0.8~1.2)的果胶和黄原胶组成。
本发明发现,通过上述助悬剂,不仅可以维持疫苗卵囊在疫苗溶液中的悬浮状态,而且不会对卵囊产量和子孢子产生不利影响,同时,对兔本身无毒性,是一种较为理想的兔球虫病减毒活疫苗助悬剂。
优选地,所述果胶和黄原胶的质量比为1:1。
本发明进一步发现,一定浓度的kcl可以在不影响上述助悬复合剂效用的同时,增加溶解速度,作为优选,所述的兔球虫病减毒活疫苗助悬剂还含有质量分数为0.6~1.2%(更优选为1.0%)的kcl。
此外,本发明在研发过程中还尝试使用过cn200510036004.6中的材料吹干粉和cn201210231082.1中的加热方法等,其均不能使果胶和黄原胶快速溶解。
作为优选,所述的果胶、黄原胶和kcl均为食品级。
当然,所述兔球虫病减毒活疫苗助悬剂中所用的其他原料(比如水)也应当为食品级或药物级。
在一些实施方案中,所述的兔球虫病减毒活疫苗助悬剂制备方法为:按质量份分别取果胶、黄原胶及kcl,与水混合搅拌混匀即可。
第二方面,本发明提供了一种兔球虫病减毒活疫苗悬浮液,含有兔球虫病减毒活疫苗和所述的兔球虫病减毒活疫苗助悬剂。
优选的,当所述兔球虫病减毒活疫苗的制备原料为大型艾美耳球虫、中型艾美耳球虫和肠艾美耳球虫的早熟系时,与本发明中的兔球虫病减毒活疫苗助悬剂具有更好的复配效果,在应用于兔时具有很好的安全性和免疫效果。
更优选所述兔球虫病减毒活疫苗的制备原料包括的艾美耳球虫、中型艾美耳球虫和肠艾美耳球虫的早熟系虫株孢子化卵囊。
作为优选,所述兔球虫病减毒活疫苗通过球虫卵囊分离纯化、孢子化后制得。
作为一种优选方案,所述兔球虫病减毒活疫苗的制备过程如下:将大型艾美耳球虫、中型艾美耳球虫、肠艾美耳球虫的早熟系,通过球虫卵囊分离纯化、孢子化后按一定比例配比混合而成。
优选地,在所述兔球虫病减毒活疫苗中,大型艾美耳球虫的早熟致弱虫株100~3000卵囊/头份,肠艾美耳球虫的早熟致弱虫株500~5000卵囊/头份,中型艾美耳球虫的早熟致弱虫株500~6000卵囊/头份。
作为优选,在所述兔球虫病减毒活疫苗悬浮液中,兔球虫病减毒活疫苗的用量为50-80ml悬浮液/头份疫苗(按6h免疫,在不造成兔群应激的情况下可适当调整免疫时间,相应的饮水量也需进行调整)。
例如,某养殖场一栋兔舍有2000只兔(假设兔日龄为30日龄,每只兔的饮水量约为10ml/h),按6h免疫,则其饮水量约为120l。按该饮水量加入本发明的助悬剂后,加入2000头份的疫苗于混悬液中搅拌均匀即可。
第三方面,本发明提供一种可经口摄入的兔球虫病减毒活疫苗产品,含有所述的兔球虫病减毒活疫苗悬浮液及其药学上可接受的佐剂。
由于仔兔一般靠母乳饲养,因此仔兔通过饮水免疫的方法具有局限性,而本发明的助悬剂能使卵囊均匀的分散在体系内因此不仅能用于饮水免疫还可用于喷雾免疫解决不同年龄段兔的球虫病预防免疫。由于现代规模化养殖兔业根据实际情况兔的出栏时间以及断奶时间有些许差异,因此建议兔群若采取主动管道饮水的进行饮水免疫,不能采用管道饮水的进行喷雾免疫。
第四方面,本发明提供所述的兔球虫病减毒活疫苗助悬剂或所述的兔球虫病减毒活疫苗悬浮液或所述的可经口摄入的兔球虫病减毒活疫苗产品在兔的养殖中的应用。
本领域人员可对优选方案进行组合,得到本发明较佳实施例。
(三)有益效果
本发明中的兔球虫病减毒活疫苗助悬剂可实现通过饮水方式对兔进行免疫,此外,该助悬剂在常温下溶解速度快,可使兔球虫卵囊在水中形成均匀分散的体系,并保持6小时以上不发生下沉,保证了兔球虫病活疫苗免疫的均匀性,为兔球虫病减毒活疫苗在实际生产中的推广与应用提供了有力的技术支持。
附图说明
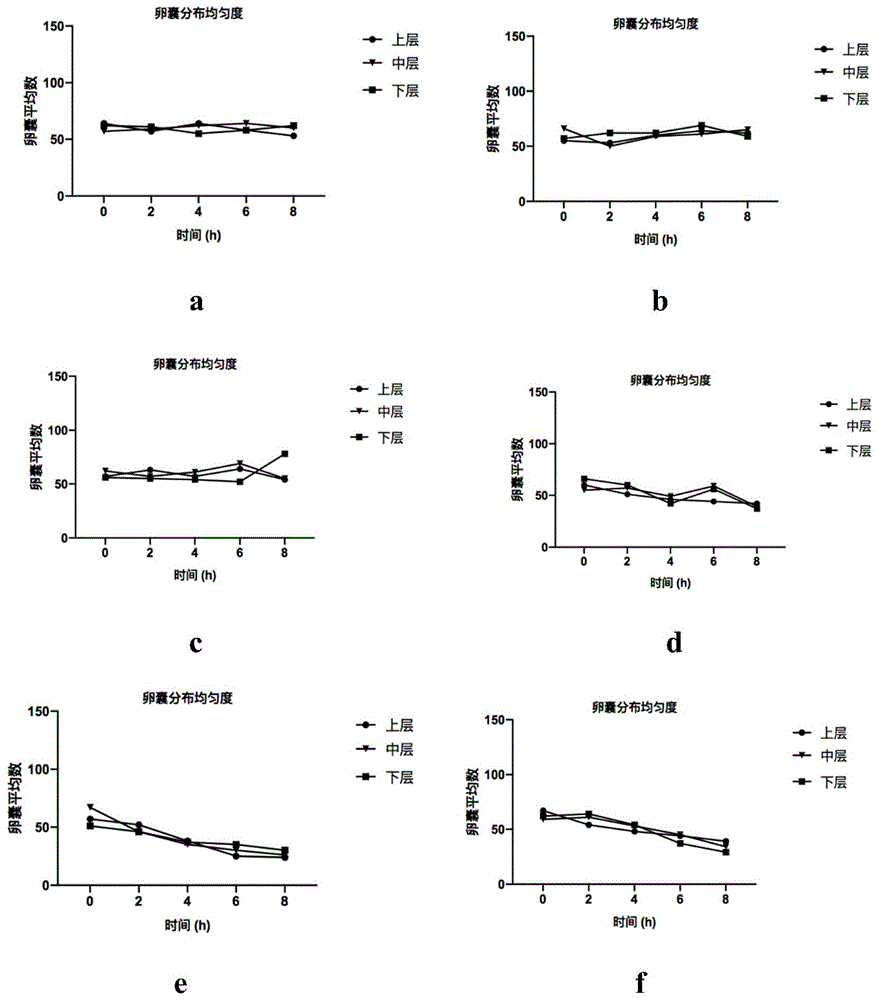
图1为试验例1中兔球虫病减毒活疫苗的卵囊分布均匀度测试结果;其中,a图~f图依次对应实施例1~3、对比例1~3的结果;
图2为试验例3中兔球虫病减毒活疫苗免疫后的卵囊产量统计结果及增重结果;其中,左图为卵囊产量统计结果,右图为增重结果;
图3为试验例4中兔球虫病减毒活疫苗攻毒前及攻毒后的卵囊产量统计结果;其中,左图为攻毒前的卵囊产量;右图为攻毒后的卵囊产量;
图4为试验例4中兔球虫病减毒活疫苗攻毒前及攻毒后的免疫均一性结果;其中,左图为攻毒前的免疫均一性;右图为攻毒后的免疫均一性;
图5为试验例4中兔球虫病减毒活疫苗攻毒前及攻毒后的体重变化结果;其中,左图为攻毒前的体重变化结果;右图为攻毒后的体重变化结果;
图6为试验例4中兔球虫病减毒活疫苗攻毒前及攻毒后的饲料转换率结果;其中,左图为攻毒前的饲料转换率结果;右图为攻毒后的饲料转换率结果;
图7为试验例5中兔球虫病减毒活疫苗攻毒前及攻毒后的卵囊产量统计结果;其中,左图为攻毒前的卵囊产量;右图为攻毒后的卵囊产量;
图8为试验例5中兔球虫病减毒活疫苗攻毒前及攻毒后的体重变化结果;其中,左图为攻毒前的体重变化结果;右图为攻毒后的体重变化结果。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。
在以下实施方式中,所用的助悬剂原料均为食品级,通过市售途径获得。
所用的兔球虫病减毒活疫苗的制备过程如下:将大型艾美耳球虫、中型艾美耳球虫、肠艾美耳球虫早熟系,通过球虫卵囊分离纯化、孢子化后按大型艾美耳球虫的早熟致弱虫株150卵囊/头份,肠艾美耳球虫的早熟致弱虫株800卵囊/头份,中型艾美耳球虫的早熟致弱虫株3000卵囊/头份配比混合而成。
其中,所述的大型艾美耳球虫、中型艾美耳球虫、肠艾美耳球虫早熟系与cn110694058a的具体实施方式中所使用的对应球虫一致。
试验动物为30日龄家兔,购自河北省张家口市涿鹿广义兔业合作社,饲养于无球虫污染的隔离器中。
实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件,或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可通过正规渠道商购买得到的常规产品。
实施例1
本实施例提供一种兔球虫病减毒活疫苗助悬剂,含有质量分数为0.2‰的助悬复合剂和质量分数为1%的kcl,所述助悬复合剂由质量比为1:1的果胶和黄原胶组成。
其制备方法为:按质量份分别取果胶、黄原胶及kcl,与水混合搅拌混匀即可。
实施例2
本实施例提供一种兔球虫病减毒活疫苗助悬剂,与实施例1的区别在于:kcl的质量分数为0.8%。
实施例3
本实施例提供一种兔球虫病减毒活疫苗助悬剂,与实施例1的区别在于:不含有kcl。
对比例1
本对比例提供一种兔球虫病减毒活疫苗助悬剂,与实施例1的区别在于:不含有果胶、kcl。
对比例2
本对比例提供一种兔球虫病减毒活疫苗助悬剂,与实施例1的区别在于:不含有黄原胶、kcl。
对比例3
本对比例提供一种兔球虫病减毒活疫苗助悬剂,与实施例1的区别在于:将果胶、黄原胶替换为等量的羧甲基纤维素。
试验例1助悬剂维持疫苗卵囊在疫苗溶液中的悬浮状态
试验步骤:取1000ml实施例1~3、对比例1~3中的助悬剂,放入2l烧杯中,用移液枪取兔球虫病减毒活疫苗(400万卵囊)加入烧杯中,充分搅拌均匀后,分别于配制好的球虫疫苗混合液后的0、2、4、6、8小时用移液枪在烧杯的1000-8000,6000-4000,2000-0ml的位置(即疫苗混悬液上、中、下三层)分别吸取100μl球虫疫苗混合液至洁净的1.5ml离心管中,每个离心管加入900μl饱和生理盐水后用1ml移液枪吹打混匀将液体充入麦克马斯特计数板,于10倍显微镜下计算卵囊数,每层取10个样。以0小时为基数,计算并统计卵囊在静置不同时间后的悬浮效果,结果见表1。
表1.卵囊分布均匀度试验结果
结果(见图1;其中,a图~f图依次对应实施例1~3、对比例1~3的结果)表明,本发明实施例1~3在6小时内,卵囊数量的比值在范围之内,疫苗卵囊既不上浮也不下沉,符合悬浮要求,加入kcl不会影响疫苗混悬液的悬浮稳定性。但实施例3助悬剂的溶解时间远远长于实施例1、实施例2。而对比例1,2,3的悬浮稳定性较差,不符合悬浮要求。
试验例2助悬剂溶于水的速度测试
在现代集约化养兔业中,兔厂的养殖规模一般较大,其任何一个环节中的工作效率均可对养殖厂的效益造成影响。必须说明的是,在大规模养兔业中,每栋兔舍饲养的兔多达2000只,相应的兔饮水量大,助悬剂加入的多,将会浪费大量的时间在溶解助悬剂上,影响兔球虫病减毒活疫苗在实际生产中的应用。因此兔球虫疫苗的使用过程中球虫活卵囊疫苗的助悬剂必须快速溶解才能符合高效率的现代化养兔生产的要求。
本实验例分别对实施例1~3的助悬剂的溶解速度进行测试,具体过程如下:按实施例1~3中的配比,分别称取原料,在同样的搅拌速度下加入含有1000ml水的2l烧杯中,静置并记录溶解时间,结果见下表2。
表2
结果表明,助悬剂中加入kcl能够加快溶解速度,当kcl浓度为1%时能立即溶解。
试验例3助悬剂对兔球虫子孢子及对兔体本身的毒性作用测试
兔球虫卵囊具有较厚的卵囊壁,可抵抗较强的外界压力和有害作用。但当卵囊进入兔体内后,卵囊中的子孢子会在胃的机械作用和肠道中消化酶的作用下释放出来。子孢子在失去卵囊壁和孢子囊壁的保护后十分脆弱,且可能与兔体摄入的悬浮剂直接接触,助悬剂有潜在的对球虫子孢子的伤害。因此验证助悬剂组分对疫苗组分中兔球虫子孢子是否具有毒性是十分必要的。
试验步骤:用30日龄的家兔,根据体重随机分为四组,第1组3只兔不接种作为空白对照组;第2组3只兔口服接种;第3组3只兔进行饮水6h免疫接种;第4组3只兔进行饮水免疫24h接种,将四组兔于相同的条件下隔离饲养,经过5天的适应期后进行接种。在实验室隔离器条件下监测到30日龄左右兔的饮水量情况如下表3:
表3.家兔饮水量情况
即30日龄左右的家兔每只饮水量为10ml/h左右。家兔的饮水量与气温、采食量等条件影响变化较大,该数据为隔离器条件下温度为26摄氏度,通风良好,正常采食的情况下测得。
第3组和第4组根据本发明实施例1配制成相应浓度的混悬剂后,取181ml和726ml该混悬剂分别加入3头份的疫苗用于6小时和24小时的饮水免疫接种。早熟株的潜伏期分别为:e.magna96h(4d),e.media72h(3d),e.intestinal132h(5.5d),根据早熟株的潜伏期收集免疫接种后3-14d的粪便进行卵囊计数,确定有效接种剂量,以及对接种前及接种后14d的兔进行称重,确定免疫后的增重情况。免疫接种方式如下表4:
表4.免疫接种方式
兔球虫病减毒活疫苗免疫后的卵囊产量统计结果及增重结果见图2;其中,左图为卵囊产量统计结果,右图为增重结果。结果表明,本发明中助悬剂的加入不会影响卵囊产量,即助悬剂对子孢子不会产生毒害作用;兔子的增重无明显变化,即助悬剂的摄入不会对兔体产生毒害作用。因此兔球虫病减毒活疫苗使用助悬剂进行饮水免疫并不会影响疫苗免疫效果及兔的生长健康。
试验例4饮水免疫
为探究该疫苗助悬剂在实际生产中的应用效果,对兔群进行饮水免疫。
试验步骤:30日龄的家兔150只,根据体重随机分为5组,第1组30只兔不接种作为空白对照组;第2组30只兔进行口服接种;第3组30只兔进行6h的饮水免疫接种(第3组和第4组有单独的水线,分别随机检查5个位置上兔的免疫情况。);第4组30只兔进行6h饮水免疫接种(该组不加助悬剂),第5组30只兔不免疫仅攻毒。经过5天的适应期后进行接种。免疫后14天进行攻毒,每只兔经口接种大型艾美耳球虫、中型艾美耳球虫、肠艾美耳球虫野生株各1万个卵囊。
第3组根据本发明实施例1配制成相应浓度的混悬剂后,取1.8l混悬剂加入30头份的疫苗用于6h小饮水免疫接种,第4组取1.8l水不加助悬剂直接加入30头份的疫苗用于6h小饮水免疫接种,野生株的潜伏期:e.magna120h(5d);e.media108h(4.5d);e.intestinal204h(8.5d)。根据早熟株的潜伏期收集免疫接种后3-14d的卵囊,确定有效接种剂量;根据野生株的潜伏期收集攻毒后4-14d的卵囊数,确定疫苗的保护效果。通过比较接种及攻毒后的卵囊产量,免疫均一性,体重变化,饲料转换率,存活率及死亡率确定饮水免疫方式的可行性。免疫接种方式如下表5:
表5饮水免疫
兔球虫病减毒活疫苗攻毒前及攻毒后的卵囊产量统计结果见图3,免疫均一性结果见图4,体重变化结果见图5,饲料转换率结果见图6,;在图3~6中,左图为攻毒前的结果,右图为攻毒后的结果;存活率及死亡率见表6。结果表明,相对于无助悬剂组的饮水免疫,添加助悬剂组的饮水免疫效果较好,免疫均一性更好。由于饮水免疫实验不是在隔离器中,而是在敞开的大环境中,因此空白组也存在球虫感染的情况。
表6存活率及死亡率
试验例5喷雾免疫
由于母兔免疫后并不能通过母源抗体使仔兔获得免疫,因此仔兔也需进行免疫,已有实验证明20日龄之前的仔兔对球虫不易感,而30日龄的兔却完全易感,因此仔兔的预防免疫应该20-30日龄之间,考虑到仔兔日龄太小易感性差会影响疫苗的免疫,因此本实验选用25日龄的仔兔进行免疫。
试验步骤:25日龄的仔兔4窝(每窝8只),每窝为1组。第1组作为空白组,第2组进行喷雾免疫,第3组进行直接口头灌服免疫,第4组不免疫仅攻毒。饲养于无球虫隔离器免疫后14天进行攻毒,每只兔经口接种大型艾美耳球虫、中型艾美耳球虫、肠艾美耳球虫野生株各1万个卵囊。收集各组兔免疫后3-14天,攻毒后4-14天的粪便检查卵囊产量,以及各组兔在免疫和攻毒过程中的体重变化。根据卵囊产量和体重变化,评估喷雾免疫的效果。免疫接种方式见表7,其中,喷雾免疫是指将8头份的疫苗加入10ml助悬液中均匀混合后喷于垫料表面进行免疫。
表7喷雾免疫
结果见图7~8,其中,图7为攻毒前及攻毒后的卵囊产量统计结果,图8为攻毒前及攻毒后的体重变化结果;在图7~8中,左图为攻毒前的结果,右图为攻毒后的结果。结果表明,通过喷雾免疫能产生一定的免疫保护作用,且该方法操作简单,对于不能通过饮水免疫的仔兔来说具有一定的优势。
虽然,上文中已经用一般性说明、具体实施方式及试验,对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!