一种pH-GSH双响应性纳米化姜黄素前药载药体系的制作方法
本发明属于纳米生物医药材料领域,涉及载药体系及其制备,具体涉及一种ph-gsh双响应性纳米化姜黄素前药载药体系。
背景技术:
研究表明,在癌症治疗中,大多数抗癌药物水溶性差、利用率低、对正常细胞具有毒副作用一直是化疗过程中面临的难题。因此,对水溶性差的小分子抗癌药物进行结构设计和修饰,将其活性基团保护起来形成前药分子,可提高疏水药物的水溶性;癌细胞内部微环境与正常细胞之间的差异,如较低的ph、较高浓度的谷胱甘肽(gsh)等,可刺激前药分子释放出活性药物,而在正常细胞中不释放或较少释放,从而降低药物对正常细胞的毒副作用。
姜黄素(curcumin,cur)是一种黄色多酚类化合物,在抗肿瘤、抗炎、抗氧化、降压、降胆固醇等方面具有广泛的药理活性,然而水溶性差限制了其在临床中的应用。纳米化的前药体系,是在传统抗癌药物结构上进行设计和改性得到能够在水溶液中自组装形成纳米结构的递药体系。此类递药体系具有高渗透长滞留效应(enhancedpermeabilityandretentioneffect,epr效应),不仅可以改善药物水溶性,而且能够优先在肿瘤组织中富集,当前药体系在癌细胞内受到刺激后,释放出活性药物,在体内外实验中显示出优异的抗肿瘤性能。2017年,姜虎林等人将苯硼酸修饰到聚乙二醇-聚丙烯酸聚合物(peg-pph)上,cur通过与苯硼酸形成硼酯键修饰到聚合物上,在水溶液中自组装形成纳米结构,分散性和稳定性较好,并且在肿瘤微环境刺激响应下释放出cur,实现药物的高效输送和有效的癌症治疗。
然而,利用聚合物的方式构建前药递送体系存在体系结构复杂、药物负载率低、刺激响应单一,使药物释放速率低,所以构建具有易于合成、负载率高、多重刺激响应的纳米化前药体系具有重大意义。
技术实现要素:
针对现有技术存在的缺陷或不足,本发明的首要目的在于提供一种具有良好生物相容性和双响应性多功能纳米化前药载药体系。
为了实现上述任务,本发明采取如下的技术解决方案:
一种ph-gsh双响应性纳米化姜黄素前药载药体系,其特征在于,采用具有ph响应性的水溶性柱[5]芳烃作为主体分子,以具有gsh响应性的二硫键和吡啶盐修饰的苯硼酸衍生物为客体分子,姜黄素通过与苯硼酸衍生物形成具有ph刺激响应的硼酯键被修饰到客体分子上,通过主客体络合作用后,形成两亲性姜黄素前药分子,进而利用亲疏水作用使得两亲性姜黄素前药分子在水溶液中自组装形成纳米粒子,得到ph-gsh双响应性纳米化姜黄素前药体系。
根据本发明,所述的水溶性柱[5]芳烃的ph响应性来自其中的水溶性羧酸盐;所述二硫键和吡啶盐修饰的苯硼酸衍生物,其gsh响应性来自其中的二硫键;所述姜黄素前药为通过硼酯键连接的姜黄素与苯硼酸衍生物,其ph响应性来自于其中的硼酯键。
上述的ph-gsh双响应性纳米化姜黄素前药载药体系的制备方法,其特征在于,按如下步骤进行:
1)在柱[5]芳烃大环分子上修饰具有ph响应性的羧酸盐,得到水溶性柱[5]芳烃作为主体分子;
2)将客体分子二硫键和吡啶盐修饰的苯硼酸衍生物与主体分子水溶性柱[5]芳烃通过主客体络合作用,制得具有ph-gsh双响应的化合物;
3)将ph-gsh双响应的化合物在水溶液中与姜黄素通过硼酯键连接,形成两亲性姜黄素前药分子,构筑纳米化姜黄素前药体系;
4)两亲性姜黄素前药分子利用亲疏水作用形成纳米粒子,形成ph-gsh双响应性纳米化姜黄素前药载药体系。
根据申请人的实验表明,上述ph-gsh双响应性纳米化姜黄素前药载药体系
实验结果表明,该ph-gsh双响应性纳米化姜黄素前药载药体系,不仅具有良好的生物相容性,还可以有效降低抗癌药物对正常细胞的毒副作用;相比于单一的抗癌药物如姜黄素或阿霉素,该纳米化姜黄素前药体系能够增强抗癌药物对癌细胞的杀伤能力,实现两种抗癌药物共同治疗癌症的效果,为构建ph-gsh双响应性的纳米化姜黄素前药载药体系提供了一个新的途径。
本发明的ph-gsh双响应性纳米化姜黄素前药载药体系,将水溶性差的抗癌药物姜黄素通过结构修饰形成前药分子,提高其水溶性。利用癌细胞内部较低的ph、较高浓度的gsh,促使体系中纳米前药粒子的破裂,从而在癌细胞内快速释放所负载的抗癌药物,同时可刺激姜黄素前药分子释放出活性药物姜黄素。与现有技术相比。具有以下技术创新:
(1)解决了纳米载药体系中用药单一和刺激响应单一的问题,符合当今社会的发展要求,具有良好的应用和发展前景。
(2)通过硼酯键将疏水抗癌药物姜黄素修饰到亲水分子上,显著提高其水溶性,ph-gsh双响应性的纳米化姜黄素前药载药体系相比小分子药物,不仅具有更高的载药量,还可避免纳米载体包裹的药物在运输过程中的泄漏。
(3)双负载抗癌药物的纳米化姜黄素前药体系在癌细胞内较低的ph和较高浓度的gsh刺激下,可加速纳米粒子破裂释放出姜黄素和其他抗癌药物,达到联合用药的目的,提高对癌细胞的杀伤力。
附图说明
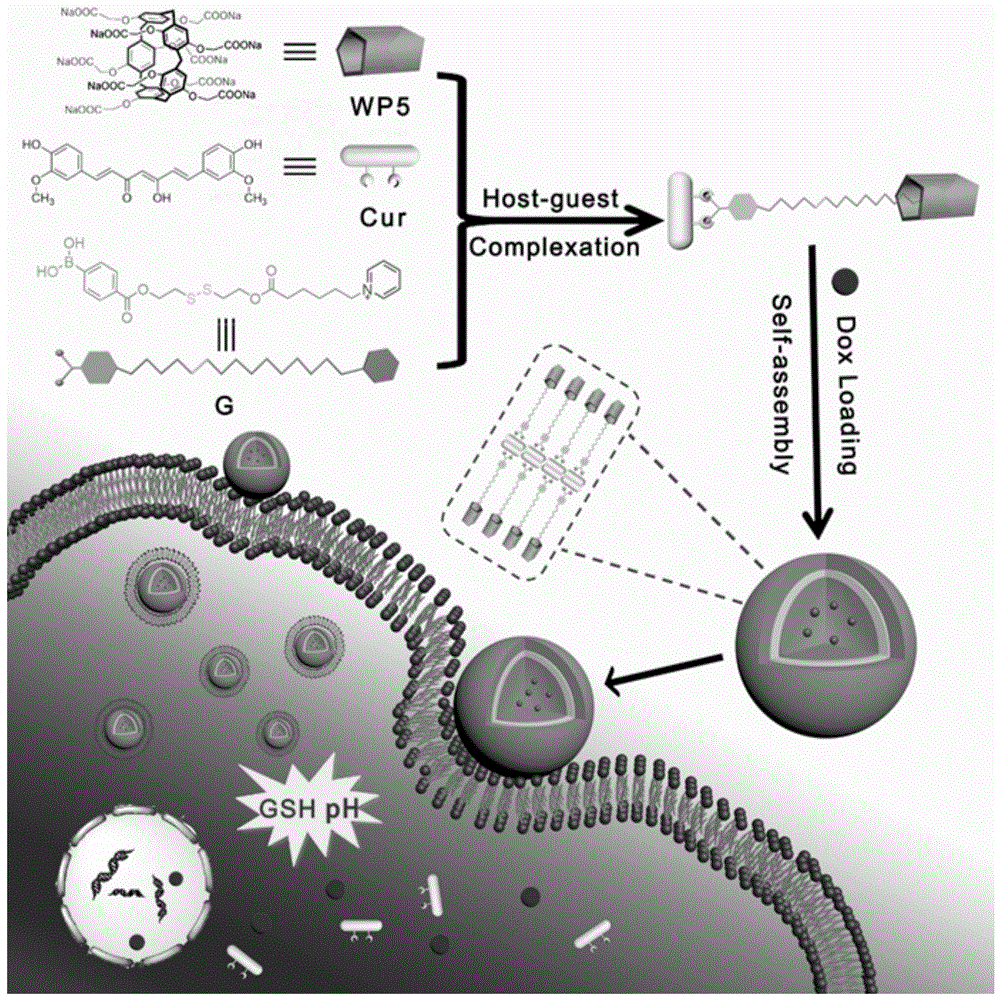
图1是本发明的ph-gsh双响应性纳米化姜黄素前药载药体系的制备以及抗癌药物在癌细胞内释放的示意图;
图2是ph-gsh双响应性纳米化姜黄素前药体系的扫描电镜图;
图3是实施例5所得化合物wp5的核磁共振氢谱图;
图4是实施例7所得化合物g的核磁共振氢谱图;
图5是实施例8所得wp5g的核磁共振氢谱图;
图6是实施例9所得两亲性姜黄素前药分子wp5g-cur的紫外吸收谱图;
图7是所得ph-gsh双响应性纳米化姜黄素前药载药体系的细胞毒性实验结果;
图8是所得ph-gsh双响应性纳米化姜黄素前药载药体系的体外模拟释放曲线;
图9是所得ph-gsh双响应性纳米化姜黄素前药载药体系的激光共聚焦实验结果,其中,图a是dapi通道(蓝色荧光),图b是dox·hcl通道(红色荧光),图c是cur通道(绿色荧光),图d是图a、b、c的合并。
以下结合附图和实施例对本发明作进一步的详细说明。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,在以下的实施例中给出了ph-gsh双响应性纳米化姜黄素前药载药体系及其制备过程,应当理解,以下的实施例仅用以解释本发明,并不用于限定本发明。
参见图3,图4,图5和图6,本实施例给出一种ph-gsh双响应性纳米化姜黄素前药载药体系,采用具有ph响应性的水溶性羧酸盐功能化柱[5]芳烃作为主体分子,吡啶盐和双硫键修饰的苯硼酸衍生物作为客体分子,通过主客体络合作用制得ph-gsh双响应性的化合物,抗癌药物姜黄素通过硼酯键与其连接形成两亲性姜黄素前药分子;两亲性姜黄素前药分子通过亲疏水作用形成多功能纳米粒子,并将抗癌药物负载在纳米粒子的孔隙中,从而构成ph-gsh双响应性纳米化姜黄素前药载药体系。
所述ph-gsh双响应性来自两亲性姜黄素前药分子中羧酸盐功能化的柱[5]芳烃,以及客体分子中的二硫键和硼酯键。
其中的姜黄素前药分子能够显著提高姜黄素在水溶液中的溶解性,此类纳米化姜黄素前药粒子不仅具有较高的载药量,实现抗癌药物姜黄素的活性保护,还可避免姜黄素在运输过程中的泄漏。
上述ph-gsh双响应性基团的选择性来源于:
1)主体分子为水溶性羧酸盐功能化的柱[5]芳烃,其ph响应性来自其中的水溶性羧酸钠盐;
2)所述的客体分子为含有二硫键和吡啶盐的苯硼酸衍生物,其gsh响应性来自其中的二硫键;
3)所述的姜黄素前药为通过硼酯键连接的抗癌药物姜黄素与苯硼酸衍生物,其ph响应性来自于其中的硼酯键。
本实施例的ph-gsh双响应性纳米化姜黄素前药载药体系,能够用于抗癌药物运输的应用,该载药体系利用癌细胞内溶酶体、内含体等较低的ph环境,促使体系中的硼酯键断裂、水溶性羧酸盐的疏水性增强,从而释放出抗癌药物姜黄素;同时癌细胞内较高浓度的gsh促使体系中二硫键快速断裂,加速纳米粒子破裂,从而在癌细胞内快速释放所负载的抗癌药物,达到联合用药的目的,提高对癌细胞的杀伤力。
以下是具体的实施过程。
参见图1,ph-gsh双响应性纳米化姜黄素前药载药体系的制备方法,按如下步骤进行:
1)在柱[5]芳烃两端修饰上羧酸盐得到主体分子wp5;
2)合成含二硫键和吡啶盐的苯硼酸衍生物客体分子g;
3)将含二硫键和吡啶盐的苯硼酸衍生物客体分子与水溶性羧酸盐功能化的柱[5]芳烃通过主客体作用形成ph-gsh双响应的wp5g,在溶液中,抗癌药物姜黄素与wp5g通过硼酯键连接形成两亲性姜黄素前药分子wp5g-cur,再通过亲疏水作用自组装形成多功能纳米粒子,并将抗癌药物负载在纳米粒子的孔隙中,从而构建ph-gsh双响应性纳米化姜黄素前药载药体系。
(一)水溶性羧酸盐功能化的柱[5]芳烃主体分子wp5的合成
实施例1:化合物2的合成
化合物2的合成路线如下:
准确称取1,4-二甲氧基苯(0.691g,5mmol)和多聚甲醛(0.450g,15mmol)于100ml圆底烧瓶中,加入60ml的1,2-二氯乙烷溶解。然后向上述溶液中加入三氟化硼乙醚(0.75ml,6mmol),氮气保护下常温搅拌2h,反应结束后加入冰水淬灭反应。常压过滤,然后使用旋转蒸发仪去除溶剂。将残留物溶解在二氯甲烷(dcm)中,分别使用去离子水、饱和nahco3溶液、饱和nacl溶液洗涤3次,收集有机相并用无水mgso4干燥2h,过滤,减压蒸馏去除有机溶剂之后,可得到粗品,柱层析分离(石油醚/二氯甲烷,v/v=2∶1)即可获得白色固体即为化合物2。
实施例2:化合物3的合成
化合物3的合成路线如下:
准确称取化合物2(0.660g,0.88mmol)于50ml圆底烧瓶中,加入20ml干燥的dcm溶解,逐滴加入三溴化硼(4ml,43mmol),氮气保护下常温搅拌24h。待反应结束后,加入冰水淬灭反应。加入冰水搅拌30min后,抽滤得白色固体并用1mmol/l的盐酸和氯仿洗涤,即可得到化合物3。(该化合物不稳定,选择得到后,直接做下一步)。
实施例3:化合物4的合成
化合物4的合成路线如下:
将化合物3(0.610g,1mmol)分散在30ml乙腈中,并向悬浊液中加入k2co3(1.658g,12mmol),室温下搅拌30min。然后加入溴乙酸乙酯(2ml,18mmol)和ki(0.166g,1mmol),氮气保护下回流24h。待反应结束,溶液自然冷却后,过滤以除去多余的k2co3,然后使用旋转蒸发仪去除溶剂。将残留物重新溶解在dcm中,分别用去离子水、饱和nacl溶液洗涤3次,收集有机相并用无水na2so4干燥2h。常压过滤,减压蒸馏去除有机溶剂之后,即可得到粗品,柱层析分离(二氯甲烷/甲醇,v/v=50:1)即可获得橘黄色固体4。
实施例4:化合物5的合成
化合物5的合成路线如下:
准确称取化合物4(0.294g,0.2mmol)于50ml圆底烧瓶中,加入12ml四氢呋喃(thf)溶解,向圆底烧瓶中加入6ml浓度为20%的naoh溶液,加热回流18h。待反应溶液冷却至室温后,将混合物减压蒸馏除去溶剂。把残余物溶解于20ml去离子水中,然后逐滴加入1mmol/l的盐酸酸化,待溶液中不再产生沉淀为止。将上述溶液以8000rpm的转速离心5min,倒去上清液,可得白色固体,用水洗涤3次,真空干燥,得到化合物5。
实施例5:化合物wp5的合成
化合物wp5的合成路线如下:
准确称取化合物5(0.240g,0.2mmol)于25ml圆底烧瓶中,加入4ml去离子水。准确称取naoh(0.080mg,0.2mmol)溶解于1ml去离子水中后,逐滴滴加到上述溶液中并不断震荡,直至混合溶液刚好完全澄清。通过真空干燥,即可得到化合物wp5,为淡黄色固体。化合物wp5的核磁共振氢谱图如图3所示。
(二)含吡啶盐的具有二硫键的苯硼酸衍生物客体分子g的合成
实施例6:化合物8的合成
化合物8的合成路线如下:
准确称取化合物7(0.772g,5mmol)于50ml圆底烧瓶中,加入15ml乙腈作为溶剂,加入二环己基碳二亚胺(dcc,1.236g,6mmol)和4-二甲氨基吡啶(dmap,0.061g,0.5mmol),室温下搅拌30min。将6-溴己酸(0.975g,5mmol)溶解在5ml乙腈中,逐滴加入圆底烧瓶中,室温下搅拌72h。待反应结束后,将反应液过滤,使用旋转蒸发仪去除溶剂,将残留物重新用dcm溶解,分别用去离子水、饱和nacl溶液洗涤3次,收集有机相并用无水mgso4干燥2h。常压过滤以除去干燥剂,使用旋转蒸发仪去除溶剂,可得到粗品。经柱层析分离(石油醚/乙酸乙酯,v/v=6:1)可获得化合物8。
实施例7:化合物g的合成
化合物g的合成路线如下:
准确称取化合物9(0.830g,5mmol)于50ml圆底烧瓶中,加入干燥thf(15ml)作为溶剂,随后加入氯化亚砜(5.950g,50mmol),室温搅拌12h。待反应后,使用旋转蒸发仪去除溶剂。向圆底烧瓶中加入干燥的吡啶,加入化合物8(0.662g,2mmol),氮气保护下加热到80℃反应24h。待溶液自然冷却后,柱层析分离(二氯甲烷/甲醇,v/v=10:1)即可获得化合物g,化合物g的核磁共振氢谱图如图4所示。
(三)ph-gsh双刺激响应性的主客体络合形成的wp5g的制备
实施例8:
wp5g制备路线如下:
准确称取7.1mgwp5和2.5mgg,分别在cd3od:d2o=1:1的混合溶剂中进行核磁共振氢谱表征。图5是双亲分子wp5g的核磁共振氢谱。(四)ph-gsh双刺激响应性的两亲性姜黄素前药分子wp5g-cur的制备
实施例9:
ph-gsh双刺激响应性的两亲性姜黄素前药分子wp5g-cur的制备线路如下:
准确称取cur,将其配置成33μmcur溶液(加入5%甲醇助溶),同时准确称取wp5g,将其配置成相同浓度的wp5g溶液。将两种溶液等比例混合,避光条件下常温搅拌12h。此外,分别取1ml上述cur溶液和wp5g溶液,各加入1ml去离子水,搅拌均匀。用紫外可见分光光度计对上述溶液进行紫外可见吸收光谱测定。图6是具有ph-gsh双响应性的姜黄素前药载药体系的紫外吸收光谱。
(五)ph-gsh双刺激响应性的两亲性姜黄素前药分子wp5g-cur的制备
实施例10:
ph-gsh双刺激响应性的两亲性姜黄素前药分子wp5g-cur的制备线路如下:
定量称取抗癌药物dox·hcl溶解于去离子水中,配置成至500μm标准溶液,加入等当量的制备好的wp5g-cur溶液,避光条件下超声处理2h后,静置24h以包封药物。取少量上述制备好的溶液滴到铜网表面,染色后自然晾干即可用扫描电子显微镜观察。图2给出了ph-gsh双响应性纳米化姜黄素前药载药体系的扫描电镜图片。
另外申请人还将上述ph-gsh双响应性纳米化姜黄素前药载药体系进行了细胞毒性实验(图7);ph-gsh双响应性纳米化姜黄素前药载药体系的体外模拟释放曲线(图8);以及癌细胞摄取ph-gsh双响应性纳米化姜黄素前药载药体系的激光共聚焦实验(图9),在图9中,图a是dapi通道(蓝色荧光),图b是dox·hcl通道(红色荧光),图c是cur通道(绿色荧光),图d是图a、图b和图c的合并。
通过激光共聚焦实验验证了该纳米载药体系成功的被癌细胞摄入,并释放出抗肿瘤药物盐酸阿霉素和姜黄素,同时也证明了该ph-gsh双响应性纳米化姜黄素前药载药体系具有ph-gsh双刺激响应性;通过体外模拟释放实验验证了该载药体系的ph-gsh双响应性;通过细胞毒性实验验证了该载药体系具有较好的生物相容性和提高药物对癌细胞的杀伤力。该多功能纳米粒子的前药载药体系制备过程简单、制备周期短,具有良好的生物相容性,在纳米载药体系中表现出良好的应用和发展前景。
上述实施例是较佳的实施例,是为便于该技术领域的普通技术人员能清楚的理解和应用本发明,本发明不限于上述实施例。熟悉本领域技术的人员显然可以容易的对这些实施例做出各种添加或替换,而不必付出大量的创造性劳动。因此,本领域技术人员对本发明的技术方案所做出的增加和替换,均应属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!