一种壳寡糖修饰的白桦脂酸药物运输体系的制备方法及其应用与流程
本发明属于生物医药材料领域,涉及一种基于活性壳寡糖桥连天然小分子纳米载体的制备方法及其协同抗癌应用。
背景技术:
当前,癌症是严重威胁人类生命安全的恶性疾病之一。基于化疗、光疗、热疗、免疫治疗相结合的肿瘤治疗方式已被广泛探索并用于临床癌症治疗。但传统的化疗药物(如:紫杉醇、盐酸多柔比星等)存在生物利用度低且毒副作用大等缺陷,即使是基于此的联合治疗也往往呈现一定的副作用。因而,探寻安全、高效的化疗药物,并与光疗或热疗相结合,实现癌症治愈意义重大。
壳寡糖(chitosanoligosaccharides,cos),作为自然界中唯一带正电荷阳离子碱性氨基低聚糖,具有优良的生物活性,如抗氧化、消炎、降低胆固醇和增强机体免疫活性、抗肿瘤的活性等。此外,其良好的生物相容性、无毒、对活体器官的不致敏特性,也使其成为纳米工程中一种潜在的药物运输载体和组织支架。然而,其本身的高水溶性特性,也极大程度限制其作为纳米药物运输体系的制备。因而,对其结构修饰并引入新的活性基团十分有必要。
天然产物因来源于植物或动物体,因而具有很好的生物相容性和生物易降解能力。其中,疏水性的小分子天然产物-白桦脂酸(betulinicacid,ba)因具有优良的抗癌活性,兼具本身天然的生物相容性被作为抗癌试剂广泛报道。
技术实现要素:
本发明的目的是提供一种壳寡糖修饰的白桦脂酸药物运输体系的制备方法及其应用。本发明在活性壳寡糖的基础上修饰白桦脂酸,制备两亲性的活性单元分子,一方面可以联合壳寡糖及白桦脂酸的抗癌活性,实现安全、高效地协同增强抗癌目的;另一方面借助分子的两亲性,可以以胶束或者自组装的形式实现药物运输的目的。作为载药体系,一方面可以运载传统化疗药物(如紫杉醇、喜树碱、盐酸多柔比星)实现多重化疗目的,增强抗癌疗效;另一方面可以运载光敏剂(如二氢卟吩e6,简称ce6),从而在实现安全化疗的基础上、联合光疗等起到三重协同增强抗癌疗效目的,有望克服并解决临床癌症治疗。
本发明的目的是通过以下技术方案实现的:
一种壳寡糖修饰的白桦脂酸药物运输体系的制备方法,包括如下步骤:
步骤一、将白桦脂酸(ba)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)、n-羟基琥珀酰亚胺(nhs)溶于有机试剂丙酮、dmf或dmso中,控制ba、edc、nhs的摩尔比为1:1~4:0.5~4;
步骤二、将壳寡糖(cos,聚合度2~6)水溶液缓慢滴加至步骤一的有机试剂中,控制ba与cos的质量比为1:2~5,随后在冰浴下室温搅拌反应20~30h;
步骤三、反应完后,用石油醚:丙酮=5:1(v/v)除去未反应完的白桦脂酸和中间体副产物,用石油醚:丙酮=3:1(v/v)分离出cos-ba;
步骤四、取cos-ba溶解在二甲基亚砜(dmso)中,制备浓度为0.1~35mm的cos-ba母液;
步骤五、取cos-ba母液在超声条件下快速滴加至二次蒸馏水中,控制dmso与水的体积比为0.1~1:10(即0.1~100μldmso:1ml水),经超声(1~25min)、离心,得到cos-banps。
一种以壳寡糖修饰的白桦脂酸药物运输体系为载体的化疗药物的制备方法,包括如下步骤:
步骤一、将白桦脂酸(ba)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)、n-羟基琥珀酰亚胺(nhs)溶于有机试剂丙酮、dmf或dmso中,控制ba、edc、nhs的摩尔比为1:1~4:0.5~4;
步骤二、将壳寡糖(cos,聚合度2~6)水溶液缓慢滴加至步骤一的有机试剂中,控制ba与cos的质量比为1:2~5,随后在冰浴下室温搅拌反应20~30h;
步骤三、反应完后,用石油醚:丙酮=5:1(v/v)除去未反应完的白桦脂酸和中间体副产物,用石油醚:丙酮=3:1(v/v)分离出cos-ba;
步骤四、配制浓度为0.1~25mm的化疗药物溶液和cos-ba母液;
步骤五、取cos-ba母液和化疗药物溶液混合均匀后,在搅拌的情况下加入到水中,控制cos-ba与化疗药物的体积比为1~8:1;在磁力搅拌器上继续搅拌4~8h,转入透析袋中透析12~48h除去有机试剂,经离心获得cos-ba@化疗药物nps。
一种以壳寡糖修饰的白桦脂酸药物运输体系为载体的协同光敏药物的制备方法,包括如下步骤:
步骤一、将白桦脂酸(ba)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)、n-羟基琥珀酰亚胺(nhs)溶于有机试剂丙酮、dmf或dmso中,控制ba、edc、nhs的摩尔比为1:1~4:0.5~4;
步骤二、将壳寡糖(cos,聚合度2~6)水溶液缓慢滴加至步骤一的有机试剂中,控制ba与cos的质量比为1:2~5,随后在冰浴下室温搅拌反应20~30h;
步骤三、反应完后,用石油醚:丙酮=5:1(v/v)除去未反应完的白桦脂酸和中间体副产物,用石油醚:丙酮=3:1(v/v)分离出cos-ba;
步骤四、取cos-ba溶解在dmso中,制备浓度为0.1~35mm的cos-ba母液;
步骤五、取cos-ba母液和光敏剂(ce6)混合均匀后,加入含有naoh的二次蒸馏水中,控制cos-ba与光敏剂的体积比为1~8:1~2,naoh与光敏剂的摩尔浓度比为1:1~3,经超声(1~25min)、离心,获得cos-ba@光敏剂nps。
相比于现有技术,本发明具有如下优点:
1、本发明提供了一种新型、安全、有效的壳寡糖-白桦脂酸(cos-ba)化疗药物,并以此为载体构建多重化疗,或化疗及光动力治疗联合抗癌的活性纳米药物。
2、本发明在活性壳寡糖的基础上,修饰抗癌天然小分子白桦脂酸,构建两亲性的双重化疗药物载体,同时运载化疗药物紫杉醇实现多重化疗;或运载光敏剂ce6,实现光动力治疗的同时,起到协同增强抗癌的目的。
3、本发明解决了传统化疗药物或光敏剂水溶性差、生理环境下易聚集导致生物利用度低下等问题。
4、本发明制备的基于壳寡糖的新型化疗药物壳寡糖-白桦脂酸(cos-ba)不仅可以作为一种安全有效的化疗试剂用于肿瘤治疗,同时也可以作为活性药物运输载体负载传统化疗药物或光敏剂,实现双重化疗及光动力治疗协同联合抗癌目的。最为重要的是,壳寡糖-白桦脂酸具有优良的生物相容性及生物易降解性,有望成为安全、高效的肿瘤治疗试剂及药物运输载体。
附图说明
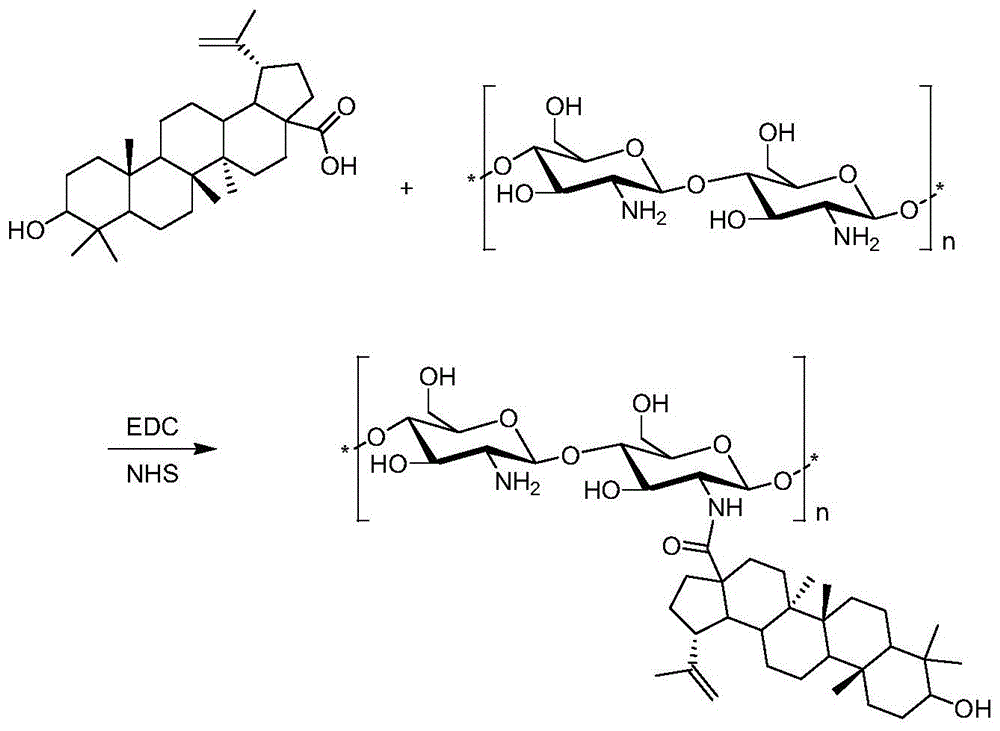
图1为壳寡糖-白桦脂酸(cos-ba)的合成过程;
图2为cos-ba的核磁共振氢谱图(1h-nmr);
图3为cos-banps及与化疗药物ptx组装后的协同抗肿瘤药物cos-ba@ptxnps,及光敏剂ce6共组装后的协同光敏药物cos-ba@ce6nps的sem图,(a)cos-banps,(b)cos-ba@ptxnps,(c)cos-ba@ce6nps;
图4为cos-ba@ptxnps的体外抗癌活性评估;
图5为cos-ba@ce6nps处理下的细胞存活率图;
图6为雌性balb-c小老鼠经cos-ba@ce6nps治疗后的肿瘤体积变化图;
图7为荷瘤老鼠经cos-ba@ce6nps治疗后的体重变化图。
具体实施方式
下面结合附图对本发明的技术方案作进一步的说明,但并不局限于此,凡是对本发明技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,均应涵盖在本发明的保护范围中。
实施例1
化合物壳寡糖-白桦脂酸(cos-ba)的合成:
壳寡糖-白桦脂酸(cos-ba)的合成主要是在缩合剂edc/nhs的催化下,采用一锅法制备,具体合成方法探索如下:将40mg白桦脂酸ba、20mg1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)、21mgn-羟基琥珀酰亚胺(nhs)溶于有机试剂丙酮(4ml)中,然后将1ml壳寡糖(cos,聚合度2~6,96mg)水溶液缓慢滴加至上述有机试剂中,随后在冰浴下室温搅拌反应24h。薄层色谱法检测反应情况;反应完后,用石油醚:丙酮=5:1除去未反应完的白桦脂酸和中间体副产物,用石油醚:丙酮=3:1分离出含量最高的点cos-ba。
壳寡糖-白桦脂酸(cos-ba)的合成过程如图1所示,其中,n=2~6。
以氘代氯仿为溶剂含内标tms(四甲基硅烷),检测cos-ba的核磁氢谱。如图2所示,在4.60ppm和4.73ppm出现的两个单峰为白桦脂酸上的烯烃峰;在0.76ppm,0.83ppm为ba上的甲基峰。在8.98ppm处为新生成的酰胺键上氢峰,在3.0~4.0ppm出现几个多重峰为壳寡糖母环上碳上氢的特征峰。相比游离的ba而言,这些新出现的峰都证实了壳寡糖成功枝接在白桦脂酸上。
实施例2
载药体系的构建(即cos-banps的制备):
取一定量的cos-ba溶解在dmso中,制备浓度为33.5mm的cos-ba母液。取40μl的dmso样品在超声条件下快速滴加至1m二次蒸馏水中,随后超声10min,13500rpm离心得到cos-banps。
实施例3
运载化疗药物:以药物紫杉醇ptx为例。
(1)采用共沉淀法制备cos-ba@ptxnps。
首先配置浓度为20mm的ptx和cos-badmso母液,取50μlcos-ba溶液,10μlptx溶液,充分混合均匀后,将溶液在搅拌的情况下缓慢滴入2ml水中;在磁力搅拌器上继续搅拌4h,转入透析袋(mw=3000)中透析24h除去有机试剂,13500rpm下离心获得cos-ba@ptxnps。
从图3可知,当cos-ba与化疗药物ptx组装后,粒子形貌同样也呈现出球的趋势,但呈现的粒子直径更小,平均直径约为84nm,进一步说明ptx与cos-ba结合可以改变纳米粒子尺寸,ptx成功装载。
(2)cos-ba@ptxnps中的ptx含量测定。
以cos-ba/ptxdmso体积比为8:1实施后续体外细胞实验。即取80μlcos-ba溶液,10μlptx溶液加入2ml二次蒸馏水中得到cos-ba@ptxnps,平行4组,以甲醇为裂解体系破坏纳米药物而释放ptx,采用高效液相色谱法检测ptx载药量。具体条件:流动相:柱温25℃,流动相:乙腈/水=65/35(体积比),流速:1ml/min,检测波长:227nm。最终确定ce6载药量为1.3%,包封率为26.3%。
实施例4
运载光敏剂药物:以ce6为例。
(1)cos-ba@ce6nps共组装药物的制备
采用共沉淀法制备cos-ba与ce6共组装纳米复合药物,即:首先配置浓度为33.5mm的cos-ba和ce6dmso母液。分别取不同体积比的cos-ba和ce6(ce6定体积为5μl)混合均匀后,加入含有10μlnaoh的1ml二次蒸馏水中,随后在超声条件下超声10min,13500rpm下离心获得cos-ba@ce6nps。
从图3中可知,游离的cos-ba本身就可发生组装形成均一的球状纳米药物,平均dls直径为254nm,这表明单一合成的cos-ba本身就可以作为一种双重抗癌活性药物用于纳米肿瘤抗癌。当与光敏剂ce6共组装后,依旧呈现出球状的纳米颗粒,尽管粒子均一性降低,但粒子尺寸出现降低的趋势(约187nm),这进一步表明cos-ba与ce6两种药物的成功组装,可用于多重协同抗癌研究。
(2)cos-ba@ce6nps中光敏剂ce6含量确定
以cos-ba/ce6dmso体积比为8:1实施后续实验,即取5μl的ce6和40μl的cos-badmso溶液加入到含10μlnaoh的1ml二次蒸馏水中,超声反应获得。平行4组实验,以二甲基亚砜为溶剂直接溶解离心得到的cos-ba@ce6nps,并定容至一定体积,而后采用高效液相色谱法检测ce6载药量。具体条件:流动相:柱温30℃,流动相:0.2%磷酸水溶液/乙腈=40/60(体积比),流速:1ml/min,检测波长:402nm。最终确定ce6载药量为8.1%,包封率为96%。
实施例5
cos-ba@ptxnps的化疗活性
以鼠源4t1乳腺癌细胞为细胞株,采用标准的mtt法检测cos-ba@ptxnps的化疗活性。具体过程如下:采用96孔板接种4t1细胞,待细胞贴壁后,加入不同等当量的ptx的cos-ba@ptxnps药物,继续培养24h后,mtt法检测细胞活性。
图4为4t1细胞经协同化疗药物cos-ba@ptxnps培养48h后的细胞存活率图。由图4可知,在等当量的ptx下,ptx和cos-banps呈现浓度相关的化疗活性。进一步说明壳寡糖修饰的白桦脂酸具有明显的化疗活性,有望实现多重协同化疗的目的。而cos-ba@ptxnps在指定的浓度下高于单独的ptx和cos-banps,说明联合抗癌目的目的,且在1ug/ml的ptx下,抗癌活性较为突出,进一步证实多重化疗协同抗癌目的。
实施例6
cos-ba@ce6nps的体外化疗及光动力抗癌活性评估:
以鼠源4t1乳腺癌细胞为细胞株,采用标准的mtt法检测cos-banps的化疗活性及cos-ba@ce6nps的光动力抗癌活性。具体过程如下:采用96孔板接种4t1细胞,待细胞贴壁后,加入不同等当量的ce6的cos-ba@ce6nps药物,对于评估化疗活性,细胞无需光照处理;对于评估药物光动力治疗活性,在加入药物后,继续培养4h后,并在675±10nm的红外光下光照10min,mtt法检测细胞存活率。
图5为协同抗癌药物cos-ba@ce6nps在光照条件下的细胞存活率图。由图5可知,在不光照条件下,游离的ce6并没有呈现任何细胞毒性,而cos-ba@ce6nps却呈现浓度相关的抗癌活性,这充分体现了cos-ba的优良抗癌活性,进一步证实了壳寡糖修饰的白桦脂酸具有明显的化疗活性,有望实现载药协同抗癌治疗。另一方面,在光照条件下,cos-ba@ce6nps相比于等当量的ce6浓度,呈现明显增强的细胞毒性,这进一步证实化疗及光动力治疗协同抗癌。此外,在等当量的低浓度ce6(1μg/ml)时,cos-ba@ce6呈现79%细胞致死率,进一步说明了cos-ba@ce6的显著抗癌活性,有望用于临床抗癌肿瘤研究。
实施例7
以cos-ba@ce6nps为例进行具体的体内抗癌活性评估。
以荷4t1乳腺癌肿瘤的磁性balb-c老鼠为研究对象,以尾静脉注射给药方式,研究药物cos-ba@ce6nps在不光照下的化疗特性及在光照条件下的光动力与化疗相结合的抗癌活性。具体实验分为5组,每组5只老鼠:组1)空白组为5%葡萄糖溶液;组2)ce6光照组3.5mg/kg;组3)ce6不光照组;组4)cos-ba@ce6nps(等当量的ce63.5mg/kg)化疗活性组,即肿瘤不光照组);组5)cos-ba@ce6nps光疗和化疗联合治疗组,即在给药6h后,对老鼠实施麻醉并红光光照肿瘤15min。治疗次数为三次,分别在第0、2、4天实施给药治疗,治疗周期2周,期间并记录肿瘤的体积及老鼠体重等重要参数。肿瘤体积按照如下公式记录:
v=(l×w2)/2;
式中,v代表肿瘤体积,l和w分别代表肿瘤的长和宽。
从图6所示的肿瘤体积变化趋势来看,正如细胞实验描述的结果一样,游离的ce6不光照并没有引起肿瘤体积明显的抑制。相反,不光照条件下,cos-ba@ce6nps呈现适度的肿瘤抑制,肿瘤体积抑制率达到40%,这是由于cos-ba本身的化疗活性导致,进一步证实了壳寡糖修饰的白桦脂酸呈现一定的抗肿瘤活性。另一方面,在光照条件下,cos-ba@ce6nps呈现明显的肿瘤抑制趋势,肿瘤体积抑制率达到76%,明显高于光照组游离的ce6(36%),这说明抗癌活性的增加是cos-ba化疗与ce6光动力疗法的结合,呈现明显的协同抗癌疗效。
从图7中可以看出,荷瘤老鼠经协同药物cos-ba@ce6nps治疗后各组老鼠体重均没呈现显著性变化。尽管光照条件下处理的cos-ba@ce6nps在治疗前期(0~4天)老鼠体重呈现降低的趋势,但在后期肿瘤体积很快恢复至正常,这说明协同药物是生物安全的。进一步说明壳寡糖-白桦脂酸具有优良的生物相容性及生物易降解性,有望成为安全、高效的肿瘤治疗试剂及药物运输载体。
- 还没有人留言评论。精彩留言会获得点赞!