HIF羟化酶抑制剂的药物制剂的制作方法
本申请是申请日为2014年6月5日、申请号为201480031209.2、发明名称为“hif羟化酶抑制剂的药物制剂”的中国发明专利申请的分案申请,原申请为国际申请号为pct/us2014/041021的国家阶段申请,该国际申请要求2013年6月6日提交的美国临时专利申请第61/831,909号的优先权。该优先权申请的全部内容通过引用并入本文。
背景
本发明总体上涉及[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸的药物制剂。
如美国专利号7323475中所述,[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸(或者本文中称为化合物a)是低氧诱导因子(hif)脯氨酰羟化酶的强效抑制剂。hif脯氨酰羟化酶抑制剂具有增加hif稳定性和/或活性的用途,且具有特别是治疗和预防与hif有关的紊乱,包括贫血以及缺血和缺氧相关紊乱的用途。
近期已发现化合物a暴露于光之后会分解。迄今为止,还没有教导提供化合物的必要光稳定性的化合物a的药物制剂。
概述
本发明通过提供包含[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸、药学上可接受的赋形剂和有效量的光稳定剂的药物制剂,来满足提供化合物a和其它化合物的光稳定性的需要。在一个实施方案中,该药物制剂包含少于约0.2%w/w(基于活性药物成分(api)的量)的[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸光降解产物。在另一实施方案中,光稳定剂阻挡波长范围为约200nm至约550nm的光。
在一个实施方案中,光稳定剂包含二氧化钛和至少一种额外的染料。在一个实施方案中,光稳定剂阻挡波长范围为约200nm至约550nm的光。在一个实施方案中,染料选自黑色染料、蓝色染料、绿色染料、红色染料、桔色染料、黄色染料及其组合。在另一实施方案中,染料选自红色染料、桔色染料、黄色染料及其组合。
在一个实施方案中,染料选自诱惑红ac(alluraredac)、诱惑红ac铝色淀(alluraredacaluminumlake)、氧化铁红、氧化铁黄、日落黄fcf、日落黄fcf铝色淀、靛蓝、靛蓝铝色淀及其组合。
在一个实施方案中,该药物制剂包含约20mg至约200mg的[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸。在另一实施方案中,该药物制剂包含约20mg、约50mg或约100mg的[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸。
在一个实施方案中,固体剂型包含该药物制剂,且固体剂型选自胶囊、片剂、珠剂(bead)、颗粒剂、球剂(pellet)、锭剂(lozenge)、丸剂或胶。在另一实施方案中,该固体剂型是片剂。在另一实施方案中,该固体剂型是胶囊。
本发明提供包含[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸、药学上可接受的赋形剂和有效量的光稳定剂的片剂。在一个实施方案中,该片剂包含片芯和包衣。在一些实施方案中,将光稳定剂混入片剂或片芯。在其它实施方案中,片芯包含[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸和药学上可接受的赋形剂,且包衣包含光稳定剂。
在一个实施方案中,包衣是以基于片芯的重量约3%w/w至约8%w/w的量存在于片剂中。在另一实施方案中,片芯包含约22%w/w至约28%w/w的[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸(基于片芯的重量)。在又一实施方案中,药学上可接受的赋形剂包含一水乳糖、微晶纤维素、聚维酮(povidone)、交联羧甲基纤维素钠和硬脂酸镁。
在一个实施方案中,包衣包含约0.1%w/w至约50%w/w的光稳定剂(基于包衣的重量)。在一些实施方案中,光稳定剂包含二氧化钛和选自诱惑红ac、诱惑红ac铝色淀、氧化铁红、氧化铁黄、日落黄fcf、日落黄fcf铝色淀、靛蓝、靛蓝铝色淀及其组合中的至少一种额外的染料。在另一实施方案中,光稳定剂包含二氧化钛和诱惑红ac铝色淀。
本发明提供包含[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸、药学上可接受的赋形剂和有效量的光稳定剂的胶囊剂。在一个实施方案中,胶囊剂包含胶囊填充物和胶囊壳。在一个实施方案中,胶囊填充物包含[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸和药学上可接受的赋形剂,且胶囊壳包含光稳定剂。
在一个实施方案中,胶囊填充物包含约12%w/w至约15%w/w的[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸(基于胶囊填充物的重量)。在另一实施方案中,药学上可接受的赋形剂包含一水乳糖、微晶纤维素、聚维酮、交联羧甲基纤维素钠和硬脂酸镁。
在一个实施方案中,胶囊壳包含约1.8%w/w至约6%w/w的量的光稳定剂(基于胶囊壳的重量)。在一些实施方案中,光稳定剂包含二氧化钛和选自诱惑红ac、氧化铁红、氧化铁黄及其组合中的至少一种额外的染料。
在一个单独的实施方案中,提供了抑制[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸的光降解的方法。该方法包括将[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸与有效量的光稳定剂配制成剂。在另一实施方案中,光稳定剂包含二氧化钛和至少一种额外的染料。
在又一实施方案中,提供了治疗、预治疗或延迟至少部分由低氧诱导因子(hif)介导的病症的发作或发展的方法。该方法包括对有需要的患者施用本文所述的药物制剂、片剂或胶囊剂。
在又一实施方案中,提供了治疗、预治疗或延迟贫血的发作或发展的方法。该方法包括对有需要的患者施用本文所述的药物制剂、片剂或胶囊剂。
附图说明
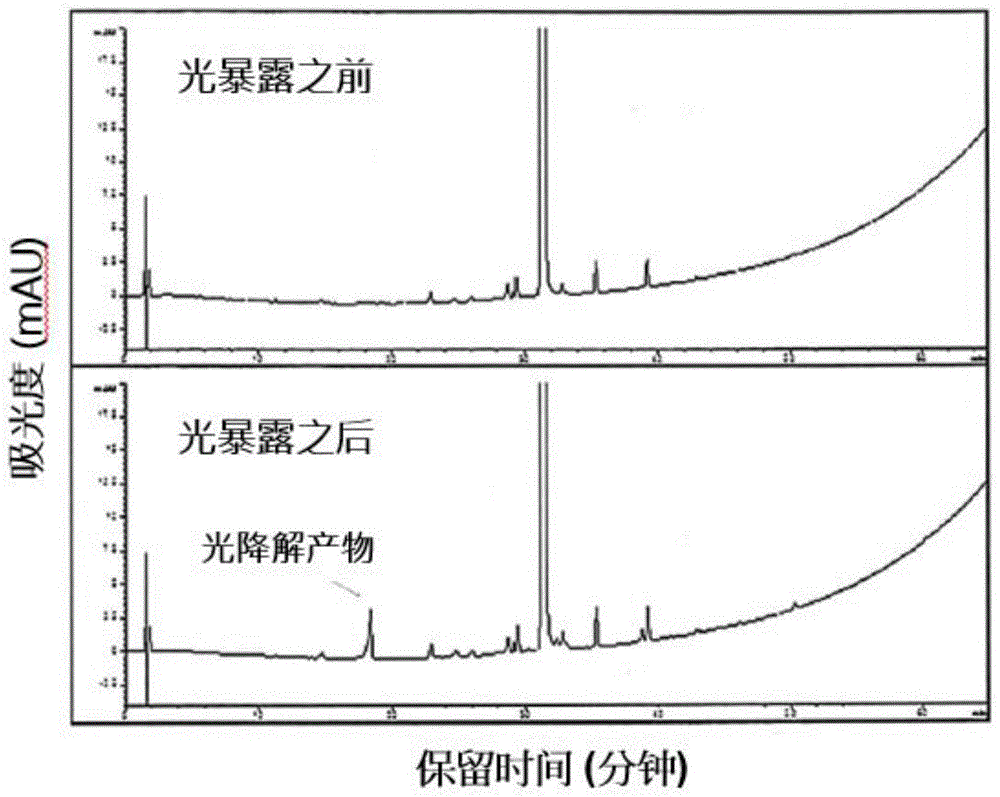
图1示出暴露于阳光之前和之后化合物a粉末的hplc色谱图。详见实施例1。
图2a和2b示出一经光暴露后含有20mg(图2a)或100mg(图2b)化合物a的片剂中光降解产物的量。用含有诱惑红ac/靛蓝/二氧化钛(图中标记为诱惑红ac/靛蓝)、诱惑红ac/二氧化钛(图中标记为诱惑红ac)或氧化铁红/二氧化钛(图中标记为氧化铁红)的包衣配方包覆片剂。详见实施例2。
图3a和3b示出一经光暴露后含有20mg(图3a)或100mg(图3b)化合物a的片剂中光降解产物的量。用多种粉色/桃色包衣配方包覆片剂。详见实施例2。
图4示出一经光暴露后用明胶膜覆盖的含有各种光稳定剂的胶囊中光降解产物的量。详见实施例3
技术实现要素:
定义
本文中使用的以下术语具有以下含义。
除非文中另有明确规定,单数形式“一个(a)”、“一种(an)”以及“该(the)”等包括复数个指示物(pluralreference)。因此,例如提及的“一种化合物”包括单一化合物和复数个不同化合物。
数字表达(numericaldesignation)例如温度、时间、量以及浓度之前使用的术语“约”包括一个范围,表示可能有±10%、±5%或±1%的变化的近似值。
除非另有定义,本文中使用的所有技术科学术语与本发明所属领域中的普通技术人员通常理解的含义相同。尽管在本发明的实践或测试中可以使用相似于或相当于本文描述的方法和材料的任何方法和材料,现还是描述了优选的方法、装置和材料。本文中引用的所有出版物以引用的方式全部并入本文,用于描述和公开可能用于与本发明相关的出版物中报道的方法、试剂和工具。此公开内容不能被视为承认本发明借助在先发明而并不早于这类公开。
除非另有说明,本发明的实践中将使用本领域技术人员能力内的化学、生化、分子生物学、细胞生物学、遗传学、免疫学以及药物科学的常规方法。这些技术在文献中有完整的解释。(参见例如gennaro,a.r.,ed.(1990)remington’spharmaceuticalsciences(雷明顿药物科学),18thed.,mackpublishingco.;colowick,s.etal.,eds.,methodsinenzymology(酶学方法),academicpress,inc.;d.m.weir,andc.c.blackwell,eds.(1986)handbookofexperimentalimmunology(实验免疫学手册),vols.i-iv,blackwellscientificpublications;maniatis,t.etal.,eds.(1989)molecularcloning:alaboratorymanual(分子克隆:实验手册),2ndedition,vols.i-iii,coldspringharborlaboratorypress;ausubel,f.m.etal.,eds.(1999)shortprotocolsinmolecularbiology(精编分子生物学实验指南),4thedition,johnwiley&sons;reametal.,eds.(1998)molecularbiologytechniques:anintensivelaboratorycourse(分子生物学技术:精编实验教程),academicpress;newton&grahameds.(1997)pcr(introductiontobiotechniquesseries)(pcr(生物技术入门系列),2nded.,springerverlag;europeanpharmacopoeia(欧洲药典)(ph.eur.),7thedition;theunitedstatespharmacopeia(usp)andthenationalformulary(美国药典和国家处方集)(nf),usp35-nf30)。
术语“api”是“活性药物成分”的缩写。本文中使用的api指的是化合物a或[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸。
术语“阻挡光(blocklight)”指的是通过吸收、反射、折射、衍射、分散和/或散射光线来阻止或降低光的透射。当染料阻挡一定波长范围的光线时,该染料通过吸收、反射、折射、衍射、分散和/或散射光线阻止或降低该波长范围的光的透射。
术语“胶囊剂”指的是包含胶囊壳和胶囊填充物的固体剂型的药物制剂。
术语“胶囊填充物”指的是包在胶囊壳内的材料。通常,胶囊填充物包含活性药物成分(api)和一种或多种药学上可接受的赋形剂。胶囊填充物中api的量可以表述为api基于胶囊填充物总重量的重量百分比(w/w%)。
术语“胶囊壳”指的是胶囊的外层。胶囊壳包含明胶、纤维素聚合物或允许递送api的其它适合的材料。胶囊壳可以是由伸缩帽和标准尺寸范围内的体片(bodypiece)组成的硬壳。可以在添加胶囊填充物之后将帽和体片密封。这种硬壳胶囊通常用于递送胶囊填充物中的干粉末状api。胶囊壳可以是用于递送胶囊填充物中呈溶液或悬浮液的api的一片式软壳。在一个实施方案中,胶囊壳可以包含光稳定剂。胶囊壳中光稳定剂的量可以表述为光稳定剂基于胶囊壳总重量的重量百分比(w/w%)。在一个实施方案中,胶囊壳包含明胶(明胶壳)。在另一实施方案中,胶囊壳包含羟丙基甲基纤维素(hpmc)(hpmc壳)。
全文中使用的术语“染料”包括真染料(如色彩和染料化学中定义的)、染料色淀和色素。真染料(如色彩和染料化学中定义的)是可溶于水和/或有机溶剂的有色物质(包括白色),并对要施用其的基底有亲和力,从而使颜色能印染到基底上。染料色淀是固体,其是真染料的水不可溶形式。其通过将真染料与惰性材料如氢氧化铝(常用的铝色淀)、硫酸钡、硫酸钙、氧化铝(二氧化铝)混合来制备。色淀中真染料的量表述为“染料浓度”。色素是不溶于水或有机溶剂的有色物质。
染料呈现为彩色,因为其吸收可见光谱(400-700nm)的光,并透射、反射或散射可见光谱中其它波长的光线。“黄色染料”主要吸收蓝光并且颜色呈黄色。“桔色染料”主要吸收绿蓝光并且颜色呈桔色。“红色染料”主要吸收蓝绿光并且颜色呈红色。“蓝色染料”主要吸收黄光并且颜色呈蓝色。“绿色染料”主要吸收红色和桔色的光并且颜色呈绿色。“黑色染料”吸收整个可见光谱的光并且颜色呈黑色。下表中列出红色染料、黄色染料、绿色染料、蓝色染料和黑色染料的实例。除了吸收光以外,这些染料还通过反射、折射、衍射、分散和/或散射光来阻挡光。
还可以通过将两种或多种染料混合获得不同颜色。例如,可以通过将不同量的红色和黄色染料混合获得不同色调的桔色染料。
本申请中描述的染料由其主体名表示。本领域技术人员将能够容易地确定染料的英文名或c.i.名(染料索引名)。下表中列出染料的非限制性实例。
术语“药学上可接受的”说明材料不具有会引起本领域技术人员考虑到待治疗的疾病或病症和各自的给药途径而避免对患者施用该材料的性质。此外,该材料被认为是能安全施用于人类或动物。
术语“赋形剂”或“药学上可接受的赋形剂”指的是除活性药物成分外加入药物制剂中的药理学上非活性的物质。赋形剂可以起到载体、稀释剂、释放、崩解或溶解改性剂、吸收促进剂、稳定剂或制备的助剂以及其它的作用。赋形剂可以包括填充物(稀释剂)、粘合剂、崩解剂、润滑剂和助流剂(glidant)。下面列出常使用的赋形剂分类的实例。
“稀释剂或填充物”指的是在递送前用于稀释活性药物成分的物质。稀释剂还可以用作稳定剂。稀释剂的非限制性实例包括淀粉、糖类、二糖类、蔗糖、乳糖、多糖、纤维素、纤维素醚、羟丙基纤维素、糖醇、木糖醇、山梨醇、麦芽糖醇、微晶纤维素、碳酸钙或碳酸钠、乳糖、一水乳糖、磷酸二钙、纤维素、可压缩糖、无水磷酸二氢钙、甘露醇、微晶纤维素和磷酸三钙。
“粘合剂”指的是可以用于将活性组分和惰性组分粘合在一起以维持粘着部分和离散部分的任何药学上可接受的物质。粘合剂的非限制性实例包括羟丙基纤维素、羟丙基甲基纤维素、聚维酮和乙基纤维素。
“崩解剂(disintegrant或disintegratingagent)”指的是加入固体制剂后会促进其给药后的崩裂或分解,并允许尽可能有效地释放活性成分以允许其快速溶解的物质。崩解剂的非限制性实例包括玉米淀粉、淀粉乙醇酸钠、交联羧甲基纤维素钠、交联聚维酮、微晶纤维素、改性玉米淀粉、羧甲基淀粉钠、聚维酮、预糊化淀粉和海藻酸。
“润滑剂”指的是加到粉末混合物中以防止压片或装胶囊过程中压缩的粉末块粘到设备上的赋形剂。其有助于片剂从模具排出,并可以改善粉末流动。润滑剂的非限制性实例包括硬脂酸镁,硬脂酸、二氧化硅,脂肪,硬脂酸钙,聚乙二醇,硬脂酰醇富马酸钠,滑石或包括月桂酸,油酸和c8/c10脂肪酸在内的脂肪酸。
本文中使用的“助流剂”意指片剂和胶囊制剂中用来改善片剂压缩期间的流动性质和产生抗结块作用的试剂。助流剂的非限制性实例包括胶态二氧化硅、滑石、气相二氧化硅、淀粉、淀粉衍生物和膨润土。
术语“配制(formulate或formulating)”指的是在生产最终医药产品的工艺中,将活性药物成分与一种或多种其它成分例如非限制性地包括一种或多种药学上可接受的赋形剂、稳定剂、光稳定剂、包衣、胶囊壳等结合。医药产品的实例包括但不限于片剂、丸剂、糖衣丸、胶囊剂、凝胶剂、糖浆剂、浆料、悬浮剂、气溶胶喷雾剂和用于注射的溶液。
术语“明胶”指的是由胶原衍生的固体物质,并可以从各种动物副产品获得。其常用作药物中的胶凝剂。
术语“光暴露(lightexposure)”指任何光暴露,包括日光(或自然光),室内光和暴露于在国际协调会议(ich)条件下的光。“ich光暴露(ichlightexposure)”指的是暴露于ich条件,可以是ich选项1或ich选项2下的光。在ich条件下,使用下面描述的两种选项之一作为光源(ichq1b),将样品暴露于光,其提供不小于1.2百万勒克斯小时的整体照明和不小于200瓦特小时/平方米的集成近紫外光能。
a.ich选项1:
设计为产生与d65/id65发射标准相似的输出的任何光源,如结合可见光和紫外光(uv)输出的人工日光色荧光灯、氙或金属卤化物灯。d65是用于iso10977(1993)中定义的户外日光的国际认可标准。id65是等同的室内间接日光标准。对于发射320纳米(nm)以下的大量辐射的光源,可以装备适合的滤光器消除这种辐射。
b.ich选项2:
设计为产生与iso10977(1993)中规定的相似输出的冷白色荧光灯;以及
具有在350-370nm有最大能量发射的320-400nm的光谱分布的近uv荧光灯;很大比例的uv应当在320-360nm波段和360-400nm波段。
术语“光稳定剂”是防止或降低暴露于光(在ich条件下的光、日光、室内光等)后分子光降解或光分解的试剂。换句话说,光稳定剂的功能是防止或降低光降解产物的形成。通常,光稳定剂通过阻挡分子暴露于一波长范围内的光来防止或降低光敏分子的光降解。光稳定剂的非限制性实例包括色素、染料、染料色淀等。
术语“光降解”(photodegradation)和“光分解”(photodecomposition)在本发明中可互换使用。
术语“有效量”的光稳定剂指的是药物制剂中光稳定剂的量足以防止或降低活性药物成分(api)的光降解,从而在指定的光条件下,将产生的光降解产物的量限制在期望的最大水平。本文所述的实施方案中,光稳定剂的有效量是在ich条件下,足以将产生的化合物a的光降解产物的量限制在小于约0.2%w/w的化合物a(或2000ppm)的水平的量。在一些实施方案中,有效量的光稳定剂可以将产生的化合物a的光降解产物的量限制在小于约0.15%w/w的化合物a、小于约0.1%w/w的化合物a或小于约0.05%w/w的化合物a的水平。对于本领域技术人员来说显而易见的是,稳定剂的有效量将会随使用的具体试剂变化。利用本发明,特别是实施例中描述的分析方法,以及制剂领域中的公知常识,本领域技术人员可以容易地确定足以将光降解产物限制在期望最大水平内的会达到光保护水平(即降低光降解产物的产生)的任何具体试剂(或试剂的组合)的量。
本文中使用的术语“光降解产物”指的是将化合物a暴露于光后,由化合物a形成的新分子。该光降解产物可以通过各种标准分析方法(例如,高效液相色谱法(hplc)、液相色谱-质谱法(lc-ms)、气相色谱法(gc)、核磁共振法(nmr)、傅里叶变换红外光谱法(ftir)等)检测。在一个实施方案中,该光降解产物可以由hplc检测和测定,如实施例1中进一步描述的。
术语“片剂”指的是药物制剂的固体剂型,其中api与一种或多种药学上可接受的赋形剂混合,并被压缩成单一固体最终剂型。可以以各种尺寸、形状和表面印痕来生产片剂。片剂可以是未包衣的或通过本领域中众所周知的各种技术进行包衣。通常,片剂包含片芯和包衣。
术语“片芯”指的是压缩成所需形状的含有api和一种或多种药学上可接受的赋形剂的片剂的内部,但不包括包衣。片芯中api的量可以表述为api基于片芯总重量的重量百分比(w/w%)。
术语“包衣”指的是包衣的外部。对于本文中所述的片剂,包衣应用在片芯的外表面且通常与其相粘。包衣可以提供以下性质的一种或多种:遮掩味道,防止api光降解,易于施用,改进api释放的修饰,防止灰尘,或独特的外观(颜色)以及其它。包衣材料的非限制性实例包括基于聚乙烯醇的化合物、羟乙基纤维素、羟丙基甲基纤维素、羧甲基纤维素钠、聚乙二醇4000和邻苯二甲酸乙酸纤维素。在一个实施方案中,包衣是基于聚乙烯醇的包衣。应用于片芯外表面的包衣的量可以表述为包衣基于片芯总重量的重量百分比(w/w%)。在一个实施方案中,包衣可包含光稳定剂如染料。包衣中染料的量可以表述为染料基于包衣重量的重量百分比(w/w%)。或者,包衣中染料的量可以表述为片芯的每表面积单位应用的染料的量,mg/cm2。
本文中使用的术语“贫血”指的是引起血液中氧水平降低的任何血红蛋白或红细胞的异常。贫血可以与红细胞或血红蛋白的异常产生、发展或表现有关。术语“贫血”指的是相对于正常血液水平的血液中血红细胞数量和/或血红蛋白水平的任何降低。贫血可由病症如急性或慢性肾病、感染、炎症、癌症、辐射、毒素、糖尿病和手术引起。感染可以是由于例如病毒、细菌和/或寄生虫等引起的。炎症可以是由于感染、自身免疫性疾病如风湿性关节炎等引起的。贫血还可以与由于例如胃溃疡、十二指肠溃疡、痔疮、胃癌或大肠癌、外伤、损伤、外科手术等引起的失血有关。贫血还与放射治疗、化疗和肾脏透析有关。贫血还与接受用叠氮胸苷(齐多夫定)或其它逆转录酶抑制剂治疗的hiv感染患者有关,并可在用例如含环顺铂或含非顺铂的化学疗法进行化疗的癌症患者中发展。再生障碍性贫血和骨髓增生异常综合征是与引起红细胞产生降低的骨髓衰竭有关的疾病。此外,贫血可以由如在包括小红细胞性贫血、低色指数性贫血等紊乱中有缺陷的或异常的血红蛋白或红细胞造成。贫血可以由铁运输、处理(processing)和利用的紊乱造成,参见例如铁粒幼红细胞性贫血等。
术语“紊乱(disorder)”、“疾病(disease)”和“病症(condition)”包含在内地使用于本文中,且指的是偏离正常的任何症状。
“治疗(treatment)”、“治疗(treating)”和“治疗(treat)”定义为使用药剂作用于疾病、紊乱或病症以降低或减轻疾病、紊乱或病症和/或其症状的有害的或任何其它不期望的影响。本文中使用的治疗涵盖了对人类患者的治疗,且包括:(a)降低确定为易患病但还没有被诊断为有病症的患者中病症出现的风险;(b)阻碍病症的发展;和/或(c)减轻病症,即引起病症衰退和/或减轻病症的一种或多种症状。
“给药(administration)”指的是对患者施用药剂。可以施用由治疗医生等确定的治疗量。对于化合物a,优选口服给药途径。当与化合物或药物制剂(和语法同等成分)相关的情况下使用时,相关术语“施用(administering)”和“给药(administrationof)”均指的是可以由医学专业人士对患者施用或由患者自己施用的直接给药,和/或可以是处方药行为的间接给药。例如,指导患者自己施用药物和/或给患者提供药物处方的医生对患者施用药物。无论怎样,给药需要将药物递送给患者。
低氧诱导因子(hif)是介导响应于细胞氧浓度变化的基因表达变化的碱性螺旋-环-螺旋(bhlh)pas(per/arnt/sim)转录激活因子。hif是含有氧调节α-亚基(hifα)和基础性表达的β亚基(hifβ/arnt)的异质二聚体。在氧化(常氧)的细胞中,通过涉及由vonhippel-lindau肿瘤抑制因子(pvhl)e3连接酶复合物泛素化的机制使hifα亚基快速降解。在低氧条件下,hifα不降解,且活性hifα/β复合物在细胞核中积累,并激活包括糖酵解酶、葡萄糖载体、红细胞生成素(epo)和血管内皮生长因子(vegf)的几种基因的表达。(jiangetal.(1996)j.biol.chem.271:1777117778;iliopoulusetal.(1996)proc.natl.acad.sci.usa,93:10595-10599;maxwelletal.(1999)nature399:271-275;sutteretal.(2000)proc.natl.acad.sci.usa97:4748-4753;cockmanetal.(2000)j.biol.chem.275:25733-25741;andtanimotoetal.(2000)emboj.19:4298-4309.)
术语“hif相关病症”和“至少部分由hif介导的病症”可互换使用,且指的是可以与hif的低于正常的、异常的或不适当的调节有关的任何病症。hif相关病症包括其中hif水平增加会提供治疗益处的任何病症。hif相关病症包括与缺血或缺氧条件有关的贫血病症和组织损伤或紊乱。
术语“hif脯氨酰羟化酶”、“phd”、“egln”和“hifph”指的是通过羟基化一个或多个脯氨酸残基修饰hif蛋白的α亚基的任何酶。hifph包括由taylor(2001,gene275:125132)描述且由aravind和koonin(2001,genomebiol2:research0007)、epstein等(2001,cell107:43-54)以及bruick和mcknight(2001,science294:1337-1340)表征的egl-nine(egln)基因族成员。本文中描述的示例性分析(如下文)中使用的hifph2可以是任何hifph2,又称为phd2,例如人egln1(基因库登记号aag33965;dupuyetal.(2000)genomics69:348-54)、小鼠egln1(基因库登记号cac42515)、大鼠egln1(基因库登记号p59722)等。或者,可以在分析中使用另一种hifph。这种hifph酶包括但不限于hifph1,又称为phd1,例如人egln2同种型1(基因库登记号cac42510;taylor,supra)、人egln2同种型3(基因库登记号np_542770)、小鼠egln2(基因库登记号cac42516)以及大鼠egln2(基因库登记号aao46039)等;以及任何hifph3,又称为pdh3,例如人egln3(基因库登记号cac42511;taylor,supra)、小鼠egln3(基因库登记号cac42517)以及大鼠egln3(sm-20)(基因库登记号aaa19321)。在本发明的其它实施方案中,egln可以包括秀丽隐杆线虫(caenorhabditiselegan)egl-9(基因库登记号aad56365)和果蝇(drosophilamelanogaster)cg1114基因产物(基因库登记号aaf52050)。
药物制剂
化合物[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸(化合物a)是低氧诱导因子(hif)脯氨酰羟化酶的强效抑制剂,且具有以下化学式:
如本文实施例中所述的,最近已发现光暴露后化合物a会光分解,转化为光降解产物。本发明提供防止或降低化合物光降解的量并限制光降解产物的量的组合物(制剂)和方法。
本文中描述的药物制剂防止化合物a光降解。相应地,在一个实施方案中,本发明提供包含[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸、药学上可接受的赋形剂和有效量的光稳定剂的药物制剂。在另一实施方案中,本发明提供包含[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸、药学上可接受的赋形剂和有效量的光稳定剂的药物制剂,其中该药物制剂包含少于约0.2%w/w(基于api即[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸的量)的[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸光降解产物。
在一个实施方案中,于ich条件下将制剂暴露于光之后,该药物制剂包含少于约0.2%w/w(相当于2000ppm,基于api的量)的[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸光降解产物。本领域普通技术人员基于本文公开的内容,使用常规分析方法可以很容易地确定光降解产物的量。如果对光降解产物的量进行多次测定,多次测定的光降解产物的量的平均值不超过约0.2%w/w。光暴露条件(光源种类、光源功率和光暴露持续时间)是本文中限定的ich条件。通过本文中描述的方法特别是hplc方法,很容易确定产生的光降解产物的量。制剂领域中的技术人员基于本文中提供的指导和实施例,可以很容易地确定足以限制光降解产物的量的光稳定剂的有效量。
在一个实施方案中,选择光稳定剂以防止或降低化合物a的光降解。在一个实施方案中,该光稳定剂通过有效阻挡光来防止或降低光降解。在一个实施方案中,该光稳定剂通过有效阻挡波长范围为约100nm至约800nm、约150nm至约700nm、约200nm至约550nm或约360nm至约440nm的光来防止或降低光降解。在一个实施方案中,本发明提供包含[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸、药学上可接受的赋形剂和有效量的光稳定剂的药物制剂,其中该光稳定剂包含二氧化钛和至少一种额外的染料。在一个实施方案中,该光稳定剂阻挡波长范围为约100nm至约800nm、约150nm至约700nm、约200nm至约550nm或约360nm至约440nm的光。
在一些实施方案中,光稳定剂包含可溶性染料、染料色淀、色素或其组合。在一个实施方案中,光稳定剂包含二氧化钛和至少一种额外的染料。在一个实施方案中,染料选自黑色染料、蓝色染料、绿色染料、红色染料、桔色染料、紫色(purple)染料、蓝紫色(violet)染料、黄色染料及其组合。在另一实施方案中,染料选自黑色染料、蓝色染料、绿色染料、红色染料、桔色染料、黄色染料及其组合。在又一实施方案中,染料选自红色染料、桔色染料、黄色染料及其组合。
在另一实施方案中,该额外的染料选自焦糖(caramel)、氧化铁黑、氧化铁红、氧化铁黄、诱惑红ac、诱惑红ac铝色淀、胭脂红、赤藓红、β-胡萝卜素或胡萝卜素的混合物、姜黄素、日落黄fcf、日落黄fcf铝色淀、柠檬黄、叶绿素及叶绿酸或其铜络合物、固绿fcf、亮蓝fcf、靛蓝、靛蓝铝色淀及其组合。
在一个实施方案中,该额外的染料选自氧化铁黑、氧化铁红、氧化铁黄、诱惑红ac、诱惑红ac铝色淀、胭脂红、赤藓红、β-胡萝卜素或胡萝卜素的混合物、日落黄fcf、日落黄fcf铝色淀、叶绿素及叶绿酸或其铜络合物、固绿fcf、靛蓝、靛蓝铝色淀及其组合。
在一个实施方案中,该额外的染料选自氧化铁黑、氧化铁红、氧化铁黄、诱惑红ac、诱惑红ac铝色淀、胭脂红、β-胡萝卜素或胡萝卜素的混合物、日落黄fcf、日落黄fcf铝色淀、靛蓝、靛蓝铝色淀及其组合。
在另一实施方案中,该额外的染料选自诱惑红ac、诱惑红ac铝色淀、氧化铁红、氧化铁黄、日落黄fcf、日落黄fcf铝色淀、靛蓝、靛蓝铝色淀以及其组合。
在一个实施方案中,光稳定剂包含二氧化钛和诱惑红ac铝色淀。在一个实施方案中,光稳定剂包含氧化铁红和二氧化钛。在一个实施方案中,光稳定剂包含诱惑红ac、氧化铁黄和二氧化钛。在一个实施方案中,光稳定剂包含氧化铁红、诱惑红ac、氧化铁黄和二氧化钛。在一个实施方案中,光稳定剂包含氧化铁红、氧化铁黄和二氧化钛。在一个实施方案中,光稳定剂包含氧化铁黄和二氧化钛。
在一些实施方案中,光稳定剂包含二氧化钛。在一些实施方案中,光稳定剂包含选自黑色染料、蓝色染料、绿色染料、红色染料、桔色染料、紫色(purple)染料、蓝紫色(violet)染料、黄色染料及其组合的染料。在另一实施方案中,光稳定剂包含选自黑色染料、蓝色染料、绿色染料、红色染料、桔色染料、黄色染料及其组合的染料。在又一实施方案中,光稳定剂包含选自红色染料、桔色染料、黄色染料及其组合的染料。
在一个实施方案中,光稳定剂包含选自焦糖(caramel)、氧化铁黑、氧化铁红、氧化铁黄、诱惑红ac、诱惑红ac铝色淀、胭脂红、赤藓红、β-胡萝卜素或胡萝卜素的混合物、姜黄素、日落黄fcf、日落黄fcf铝色淀、柠檬黄、叶绿素及叶绿酸或其铜络合物、固绿fcf、亮蓝fcf、靛蓝、靛蓝铝色淀及其组合的染料。
在一个实施方案中,药物制剂包含约1mg至约400mg[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸。在另一实施方案中,药物制剂包含约20mg至约200mg[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸。在另一实施方案中,药物制剂包含约1mg、约5mg、约10mg、约15mg、约20mg、约25mg、约50mg、约75mg、约100mg、约125mg、约150mg、约175mg、约200mg、约250mg、约300mg、约350mg或约400mg[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸。在又一实施方案中,药物制剂包含约20mg、约50mg或约100mg的[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸。在又一实施方案中,药物制剂包含约20mg或约50mg的[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸。
在一个实施方案中,药物制剂包含约1%w/w至约90%w/w的[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸。在另一实施方案中,药物制剂包含约0.1%w/w至约50%w/w的光稳定剂。在另一实施方案中,药物制剂包含约1%w/w至约7%w/w的光稳定剂。在每个实施方案中,药物制剂包含药学上可接受的赋形剂。该药学上可接受的赋形剂可以包括填充物如糖,其包括乳糖、一水乳糖、蔗糖、甘露醇或山梨醇;纤维素制剂如玉米淀粉、小麦淀粉、大米淀粉、土豆淀粉、明胶、黄蓍胶、甲基纤维素、羟丙基甲基纤维素、羧甲基纤维素钠、微晶纤维素和/或聚乙烯吡咯烷酮(pvp或聚维酮);崩解剂,如交联聚乙烯吡咯烷酮、琼脂,交联羧甲基纤维素钠或海藻酸或其盐如海藻酸钠;以及湿润剂如十二烷基硫酸钠,或润滑剂如硬脂酸镁。在一个实施方案中,药物制剂包含选自一水乳糖、微晶纤维素、聚维酮、交联羧甲基纤维素钠或硬脂酸镁的一种或多种药学上可接受的赋形剂。
在一个实施方案中,固体剂型包含药物制剂,且固体剂型选自胶囊剂、片剂、珠剂、颗粒剂、球剂、锭剂、丸剂或胶。在另一实施方案中,固体剂型是片剂。在另一实施方案中,固体剂型是胶囊剂。
片剂
本发明提供包含[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸、药学上可接受的赋形剂和有效量的光稳定剂的片剂。在一个实施方案中,该片剂包含片芯和包衣。
在一些实施方案中,将光稳定剂混入片剂或片芯。通过将api与一种或多种赋形剂如填充剂(稀释剂)、粘合剂、崩解剂、润滑剂和助流剂混合,然后压缩混合物来制备片剂或片芯。在将光稳定剂混入片剂或片芯的实施方案中,将光稳定剂与api和赋形剂混合,然后将该混合物压缩形成片剂或片芯。制备这种压缩片剂和片芯的方法在制药领域中是众所周知的。
在一个实施方案中,片剂包含片芯和包衣,其中片芯包含[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸和药学上可接受的赋形剂,且包衣包含光稳定剂。
基于本文中提供的描述和实施例以及制剂领域中的常规实践,本领域技术人员将能根据密度和厚度确定含有光稳定剂的包衣的适合的量,以提供光稳定性。在一个实施方案中,该包衣以基于片芯的重量约3%w/w至约8%w/w的量存在于片剂中。例如,约7%w/w至约8%w/w的包衣可以用于80mg片芯;约5%w/w至约6%w/w的包衣可以用于200mg片芯;或约4%w/w至约5%w/w的包衣可以用于400mg片芯。在这些包衣中光稳定剂的量可以变化,并在本文中进行了描述(例如,参见实施例2)。包衣的非限制性实例包括聚乙烯醇类、羟乙基纤维素、羟丙基甲基纤维素、羧甲基纤维素钠、聚乙二醇4000和邻苯二甲酸乙酸纤维素包衣。在一个实施方案中,该包衣是聚乙烯醇基包衣。
在一个实施方案中,片剂中的光稳定剂包含二氧化钛和至少一种额外的染料,其选自诱惑红ac、诱惑红ac铝色淀、氧化铁红、氧化铁黄、日落黄fcf、日落黄fcf铝色淀、靛蓝、靛蓝铝色淀及其组合。在另一实施方案中,光稳定剂包含二氧化钛和诱惑红ac铝色淀。
本领域技术人员将能够确定防止或降低光降解所需的光稳定剂的有效量。包衣中的光稳定剂的量可以描述为%w/w,光稳定剂基于包衣重量的重量百分比。在一个实施方案中,包衣包含约0.1%w/w至约50%w/w的光稳定剂(基于包衣的重量)。在一个实施方案中,包衣包含约0.5%w/w至约40%w/w的光稳定剂(基于包衣的重量)。在另一实施方案中,包衣包含约2%w/w至约35%w/w的光稳定剂(基于包衣的重量)。
包衣中光稳定剂的量还可以描述为每表面积单位片芯应用的光稳定剂的重量(mg/cm2)。为了确定防止或降低光降解所需的光稳定剂的量,可以用不同量的包衣包覆片芯,且每个包衣可以含有不同量的不同染料。光暴露后(于ich条件或日光下),在有光降解时,可以通过出现的光降解产物监测光降解。实施例2描述了具有不同染料组合物的各种包衣及其光稳定结果。当染料以其铝色淀形式存在包衣中时,染料的量指的是其铝色淀中纯染料的总量,而不包括铝色淀的其它成分。
在一个实施方案中,包衣中的光稳定剂包含至少约0.1mg/cm2的二氧化钛和选自下列的至少一种额外的染料:
至少约0.1mg/cm2的诱惑红ac;
至少约0.1mg/cm2的诱惑红ac铝色淀;
至少约0.004mg/cm2的氧化铁红;
至少约0.009mg/cm2的氧化铁黄;
至少约0.01mg/cm2的日落黄fcf;以及
至少约0.01mg/cm2的日落黄fcf铝色淀;
其中光稳定剂的量是基于片芯的表面积。
在另一实施方案中,包衣中的光稳定剂包含约0.1mg/cm2至2mg/cm2的二氧化钛和选自下列的至少一种额外的染料:
约0.1mg/cm2至约0.4mg/cm2的诱惑红ac;
约0.1mg/cm2至约0.4mg/cm2的诱惑红ac铝色淀;
约0.004mg/cm2至约0.4mg/cm2的氧化铁红;
约0.009mg/cm2至约0.2mg/cm2的氧化铁黄;
约0.01mg/cm2至0.03mg/cm2的日落黄fcf;以及
约0.01mg/cm2至0.03mg/cm2的日落黄fcf铝色淀;
其中光稳定剂的量是基于片芯的表面积。
在又一实施方案中,包衣中的光稳定剂基于片芯的表面积包含约0.1mg/cm2至约2mg/cm2,或0.1mg/cm2至约0.4mg/cm2的二氧化钛,以及约0.1mg/cm2至约0.4mg/cm2的诱惑红ac或诱惑红ac铝色淀。
在实施例2中给出应用于片芯的光稳定剂的各种适合的量的其它实例。
在一些实施方案中,片芯包含约1%w/w至约90%w/w、约5%w/w至约80%w/w、约5%w/w至约40%w/w、约11%w/w至约30%w/w、20%w/w至约30%w/w或约22%w/w至约28%w/w的[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸,和药学上可接受的赋形剂。
在一些实施方案中,片芯包含约1mg至约400mg或约20mg至约200mg的[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸,和药学上可接受的赋形剂。在其它实施方案中,片芯包含约1mg、约5mg、约10mg、约15mg、约20mg、约25mg、约50mg、约75mg、约100mg、约125mg、约150mg、约175mg、约200mg、约250mg、约300mg、约350mg或约400mg[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸,和药学上可接受的赋形剂。在其它实施方案中,片芯包含约20mg、约50mg或约100mg[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸,和药学上可接受的赋形剂。
适合的赋形剂是例如,填充物如糖类,包括乳糖、一水乳糖、蔗糖、甘露醇或山梨醇;纤维素制剂如玉米淀粉、小麦淀粉、大米淀粉、土豆淀粉、明胶、黄蓍胶、甲基纤维素、羟丙基甲基纤维素、羧甲基纤维素钠、微晶纤维素和/或聚乙烯吡咯烷酮(pvp或聚维酮)。若需要,可以添加崩解剂如交联聚乙烯吡咯烷酮、琼脂,交联羧甲基纤维素钠或海藻酸或其盐,如海藻酸钠。并且,还包括湿润剂如十二烷基硫酸钠或润滑剂如硬脂酸镁。
在一个实施方案中,药学上可接受的赋形剂包含一水乳糖、微晶纤维素、聚维酮、交联羧甲基纤维素钠和硬脂酸镁。
本发明提供包含片芯和包衣的片剂,其中片芯包含[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸和药学上可接受的赋形剂,且包衣包含有效量的光稳定剂,其中包衣是以约3%w/w至约8%w/w的量(基于片芯的重量)存在于片剂中。
在一个实施方案中,该片芯包含约22%w/w至约28%w/w的[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸(基于片芯的重量)和药学上可接受的赋形剂。在一个实施方案中,药学上可接受的赋形剂包含一水乳糖、微晶纤维素、聚维酮、交联羧甲基纤维素钠和硬脂酸镁。在另一实施方案中,片芯包含约20mg至约200mg的[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸。在另一实施方案中,片芯包含约20mg、约50mg或约100mg[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸。
在一个实施方案中,光稳定剂包含二氧化钛和选自诱惑红ac、诱惑红ac铝色淀、氧化铁红、氧化铁黄、日落黄fcf、日落黄fcf铝色淀、靛蓝、靛蓝铝色淀及其组合中的至少一种额外的染料。在另一实施方案中,光稳定剂包含二氧化钛和诱惑红ac铝色淀。在又一实施方案中,包衣包含约0.1mg/cm2至约0.4mg/cm2的二氧化钛和约0.1mg/cm2至0.4mg/cm2的诱惑红ac铝色淀,其中二氧化钛和诱惑红ac铝色淀的量是基于片芯的表面积。
本发明提供包含片芯和包衣的片剂,其中片芯包含[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸和药学上可接受的赋形剂,且包衣包含有效量的光稳定剂,其中包衣以约3%w/w至约8%w/w的量存在(基于片芯的重量),其中片芯包含约20mg、约50mg或约100mg[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸、一水乳糖、微晶纤维素、聚维酮、交联羧甲基纤维素钠和硬脂酸镁;且其中光稳定剂包含0.1至约0.4mg/cm2的二氧化钛和约0.1mg/cm2至约0.4mg/cm2的诱惑红ac铝色淀,其中二氧化钛和诱惑红ac铝色淀的量是基于片芯的表面积。
胶囊剂
本发明提供包含[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸、药学上可接受的赋形剂和有效量的光稳定剂的胶囊剂。在一个实施方案中,胶囊剂包含胶囊填充物和胶囊壳,其中胶囊填充物包含[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸和药学上可接受的赋形剂,且胶囊壳包含光稳定剂。
在一些实施方案中,胶囊填充物包含光稳定剂、[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸和药学上可接受的赋形剂。在这些实施方案中,通过将光稳定剂与api和赋形剂混合(共混)制备胶囊填充物。
在一些实施方案中,胶囊剂中的光稳定剂包含二氧化钛和选自诱惑红ac、氧化铁红、氧化铁黄及其组合中的至少一种额外的染料。在另一实施方案中,光稳定剂包含氧化铁红和二氧化钛。在另一实施方案中,光稳定剂包含氧化铁红、诱惑红ac、氧化铁黄和二氧化钛。在又一实施方案中,光稳定剂包含氧化铁红、氧化铁黄和二氧化钛。在又一实施方案中,光稳定剂包含诱惑红ac、氧化铁黄和二氧化钛。在又一实施方案中,光稳定剂包含氧化铁黄和二氧化钛。
基于本文中的公开内容和常规实验,本领域技术人员将能容易地确定防止或降低胶囊剂中化合物a的光降解需要的光稳定剂的有效量。胶囊壳中光稳定剂的量可以描述为%w/w,光稳定剂基于胶囊壳重量的重量百分比。为了确定防止或降低化合物a的光降解需要的光稳定剂的量,可以对具有含不同量的不同染料的胶囊壳的胶囊剂进行光稳定性测试。作为替代方案,可以用含有不同量的不同染料的明胶膜覆盖含有化合物a的胶囊填充物,并且(于ich条件或日光下)光暴露后,在有光降解时,可以监控化合物a的光降解。实施例3描述了具有不同染料组合物的几种明胶膜及其光稳定结果。
在一个实施方案中,胶囊壳包含约1%w/w至约7%w/w、约1.8%w/w至约6%w/w、约2%w/w至约4%w/w或约2%w/w至约3.5%w/w的光稳定剂(基于胶囊壳的重量)。在另一实施方案中,胶囊壳包含约1.8%w/w至约6%w/w的光稳定剂(基于胶囊壳的重量)。在另一实施方案中,胶囊壳包含约2%w/w至约3.5%w/w的光稳定剂(基于胶囊壳的重量)。
在一个实施方案中,胶囊壳是明胶壳。在另一实施方案中,胶囊壳是羟丙基甲基纤维素(hpmc)壳。
在一个实施方案中,胶囊壳包含约2%w/w氧化铁红和约0.9%w/w二氧化钛(基于胶囊壳的重量);或约0.3%w/w诱惑红ac、约1%w/w氧化铁黄和约1%w/w的二氧化钛(基于胶囊壳的重量);或约0.7%w/w氧化铁红、约0.3%w/w诱惑红ac、约1%w/w氧化铁黄和约1%w/w二氧化钛(基于胶囊壳的重量);或约1%w/w氧化铁红、约1%w/w氧化铁黄和约1%w/w二氧化钛(基于胶囊壳的重量);或约1%w/w诱惑红ac、约1%w/w氧化铁黄和约1%w/w二氧化钛(基于胶囊壳的重量);或约2%w/w氧化铁红和约1%w/w二氧化钛(基于胶囊壳的重量);或约2%w/w氧化铁黄和约1%w/w二氧化钛(基于胶囊壳的重量)。
在一些实施方案中,胶囊填充物包含[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸,其含量为约1%w/w至约90%w/w、约5%w/w至约80%w/w、约5%w/w至约40%w/w、约8%w/w至约30%w/w、10至约30%w/w或约12%w/w至约15%w/w(基于胶囊填充物的重量);和药学上可接受的赋形剂。
在一些实施方案中,胶囊填充物包含约1mg至约400mg、约5mg至约250mg、约20mg至约200mg、约20mg至约100mg或约20mg至约50mg的[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸;和药学上可接受的赋形剂。在其它实施方案中,胶囊填充物包含约1mg、约5mg、约10mg、约15mg、约20mg、约25mg、约50mg、约75mg、约100mg、约125mg、约150mg、约175mg、约200mg、约250mg、约300mg、约350mg或约400mg的[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸;和药学上可接受的赋形剂。在其它实施方案中,胶囊填充物包含约20mg或约50mg的[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸;和药学上可接受的赋形剂。
适合的赋形剂是例如,填充物如糖类,包括乳糖、一水乳糖、蔗糖、甘露醇或山梨醇;纤维素制剂如玉米淀粉、小麦淀粉、大米淀粉、土豆淀粉、明胶、黄蓍胶、甲基纤维素、羟丙基甲基纤维素、羧甲基纤维素钠、微晶纤维素和/或聚乙烯吡咯烷酮(pvp或聚维酮)。若需要,可以添加崩解剂如交联聚乙烯吡咯烷酮、琼脂,交联羧甲基纤维素钠或海藻酸或其盐,如海藻酸钠。并且,可以包括湿润剂如十二烷基硫酸钠或润滑剂如硬脂酸镁。
在一个实施方案中,胶囊剂中药学上可接受的赋形剂包含一水乳糖、微晶纤维素、聚维酮、交联羧甲基纤维素钠和硬脂酸镁。
本发明提供包含胶囊填充物和胶囊壳的胶囊剂,其中胶囊填充物包含约12%w/w至约15%w/w的[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸(基于胶囊填充物的重量)和药学上可接受的赋形剂,且其中胶囊壳包含有效量的光稳定剂。在一个实施方案中,药学上可接受的赋形剂包含一水乳糖、微晶纤维素、聚维酮、交联羧甲基纤维素钠和硬脂酸镁。在另一实施方案中,胶囊填充物包含约20mg或约50mg[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸。在又一实施方案中,胶囊壳包含约2%w/w至约3.5%w/w的光稳定剂(基于胶囊壳的重量)。
在一个实施方案中,胶囊填充物包含约20mg或约50mg[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸,和药学上可接受的赋形剂,其包含一水乳糖、微晶纤维素、聚维酮、交联羧甲基纤维素钠和硬脂酸镁;且其中胶囊壳是包含约2%w/w的氧化铁红和约0.9%w/w的二氧化钛(基于胶囊壳的重量)的明胶壳。
在一个实施方案中,胶囊填充物包含约20mg或约50mg的[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸,和药学上可接受的赋形剂,其包含一水乳糖、微晶纤维素、聚维酮、交联羧甲基纤维素钠和硬脂酸镁;且其中胶囊壳是包含约0.3%w/w诱惑红ac、约1%w/w氧化铁黄和约1%w/w二氧化钛(基于胶囊壳的重量)的明胶壳。
在一个实施方案中,胶囊填充物包含约20mg或约50mg的[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸,和药学上可接受的赋形剂,其包含一水乳糖、微晶纤维素、聚维酮、交联羧甲基纤维素钠和硬脂酸镁;且其中胶囊壳是包含约0.7%w/w的氧化铁红、约0.3%w/w的诱惑红ac、约1%w/w的氧化铁黄和约1%w/w的二氧化钛(基于胶囊壳的重量)的明胶壳。
在一个实施方案中,胶囊填充物包含约20mg或约50mg的[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸,和药学上可接受的赋形剂,其包含一水乳糖、微晶纤维素、聚维酮、交联羧甲基纤维素钠和硬脂酸镁;且其中胶囊壳是包含约1%w/w的氧化铁红、约1%w/w的氧化铁黄和约1%w/w的二氧化钛(基于胶囊壳的重量)的明胶壳。
在一个实施方案中,胶囊填充物包含约20mg或约50mg[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸,和药学上可接受的赋形剂,其包含一水乳糖、微晶纤维素、聚维酮、交联羧甲基纤维素钠和硬脂酸镁;且其中胶囊壳是包含约1%w/w的诱惑红ac、约1%w/w的氧化铁黄和约1%w/w的二氧化钛(基于胶囊壳重量)的明胶壳。
在一个实施方案中,胶囊填充物包含约20mg或约50mg的[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸,和药学上可接受的赋形剂,其包含一水乳糖、微晶纤维素、聚维酮、交联羧甲基纤维素钠和硬脂酸镁;且其中胶囊壳是包含约2%w/w的氧化铁红和约1%w/w的二氧化钛(基于胶囊壳的重量)的明胶壳。
在一个实施方案中,胶囊填充物包含约20mg或约50mg的[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸,和药学上可接受的赋形剂,其包含一水乳糖、微晶纤维素、聚维酮、交联羧甲基纤维素钠和硬脂酸镁;且其中胶囊壳是包含约2%w/w的氧化铁黄和约1%w/w的二氧化钛(基于胶囊壳的重量)的明胶壳。
给药途径
适合的给药途径可包括例如口服、直肠给药、粘膜给药、经鼻给药或肠道给药以及肠胃外递送,包括肌内注射、皮下注射、髓内注射以及鞘内注射、直接心室内注射、静脉注射、腹腔内注射、鼻内注射或眼内注射。可以以局部而不是全身的方式施用药物制剂。例如,可以通过注射或在靶向药物递送系统如储库(depot)制剂或缓释制剂中递送药物制剂。在一个实施方案中,给药途径为口服给药。当口服药物制剂时,其可以作为片剂或胶囊剂施用。
本发明的药物制剂可以通过本领域熟知的方法中的任一种制备,如通过常规混合、溶解、制粒、包制糖衣、磨细、乳化、装胶囊、包裹或冻干工序。如上所述,组合物可以包括利于将活性分子加工成药用制剂的一种或多种药学上可接受的赋形剂。
适合的制剂依赖于选择的给药途径。对于注射,组合物可例如配制为水溶液,优选生理学上兼容的缓冲液如汉克斯溶液(hanks'solution)、林格式溶液(ringer'ssolution)或生理盐水缓冲液。对于粘膜或经鼻给药,在制剂中使用适于待渗透的屏障(barrier)的渗透剂。这种渗透剂在本领域通常是已知的。本发明的一个实施方案中,药物制剂用于口服给药。对于口服给药,其可以通过将化合物a与本领域中熟知的药学上可接受的赋形剂结合而容易地配制。这种赋形剂使化合物a能配制成片剂、丸剂、糖衣丸、胶囊剂、液体剂、凝胶剂、糖浆剂、浆体(slurry)、悬浮剂等,用于个体口服。药物制剂还可以配制为直肠给药组合物如栓剂或保留灌肠,例如含有常规栓剂基体如可可脂或其它甘油酯。
可以使用固体赋形剂,在添加适合的辅料后可选地研磨所得混合物以及加工颗粒混合物获得口服使用的药物制剂,若需要,获得片剂或片芯。适合的赋形剂是本领域熟知的,并在本文另有说明。
用于口服给药的药物制剂包括由明胶、hpmc和其它适合的材料制成的硬胶囊(push-fitcapsule)以及由明胶和增塑剂如甘油或山梨醇制成的软密封胶囊。硬胶囊可以含有活性成分,其与填充物如乳糖、粘合剂如淀粉和/或润滑剂如滑石或硬脂酸镁以及可选的稳定剂混合。在软胶囊中,活性成分可以溶于或悬浮于适合的液体如脂油、液体石蜡或液体聚乙二醇。另外,可以添加稳定剂。
药物制剂还可以配制为储库(depot)制剂。通过移植(例如皮下移植或肌内移植)或通过肌肉注射可以施用这种长效制剂。因此例如,可以用适合的聚合或疏水材料(例如作为可接受油中的乳剂)或离子交换树脂,或作为略溶的衍生物例如作为略溶的盐配制药物制剂。
对于本文实施的各种处理中使用的任何组合物,可以使用本领域熟知的各种技术初步估计有效剂量(或治疗有效剂量)。例如,在细胞培养分析中,可以在动物模型中制定剂量以达到包括细胞培养中确定的ic50的循环浓度范围。可以例如使用从细胞培养分析和非人动物研究获得的数据确定适于人类个体的剂量范围。在一个实施方案中,剂量可以是0.05mg/kg至约700mg/kg。通常,剂量可以是约0.05mg/kg至约500mg/kg、约0.1mg/kg至约250mg/kg、约0.2mg/kg至约100mg/kg、约0.3mg/kg至约10mg/kg、约0.5mg/kg至约5mg/kg或约1mg/kg至约2mg/kg。例如,剂量可以是约0.5mg/kg、约0.7mg/kg、1.0mg/kg、约1.2mg/kg、约1.5mg/kg、约2.0mg/kg、约2.5mg/kg、约3.0mg/kg、约3.5mg/kg、约4.0mg/kg、约4.5mg/kg或约5.0mg/kg。可以以各种间隔,例如每日、每隔一日、一周1、2或3次等施用该剂量。通常以一周2或3次施用该剂量。
化合物的治疗有效剂量指的是引起个体症状改善或存活期延长的化合物的量。这种分子的毒性和治疗效力可以在细胞培养或试验动物中按照标准药物规程(pharmaceuticalprocedure)确定,例如通过测定ld50(群体的50%致死的剂量)和ed50(群体的50%治疗有效的剂量)。毒效与疗效的剂量比是治疗指数,其可以表达为比例ld50/ed50。优选治疗指数高的化合物。
剂量优选落在包括ed50且具有很少或没有毒性的循环浓度范围内。在该范围内,剂量可以依赖于使用的剂型和利用的给药途径而变化。确切的制剂、给药途径和剂量应当根据本领域中已知的方法,基于个体病症的特点进行选择。
可以单独调节剂量和间隔以提供足以调节期望参数的活性部分的血浆水平,例如内源性促红细胞生成素血浆水平,即最小有效浓度(mec)。对于每种化合物,mec将会变化,但可以通过例如体外数据来估计。在局部给药或选择性摄取的情况中,药物的有效局部浓度可以与血浆浓度无关。或者,可以通过1)施用负荷剂量后,施用维持剂量;2)施用诱导剂量以快速达到目标范围内的期望参数例如促红细胞生成素水平,接着施用较低的维持剂量以将例如红细胞比容(hematocrit)维持在期望的目标范围内;或3)重复间歇式给药,来实现期望参数例如内源性促红细胞生成素刺激的调节。
施用的化合物或组合物的量无疑将取决于各种因素,包括进行治疗的个体的性别、年龄以及重量、疼痛严重程度、给药方式以及处方医生的判断。
若需要,组合物可以存在于容纳含有活性成分的一种或多种单位剂型的包装或分散器装置中。这种包装或装置可以包含例如金属或塑料箔如吸塑包装(blisterpack)。该包装或分散器装置可以附有给药说明。还可以制备在兼容的药物赋形剂中配制的本发明的药物制剂,将其放在适合的容器中,并标明用于指定病症的治疗。标签上指明的适合的病症可以包括治疗贫血是主要迹象的病症、紊乱或疾病。
方法
本发明提供抑制(防止和/或降低)[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸(化合物a)的光降解的方法。在一个实施方案中,该方法包括将[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸与有效量的光稳定剂配制成剂。光稳定剂的有效量是在ich条件下,足以将产生的化合物a的光降解产物的量限制在小于约0.2%w/w的化合物a(或2000ppm)的水平的量。在一个实施方案中,光稳定剂包含二氧化钛。在一个实施方案中,光稳定剂包含染料。在一些实施方案中,该方法包括将[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸与二氧化钛和至少一种额外的染料配制成剂。在另一实施方案中,光稳定剂阻挡波长范围为约220nm至约550nm的光。在其它实施方案中,染料选自黑色染料、蓝色染料、绿色染料、红色染料、桔色染料、黄色染料及其组合。在另一实施方案中,染料选自红色染料、桔色染料、黄色染料及其组合。本发明还提供抑制(防止和/或降低)[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸(化合物a)的光降解的方法,该方法包括将[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸与有效量的光稳定剂和药学上可接受的赋形剂配制成剂。本文中已描述了包含光稳定剂的各种制剂。
可以按任何常规方式,例如通过将化合物a和光稳定剂一起混合或共混为均质干粉末,压缩为固体片剂剂型,填装进胶囊等,将光稳定剂与化合物a配制成剂。或者,可以通过用包含光稳定剂的包衣涂覆包含化合物a的片芯,或通过用包含光稳定剂的胶囊壳包裹包含化合物a的胶囊填充物,将化合物a与光稳定剂配制成剂。
在其它实施方案中,抑制化合物a的光降解的方法可以用光稳定包装作为替代品或作为光稳定制剂的额外加成来实现。用于片剂或胶囊剂的光稳定包装的实例包括但不限于不透明的容器或包装材料如棕色瓶、黑内衬瓶、琥珀瓶、不透明吸塑包装、由含有光稳定剂的吸塑膜制得的吸塑包装,以及箔内衬包装。
本发明的一个方面提供了药物制剂用于制备治疗本文所述各种病症或紊乱的药物的用途。其还提供使用药物制剂或其组合物或药物以治疗、预治疗或延迟本文所述各种病症或紊乱的发展或发作的方法。
该药物或组合物可以用于调节hif的稳定性和/或活性,并因此激活hif调节的基因表达。在一方面,该药物或组合物可以用于抑制或降低hif羟化酶,特别是hif脯氨酰羟化酶例如egln1、egln2和egln3(又分别称为phd2、phd1和phd3)的活性,如taylor(2001,gene275:125132)所描述的和aravind和koonin(2001,genomebiol2:research0007)、epstein等(2001,cell107:43-54)以及bruick和mcknight(2001,science294:1337-1340)所表征的。
本文中描述的药物制剂可以用在方法中以治疗、预治疗或延迟与hif有关的病症(包括但不限于贫血、缺血和缺氧病症)的发展或发作。在各个实施方案中,出现引起急性缺血的病症(例如心肌梗塞、肺栓塞、肠梗塞、缺血性中风和肾缺血再灌注损伤)后立即施用该药物制剂。在另一实施方案中,对诊断有与慢性缺血的发展有关的病症(例如心源性肝硬化、黄斑变性、肺栓塞、急性呼吸衰竭、新生儿呼吸窘迫综合征和充血性心脏衰竭)的患者施用药物制剂。在又一实施方案中,外伤或损伤后立即施用药物制剂。在其它实施方案中,可以根据诱发的病症,例如高血压、糖尿病、闭塞性动脉疾病、慢性静脉功能不全、雷诺氏病(raynaud’sdisease)、慢性皮肤溃疡、肝硬化、充血性心脏衰竭和系统性硬化症,对个体施用药物制剂。在其它实施方案中,可以施用药物制剂预治疗个体以降低或防止与缺血或缺氧有关的组织损伤的发展。在其它实施方案中,药物制剂和组合物可以用在方法中以治疗或延迟炎症性肠病(包括各种形式的结肠炎(例如溃疡性结肠炎)和克罗恩病)的发展。
药物制剂和组合物可以用在方法中以治疗有需要的个体的贫血,从而增加血液血红蛋白水平和/或增加红血球比容。在一方面,药物制剂和组合物可以用在方法中以治疗患有慢性肾病或晚期肾病的个体的贫血,从而增加血液血红蛋白水平和/或增加红血球比容。在一方面,药物制剂和组合物可以用在方法中以治疗患有慢性病贫血的个体的贫血,从而增加血液血红蛋白水平和/或增加血球容积比。
药物制剂和组合物还可以用在调节血糖代谢和实现血糖稳态的方法中。还通过施用本文描述的制剂或组合物实现个体中降低血糖水平、减小胰岛素耐受性、降低糖化血红蛋白水平、降低血甘油三脂水平以及改善血糖控制的方法。提供了治疗或预防糖尿病、高血糖和与血糖水平增加有关的其它病症的方法,以及治疗或预防与糖尿病有关的病症(例如是糖尿病的风险因子的或与糖尿病平行发展的或由糖尿病引起的病症)的方法。
药物制剂还可以用于增加内源性促红细胞生成素(epo)。可以施用药物制剂以预防、预治疗或治疗与epo有关的病症,包括例如与贫血和神经障碍有关的病症。与贫血有关的病症包括病症如急性或慢性肾症、糖尿病、癌症、溃疡、病毒感染例如hiv、细菌或寄生虫的感染、炎症等。贫血病症还可以包括与包括例如放射治疗、化疗、透析和手术的过程或治疗有关的病症。与贫血有关的紊乱另外包括血红蛋白和/或红细胞异常,如在疾病如小细胞性贫血、低色性贫血、再生障碍性贫血等中发现的血红蛋白和/或红细胞异常。
在一方面,药物制剂和组合物可以用在诱导个体的红血球生成增强或完全的方法中。
本发明还涉及药物制剂治疗、预治疗或延迟与紊乱有关的病症的发作,所述紊乱选自贫血症;神经障碍和/或损伤,包括中风、外伤、癫痫和神经退行性疾病;心肌缺血,包括但不限于心肌梗死和充血性心脏衰竭;肝缺血,包括但不限于心源性肝硬化;肾缺血,包括但不限于急性肾功能衰竭和慢性肾功能衰竭;外周血管疾病、溃疡、烧伤和慢性创面;肺栓塞;和缺血再灌注损伤。在一方面,制剂和组合物有效用于治疗多发性硬化和/或增加神经形成的方法中。
在另一方面,制剂和组合物可以用在降低血压或防止血压升高以及治疗或预防任何个体(包括但不限于患有肾病的个体)的高血压或前期高血压的方法中。
在另一实施方案中,本发明提供制剂和组合物在改善患有或有患有肾功能不全风险的个体的肾功能的方法中的用途,该方法包括对个体施用抑制低氧诱导因子(hif)羟化酶活性的药剂。
在另一方面中,制剂和组合物可以用在调节铁过程(ironprocessing)和治疗/预防与缺铁和/或铁过程有关的病症的方法中。在某些方面,本发明预期到制剂和组合物在个体中增加血清铁、增加转铁蛋白饱和度、提高溶性转铁蛋白受体水平以及增加血清铁蛋白水平的方法中的用途。
在另一方面,制剂和组合物可以用在通过降低总胆固醇的循环水平,特别是通过降低低密度脂蛋白胆固醇和/或非常低密度脂蛋白胆固醇的循环水平,和/或增加高密度脂蛋白胆固醇/低密度蛋白胆固醇的比例来治疗高胆固醇的方法中。
许多出版物,包括美国专利申请公开号2003/0176317、2003/0153503、2004/0204356、2004/0235082、2005/0020487、2007/0042937、2007/0004627、2006/0276477、2007/0293575、2012/0149712、2007/0259960、2007/0292433、2011/0039878、2011/0039885、2010/0144737、2011/0039879和2011/0263642;pct公开号wo2012/097329、wo2012/097331和wo2013/070908;国际专利申请号pct/us2013/029851中已描述了使用hif脯氨酰羟化酶抑制剂,特别是化合物a治疗各种病症和紊乱的方法。
本发明还涉及抑制修饰低氧诱导因子的α亚基的至少一种羟化酶的活性的方法。hif羟化酶可以是脯氨酰羟化酶,包括但不限于egln1、egln2和egln3(又分别称为phd2、phd1和phd3),如taylor(2001,gene275:125132)所描述的和aravind和koonin(2001,genomebiol2:research0007)、epstein等(2001,cell107:43-54)以及bruick和mcknight(2001,science294:1337-1340)所表征的。该方法包括使酶与化合物a接触。在一些实施方案中,hif羟化酶是天冬酰胺酰羟化酶或脯氨酰羟化酶。在其它实施方案中,hif羟化酶是抑制hif、人egln1、egln2或egln3的因子。
虽然已结合具体实施方案和实施例描述本发明,但对于本领域技术人员而言显而易见的是,考虑到技能和本发明,具体公开的材料和方法的等同物也将适用于本发明;并意图将这种等同物包含在附随的权利要求中。
实施例
实施例1:化合物a的固态日光暴露
将大约500mg化合物a的干粉末置于1加仑聚乙烯袋中,并在白天将其暴露于日光下连续两个月。该粉末呈非常薄的层,经常摇晃袋,确保所有粉末而不是只有顶层暴露于日光下。将化合物a粉末对照样品在琥珀瓶中于黑暗中储存同样的时间用于比较。两个月后,目测两种样品表明相对于黄色的对照样品,光暴露样品已变成灰白色。通过hplc分析光暴露样品和对照样品,评价其组成的区别。hplc方法使用反相色谱柱zorbaxeclipsexdb-c8,3.5μm,4.6×150mm。流动相由水和用三氟乙酸酸化的乙腈混合物组成。用增加乙腈的梯度洗脱提供了化合物a对照样品(图1,光暴露之前)和化合物a的光暴露样品(图1,光暴露之后)在230nm下用uv检测的色谱图。光暴露样品的hplc显示出现新峰,图1中表示为“光降解产物”。
暴露于日光前,由反相hplc测得化合物a粉末纯度值为99.1%,并且没有一种杂质以多于0.2%w/w(2000ppm)的水平存在。暴露于日光后,化合物a粉末纯度值稍微降低为98.4%。暴露于日光后,色谱图中出现新峰,证明有新分子。新峰面积为0.34%。暴露于日光后化合物a的面积百分比降低并且出现新分子表明化合物a的一部分转化为新分子,即光降解产物。
实施例2:片剂的光稳定包衣
据发现包含[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸的片剂暴露于光后发生光降解。为了降低片剂中化合物a的光降解,对各种包衣测试其光降解性质。
测试的粉色/桃色包衣配方包括包衣,其包含:
配方1:氧化铁红、氧化铁黄和二氧化钛(“粉色/桃色#1”);
配方2:日落黄fcf、氧化铁红和二氧化钛(“粉色/桃色#2”);或
配方3:氧化铁红、氧化铁黄和二氧化钛(“粉色/桃色#3”)。
测试的红色包衣配方包括包衣,其包含:
配方4:诱惑红ac和靛蓝铝色淀以及二氧化钛(“诱惑红ac/靛蓝”);
配方5:诱惑红ac铝色淀和二氧化钛(“诱惑红ac”);或
配方6:氧化铁红和二氧化钛(“红氧化铁”)。
于降低的光照下在包衣锅中,以每片剂表面积含不同量的光稳定剂(mg/cm2)将包含20mg或100mg[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸的片剂包覆在均匀分布的层中。表1列出使用不同包衣配方的不同水平的片剂包衣实例。3%、4%、4.5%或7.5%包衣水平是包衣材料的重量相对于被包覆片芯重量的百分比。
表1:存在于不同包衣水平包覆的片剂中的每片剂表面积的光稳定剂的实例具有3%目标包衣水平的20mg强度片剂
具有4%目标包衣水平的20mg强度片剂
具有7.5%目标包衣水平的20mg强度片剂
具有3%目标包衣水平的100mg强度片剂
具有4%目标包衣水平的100mg强度片剂
具有4.5%目标包衣水平的100mg强度片剂
将包覆的片剂暴露于光(ich选项2),并通过使用反相hplc测量存在的光降解产物的量来测试光降解。用铝箔包裹暗对照。用于对光降解产物定量的反相hplc方法的定量上限为0.25%或2500ppm。报道了大于0.25%或2500ppm的值时,使用具有较高定量上限但灵敏性较低的改进的反相hplc方法。表2和3示出测试的每个红色包衣片剂批次的光降解产物的平均值(n=10)(ppm,相对于化合物a)。“nd”指的是未测定。“na”指的是不适用。
表2:具有红色包衣的20mg强度片剂的光降解
表3:具有红色包衣的100mg强度片剂的光降解
图2a(20mg强度片剂)和2b(100mg强度片剂)中以图示方式描述了这些结果。
暴露于ich选项2的条件后,用粉色/桃色配方包覆的3%或4%包衣水平(基于片芯的重量)的20mg强度片剂的光降解结果在图3a和表4中示出,100mg强度片剂的结果在图3b和表5中示出。
表4:具有粉色/桃色包衣的20mg强度片剂的光降解
表5:具有粉色/桃色包衣的100mg强度片剂的光降解
实施例3:光稳定明胶胶囊
光暴露后,明胶胶囊中的化合物a也表现出光降解。对含有各种染料组合的明胶膜包衣测试其光稳定性质。
用包含各种光稳定剂的明胶膜覆盖在无色透明硬明胶胶囊壳中包含[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸的明胶胶囊,将其暴露于本文中描述的ich选项2下的光,并通过使用实施例1中描述的反相hplc测量光降解产物的量来测试[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸的光降解。结果表示10个胶囊测得的光降解产物的平均值。
在下面的表6中示出测试的硬胶囊膜的组成。
表6:明胶膜
如表7和图4中所示,桔色染料提供硬明胶胶囊中化合物a的最佳光稳定性。
表7:含有化合物a的硬明胶胶囊的光降解
- 还没有人留言评论。精彩留言会获得点赞!