一种递送siRNA的壳聚糖衍生物纳米颗粒的制备方法与流程
本发明属于基因生物技术领域,具体涉及一种ph敏感性的sirna/壳聚糖衍生物纳米系统的制备和应用。
背景技术:
基于基因的治疗方法在调控大量靶mrna分子沉默方面具有很大的潜力,最终可降低靶蛋白水平。然而,这一基因沉默技术的应用还需要克服挑战,包括生理条件下sirna的快速降解及其通过带负电荷的胞质膜非常困难。实现sirna治疗效能的关键挑战是开发和设计新型可降解载体,使其具有安全、充分的基因传递效能。目前,结肠癌肝转移的化疗或切除的患者5年生存率低于50%。一般认为,与放疗和化疗相比,基因治疗的副作用相对较小,在大多数结肠癌细胞或者其他肿瘤细胞增殖与β-catenin的过度表达有关。
壳聚糖是一种具有生物相容性和低免疫原性的聚合物,已被用于通过静电相互作用建立针对上皮表面的药物和营养传递系统。它具有细胞渗透增强性能和生物粘附特性可以有效地促进粘膜递送。然而,壳聚糖的应用往往受到其水溶性的限制。带负电荷的羧甲基壳聚糖和带正电荷的壳聚糖盐酸盐属于水溶性壳聚糖衍生物,它们与壳聚糖分子骨架相似,具有壳聚糖的独特优点,同时也弥补壳聚糖只能溶于酸性溶液的不足,是理想的新型口服递送营养素的载体。因此,水溶性壳聚糖为基础的给药系统具有口服给药途径的重要优势,这将有助于形成高效递送基因的纳米系统。结肠癌环境的复杂性使其难以实现sirna的按需释放。超声可使功能物质/药物从水凝胶和微泡中可控释放进入机体环境。超声触发的智能给药系统可以为sirna的按需、可重复、可调节给药提供有希望的基础。目前,尚未有羧甲基壳聚糖和壳聚糖盐酸盐封装sirna形成的纳米颗粒,促进细胞对sirna的摄取,胃液中保护sirna不被降解,肠道中控制sirna的释放。利用上述壳聚糖衍生物(羧甲基壳聚糖和壳聚糖盐酸盐)制备递送sirna的壳聚糖衍生物纳米颗粒,使sirna可控释放、有较高的基因转染率和沉默效率即为本发明的研究重点。有望广泛应用于疾病的基因治疗,具有良好的临床应用前景。
技术实现要素:
为了实现高效负载sirna,可控释放sirna,有效递送,并促使结肠癌细胞中β-catenin蛋白表达减少,有效抑制结肠癌细胞增殖和迁移,本发明提供一种递送sirna的壳聚糖衍生物纳米颗粒的制备方法。
一种递送sirna的壳聚糖衍生物纳米颗粒的制备方法的操作步骤如下:
将带正电的浓度1mg/ml的壳聚糖盐酸盐溶液和浓度7.24μm的sirna溶液混合均匀,加入带负电的浓度2mg/ml的羧甲基壳聚糖溶液,磁力搅拌;通过分子间静电相互作用自组装形成递送sirna的壳聚糖衍生物纳米系统颗粒;
其中壳聚糖盐酸盐溶液、sirna溶液和羧甲基壳聚糖溶液体积比为30~60:60~30:5。
进一步限定的技术方案如下:
所述带正电的浓度1mg/ml的壳聚糖盐酸盐溶液由10mg的壳聚糖盐酸盐加入到10ml超纯水中直至完全溶解制得。
所述带负电的浓度2mg/ml的羧甲基壳聚糖溶液由20mg的壳聚糖盐酸盐加入到10ml超纯水中直至完全溶解制得。
所述磁力搅拌为转速800-1300rpm条件下的磁力搅拌。
一种递送sirna的壳聚糖衍生物纳米颗粒的制备方法的操作步骤如下:
将50μl浓度7.24μm的sirna溶液逐滴加入300μl的带正电的浓度1mg/ml的壳聚糖盐酸盐溶液,搅拌混合,再逐滴加入600μl带负电的浓度2mg/ml的羧甲基壳聚糖溶液,磁力搅拌;通过分子间静电相互作用自组装形成递送sirna的壳聚糖衍生物纳米系统颗粒。
本发明的有益技术效果体现在以下方面:
1.本发明通过带正电的壳聚糖盐酸盐溶液与可抑制结肠癌细胞增殖和迁移相关的蛋白表达的sirna溶液混合后,再加入带负电的羧甲基壳聚糖溶液,通过分子间静电相互作用自组装形成递送sirna的壳聚糖衍生物纳米颗粒(sirna-cdnps),再将递送sirna的壳聚糖衍生物纳米颗粒(sirna-cdnps)加入结肠癌细胞(ht-29)中孵育16h,ht-29中β-catenin蛋白的表达仅有对照组(不添加的sirna-cdnps的ht-29)40.10±6.2%,这表明sirna-cdnps处理后β-catenin表达显著降低。
所述递送sirna的壳聚糖衍生物纳米颗粒,在ph值2.2的胃环境中有效保护sirna不被降解;在ph值5.5的模拟结肠癌细胞环境中,超声刺激可促进sirna释放;在结肠癌细胞的环境中高效转染所负载的sirna,并促使结肠癌细胞中β-catenin蛋白表达减少,可望有效抑制结肠癌细胞增殖和迁移。
2.本发明的制备方法通过静电相互作用自组装形成sirna-cdnps,该制备过程不添加任何化学交联剂,该方法简单、绿色、无毒,细胞毒性实验结果表明在sirna的载体材料(cdnps)(1.2mg/l)处理ht-29细胞其中93%的细胞是正常存活的。该方法所建sirna-cdnps在ph2.2条件下sirna累积释放率为11.08%,可有效的封装保护sirna,在ph5.5,超声刺激sirna-cdnps释放靶向sirna,积释放率为70.07%。该方法所建sirna-cdnps使sirna被ht-29细胞有效内化,显示出良好的转染效果。
附图说明
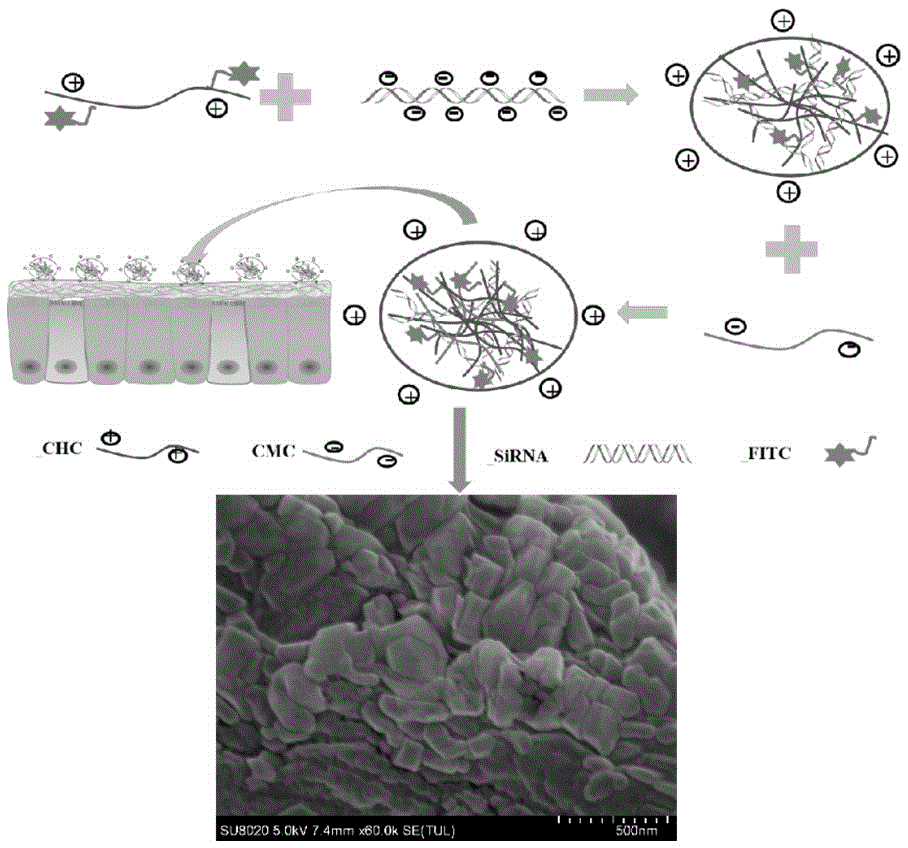
图1为本发明实施例1递送sirna的壳聚糖衍生物纳米颗粒(sirna-cdnps)形成示意图。
图2为本发明实施例1中在胃以及结肠癌ph条件sirna-cdnps中的sirna控制释放图。
图3为本发明实施例1中sirna-cdnps中sirna有效转染结肠癌细胞(ht-29)的荧光显微镜图。其中cy5标记sirna为红色,fitc标记cdnps为绿色dapi(4′,6-二氨基-2-苯基吲哚)染色细胞核为蓝色。
图4为本发明实施例1中sirna-cdnps孵育结肠癌细胞后β-catenin蛋白表达图。
具体实施方式
下面结合实施例,对本发明作进一步地描述。
虽然以下描述了本发明的优选实施方式,然而应该理解,可以以各种形式实现本发明而不应被这里阐述的实施方式所限制。
实施例1
制备fitc标记的壳聚糖盐酸盐粉体的具体操作步骤如下:
将10mg壳聚糖盐酸盐完全溶解在10mg去离子水中,得到浓度1mg/ml的壳聚糖盐酸盐溶液。在浓度1mg/ml的壳聚糖盐酸盐溶液中加入10ml浓度为5.8mg/l的异硫氰酸荧光素(fitc)溶液(5.8mg/l,无水甲醇),在磁力搅拌(500rpm)下处理4h。然后加入1m浓度的氢氧化(naoh)将ph值调整至10,析出fitc标记的壳聚糖盐酸盐。用超纯水洗涤游离fitc,离心分离至上清液中未检测到荧光。最后,通过冻干法得到了fitc标记的壳聚糖盐酸盐粉体。
按照表1中sirna、不同体积的chc和不同体积的cmc(600μl、500μl、400μl、300μl)制备sirna-cdnps,一种递送sirna的壳聚糖衍生物纳米颗粒的制备操作步骤如下:将50μl体积、浓度为7.24μm的sirna逐滴加入不同体积(300μl、400μl、500μl、600μl)、浓度为1mg/mlfitc-壳聚糖盐酸盐溶液中,不断搅拌混合,再逐滴加入不同体积(600μl、500μl、400μl、300μl)、浓度为2mg/ml的羧甲基壳聚糖溶液,转速800-1300rpm条件下的磁力搅拌;sirna、chc和cmc带不同电性电荷,利用他们分子间静电相互作用自组装形成封装sirna的壳聚糖衍生物纳米颗粒(sirna-cdnps),制备示意图如图1所示。
实施例1制备的sirna-cdnps进行的粒径、pdi、zeta电位及封装率
测定,结果如表1所示。
由表1可知,sirna(7.24μm)、fitc-壳聚糖盐酸盐(1mg/ml)和羧甲基壳聚糖(2mg/ml)的体积分别为50μl,300μl和600μl时,所制备的sirna-cdnps粒径最小,zeta电位高,分散指数良好,封装率最高。
实施例2
sirna-cdnps在模拟结肠癌细胞环境中sirna控制释放的应用:
取实施例1制备的sirna-cdnps放于在37℃的胃环境(ph值=2.2,120rpm)中孵育不同时间,最长可达120min。然后将上述酸性溶液与naoh(1m)混合,调节ph值至弱酸(ph值=5.5)。随后超声处理8min,37℃孵育,摇匀(120rpm)112min。在预定时间(0、30、60、90、120、128、150、180、210和240min)获取样品。样品用5%(w/v)聚丙烯酰胺凝胶分析,在1×tbe缓冲液中进行120mv电泳,凝胶用溴化乙锭染色,用凝胶成像仪fla7000观察,结果如图2所示。
通过分析ph2.2和ph5.5下的sirna含量,采用聚丙烯酰胺凝胶电泳法检测sirna-cdnps中sirna的释放。图2中的红色箭头和白色箭头表示未封装的sirna和fitc。sirna-cdnps在ph值2.2(胃环境)下120分钟内释放sirna并不具有时间依赖性,因为静电相互作用可能会增加sirna-cdnps的稳定性,并阻止sirna的释放。在ph值5.5(模拟结肠癌细胞环境)超声处理(8min)sirna含量有效增加。因此,sirna-cdnps可以保护胃内包裹的sirna,实现结肠癌部位特异性sirna的释放,增强其口服吸收。
实施例3
sirna-cdnps中的sirna被ht-29细胞有效内化的应用:
取实施例1制备的sirna-cdnps孵育结肠癌细胞(ht-29),分析sirna的转染效果,具体步骤如下:100μlsirna-cdnps(包含0.55nmolsirna)加入到ht-29细胞(1×105/孔)孵育16h。随后把加入的sirna-cdnps轻轻吸收,并用pbs清洗三次细胞。用4%多聚甲醛pbs固定细胞15min,pbs洗涤2次,dapi(4′,6-二氨基-2-苯基吲哚)核染色10min。pbs再次洗涤细胞,用超纯水冲洗后,置于显微镜载玻片上。用荧光显微镜拍摄荧光图像,结果如图3所示。
取实施例1制备的sirna-cdnps加入结肠癌细胞(ht-29),分析sirna的转染效果,结果如图3所示。
将ht-29细胞与sirna-cdnps孵育16h,通过荧光显微镜观察细胞对sirna的摄取情况(图3)。sirna-cdnps中的sirna被ht-29细胞有效内化,显示出良好的转染效果。
实施例4
sirna-cdnps体外治疗的应用:
取实施例1制备的sirna-cdnps体外治疗,评估与结肠癌细胞增殖和迁移相关的β-catenin蛋白质表达水平的变化。分析蛋白表达,具体步骤如下:ht-29细胞以5×105/孔的速度接种于6孔板上,置于完全培养基中,37℃、5%co2中培养1天。随后,在添加10%胎牛血清、100u/ml青霉素和100mg/ml链霉素(2ml/孔)的新鲜dmem高糖培养基中培养。然后用200μl的sirna-cdnps(cy5标记sirna,包含1.1nmol)或200μl壳聚糖衍生物纳米系统(cdnps)孵育细胞24h和48h,结果如图4所示。
由图4可知,sirna-cdnps转染ht-29细胞后(24小时)β-catenin蛋白水平显著(p<0.05)降低为67±4.1%。sirna-cdnps转染ht-29细胞48h后β-catenin蛋白含量表现出显著减少(p<0.05),在β-catenin蛋白质含量为40.10±6.2%。cdnps处理后没有明显减弱(p>0.05)β-catenin蛋白表达。sirna-cdnps显著抑制ht-29细胞中β-catenin蛋白表达。以上结果说明sirna-cdnps的应用成功抑制β-catenin蛋白表达。
以上已经描述了本发明的各实施例,上述说明是示例性的,并非穷尽性的,并且也不限于所披露的各实施例。在不偏离所说明的各实施例的范围和精神的情况下,对于本技术领域的普通技术人员来说许多修改和变更都是显而易见的。
- 还没有人留言评论。精彩留言会获得点赞!