疫苗佐剂及其制备方法和应用以及制得的疫苗与流程
本发明涉及疫苗佐剂
技术领域:
,尤其是涉及一种疫苗佐剂及其制备方法和应用以及制得的疫苗。
背景技术:
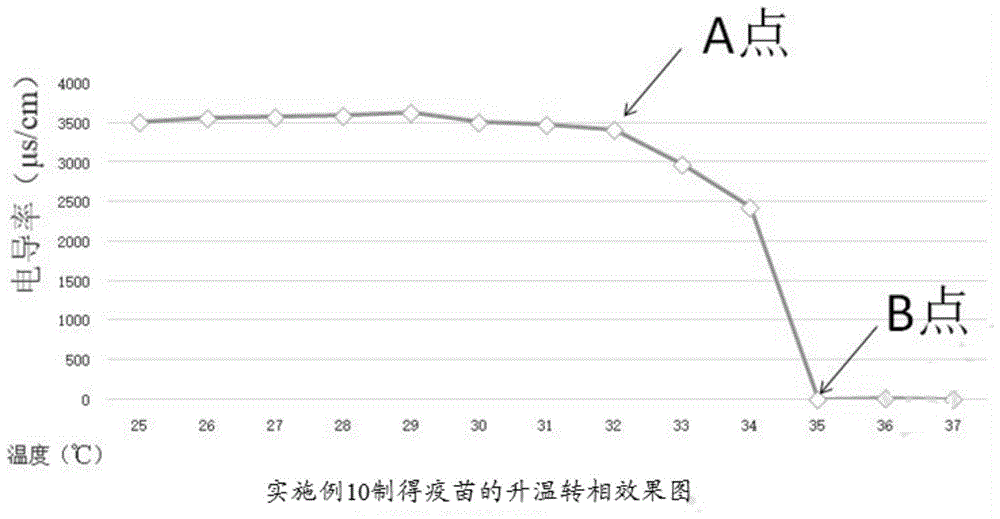
:根据免疫学原理,免疫的激活有一个阈值,这就要求疫苗要激活免疫需要一次暴露较多的抗原,但之后的免疫建立过程需要的暴露的抗原量会低很多,然而暴露过多过少的抗原都容易引发免疫副反应或免疫抑制现象的发生。目前广泛应用的疫苗乳液,通常可分为水包油(o/w)型疫苗乳液和油包水(w/o)型疫苗乳液两种。水包油(o/w)型疫苗乳液由于外相水中含有较高抗原,其注射到动物体很短的时间内能够出现一个很高的抗原量暴露,这很容易导致免疫副反应的发生,所以为了降低副反应水包油(o/w)型疫苗乳液不能携带较高浓度的抗原;而油包水(w/o)型疫苗乳液,由于外相抗原暴露较少,不易引起免疫应答,存在激活免疫时间较慢的缺陷。因此,目前市场上的上述两种疫苗乳液,都不能完美的满足免疫反应不同时间对抗原暴露量的需要。有鉴于此,特提出本发明。技术实现要素:本发明的目的在于提供一种疫苗佐剂及其进一步制得的疫苗,由上述疫苗佐剂制得的疫苗,在0~25℃时为水包油型疫苗乳液,在29~37℃温度下,能够由水包油型疫苗乳液转相为油包水型疫苗乳液。因此,其注射到动物体内在发生转相前会在很短的时间内出现一个很高抗原量暴露的突释现象,然后疫苗在体温作用下迅速发生转相为油包水型疫苗乳液,能迅速降低了抗原暴露数量,进而实现了保证持续刺激机体免疫的同时又能减少免疫副反应发生的效果。为了实现本发明的上述目的,特采用以下技术方案:本发明提供的一种疫苗佐剂,按质量百分数计,所述疫苗佐剂包括以下组分:注射用油75~90wt%、二缩甘露醇油酸酯2~16wt%、吐温-852~10wt%和稳定剂1~2.5wt%;所述疫苗佐剂中各组分的质量百分数之和为100%。进一步的,按质量百分数计,所述疫苗佐剂包括以下组分:注射用油80~90wt%、吐温-852~10wt%、二缩甘露醇油酸酯5~14wt%和稳定剂1~2wt%;所述疫苗佐剂中各组分的质量百分数之和为100%;优选地,按质量百分数计,所述疫苗佐剂包括以下组分:注射用油82wt%、二缩甘露醇油酸酯14wt%、吐温-853wt%和稳定剂1wt%。进一步的,所述吐温-85和二缩甘露醇油酸酯的质量比为1~5:3~15,优选为1:3。进一步的,所述注射用油包括注射用矿物油或注射用植物油中的至少一种;优选地,所述注射用油包括注射用矿物油,优选为白油;优选地,所述稳定剂包括硬脂酸铝、明胶、peg和乙二醇中的至少一种,优选为乙二醇;优选地,所述二缩甘露醇油酸酯为sigma公司生产的货号为m8819-500g的mannidemonooleate。本发明提供的一种疫苗佐剂的制备方法,所述制备方法包括以下步骤:将配方量的注射用油、吐温-85、二缩甘露醇油酸酯和稳定剂混匀,得到疫苗佐剂;优选地,所述混匀为搅拌混匀,所述搅拌的条件至少满足如下中的至少一个:搅拌转速为45~55rpm/min,温度为25~35℃,时间为30~60min;更优选地,所述搅拌的条件至少满足如下中的至少一个:搅拌转速为50rpm/min,温度为30℃,时间为60min。本发明提供的一种上述疫苗佐剂在制备疫苗产品中的应用。本发明提供的一种疫苗,所述疫苗主要由上述疫苗佐剂和水性溶液混匀乳化制得。进一步的,所述水性溶液包含至少一种灭活抗原;优选地,所述疫苗佐剂与水性溶液的质量比为1:0.8~1.2,优选为1:1。本发明提供的一种疫苗的制备方法,所述制备方法包括以下步骤:将水性溶液加入疫苗佐剂中,乳化,得到疫苗;优选地,所述乳化包括第一次乳化和第二次乳化,所述第一次乳化和第二次乳化顺次进行;优选地,所述第一次乳化的反应条件至少满足如下中的至少一个:乳化温度为25~35℃、转速为75~85rpm/min、时间为110~130min;更优选地,所述第一次乳化的反应条件至少满足如下中的至少一个:乳化温度为30℃、转速为80rpm/min、时间为120min;优选地,所述第二次乳化的反应条件至少满足如下中的至少一个:乳化温度为10~15℃、转速为45~55rpm/min、时间为25~35min;更优选地,所述第二次乳化的反应条件至少满足如下中的至少一个:乳化温度为12℃、转速为50rpm/min、时间为30min。进一步的,所述制备方法包括以下步骤:在25~35℃下,将水性溶液加入疫苗佐剂中,75~85rpm搅拌乳化110~130min,完成第一次乳化,得到乳液a;随后将乳液a降温至10~15℃,45~55rpm/min搅拌乳化25~35min,完成第二次乳化,得到疫苗;优选地,所述制备方法包括以下步骤:在30℃下,将水性溶液加入疫苗佐剂中,80rpm搅拌乳化120min,完成第一次乳化,得到乳液a;随后将乳液a降温至12℃,50rpm/min搅拌乳化30min,完成第二次乳化,得到疫苗。与现有技术相比,本发明的有益效果为:本发明提供的疫苗佐剂,所述疫苗佐剂主要由注射用油、吐温-85、二缩甘露醇油酸酯和稳定剂,按特定比例复配制得。上述疫苗佐剂中利用二缩甘露醇油酸酯对温度比较敏感,低温时倾向于o/w乳剂高温时倾向于w/o乳剂的特点选取适合的注射用油与一定比例及浓度的二缩甘露醇油酸酯调配而成。因此,由本申请疫苗佐剂进一步制得的疫苗,具有在29~37℃温度下,由水包油型疫苗乳液转相为油包水型疫苗乳液的效果。本发明提供的疫苗佐剂的制备方法,所述制备方法为将配方量的注射用油、吐温-85、二缩甘露醇油酸酯和稳定剂和混匀,得到疫苗佐剂;上述疫苗佐剂的制备方法具有制备工艺简单,易于操作的优势。本申请提供的疫苗佐剂可以广泛应用于制备疫苗产品中。本申请提供的疫苗主要由上述疫苗佐剂和水性溶液混匀乳化制得。由上述疫苗佐剂与水性溶液乳化混匀后制得的疫苗具有升温转相的效果,所述疫苗在0~25℃时为水包油型疫苗乳液,在29~37℃时可转相为油包水型疫苗乳液。因此,其注射到动物体内在发生转相前会在很短的时间内出现一个很高抗原量暴露这一突释现象,然后疫苗在体温作用下迅速发生转相为油包水型疫苗乳液,能迅速降低了抗原暴露数量,从而实现既能满足免疫阈值对大量的抗原需要,又能迅速减少抗原的暴露量,进而实现了保证持续刺激机体免疫的同时又能减少免疫副反应发生的效果。本发明提供的疫苗的制备方法,所述制备方法为将水性溶液加入疫苗佐剂中,乳化,得到疫苗。上述方法具有制备工艺简单,易于工业化生产的优势。附图说明为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。图1为本发明效果例1提供的实施例10制得疫苗的升温转相效果图。具体实施方式下面将结合实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。根据本发明的一个方面,一种疫苗佐剂,按质量百分数计,所述疫苗佐剂包括以下组分:注射用油75~90wt%、吐温-852~16wt%、二缩甘露醇油酸酯2~10wt%、稳定剂1~2.5wt%和;所述疫苗佐剂中各组分的质量百分数之和为100%。本发明提供的疫苗佐剂,所述疫苗佐剂主要由注射用油、吐温-85、二缩甘露醇油酸酯和稳定剂,按特定比例复配制得。上述疫苗佐剂中利用二缩甘露醇油酸酯对温度比较敏感,低温时倾向于o/w乳剂高温室倾向于w/o乳剂的特点选取适合的注射用油与一定比例及浓度的二缩甘露醇油酸酯调配而成。因此,由本申请疫苗佐剂进一步制得的疫苗,具有在温度下升温转相的效果。上述注射用油典型但非限制性的优选实施方案为:75wt%、80wt%、82wt%、85wt%和90wt%;上述吐温-85典型但非限制性的优选实施方案为:2wt%、3wt%、4wt%、8wt%、10wt%、12wt%、14wt%和16wt%;上述稳定剂典型但非限制性的优选实施方案为:1wt%、1.5wt%、1.8wt%、2.0wt%、2.2wt%和2.5wt%;上述二缩甘露醇油酸酯典型但非限制性的优选实施方案为:2wt%、3wt%、4wt%、5wt%、6wt%、7wt%、8wt%、9wt%和10wt%。在本发明的一种优选实施方式中,按质量百分数计,所述疫苗佐剂包括以下组分:注射用油80~90wt%、二缩甘露醇油酸酯5~14wt%、吐温-852~10wt%和稳定剂1~2wt%;所述疫苗佐剂中各组分的质量百分数之和为100%;优选地,按质量百分数计,所述疫苗佐剂包括以下组分:注射用油82wt%、二缩甘露醇油酸酯14wt%、吐温-853wt%和稳定剂1wt%。本发明中,通过对各组分原料用量比例的进一步调整和优化,从而进一步优化了本发明疫苗佐剂的技术效果。在本发明的一种优选实施方式中,所述吐温-85和二缩甘露醇油酸酯的质量比为1~5:3~15,优选为1:3。在本发明的一种优选实施方式中,所述注射用油包括注射用矿物油或注射用植物油中的至少一种;优选地,所述注射用油包括注射用矿物油,优选为白油;更优选为药用级白油。作为一种优选的实施方式,上述注射用油为药用级7#白油。在本发明的一种优选实施方式中,所述稳定剂包括硬脂酸铝、明胶、peg和乙二醇中的至少一种,优选为乙二醇。作为一种优选的实施方式,上述稳定剂由国药集团化学试剂有限公司生产。优选地,所述二缩甘露醇油酸酯为sigma公司生产的货号为m8819-500g的mannidemonooleate。根据本发明的一个方面,一种疫苗佐剂的制备方法,所述制备方法包括以下步骤:将配方量的注射用油、吐温-85、稳定剂和二缩甘露醇油酸酯混匀,得到疫苗佐剂;本发明提供的疫苗佐剂的制备方法,所述制备方法为将配方量的注射用油、吐温-85、稳定剂和二缩甘露醇油酸酯混匀,得到疫苗佐剂;上述制备方法具有制备工艺简单,易于操作的优势。在本发明的一种优选实施方式中,所述搅拌的条件至少满足如下中的至少一个:搅拌转速为45~55rpm/min,温度为25~35℃,时间为30~120min;作为一种优选的实施方式,上述搅拌混匀搅拌转速为50rpm/min,温度为30℃,时间为60min。上述搅拌混匀的搅拌转速典型但非限制性的优选实施方案为:45rpm/min、48rpm/min、50rpm/min、52rpm/min和55rpm/min;上述搅拌混匀的温度典型但非限制性的优选实施方案为:25℃、28℃、30℃、32℃和35℃。更优选地,所述搅拌的条件至少满足如下中的至少一个:搅拌转速为50rpm/min,温度为30℃,时间为60min。根据本发明的一个方面,一种上述疫苗佐剂在制备疫苗产品中的应用。本申请提供的疫苗佐剂可以广泛应用于制备疫苗产品中。根据本发明的一个方面,一种疫苗,所述疫苗主要由上述疫苗佐剂和水性溶液混匀乳化制得;所述水性溶液为本申请疫苗中的水相,其与作为油剂的本申请上述疫苗佐剂混匀后,可以形成疫苗乳液,该疫苗乳液在在0~25℃时为水包油型疫苗乳液,在29~37℃时可转相为油包水型疫苗乳液。优选地,所述水性溶液包含至少一种灭活抗原;本申请提供的疫苗主要由上述疫苗佐剂和水性溶液混匀乳化制得。由上述疫苗佐剂与水性溶液乳化混匀后制得的疫苗,具有在温度下升温转相的效果,所述疫苗在0~25℃时为水包油型疫苗乳液,在29~37℃时可转相为油包水型疫苗乳液。因此,其注射到动物体内在发生转相前会在很短的时间内出现一个很高抗原量暴露这一突释现象,然后疫苗在体温作用下迅速发生转相为油包水型疫苗乳液,能迅速降低了抗原暴露数量,从而实现既能满足免疫阈值对大量的抗原需要,又能迅速减少抗原的暴露量,进而实现了保证持续刺激机体免疫的同时又能减少免疫副反应发生的效果。进一步的,本申请上述疫苗与目前市场上的油佐剂疫苗相比,具有以下优势:1、黏度低易于注射:本申请上述疫苗由于常温下(0~25℃时)是水包油型疫苗乳液,其黏度大约在30cp左右,与市面上的水包油型疫苗乳液一样容易注射。2、起效快:本申请上述疫苗由于注射到动物体内在发生转相前会在很短的时间内出现一个突释效应,注射到机体内能迅速激活免疫,以口蹄疫疫苗为例,5-7天可以检测到抗体产生。3、抗原贮量大:本申请上述疫苗在29~37℃下发生转相后,抗原的暴露速率远远低于现有的水包油型疫苗乳液。因此,在满足免疫阈值刺激要求的同时还可以携带更高浓度的抗原,而不用向现有的水包油型疫苗乳液,虽然实现了免疫快速激活但由于抗原暴露速度依然很快,所以为了降低副反应而不能携带较高浓度的抗原。4、抗体增长持续期长:本申请上述疫苗在29~37℃下发生转相后为油包水型疫苗乳液,即具备了目前市场上水包油型疫苗乳液的快速激活免疫的优点,又具备了油包水型疫苗乳液抗原暴露速率低,抗体增长期长的优点,经检测疫苗抗体持续增长期超过28天,可以实现一针免疫。在上述优选实施方式中,所述疫苗佐剂与水性溶液的质量比为1:0.8~1.2,优选为1:1。作为一种优选的实施方式,上述疫苗佐剂与水性溶液的质量比为1:1。根据本发明的一个方面,一种疫苗的制备方法,所述制备方法包括以下步骤:将水性溶液加入疫苗佐剂中,乳化,得到疫苗;本发明提供的疫苗的制备方法,所述制备方法为将水性溶液加入疫苗佐剂中,乳化,得到疫苗。上述方法具有制备工艺简单,易于工业化生产的优势。在本发明的一种优选实施方式中,所述乳化包括第一次乳化和第二次乳化,所述第一次乳化和第二次乳化顺次进行;作为一种优选的实施方式,上述乳化包括第一次乳化和第二次乳化,第一次乳化是选在转相温度点下2℃左右完成,这样更容易得到颗粒小而均匀度好的乳滴,第二次乳化选择在较低温度是为了促进乳剂分布更加均匀以确保封装时乳剂更加稳定。在本发明的一种优选实施方式中,所述第一次乳化的反应条件至少满足如下中的至少一个:乳化温度为25~35℃、转速为75~85rpm/min、时间为110~130min;上述第一次乳化的温度典型但非限制性的优选实施方案为:25℃、28℃、30℃、32℃和35℃;上述第一次乳化的搅拌转速典型但非限制性的优选实施方案为:75rpm/min、78rpm/min、80rpm/min、82rpm/min和85rpm/min;上述第一次乳化的时间典型但非限制性的优选实施方案为:110min、110~130min、115min、120min和130min。更优选地,所述第一次乳化的反应条件至少满足如下中的至少一个:乳化温度为30℃、转速为80rpm/min、时间为120min;在本发明的一种优选实施方式中,所述第二次乳化的反应条件至少满足如下中的至少一个:乳化温度为10~15℃、转速为45~55rpm/min、时间为25~35min;作为一种优选的实施方式,上述第二次乳化的反应条件,接近疫苗贮藏温度以促进做出的疫苗适宜较长时间贮存。上述第二次乳化的温度典型但非限制性的优选实施方案为:10℃、11℃、12℃、13℃、14℃和15℃;上述第二次乳化的搅拌转速典型但非限制性的优选实施方案为:45rpm/min、48rpm/min、50rpm/min、52rpm/min和55rpm/min;上述第二次乳化的时间典型但非限制性的优选实施方案为:25min、28min、30min、32min和35min。更优选地,所述第二次乳化的反应条件至少满足如下中的至少一个:乳化温度为12℃、转速为50rpm/min、时间为30min。在本发明的一种优选实施方式中,所述制备方法包括以下步骤:在25~35℃下,将水性溶液加入疫苗佐剂中,75~85rpm搅拌乳化110~130min,完成第一次乳化,得到乳液a;随后将乳液a降温至10~15℃,45~55rpm/min搅拌乳化25~35min,完成第二次乳化,得到疫苗;优选地,所述制备方法包括以下步骤:在30℃下,将水性溶液加入疫苗佐剂中,80rpm搅拌乳化120min,完成第一次乳化,得到乳液a;随后将乳液a降温至12℃,50rpm/min搅拌乳化30min,完成第二次乳化,得到疫苗。下面将结合实施例和对比例对本发明的技术方案进行进一步地说明。注:本申请实施例和对比例中使用的二缩甘露醇油酸酯为sigma公司生产的货号为m8819-500g的mannidemonooleate。实施例1一种疫苗佐剂,按质量百分数计,所述疫苗佐剂包括以下组分:白油75wt%、吐温-855wt%、司盘-857.5wt%、乙二醇2.5wt%和二缩甘露醇油酸酯10wt%;所述疫苗佐剂的制备方法包括以下步骤:在25℃下,将配方量的上述原料以45rpm/min的转速搅拌混匀60min,制得疫苗佐剂。实施例2一种疫苗佐剂,按质量百分数计,所述疫苗佐剂包括以下组分:白油90wt%、吐温-851.5%、司盘-853wt%、乙二醇1wt%和二缩甘露醇油酸酯4.5wt%;所述疫苗佐剂的制备方法包括以下步骤:在35℃下,将配方量的上述原料以55rpm/min的转速搅拌混匀60min,制得疫苗佐剂。实施例3一种疫苗佐剂,按质量百分数计,所述疫苗佐剂包括以下组分:白油80wt%、吐温-855%、司盘-854wt%、乙二醇1wt%和二缩甘露醇油酸酯10wt%;所述疫苗佐剂的制备方法包括以下步骤:在28℃下,将配方量的上述原料以48rpm/min的转速搅拌混匀60min,制得疫苗佐剂。实施例4一种疫苗佐剂,按质量百分数计,所述疫苗佐剂包括以下组分:白油79.5wt%、吐温-855wt%、司盘-8511wt%、乙二醇2.5wt%和二缩甘露醇油酸酯2wt%;所述疫苗佐剂的制备方法包括以下步骤:在32℃下,将配方量的上述原料以52rpm/min的转速搅拌混匀60min,制得疫苗佐剂。实施例5一种疫苗佐剂,按质量百分数计,所述疫苗佐剂包括以下组分:白油82wt%、吐温-853.5wt%、司盘-8510.5wt%、乙二醇1wt%和二缩甘露醇油酸酯3wt%;所述疫苗佐剂的制备方法包括以下步骤:在30℃下,将配方量的上述原料以50rpm/min的转速搅拌混匀60min,制得疫苗佐剂。实施例11一种疫苗佐剂,按质量百分数计,所述疫苗佐剂包括以下组分:注射用植物油82wt%、吐温-803.5wt%、司盘-8010.5wt%、peg1wt%和二缩甘露醇油酸酯3wt%;所述疫苗佐剂的制备方法同实施例5。对比例1本对比例除了将二缩甘露醇油酸酯替换为聚异丁希丁二酰胺外,其余同实施例5。对比例3一种疫苗佐剂,按质量百分数计,所述疫苗佐剂包括以下组分:白油92wt%、吐温-852wt%、司盘-852wt%、二缩甘露醇油酸酯5wt%和乙二醇1wt%;所述疫苗佐剂的制备方法同实施例5。对比例4一种疫苗佐剂,按质量百分数计,所述疫苗佐剂包括以下组分:白油82wt%、吐温-805wt%、司盘-852wt%、聚异丁希丁二酰胺10wt%和乙二醇1wt%;所述疫苗佐剂的制备方法同实施例5。实施例6一种疫苗,所述疫苗由实施例1制得的疫苗佐剂和水性溶液以1:0.8的质量比,混匀乳化制得;所述水性溶液包含至少一种灭活抗原;所述制备方法包括以下步骤:在25℃下,将水性溶液加入疫苗佐剂中,75rpm搅拌乳化110min,完成第一次乳化,得到乳液a;随后将乳液a降温至10℃,45rpm/min搅拌乳化25min,完成第二次乳化,得到疫苗。实施例7一种疫苗,所述疫苗由实施例2制得的疫苗佐剂和水性溶液以1:1.2的质量比,混匀乳化制得;所述水性溶液包含至少一种灭活抗原;所述制备方法包括以下步骤:在35℃下,将水性溶液加入疫苗佐剂中,85rpm搅拌乳化130min,完成第一次乳化,得到乳液a;随后将乳液a降温至15℃,55rpm/min搅拌乳化35min,完成第二次乳化,得到疫苗。实施例8一种疫苗,所述疫苗由实施例3制得的疫苗佐剂和水性溶液以1:1的质量比,混匀乳化制得;所述水性溶液包含至少一种灭活抗原;所述制备方法包括以下步骤:在30℃下,将水性溶液加入疫苗佐剂中,80rpm搅拌乳化120min,完成第一次乳化,得到乳液a;随后将乳液a降温至12℃,50rpm/min搅拌乳化30min,完成第二次乳化,得到疫苗。实施例9本实施例除将实施例3制得的疫苗佐剂替换为实施例4制得的疫苗佐剂外,其余同实施例8。实施例10本实施例除将实施例3制得的疫苗佐剂替换为实施例5制得的疫苗佐剂外,其余同实施例8。实施例12本实施例除将实施例3制得的疫苗佐剂替换为实施例11制得的疫苗佐剂外,其余同实施例8。对比例2本实施例除将实施例3制得的疫苗佐剂替换为对比例1制得的疫苗佐剂外,其余同实施例8。对比例5本实施例除将实施例3制得的疫苗佐剂替换为对比例3制得的疫苗佐剂外,其余同实施例8。对比例6本实施例除将实施例3制得的疫苗佐剂替换为对比例4制得的疫苗佐剂外,其余同实施例8。效果例1为表明由本申请疫苗佐剂制备得到的疫苗具有升温转相的效果,在0~25℃时为水包油型疫苗乳液,在29~37℃时可转相为油包水型疫苗乳液。现特将实施例6~x1以及对比例2~y1制备得到的疫苗进行实验分析,具体方法如下:(1)、将2-8℃冰箱冷藏的实施例1~5、实施例11以及对比例1、3、4制备得到的疫苗佐剂与水性溶液混合乳化,制得实施例6~10、实施例12以及对比例2、5、6的疫苗乳液;(2)、随后分别称取100~110ml步骤(1)制得的疫苗乳液置于具有磁力搅拌子的250ml烧杯中,然后将烧杯置入具有磁力搅拌器的水浴锅中,水浴锅中的水位高于乳剂液面1cm,水温为39℃恒温。磁力搅拌器转速为300±20转/分(3)、检测各疫苗乳液在水浴锅加温过程中温度与电导率的变化并记录。注:由于本效果例的目的在于对制得疫苗的电导率进行检测,因此,出于实验目的,本效果例中的水性溶液采用了标准水性溶液未包含抗原;所述标准水性溶液的配置方法如下:使用纯水800ml依次加入hepe缓冲盐10mmol;mgcl210mmol;nacl80mmol,溶解混匀使用0.01m浓度的naoh溶液调整ph值为7.5±0.5,加纯水值1l混匀,制得标准水性溶液;所述hepe缓冲盐为4-羟乙基哌嗪乙磺酸;n-(2-羟乙基)哌嗪-n'-2-乙烷磺酸。具体检测结果如下表1~3所示:表1:本效果例中各实施方式在25~30℃下的电导率(μs/cm)。表2:本效果例中各实施方式在31~30℃下的电导率(μs/cm)。表3:本效果例中各实施方式在37~39℃下的电导率(μs/cm)。组别电导率(37℃)电导率(38℃)电导率(39℃)实施例60.920.030.03实施例716360.250.03实施例8///实施例9///实施例100.03//实施例12402516360.25对比例2466544524321对比例5265626382582对比例6344933653218由上述表格的数据可知,本申请实施例6~10以及实施例12在38℃以内都能转相完成,剂型由o/w变为w/o,而对比例在39℃依然不能完成转相,结合疫苗实际应用分析能在38℃以内完成转相的剂型为最佳剂型,而不再本申请组成范围内的对比例2、5、6的实施方式无法达到上述效果。进一步的,为了更为直观的呈现本申请疫苗升温转相的效果,申请人以实施例10的数据为例,进行了转相质量控制要点分析;关于控制点,a点为实施例10疫苗乳剂随温度的上升,其电导率开始不变或缓慢上升,当到达某个点时其电导率会迅速下降开始发生转相。我们将连续下降过程中以两个整数温度之间电导率下降超过2.5%时的前一个温度判断为a控制点温度。b点为实施例10疫苗乳剂随温度的上升,其电导率开始不变或缓慢上升,当到达某个点时其电导率会迅速下降,当下降超过a点时的80%以上时的该点温度。上述转相温度分析方法是领域内公知方法,至于本申请中a,b控制点,其中a点在质量分析中比较稳定重复性好b点是结果必须能完成转相,但b点受环境因数影响要大,因此波动范围较大为了更好描述产品控制标准因此选着ab两点的变化范围来控制产品质量。具体到实施例10:当32℃时的电导率为3416us/cm,33℃时的电导率为2973us/cm,它们之间差值为3416us/cm-2973us/cm=443us/cm,下降率为:443us/cm÷3416us/cm=12.97%那么32℃即为a点温度。当升温至34℃时电导率为2430us/cm其下降率为(3416-2430)÷3416=28.86%,然而电导率下降80%时的电导应该为3416-3416×80=638.2us/cm,35℃时的电导率为2.08us/cm很显然下降到80%时的温度应该在34℃-35℃之间,但为了描述与记录方便,申请人将电导率下降超过a点时的80%以上的35℃作为b点。同时,申请人将上述分析进行了附图表示,图1为本申请实施例10制得疫苗的升温转相效果图。效果例2申请人对本申请实施例6~10制备得到的疫苗乳剂进行了粘度和稳定性的检测,具体如下:粘度:经测定在30℃以下实施例6~10制备得到的疫苗乳剂黏度为30cp左右与市场上常见的水包油疫苗一样容易注射使用;稳定性:将实施例6~10制备得到的疫苗乳剂在2-8℃疫苗贮存环境下观察两年乳剂未出现分层现象,只是转相温度略有上升(升高0.2~0.5℃),但动物免疫检验未见不良反应以及抗体增长曲线等疫苗免疫性能发生变化。由于疫苗质量保证期一般为1年至1年半,因此未观察2年以后的变化情况。综上所述,本申请疫苗在0~25℃时为水包油型疫苗乳液,在29~37℃时可转相为油包水型疫苗乳液。因此,其注射到动物体内在发生转相前会在很短的时间内出现一个很高抗原量暴露这一突释现象,然后疫苗在体温作用下迅速发生转相为油包水型疫苗乳液,从而实现既能满足免疫阈值对大量的抗原需要,又能迅速减少抗原的暴露量,进而实现了保证持续刺激机体免疫的同时又能减少免疫副反应发生的效果。最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1