一类卤代二芳基脲类化合物及其在制备抗过敏药物中的应用的制作方法
本发明属于生物医药技术领域,具体涉及一类卤代二芳基脲类化合物及其在制备抗过敏药物中的应用。
背景技术:
类过敏反应是指抗原或其他小分子直接激活肥大细胞,不经ige等免疫球蛋白介导而刺激机体产生过敏样症状的过程。过敏原初次接触机体即可出现过敏症状,由于其临床表现与i型过敏反应相似,故称为类过敏反应。在临床上,类过敏反应常常是由药物引起,当药物刺激人嗜碱性粒细胞后,可引起胞内钙离子浓度升高而引发脱颗粒反应。
β-氨基己糖苷酶释放量和组胺释放量检测实验是临床以及实验室常用的用于表征与评价类过敏反应的指标。人外周血嗜碱性白血病细胞ku812属于人嗜碱性粒细胞。因此,制备能够拮抗ku812细胞释放β-氨基己糖苷酶和组胺的化合物对于制备抗过敏药物具有重要意义。
二芳基脲类化合物广泛用作农业上的除草剂、植物生长调节剂;在医药领域常常用作抗癌药、抗菌药等重要中间体,但其与抗过敏相关的研究未见报道。
技术实现要素:
为了克服上述现有技术的缺点,本发明的目的在于提供一类卤代二芳基脲类化合物及其在制备抗过敏药物中的应用。
为了达到上述目的,本发明采用以下技术方案予以实现:
本发明公开了卤代二芳基脲类化合物在制备抗过敏药物中的应用,所述卤代二芳基脲类化合物的结构式如下:
其中,r1、r2、r3、r4为氢、氟、氯、溴或三氟甲基;r1’、r2’、r3’、r4’为氢、氟、氯、溴或三氟甲基。
优选地,所述的药物为能够拮抗人嗜碱性粒细胞ku812的β-氨基己糖苷酶的释放的药物。
优选地,所述的药物为能够拮抗c48/80引起的人嗜碱性粒细胞ku812的的β-氨基己糖苷酶的释放的药物。
优选地,所述的药物为能够拮抗人嗜碱性粒细胞ku812组胺的释放的药物。
本发明还公开了一类卤代卤代二芳基脲类化合物,所述卤代二芳基脲类化合物的结构式如下:
其中,r1、r2、r3、r4、r1’、r2’、r3’、r4’为氢、氟、溴或三氟甲基。
本发明还公开了一种抗过敏药物,由权利要求5所述的卤代卤代二芳基脲类化合物添加药学上可接受的药用辅料制成。
与现有技术相比,本发明具有以下有益效果:
本发明首次公开了卤代二芳基脲类化合物可以有效拮抗由c48/80引起的人嗜碱性粒细胞ku812的β-氨基己糖苷酶释放和组胺释放,从而抑制类过敏反应的发生,因此将卤代二芳基脲类化合物用作于抗过敏制剂,将丰富抗过敏药物类型,为临床抗过敏治疗提供更多可能的治疗方案。
此外,本发明公开了一组新的卤代二芳基脲类化合物,首次公开了其结构,并且通过实验证实其能够拮抗ku812细胞释放β-氨基己糖苷酶和组胺,因此能够将其制备成抗过敏药物。
附图说明
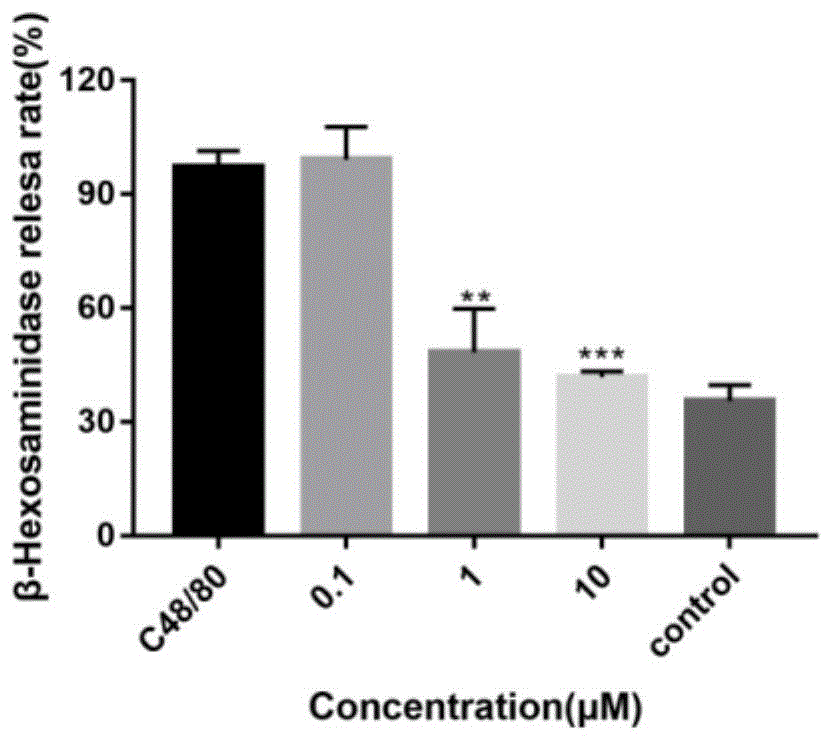
图1为不同浓度的卤代二芳基脲类化合物2抑制由c48/80引起的ku812的β-氨基己糖苷酶释放结果图,其中,c48/80作为阴性对照药物,以tm缓冲液作为空白对照(control)。
图2为不同浓度的卤代二芳基脲类化合物4抑制由c48/80引起的ku812的β-氨基己糖苷酶释放结果图,其中,c48/80作为阴性对照药物,以tm缓冲液作为空白对照(control)。
图3为不同浓度的卤代二芳基脲类化合物5抑制由c48/80引起的ku812的β-氨基己糖苷酶释放结果图,其中,c48/80作为阴性对照药物,以tm缓冲液作为空白对照(control)。
图4为不同浓度的卤代二芳基脲类化合物6抑制由c48/80引起的ku812的β-氨基己糖苷酶释放结果图,其中,c48/80作为阴性对照药物,以tm缓冲液作为空白对照(control)。
图5为不同浓度的卤代二芳基脲类化合物7抑制由c48/80引起的ku812的β-氨基己糖苷酶释放结果图,其中,c48/80作为阴性对照药物,以tm缓冲液作为空白对照(control)。
图6为不同浓度的卤代二芳基脲类化合物8抑制由c48/80引起的ku812的β-氨基己糖苷酶释放结果图,其中,c48/80作为阴性对照药物,以tm缓冲液作为空白对照(control)。
图7为不同浓度的卤代二芳基脲类化合物9抑制由c48/80引起的ku812的β-氨基己糖苷酶释放结果图,其中,c48/80作为阴性对照药物,以tm缓冲液作为空白对照(control)。
图8为不同浓度的卤代二芳基脲类化合物10抑制由c48/80引起的ku812的β-氨基己糖苷酶释放结果图,其中,c48/80作为阴性对照药物,以tm缓冲液作为空白对照(control)。
图9为不同浓度的卤代二芳基脲类化合物14抑制由c48/80引起的ku812的β-氨基己糖苷酶释放结果图,其中,c48/80作为阴性对照药物,以tm缓冲液作为空白对照(control)。
图10为不同浓度的卤代二芳基脲类化合物17抑制由c48/80引起的ku812的β-氨基己糖苷酶释放结果图,其中,c48/80作为阴性对照药物,以tm缓冲液作为空白对照(control)。
图11为不同浓度的卤代二芳基脲类化合物18抑制由c48/80引起的ku812的β-氨基己糖苷酶释放结果图,其中,c48/80作为阴性对照药物,以tm缓冲液作为空白对照(control)。
图12为不同浓度的卤代二芳基脲类化合物20抑制由c48/80引起的ku812的β-氨基己糖苷酶释放结果图,其中,c48/80作为阴性对照药物,以tm缓冲液作为空白对照(control)。
图13为不同浓度的卤代二芳基脲类化合物6抑制由c48/80引起的ku812的组胺释放结果图,其中,c48/80作为阴性对照药物,以tm缓冲液作为空白对照(control)。
图14为不同浓度的卤代二芳基脲类化合物8抑制由c48/80引起的ku812的组胺释放结果图,其中,c48/80作为阴性对照药物,以tm缓冲液作为空白对照(control)。
具体实施方式
为了使本技术领域的人员更好地理解本发明方案,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分的实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都应当属于本发明保护的范围。
需要说明的是,本发明的说明书和权利要求书及上述附图中的术语“第一”、“第二”等是用于区别类似的对象,而不必用于描述特定的顺序或先后次序。应该理解这样使用的数据在适当情况下可以互换,以便这里描述的本发明的实施例能够以除了在这里图示或描述的那些以外的顺序实施。此外,术语“包括”和“具有”以及他们的任何变形,意图在于覆盖不排他的包含,例如,包含了一系列步骤或单元的过程、方法、系统、产品或设备不必限于清楚地列出的那些步骤或单元,而是可包括没有清楚地列出的或对于这些过程、方法、产品或设备固有的其它步骤或单元。
下面结合附图对本发明做进一步详细描述:
卤代二芳基脲类化合物(结构式如表1)是通过前期应用mrgprx2受体高表达细胞膜色谱(cmc)筛选,发现其与mrgprx2受体有较好的亲和作用。在此基础上,本发明运用体外细胞药理学实验,采用细胞表面高表达mrgprx2受体的ku812细胞模型,考察了该类化合物对由c48/80引起的ku812的β-氨基己糖苷酶释放和组胺释放的抑制作用。
研究结果表明:卤代二芳基脲类化合物可以有效的抑制由c48/80引起的ku812细胞β-氨基己糖苷酶和组胺的释放,说明卤代二芳基脲类化合物具有潜在的抗过敏活性,可用于制备抗过敏药物。
表1卤代二芳基脲类化合物结构式
实施例1:
本发明公开的一类卤代卤代二芳基脲类化合物,为化合物10-20化合物结构式如上表1所示,化合物10-化合物20的结构解析核磁数据如下所示:
化合物10:在冰浴条件下,用20ml无水二氯甲烷将双(三氯甲基)碳酸酯(btc)(0.25g,0.83mmol)溶解并搅拌5min,缓慢滴加3-溴-5-三氟甲基苯胺(0.5g,2.08mmol)的二氯甲烷溶液,滴加完毕搅拌15min,向浑浊液中继续滴三乙胺(0.25g,2.50mmol)的二氯甲烷溶液,滴加完毕后搅拌15min,然后向反应溶液中滴加3-溴-5-三氟甲基苯胺(0.5g,2.08mmol)和三乙胺(0.25g,2.50mmol)的二氯甲烷溶液,滴加完毕后搅拌20min,将反应液依次用饱和nahco3溶液(100ml×3),饱和nacl洗涤(100ml×3),无水na2so4干燥,旋干,用层析柱纯化,得化合物dpu-10,为白色固体粉末,产量0.80g,产率76%。1hnmr(400mhz,dmso)δ9.48(s,1h),7.99(s,1h),7.89(s,1h),7.57(s,1h);13cnmr(400mhz,dmso)δ152.67,142.14,125.06,122.80,121.61,121.58,114.44,114.40;ei-ms(m/z):506.89[m]+.
化合物11:与制备化合物10的不同点在于,反应物以4-氟苯胺和2-氯-4-三氟甲基苯胺替代。产率68.1%;1hnmr(400mhz,dmso)δ9.68(s,1h),8.63(s,1h),8.46(d,j=8.7hz,1h),7.88(s,1h),7.69(d,j=8.9hz,1h),7.49(m,2h),7.17(t,j=8.8hz,2h);13cnmr(400mhz,dmso)δ152.30,140.26,135.81,135.79,126.74,125.30,121.88,120.72,120.66,120.58,116.08,115.86;ei-ms(m/z):331.02[m]-.
化合物12:与制备化合物10的不同点在于,反应物以4-氟苯胺和3-溴-5-三氟甲基苯胺替代。产率53.0%;1hnmr(400mhz,dmso)δ9.19(s,1h),8.96(s,1h),7.99(s,1h),7.88(s,1h),7.51(m,3h),7.14(t,2h);13cnmr(400mhz,dmso)δ152.89,142.69,135.87,135.84,124.53,122.78,121.20,121.12,115.89,115.67,113.95,113.91;ei-ms(m/z):378.98[m]+.
化合物13:与制备化合物10的不同点在于,反应物以4-溴苯胺和2-氯-4-三氟甲基苯胺替代。产率72.4%;1hnmr(400mhz,dmso)δ9.73(s,1h),8.64(s,1h),8.45(d,j=8.8hz,1h),7.88(s,1h),7.69(d,j=8.8hz,1h),7.48(q,j=8.9hz,4h);13cnmr(400mhz,dmso)δ152.12,140.10,138.89,132.19,126.81,126.77,125.36,125.33,122.02,120.82,120.76,114.46;ei-ms(m/z):394.95[m]+.
化合物14:与制备化合物10的不同点在于,反应物以3-三氟甲基苯胺和2-氯-4-三氟甲基苯胺替代。产率66.6%;1hnmr(400mhz,dmso)δ9.95(s,1h),8.70(s,1h),8.47(d,j=8.8hz,1h),8.05(s,1h),7.90(d,j=1.4hz,1h),7.70(d,j=8.9hz,1h),7.57(d,j=5.1hz,2h),7.38(d,j=3.7hz,1h);13cnmr(400mhz,dmso)δ153.68,152.27,140.33,139.95,130.63,130.28,129.96,126.83,125.34,123.84,122.18,120.98,119.30,119.26,114.72;ei-ms(m/z):383.03[m]+.
化合物15:与制备化合物10的不同点在于,反应物以3-三氟甲基苯胺和3-溴-5-三氟甲基苯胺替代。产率45.0%;1hnmr(400mhz,dmso)δ9.32(d,j=6.7hz,2h),7.99(d,j=11.3hz,2h),7.89(s,1h),7.63(d,j=7.9hz,1h),7.53(d,j=10.9hz,2h),7.35(d,j=7.4hz,1h);13cnmr(400mhz,dmso)δ152.81,142.37,140.50,130.40,130.15,124.79,122.84,122.80,121.32,121.38,119.11,115.15,115.11,114.19,114.15;ei-ms(m/z):428.99[m]+.
化合物16:与制备化合物10的不同点在于,反应物以4-三氟甲基苯胺和2-氯-4-三氟甲基苯胺替代。产率51.4%;1hnmr(400mhz,dmso)δ9.99(s,1h),8.72(s,1h),8.46(d,j=8.8hz,1h),7.89(s,1h),7.7.68(m,6h);13cnmr(400mhz,dmso)δ152.10,143.21,139.93,126.73,126.69,125.38,123.89,123.57,123.09,122.77,122.22,120.97,110.58;ei-ms(m/z):383.04[m]+.
化合物17:与制备化合物10的不同点在于,反应物以4-三氟甲基苯胺和3-溴-5-三氟甲基苯胺替代。产率58.1%;1hnmr(400mhz,dmso)δ9.37(s,1h),9.33(s,1h),7.97(s,1h),7.89(s,1h),7.67(q,j=8.8hz,4h),7.54(s,1h);13cnmr(400mhz,dmso)δ152.62,143.39,142.31,131.85,131.53,126.55,126.52,124.97,124.77,122.81,121.34,118.84,114.18;ei-ms(m/z):428.98[m]+.
化合物18:与制备化合物10的不同点在于,反应物以2-氯-4-三氟甲基苯胺替代。产率54.3%;1hnmr(400mhz,dmso)δ9.51(s,1h),8.39(d,j=8.8hz,1h),7.91(s,1h),7.71(d,j=8.6hz,1h);13cnmr(400mhz,dmso)δ152.54,140.22,126.89,126.85,125.18,125.14,122.98,122.14;ei-ms(m/z):416.97[m]-.
化合物19:与制备化合物10的不同点在于,反应物以2-氯-4-三氟甲基苯胺和3-溴-5-三氟甲基苯胺替代。产率24%;1hnmr(400mhz,dmso)δ10.06(s,1h),8.71(s,1h),8.42(d,j=8.7hz,1h),7.92(s,1h),7.88(s,1h),7.82(s,1h),7.68(d,j=8.8hz,1h),7.57(s,1h);13cnmr(400mhz,dmso)δ152.11,141.86,139.67,126.83,126.79,125.36,125.32,124.59,122.97,122.48,121.75,121.71,121.22,113.97,113.93;ei-ms(m/z):460.92[m]-.
化合物20:与制备化合物10的不同点在于,反应物以4-溴苯胺和3-溴-5-三氟甲基苯胺替代。产率61.2%;1hnmr(400mhz,dmso)δ9.24(s,1h),9.09(s,1h),7.95(s,1h),7.87(s,1h),7.38(m,5h);ei-ms(m/z):436.88[m]-。
实施例2:
1.实验材料
仪器:全自动微板读取仪购于bio-rad公司(california,美国)。
细胞系:ku812培养在10%血清的imem培养基中,加1:100青霉素-链霉素。培养基每隔天用新鲜培养基半置换使细胞维持在2×106个细胞每毫升的密度。
主要试剂:tm缓冲溶液(组成(g/l):6.954gnacl,0.353gkcl,2.383ghepes,0.162gkh2po4,0.282gcacl2,0.143的mgso4,0.991g葡萄糖,1g牛血清白蛋白。0.1%tritonx-100裂解液;1mmol/lβ-氨基己糖溶液;0.1mol/lna2co3/nahco3终止液(ph11.0)。
2.实验方法
将ku812细胞接种于96孔板中,30000个细胞/孔,培养过夜。96孔板1500rpm离心5min后,吸弃原培养基,按预设的分组分别加入不同的药物:空白组加入90μltm缓冲液,给药组加入90μl待测药物的30μg/mlc48/80溶液,阴性组加入90μl30μg/mlc48/80溶液。37℃孵育30min,1500rpm离心5min,分别吸取50μl至新孔。再将阴性组剩余tm缓冲液吸弃,加90μl0.1%tritonx-100裂解液,吹打,静置5min,1500rpm离心5min后取50μl至新孔为裂解组。向各孔加入50μlβ-氨基己糖。37℃孵育90min后加入150μl/孔的na2co3/nahco3终止液,放置于摇床上以50转/min的频率混匀2min,于405nm测定其吸光度。
按以下公式计算β-氨基己糖苷酶释放率。
β-氨基己糖苷酶释放率=(测试组od值/(空白组od值+裂解组od))×100%;
其中,所述测试组od值为空白组od值、给药组od值或者阴性组od值。
3.实验结果
数据用均数±标准误(mean±sem)表示,图表绘制应用graphpadprism5.0软件。实验结果展示在附图中,其中,化合物48/80(c48/80)是生化研究中常用来促肥大细胞脱颗粒的物质,c48/80为阴性组,代表致敏物质c48/80引起的β-氨基己糖苷酶释放率;不同的浓度表示不同的实验细胞组,化合物2(图1)、化合物4(图2)、化合物5(图3)、化合物6(图4)、化合物7(图5)、化合物8(图6)、化合物9(图7)、化合物10(图8)、化合物14(图9)、化合物17(图10)、化合物18(图11)、化合物20(图12)在c48/80存在下拮抗β-氨基己糖苷酶释放率;control为空白细胞组,为不受c48/80刺激时的β-氨基己糖苷酶释放率。
实验结果表明,化合物6、化合物8能够显著拮抗由c48/80引起的ku812细胞释放β-氨基己糖苷酶,在较低剂量就具有拮抗效果,并且这种拮抗作用与用药剂量呈正相关。。
实施例3:
1.实验材料
仪器:lcms-8040三重四极液相色谱质谱联用仪(日本shimadzu公司)
细胞系:ku812培养在10%血清的imem培养基中,加1:100青霉素-链霉素。培养基每隔天用新鲜培养基半置换使细胞维持在2×106个细胞每毫升的密度。
基本色谱条件:色谱柱:venusilhilic柱(3μm,2.1×150mm);流动相为乙腈(0.1%甲酸):20mm甲酸铵水=80:20;流速:0.3ml/min;柱温:35℃。
2.实验方法
将ku812细胞接种于96孔板中,30000个细胞/孔,培养过夜。96孔板1500rpm离心5min,吸弃培养基。给药组分别加入50μl配好的一系列浓度的药物;空白组与对照组加入50μltm缓冲液。37℃孵育30min后,给药组与对照组每孔加入50μl60μg/mlc48/80;空白组加入50μltm缓冲液,继续孵育30min。然后将96孔板1500rpm离心5min,吸取每孔50μl细胞上清液至1.5ml离心管中,再加入200μl5ng/ml氘代组胺(内标),将混合溶液涡旋振荡后,在4℃下12000rpm离心20min,取上清100μl进行质谱检测。
按以下公式计算组胺释放量。
组胺释放量(ng)=(sha/sha-d4-0.0978)×11.065。其中sha为组胺的峰面积,sha-d4为氘代组胺的峰面积。
3.实验结果
数据用均数±标准误(mean±sem)表示,图表绘制应用graphpadprism5.0软件。部分实验结果展示在附图中,其中,c48/80为阴性组,代表致敏物质c48/80引起的组胺释放率;不同的浓度表示不同的实验细胞组,化合物6(图13),8(图14)在c48/80存在下拮抗组胺的释放率,其中control为空白细胞组,为不c48/80刺激时的组胺释放率。
实验结果表明,化合物6、化合物8能够显著拮抗由c48/80引起的ku812细胞释放组胺,在较低剂量就具有明显拮抗效果,并且这种拮抗作用与用药剂量呈正相关。
以上内容仅为说明本发明的技术思想,不能以此限定本发明的保护范围,凡是按照本发明提出的技术思想,在技术方案基础上所做的任何改动,均落入本发明权利要求书的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!