注射剂的制作方法
本申请是申请号为201380021612.2(国际申请号为:pct/jp2013/061950),申请日为2013年4月23日,发明名称为“注射剂”的发明专利申请的分案申请。
本发明涉及一种注射剂,其包含7-[4-(4-苯并[b]噻吩-4-基-哌嗪-1-基)丁氧基]-1h-喹啉-2酮或其盐。
背景技术:
7-[4-(4-苯并[b]噻吩-4-基-哌嗪-1-基)丁氧基]-1h-喹啉-2-酮(以下也称为“化合物(i)”)是一种由式(i)表示的苯并噻吩化合物:
除了多巴胺d2受体的部分激动剂活性(d2受体的部分激动剂活性)、血清素5-ht2a受体拮抗活性(5-ht2a受体拮抗活性)和肾上腺素α1受体拮抗活性(α1受体拮抗活性),化合物(ⅰ)或其盐,已知具有血清素吸收抑制活性(或血清素再吸收的抑制活性)(专利文献(ptl)1)。化合物(ⅰ)及其盐对中枢神经系统疾病(特别是精神分裂症)具有广治疗谱。
引文列表
专利文献
专利文献1:jp2006-316052a
技术实现要素:
技术问题
在中枢神经系统疾病(如精神分裂症)中,长效药物给药形式由于其增加了患者的依从性是有用的,从而在治疗过程中降低了复发率。
本发明的一个目的是提供一种注射剂,其在长时间周期表现化合物(ⅰ)或其盐的作用,即使经过长期贮存也是稳定的,并且能够容易地注射。本发明提供一种优选地保持化合物(ⅰ)或其盐的有效血液浓度至少一周的持续释放注射剂。
技术方案
为了达到上述目的,本发明人进行了广泛的研究,结果发现,即使当化合物(i)沉淀时,具有包含化合物(i)或其盐作为活性成分的特定组合物的注射剂不会形成硬饼,通过使用简单操作(如温和搅拌)能够很容易地再分散,并适当地注射。本发明人还发现,具有所述特定组合物的注射剂能够显示出化合物(i)或其盐在长时间周期的效果。特别是,本发明人发现,该注射剂能够释放治疗有效量的化合物(i)或其盐至少一周。基于该发现进一步研究完成本发明,本发明包括下列发明:
第1项一种水悬浮液,包含由7-[4-(4-苯并[b]噻吩-4-基-哌嗪-1-基)丁氧基]-1h-喹啉-2-酮或其盐的颗粒(初级颗粒)聚集形成的次级颗粒,所述次级颗粒具有1至50μm的平均颗粒直径(平均次级颗粒直径),且以分散态包含在其中。
第2项根据第1项所述的水悬浮液,其中,7-[4-(4-苯并[b]噻吩-4-基-哌嗪-1-基)丁氧基]-1h-喹啉-2-酮或其盐的颗粒具有0.1至20μm的平均初级颗粒直径。
第3项根据第1项或第2项所述的水悬浮液,其包含7-[4-(4-苯并[b]噻吩-4-基-哌嗪-1-基)丁氧基]-1h-喹啉-2-酮的量为0.1至40wt%。
第4项一种注射剂,其包含前述第1至3项中任一项所述的水悬浮液。
第5项一种注射剂,其包含7-[4-(4-苯并[b]噻吩-4-基-哌嗪-1-基)丁氧基]-1h-喹啉-2-酮或其盐、颗粒粘合剂和注射用水,所述颗粒粘合剂为选自氯化钠、聚氧乙烯脱水山梨醇脂肪酸酯、环氧乙烷和环氧丙烷的嵌段共聚物、聚乙二醇、生育酚、生育三烯酚及其酯、生育酚醋酸酯、生育酚琥珀酸酯、苄醇、水难溶性的聚氧乙烯二醇二苯甲酸酯、水难溶性的聚氧乙烯二醇二甲基磺酸及其酯和苯甲酸苄酯中的至少一种。
第6项根据第5项所述的注射剂,其中,所述7-[4-(4-苯并[b]噻吩-4-基-哌嗪-1-基)丁氧基]-1h-喹啉-2-酮或其盐形成次级颗粒,且所述次级颗粒具有1至50μm的平均次级颗粒直径。
第7项根据第5项或第6项所述的注射剂,其包含7-[4-(4-苯并[b]噻吩-4-基-哌嗪-1-基)丁氧基]-1h-喹啉-2-酮或其盐在注射用水中的悬浮液。
第8项根据第5项或第6项所述的注射剂,其包含7-[4-(4-苯并[b]噻吩-4-基-哌嗪-1-基)丁氧基]-1h-喹啉-2-酮或其盐的沉淀物。
第9项根据第5至8项中任一项所述的注射剂,其中,所述颗粒粘合剂为选自氯化钠、聚氧乙烯(20)失水山梨醇油酸酯、聚氧乙烯(160)聚氧丙烯(30)甘醇、具有200至6000的平均分子量的聚乙二醇、苄醇以及苯甲酸苄酯中的至少一种。
第10项根据第4至9项中任一项所述的注射剂,其ph值为5至8。
第11项根据第4至10项中任一项所述的注射剂,其用于治疗或预防精神分裂症、双相型障碍或抑郁症的复发。
第12a项根据第1至3项中任一项所述的水悬浮液,其中,所述7-[4-(4-苯并[b]噻吩-4-基-哌嗪-1-基)丁氧基]-1h-喹啉-2-酮或其盐是7-[4-(4-苯并[b]噻吩-4-基-哌嗪-1-基)丁氧基]-1h-喹啉-2-酮的二水合物。
第12b项根据第4至11项中任一项所述的注射剂,其中,所述7-[4-(4-苯并[b]噻吩-4-基-哌嗪-1-基)丁氧基]-1h-喹啉-2-酮或其盐是7-[4-(4-苯并[b]噻吩-4-基-哌嗪-1-基)丁氧基]-1h-喹啉-2-酮的二水合物。
第13a项根据权利要求12a所述的水悬浮液,其包含选自聚氧乙烯脱水山梨醇脂肪酸酯和聚乙二醇中的至少一种作为颗粒粘合剂。
第13b项根据权利要求12b所述的注射剂,其包含选自聚氧乙烯脱水山梨醇脂肪酸酯和聚乙二醇中的至少一种作为颗粒粘合剂。
第14项一种预装注射器,其预充有根据第4至11、12b和13b项中任一项所述的注射剂。
a项一种注射剂,其包含7-[4-(4-苯并[b]噻吩-4-基-哌嗪-1-基)丁氧基]-1h-喹啉-2-酮或其盐作为活性成分,所述制剂以这样的方式释放所述活性成分:其治疗有效的血药浓度维持至少一周。
b项根据a项所述的注射剂,其还包含粘合剂。
c项根据a或b项所述的注射剂,其ph值为5~8。
本发明的注射剂包含化合物(ⅰ)或其盐作为活性成分。由于注射剂具有包含化合物(i)或其盐作为活性成分的特定组合物,甚至发生沉淀时所述活性成分也可以很容易地再分散,并由此可以恢复到适合于注射的状态。另外,化合物(i)或其盐的有效血药浓度可维持至少一周。给药时,本发明的注射剂以包含注射用水的悬浮液的形式使用。
在本发明的注射剂中,化合物(i)或其盐形成次级颗粒,所述次级颗粒优选具有1至50μm的平均颗粒直径(平均次级颗粒直径)。优选地(特别是给药前),所述次级颗粒悬浮于注射剂中。
本发明的注射剂的一种优选方式是一种包含水悬浮液的注射剂,所述水悬浮液包含由化合物(i)或其盐的颗粒(初级颗粒)聚集形成的次级颗粒,所述次级颗粒优选具有1至50μm的平均颗粒直径(平均次级颗粒直径)且所述次级颗粒是悬浮的。
所述次级颗粒更优选具有2至30μm的平均颗粒直径(平均次级颗粒直径),还更优选地为3至20μm,甚至更优选为4至17μm,还更优选为5至15μm,特别优选为5至12μm。
由于本发明的注射剂的制备是通过将特定成分7-[4-(4-苯并[b]噻吩-4-基-哌嗪-1-基)丁氧基]-1h-喹啉-2-酮(化合物(i))或其盐悬浮在水中,并进一步添加特定的颗粒粘合剂,化合物(i)或其盐的初级颗粒物可以有利地形成次级颗粒,并且所述制剂可以有利地以一种稳定的方式包含具有这样的平均次级颗粒直径的化合物(i)或其盐的次级颗粒。本发明所用的特定的颗粒粘合剂是指一种能够使化合物(i)或其盐的颗粒(初级颗粒)聚集以形成次级颗粒的成分。
在一般情况下,当水难溶性化合物悬浮于水中,放置很长一段时间,该化合物的颗粒往往沉淀和坚固地固结(具体地,形成硬饼)。一旦在通过将水难溶性的活性成分悬浮在水中制备的注射剂中已经形成这样的硬饼,使活性成分再悬浮是困难的。如果所述活性成分不能悬浮,会出现例如不能注入足够量的活性成分和不希望的降低的注射性(syringability)的问题。因此,防止硬饼形成是注射剂中的一个重要问题。
如在下面详细解释的,即使当化合物(i)或其盐沉淀时,本发明的注射剂也不会形成硬饼。通过采用简单的操作(例如,轻轻搅拌),颗粒容易有利地悬浮。虽然不希望限制性解释,但是基于以下机理预测性地提供本发明的注射剂的有益效果。由于本发明的注射剂是通过将特定成分7-[4-(4-苯并[b]噻吩-4-基-哌嗪-1-基)丁氧基]-1h-喹啉-2-酮或其盐悬浮在水中,并进一步添加特定的颗粒粘合剂,化合物(ⅰ)或其盐的颗粒聚集以形成次级颗粒;因此,即使化合物(i)或其盐沉淀,所述颗粒很难处于非常紧密堆积的状态。本发明包括包含呈沉淀状态的化合物(i)或其盐的次级颗粒的注射剂。
例如,可以通过将具有平均初级颗粒直径的化合物(ⅰ)或其盐与下述的载体一起分散于注射用水中以制备具有前述的平均次级颗粒直径的化合物(i)或其盐的次级颗粒,所述平均初级颗粒直径为约0.1至20μm,更优选为约1至10μm,甚至更优选为约2至5μm。当使用具有上述平均初级颗粒直径的化合物(ⅰ)或其盐的散装粉末和特定颗粒粘合剂,配制成水悬浮液(注射剂)时,颗粒聚集至所需的平均颗粒直径,聚集的化合物(i)或其盐的次级颗粒可以很好地分散。
本发明中所用的术语“平均颗粒直径”是指通过使用激光衍射散射法测得的体积平均直径。粒度分布是使用激光衍射散射法测得,平均颗粒直径是由粒度分布计算所得。
更具体地说,术语“平均初级颗粒直径”是指,当使用循环单元并使用水作为介质时,在超声波照射下使水悬浮液循环,由通过使用激光衍射散射法测定的粒度分布计算的体积平均直径值。本发明所用的术语“次级颗粒直径”是指,当使用循环单元并使用水作为介质时,使水悬浮液循环,由通过使用激光衍射散射法测定的粒度分布计算的体积平均直径值(无超声辐照)。
可以在本发明中使用的颗粒粘合剂的实例包括水性颗粒粘合剂,例如氯化钠、聚氧乙烯脱水山梨醇脂肪酸酯、聚乙二醇、环氧乙烷和环氧丙烷的嵌段共聚物;以及油性颗粒粘合剂,例如生育酚、生育三烯酚及其酯、生育酚乙酸酯、生育酚琥珀酸酯、苄醇,水难溶性的聚氧乙烯二醇二苯甲酸酯、水难溶性的聚氧乙烯二醇二甲基磺酸及其酯、苯甲酸苄酯和类似的苯甲酸酯。
聚氧乙烯脱水山梨醇脂肪酸酯的“脂肪酸”优选为具有12至18个碳原子的脂肪酸,更优选为具有16至18个碳原子的脂肪酸。具体的实例包括月桂酸、肉豆蔻酸、棕榈酸、硬脂酸、油酸、亚油酸等。油酸是特别优选的。在聚氧乙烯脱水山梨醇脂肪酸酯中,聚氧乙烯(20)失水山梨醇月桂酸酯、聚氧乙烯(20)失水山梨醇硬脂酸酯和聚氧乙烯(20)失水山梨醇油酸酯是优选的。具体实例包括聚山梨醇酯20、聚山梨醇酯60和聚山梨醇酯80。聚氧乙烯(20)失水山梨醇油酸酯是特别优选的。
聚乙二醇优选具有约200至6000的平均分子量。这样的聚乙二醇的具体实例包括聚乙二醇400、聚乙二醇4000等。
环氧乙烷和环氧丙烷的嵌段共聚物(也称为eo/po嵌段无规共聚物)优选相对于环氧丙烷含有更高的聚合重量比的环氧乙烷。特别地,优选聚氧乙烯(160)聚氧丙烯(30)甘醇(例如pluronicf68)。这种颗粒粘合剂可以单独使用或以两种或多种组合使用。当使用两种或多种类型的粘合剂时,优选选自水性颗粒粘合剂中的两种或多种类型的粘合剂,或者选自油性颗粒粘合剂中的两种或多种类型的粘合剂。优选单独使用水性颗粒粘合剂或单独使用油性颗粒粘合剂。
特别地,优选使用选自氯化钠、聚氧乙烯脱水山梨醇脂肪酸酯(特别是聚氧乙烯(20)失水山梨醇油酸酯)、聚乙二醇、环氧乙烷和环氧丙烷的嵌段共聚物(特别是,聚氧乙烯(160)聚氧丙烯(30)甘醇)、苄醇和苯甲酸苄酯中的至少一种颗粒粘合剂。更优选地,至少使用氯化钠、聚氧乙烯(20)失水山梨醇油酸酯、具有200至6000的平均分子量的聚乙二醇、聚氧乙烯(160)聚氧丙烯(30)甘醇或苯甲酸苄酯。
其中,氯化钠可以特别有利地使化合物(i)或其盐聚集至次级颗粒直径,并且可以稳定地维持次级颗粒。另外,如下所述,氯化钠可以起到等渗剂的作用。因此,氯化钠的使用是特别优选的。
此外,聚氧乙烯脱水山梨醇脂肪酸酯、聚乙二醇以及环氧乙烷和环氧丙烷的嵌段共聚物是优选的,因为这些化合物具有改善注射剂的注射性的效果。
在本发明中使用的特定颗粒粘合剂的浓度可以根据所用颗粒粘合剂的类型而有所不同。例如,颗粒粘合剂优选地以约0.01至500mg/ml的浓度包含在注射剂中,更优选为约0.05至450mg/ml,甚至更优选为约0.06至300mg/ml。优选地,每100重量份的化合物(ⅰ)或其盐含有约0.01至500重量份的颗粒粘合剂,更优选为约0.05至450重量份,甚至更优选为约0.06至300重量份。
可以在注射剂中用作颗粒粘合剂的各成分的浓度叙述如下。
氯化钠优选地以约0.1mg/ml以上的浓度包含在注射剂中,更优选为1mg/ml以上。更具体地讲,优选地含有约0.1至400mg/ml浓度的氯化钠,更优选为约1至200mg/ml,进一步优选为约1至100mg/ml,甚至更优选为约1至50mg/ml,特别优选为约2至40mg/ml。每100重量份的化合物(i)或其盐,氯化钠的量优选为1至100重量份,更优选为1至200重量份,进一步优选为1至100重量份,更进一步优选为1至50重量份,特别优选为2至40重量份。
聚乙二醇优选地以约1至40mg/ml的浓度包含在注射剂中,更优选为约5至40mg/ml,进一步优选约10至40mg/ml,更进一步优选为约20至40mg/ml。每100重量份的化合物(i)或其盐,聚乙二醇的量优选为1至40重量份,更优选为5至40重量份,进一步优选为10至40重量份,更进一步优选为20至40重量份。
聚氧乙烯脱水山梨醇脂肪酸酯优选地以约0.01至10mg/ml的浓度包含在注射剂中,更优选约0.1至5mg/ml,进一步优选为约0.1至1mg/ml,更进一步优选为约0.2至0.5mg/ml。每100重量份的化合物(ⅰ)或其盐,聚氧乙烯脱水山梨醇脂肪酸酯的量优选为0.01至10重量份,更优选为0.1至5重量份,进一步优选为0.1至1重量份,更进一步优选为0.2至0.5重量份。
苯甲酸苄酯优选地以约0.1至10mg/ml的浓度包含在注射剂中,更优选为约0.5至5mg/ml,进一步优选为约0.5至3mg/ml。每100重量份的化合物(i)或其盐,苯甲酸苄基酯的量优选为0.1至10重量份,更优选为0.5至5重量份,进一步优选为0.5至3重量份。
本发明中所用的术语“100重量份的化合物(i)或其盐”是指100重量份的化合物(i)的量,其是通过将注射剂中含有的化合物(ⅰ)或其盐的量转换为化合物(ⅰ)的量而得到。
化合物(ⅰ)的盐没有特别的限制,只要它是药学上可接受的盐。实例包括碱金属盐(例如,钠盐和钾盐);碱土金属盐(例如,钙盐和镁盐)和类似的金属盐;铵盐;碱金属碳酸盐(例如,碳酸锂、碳酸钾、碳酸钠和碳酸铯);碱金属碳酸氢盐(例如,碳酸氢锂、碳酸氢钠和碳酸氢钾);碱金属氢氧化物(例如,氢氧化锂、氢氧化钠、氢氧化钾和氢氧化铯)和类似的无机碱的盐;三(低级)烷基胺(例如,三甲胺、三乙胺和n-乙基二异丙胺),吡啶,喹啉,哌啶,咪唑,甲基吡啶,二甲基氨基吡啶,二甲基苯胺,n-(低级)烷基-吗啉(例如,n-甲基吗啉),1,5-二氮杂双环[4.3.0]壬烯-5(dbn),1,8-二氮杂双环[5.4.0]十一碳烯-7(dbu),1,4-二氮杂双环[2.2.2]辛烷(dabco),以及类似的有机碱的盐;盐酸盐,氢溴酸盐,氢碘酸盐,硫酸盐,硝酸盐,磷酸盐,以及类似的无机酸的盐;以及甲酸盐,乙酸盐,丙酸盐,草酸盐,丙二酸盐,琥珀酸盐,富马酸盐,马来酸盐,乳酸盐,苹果酸盐,柠檬酸盐,酒石酸盐,碳酸盐,苦味酸盐,甲磺酸盐,乙磺酸盐,对甲苯磺酸盐,谷氨酸盐,双羟萘酸盐和类似的有机酸的盐。本发明中使用的术语“(低级)烷基”是指具有1至6个碳原子的烷基。
除非另有规定,“化合物(i)或其盐”包括化合物(i)或其盐的脱水物,化合物(i)或其盐的溶剂合物(例如水合物,优选为二水合物),这样的脱水物和溶剂合物的各种结晶形式,以及它们的混合物。“化合物(ⅰ)或其盐”优选化合物(i)或其盐的脱水物,或者化合物(i)或其盐的水合物,更优选地为化合物(i)或其盐的水合物,甚至更优选的是化合物(i)或其盐的二水合物。用语“化合物(i)或其盐的脱水物”是指化合物(i)的脱水物或化合物(i)的盐的脱水物。用语“化合物(i)或其盐的溶剂合物(例如水合物)”是指化合物(i)的溶剂合物(例如,水合物)或化合物(i)的盐的溶剂合物(例如,水合物)。
化合物(ⅰ)或其盐可以单独使用或两种以上组合(例如,作为混合物)使用。
例如,化合物(i)或其盐的脱水物可以通过使用在jp2006-316052a的实施例1、42至47中公开的方法得到,其公开内容在此通过引用并入本发明中。化合物(i)或其盐的水合物的优选的实例是如上所述的二水合物。例如,二水合物可以通过使用如下方法得到,包括以下步骤:
(1)将酸(优选为选自乙酸和乳酸中的至少一种有机酸)和化合物(i)在醇-水混合溶液(优选乙醇和水的混合物)中混合以制备酸性混合溶液;
(2)冷却上述步骤中得到的溶液;以及
(3)将在步骤(2)中冷却的溶液与碱(例如氢氧化钠或氢氧化钾)混合以调节ph至7以上。
更具体地,例如,化合物(i)的二水合物可通过使用以下的制备方法(a)或(b)生成。
制备方法(a)包括以下步骤:
(a1):在乙醇-水混合溶液中混合乙酸和化合物(i)以制备酸性溶液;
(a2):将步骤(a1)中得到的溶液冷却至4℃以下;以及
(a3):用碱(例如,氢氧化钠或氢氧化钾)调节冷却的溶液的ph至7以上。
制备方法(b)包括以下步骤:
(b1):在乙醇-水混合溶液中混合乳酸和化合物(i)以制备酸性混合溶液;
(b2):将步骤(b1)中得到的溶液冷却至4℃以下;以及
(b3):用碱(例如,氢氧化钠或氢氧化钾)调节冷却的溶液的ph至7以上。
式(i)的苯并噻吩化合物或其盐的二水合物可以通过使用以上所述的步骤(1)至(3)来制备。步骤(1)可以是一个这样的步骤(步骤(i')),其中,醇、水、选自乙酸和乳酸中的至少一种有机酸和化合物(i)混合以制备酸性混合溶液。特别优选地,在步骤(1)中,选自乙酸和乳酸中的至少一种有机酸和式(i)的苯并噻吩化合物的脱水物在乙醇-水混合溶液中混合,以制备酸性溶液。用来作为有机酸的乳酸可以是d型、l型或它们的混合物。
优选地制备在步骤(1)中使用的乙醇-水混合溶液使其包含约95体积%以下的量的乙醇,更优选为约70体积%以下,甚至更优选为约60体积%以下。当溶液包含95体积%以下的量的乙醇时,可以得到化合物(i)的二水合物。尽管在溶液中的乙醇的量的下限没有特别限制,但优选为约20体积%,更优选为约30体积%。
式(i)的苯并噻吩化合物在乙醇-水混合溶液中的浓度优选为约0.1至30wt%,更优选为约0.5至20wt%,甚至更优选为约1至10wt%。本发明所所用的表述“wt%”是指w/w%。当式(i)的苯并噻吩化合物的浓度设定在上述范围内时,式(ⅰ)的苯并噻吩化合物可以完全溶解在乙醇-水混合溶液中,高纯度的二水合物可以通过进行下面描述的后续步骤(步骤(2)和(3))而得到。
在乙醇-水混合溶液中的有机酸的量没有特别限制,只要该体系能够调节至酸性条件。例如,在乙醇-水混合溶液中,有机酸的含量优选为约0.1至20wt%,更优选为约0.3至10wt%,甚至更优选为约0.5至5wt%,。
有机酸的量没有特别限制,只要该体系能够调节至酸性条件。例如,基于100重量份的式(i)的苯并噻吩化合物,有机酸的含量优选为约5至100重量份,更优选为约20至80重量份。
在步骤(1)中制备溶液的温度没有特别限制,只要满足以下条件:式(i)的苯并噻吩化合物溶解在包含上述有机酸和乙醇-水混合溶液的液体中;乙醇、水或有机酸未蒸发;以及式(ⅰ)的苯并噻吩化合物不分解。具体而言,所述温度优选为约50至120℃,更优选为约70至100℃。可以使用回流温度(约80℃)。步骤(2)是冷却步骤(1)中得到的溶液的步骤。
冷却温度为5℃以下,优选为约0℃以下,更优选为约-2℃以下。当在随后的步骤中用碱调节溶液的ph值时,产生热。因此,当冷却温度高于5℃时,式(i)的苯并噻吩化合物或其盐的二水合物的产量倾向于不足。在步骤(2)中的冷却温度的下限没有特别的限制。然而,鉴于温度必须在随后的步骤中提高并且可以将水冷冻的事实,冷却温度的下限优选为约-20℃,更优选为约-10℃。
步骤(3)是将在步骤(2)中冷却的溶液与碱混合以调节ph至7以上的步骤。所述碱的实例包括氢氧化钠、氢氧化钾等。
为了将在步骤(2)中冷却的溶液与碱混合,可以使用预先制备的碱水溶液。例如,碱水溶液的浓度为约0.1至25wt%,更优选为约0.5至10wt%。
为了避免如上所述通过碱(水溶液)的加入体系中的混合溶液的温度的急剧上升,碱(水溶液)优选预冷却。碱(水溶液)的温度优选为约-5至15℃,更优选为约-2到5℃。
碱的用量没有特别限制,只要在体系中的溶液可以调节至ph为7以上。例如,加入碱的量优选为步骤(1)中加入溶液中的每重量份的有机酸中约0.3至10重量份,更优选为约0.5至3重量份。
在步骤(3)中,用碱调节溶液的ph至7以上,更优选为约7.5以上,进一步优选为约8以上。当ph小于7时,式(i)的苯并噻吩化合物或其盐的二水合物的产量倾向于不足。虽然ph的上限没有特别的限制,但考虑到有助于洗涤式(i)的苯并噻吩化合物的沉淀的二水合物,形成苯并噻吩化合物的盐等,例如ph优选为约12,更优选的ph为约10。
通过进行步骤(1)至(3),式(i)的苯并噻吩化合物或其盐的二水合物析出。
析出的式(i)的苯并噻吩化合物或其盐的沉淀的二水合物通过使用已知的方法分离为固相和液相,并通过用水洗涤而纯化。
优选地,所得到的式(i)的苯并噻吩化合物的二水合物加热至约10℃以上,更优选为约10至50℃。
通过使用上述制备方法得到的式(ⅰ)的苯并噻吩化合物的二水合物的物理化学性质如下所示。
x射线粉末衍射
通过单色器使用由
衍射角(2θ)
8.1°
8.9°
15.1°
15.6°
24.4°
如图2所示,除了上述的峰,本发明的式(i)的苯并噻吩化合物的二水合物在以下衍射角(2θ)处具有峰。
衍射角(2θ)
11.6°、12.2°、14.0°、16.3°、18.1°、18.4°、18.9°、19.5°、20.5°、21.5°、22.6°、23.3°、25.0°、26.1°、26.4°、27.1°、28.1°、28.5°、28.9°、29.8°、30.4°、30.7°、31.6°、32.9°、33.9°、34.4°、35.2°、36.0°、36.7°、37.4°、38.3°。
虽然根据测量仪器、测量条件等,上述的衍射角(2θ)可以含有-0.2°至+0.2°的误差,但是这样的误差水平是在本发明可接受的范围内。
红外吸收测量
使用利用溴化钾压片法测定的红外吸收光谱鉴别式(i)的苯并噻吩化合物的二水合物。在红外吸收光谱中,式(i)的苯并噻吩化合物的二水合物具有如图3所示的光谱,且在下列波数(cm-1)具有峰:
波数
3509cm-1
2934cm-1
2812cm-1
1651cm-1
1626cm-1
1447cm-1
1223cm-1
839cm-1
除了上述的峰,本发明的式(i)的苯并噻吩化合物的二水合物在图3所示的波数处具有峰。
虽然根据测量仪器、测量条件等,所述波数(cm-1)可以含有-0.5至+0.5cm-1的误差,但是这样的误差水平是在本发明可接受的范围内。
式(i)的苯并噻吩化合物的二水合物通过使用拉曼光谱鉴别。所述二水合物具有图4中所示的拉曼光谱,且在下列波数(cm-1)附近具有峰:
波数
1497cm-1
1376cm-1
1323cm-1
1311cm-1
1287cm-1
1223cm-1
781cm-1
除了上述的峰,二水合物在图4中所示的下列波数附近具有峰:
波数
1656cm-1、1613cm-1、1563cm-1、1512cm-1、1468cm-1、1446cm-1、1241cm-1、1203cm-1、1145cm-1、1096cm-1、1070cm-1、971cm-1、822cm-1
含水量
式(i)的苯并噻吩化合物的二水合物中含水量为6.5至8.8wt%,更具体地为7.3至8.1wt%。水含量是用卡尔·费休(karlfischer)法测定的。
1h-nmr测定
根据通过1h-nmr光谱法测得的峰测定式(i)的苯并噻吩化合物的二水合物。式(i)的苯并噻吩化合物的二水合物具有图1所示的1h-nmr光谱,且在以下制备实施例1中测得的1h-nmr光谱中具有质子峰。
基于注射剂的总重量,注射剂优选包含化合物(i)或其盐的比例为约0.1至40wt%,更优选为约1至20wt%,甚至更优选为约5至15wt%。也就是说,基于注射剂的总重量,存在于注射剂中的化合物(ⅰ)或其盐的量优选为约0.1%至40%(w/v),更优选为约1至20%(w/v),甚至更优选为约2至15%(w/v),还更优选为约5至15%(w/v),特别优选为约5至11%(w/v)。更具体地,例如,注射剂优选包含化合物(i)或其盐浓度为约1至400mg/ml,更优选为约10至200mg/ml,甚至更优选为约20至150mg/ml,还更优选为约50至110mg/ml。
在本发明的注射剂中的化合物(i)或其盐的比例和量是基于化合物(i)的比例和量。
在本发明的包含相对高的浓度(具体地,200mg/ml或更高)的化合物(i)或其盐的注射剂的生产中,由于其高的粘度(由于气泡滞留增加的粘度),可能难以处理注射剂。在这样的情况下,优选在生产过程中添加脱泡步骤。还优选使用抑制粘度的悬浮剂,或者进一步使用疏水小瓶(特别是氟涂覆的疏水小瓶)。使用疏水小瓶可以提高处理性并减少起泡。
注射剂中的化合物(i)或其盐的量优选为约1至400mg,更优选为约10至200mg,甚至更优选为约50至110mg。
具有期望的初级颗粒平均粒径的化合物(i)或其盐的散装粉末可以通过使用湿研磨法制备,例如使用介质的湿式球磨或不使用介质的湿磨(例如manton-gaulin均化器),或者通过使用干式研磨方法(例如喷射研磨)制备。也可以使用在液氮中或冷冻下的冻结研磨方法。
湿式研磨方法优选采用湿式球磨。当所希望的化合物(i)或其盐的初级颗粒的平均粒径大于约1μm时,初级悬浮液(包含化合物(i)或其盐与载体的混合物)以约5~15l/hr、优选约8至12l/hr、更优选约10l/hr单次(单程)通过湿式球磨机,以降低初级颗粒的平均粒径至所需范围(例如约1至5μm)。
除了球磨机(例如dyno研磨机),也可以使用其它低能量研磨机(例如辊式研磨机)和高能量研磨机。可用的高能量研磨机的实例包括netzsch研磨机、dc研磨机和行星式研磨机。
可以使用的用来减小颗粒尺寸的其他技术包括无菌控制的结晶、高剪切均化、高压均质化和微流化。
本发明的注射剂可以稳定地包含上述的具有特定的平均次级颗粒直径的化合物(i)或其盐的次级颗粒。
对于包含化合物(i)或其盐作为活性成分的注射剂,与包含初级颗粒的形式的相同的活性成分的注射剂相比,包含具有前述特定的次级颗粒直径的次级颗粒的形式的该活性成分的注射剂在给药后显示出更好的持续释放性能(更具体地,没有观察到血药浓度的过度增加,药物效力的持续性是同等的或更好的)。
此外,包含具有前述特定平均次级颗粒直径的化合物(i)或其盐的次级颗粒的本发明的注射剂具有以下性能:当静置很长一段时间时,次级颗粒析出但沉淀物不会固结,并在简单的操作(例如轻轻搅拌或用手轻微抖动)下,次级颗粒很容易悬浮并恢复为悬浮液。因此,本发明的注射剂可以很容易地从经过长期贮存所形成的沉淀物恢复到悬浮液,且恢复的悬浮液可以更好地注射到患者体内。
当静置后发生沉淀时,液体表面的高度限定为1,沉淀高度(rf值)优选为0.5以上,更优选为0.6以上,进一步优选为0.7以上,更进一步优选为0.8以上。注射剂充分搅拌并在室温下静置至少五天后测定rf值。较大的rf值被认为表明对于沉淀的颗粒处于非常密集的状态是更加困难的。因此,具有较大rf值的药物制剂最有可能具有防止硬饼形成的高效果。
本发明的注射剂优选具有接近1的相对的渗透压。更具体地,注射剂优选具有1至2的相对渗透压,更优选为1至1.5,甚至更优选为1至1.2,甚至进一步优选为1至1.1。
除了化合物(i)或其盐,包含本发明的化合物(i)或其盐的注射剂优选包含化合物(i)或其盐的载体和注射用水。
化合物(i)或其盐的载体的实例包括颗粒粘合剂、分散剂(悬浮剂)、等渗剂、稳定剂、缓冲剂、ph调节剂、溶剂等。特别是,如上所述,由于包含在本发明的注射剂中的特定的颗粒粘合剂,化合物(i)或其盐聚集以形成次级颗粒,注射剂可以有利地以稳定的方式包含次级颗粒。因此,使用特定的颗粒粘合剂是重要的。只要对本发明的效果没有不利的影响,可以适当地添加其他载体。
分散剂(悬浮剂)的实例包括羧甲基纤维素钠、羟丙基纤维素、羧甲基纤维素、羟丙基乙基纤维素、羟丙基甲基纤维素和carbopol934(注册商标)(unioncarbide公司生产)、氯化十六烷基吡啶、明胶、酪蛋白、卵磷脂(磷脂)、葡聚糖、甘油、阿拉伯胶(gumacacia)、胆固醇、黄蓍胶、硬脂酸、苯扎氯铵、硬脂酸钙、单硬脂酸甘油酯、鲸蜡硬脂醇、聚西托醇乳化蜡、脱水山梨醇酯、聚氧乙烯烷基醚(例如,聚乙二醇醚(如聚西托醇1000))、聚氧乙烯蓖麻油衍生物、十二烷基三甲基溴化铵、聚氧乙烯硬脂酸酯、二氧化硅胶体、磷酸酯、十二烷基硫酸钠、羧甲基纤维素钙、羟丙基纤维素(例如,hpc、hpc-sl和hpc-l)、甲基纤维素、羟乙基纤维素、羟丙基纤维素、羟丙基甲基纤维素邻苯二甲酸酯、非结晶性纤维素、硅酸镁铝、三乙醇胺、聚乙烯醇(pva)、4-(1,1,3,3-四甲基丁基)-苯酚与环氧乙烷和甲醛的聚合物(也称为泰洛沙泊(tyloxapol)、superione和曲拉通(triton));向乙二胺中连续加入环氧丙烷和环氧乙烷而衍生的四官能嵌段共聚物(poloxamines)(例如,tetronic908(注册商标),也称为poloxamine908(注册商标)(由basfwyandotte公司生产,新泽西州帕西帕尼));带电荷的磷脂(例如,二肉豆蔻酰磷脂酰甘油)、二辛基磺基琥珀酸酯(doss);tetronic1508(注册商标)(t-1508)(由basfwyandotte公司制造)、磺基琥珀酸钠的二烷基酯类(例如aerosolot(注册商标),它是磺基琥珀酸钠的二辛酯(由americancyanamid公司制造));duponolp(注册商标),其是十二烷基硫酸钠(由dupont制造);tritonx-200(注册商标),其是一种烷基芳基聚醚磺酸酯(由rohm和haas制造);crodestasf-110(注册商标),其是蔗糖硬脂酸酯和蔗糖二硬脂酸酯的混合物(由croda公司制造);对异壬基苯氧基聚-(缩水甘油),也称为olin-10g(注册商标)或surfactant10-g(注册商标)(由olinchemicals,制造,康涅狄格州斯坦福德市);crodestassl-40(由croda公司制造);以及sa9ohco,其是c18h37ch2(con(ch3))-ch2(choh)4(ch2oh)2(由eastmankodak公司制造);癸酰基-n-甲基葡糖酰胺;正癸基-β-d-吡喃葡糖苷;正癸基-β-d-吡喃麦芽糖苷;正十二烷基-β-d-吡喃葡糖苷;正十二烷基-β-d-麦芽糖苷;庚酰基-n-甲基葡糖酰胺;正庚基-β-d-吡喃葡糖苷;正庚基-β-d-硫代葡萄糖苷;正己基-β-d-吡喃葡糖苷;壬酰基-n-甲基葡糖酰胺;正壬基-β-d-吡喃葡糖苷;辛酰基-n-甲基葡糖酰胺;正辛基-β-d-吡喃葡糖苷;辛基-β-d-硫代吡喃葡糖苷、甲硫氨酸(其可以是任何的d-型、l-型和外消旋型(dl型))、阿拉伯胶(gumarabic)、聚乙烯吡咯烷酮等。这些分散剂可单独使用或以两种以上组合使用。
这些分散剂中的大多数是已知的药用辅料,在由美国医药协会和英国药学会联合出版的药用辅料手册(医药出版社,1986)中有详细的描述。也可使用该出版物中所描述的药用辅料。也可以使用市售的分散剂,或可通过使用本领域公知的技术制备的分散剂。
基于注射剂的总体积,注射剂中的分散剂的浓度优选为约0.1至45mg/ml,更优选为约0.5至40mg/ml,甚至更优选为约0.6至35mg/ml。注射剂中的分散剂的比例优选为约0.01至10wt%,更优选为约0.05至8wt%,甚至更优选为约0.06至5wt%。基于100重量份的化合物(i)或其盐,分散剂的量优选为约0.01至45重量份,更优选为约0.1至40重量份,甚至更优选为约0.5至35重量份。
分散剂也可具有其它添加剂的功能。在这种情况下,分散剂的浓度、比例和量为这些所使用的添加剂的总的浓度、比例和量。
等渗剂的实例包括非电解质渗透压调节剂,例如甘露糖醇、蔗糖、麦芽糖、木糖醇、葡萄糖、淀粉、山梨糖醇、甘油和丙二醇;以及电解质渗透压调节剂,例如氯化钠、氯化钾、硫酸钠和氯化镁。这些等渗剂可以单独使用或两种以上组合使用。
当油性颗粒粘合剂用作颗粒粘合剂时,优选使用山梨糖醇。当水性颗粒粘合剂用作粘合剂时,优选使用氯化钠。
糖或糖醇(例如甘露糖醇、海藻糖、蔗糖、麦芽糖、木糖醇和山梨糖醇)是优选的,因为可以期待它们在冷冻保存期间稳定所制备的注射剂。
注射剂中的等渗剂的浓度优选为约0.1至70mg/ml,更优选为约0.5至60mg/ml,甚至更优选为约1至55mg/ml。注射剂中的等渗剂的比例优选为约0.05至10wt%,更优选为约0.1至7wt%,甚至更优选为约0.2至5wt%。基于100重量份化合物(i)或其盐,等渗剂的量优选为约1至70重量份,更优选为约2至60重量份,甚至更优选为约4至55重量份。
等渗剂也可具有其它添加剂的功能。在这种情况下,等渗剂的浓度、比例和量为这些所使用的添加剂的总的浓度、比例和量。
稳定剂的实例包括抗坏血酸、抗坏血酸衍生物(例如异抗坏血酸和抗坏血酸钠)、甲硫氨酸等。甲硫氨酸可以是任何的d型、l型和外消旋型(dl型)。
注射剂中稳定剂的浓度优选为约0.1至5mg/ml,更优选为约0.5至4mg/ml,甚至更优选为约1至3mg/ml。注射剂中稳定剂的比例优选为约0.01至5wt%,更优选为约0.05至2wt%,甚至更优选为约0.1至0.5wt%。基于100重量份化合物(i)或其盐,稳定剂的量优选为约0.1至5重量份,更优选为约0.5至4重量份,甚至更优选为约0.1至3重量份。
稳定剂也可具有其它添加剂的功能。在这种情况下,稳定剂的浓度、比例和量为这些所使用的添加剂的总的浓度、比例和量。
缓冲剂的实例包括磷酸钠、磷酸钾、三羟甲基氨基甲烷缓冲液(trisbuffer)、磷酸氢钠、磷酸二氢钠、磷酸三钠以及它们的水合物。水合物的具体实例包括磷酸二氢钠二水合物和磷酸氢二钠十二水合物。这些缓冲剂可单独使用或以两种以上组合使用。
缓冲剂的比例和量是这样的:包含化合物(ⅰ)或其盐的注射剂可以调节到下述的ph值(优选的ph值为约4至9,更优选为约4.5至8.5,甚至更优选为约5至8)。一般地,注射剂中的缓冲剂的比例可以根据缓冲剂的种类等适当地改变。例如,基于注射剂的总重量,优选为约0.01至10mg/ml,更优选为约0.1至7mg/ml,甚至更优选为约0.2至5mg/ml。注射剂中的缓冲剂的浓度优选为约0.001至5wt%,更优选为约0.01至1wt%,甚至更优选为约0.02至0.8wt%。注射剂中的缓冲剂的量也可以根据缓冲剂的类型等适当地改变。例如,基于100重量份的化合物(i)或其盐,缓冲剂的量优选为约0.01至10重量份,更优选为约0.1至5重量份,甚至更优选为约0.2至3重量份。
当注射剂具有高的ph并调节到较低的ph时,可以使用酸性ph调节剂,例如盐酸、乙酸或柠檬酸。
当注射剂具有低的ph值并调节到较高的ph时,可以使用碱性ph调节剂,例如氢氧化钠、氢氧化钾、碳酸钙、氧化镁或氢氧化镁。优选使用氢氧化钠。
这样的ph调节剂可以单独使用或以两种以上组合使用。
ph调节剂的比例和量是这样的:包含化合物(ⅰ)或其盐的注射剂可以调节到下述的ph值(优选的ph值为约4至9,更优选为约4.5至8.5,甚至更优选为约5至8)。为了达到所需的ph值,适当选择酸或碱。
通过在注射用水中悬浮化合物(i)或其盐和用于化合物(ⅰ)或其盐的载体得到悬浮液。虽然没有特别的限制,但优选的是,所述载体溶解于注射用水中以制备注射溶液,化合物(ⅰ)或其盐悬浮于注射溶液中。
灭菌水(纯水)作为注射用水。注射用水的量优选为每毫升的注射剂中约0.7至1.0ml,更优选为约0.8至0.9ml。
根据本发明的注射剂,所述悬浮液可以按原样用作注射剂。
所得到的注射剂的ph优选为约4至9,更优选为约4.5至8.5,甚至更优选为约5至8。当其ph值设定为约5以上时,更好地制备稳定的悬浮液,其中,较小量的药物溶解于注射溶剂中。当其ph值设定为约8以下时,可以更好地制备通过其减少刺激的稳定的悬浮液。
用于本发明的注射剂中的化合物(ⅰ)或其盐和用于化合物(ⅰ)或其盐的载体可以是冻干产品或粉末混合物。例如,这种冻干产品可以通过将化合物(ⅰ)或其盐和用于化合物(ⅰ)或其盐的载体悬浮于水中,然后冷冻干燥该悬浮液来得到。化合物(ⅰ)或其盐和用于化合物(ⅰ)或其盐的载体在冻干产品或粉末混合物中的比例可以通过随后加入注射用水适当地设定至上述比例。
冻干产品或粉末混合物在使用时还可以加入注射用水配制成注射剂。
制备本发明的注射剂的方法没有特别的限制。例如,当水性颗粒粘合剂用作颗粒粘合剂时,可以通过使用包括以下步骤的方法来制备注射剂:在注射用水中溶解载体来制备注射溶液,并进一步将化合物(i)或其盐悬浮于所获得的注射溶液中。
当油性颗粒粘合剂用作颗粒粘合剂时,例如,可以通过使用包括以下步骤的方法来制备注射剂:在注射用水中溶解载体,并添加通过灭菌亲油过滤器过滤的油性颗粒粘合剂,以得到注射溶液,进一步在所获得的注射溶液中掺入化合物(i)或其盐,搅拌并加热所得的混合物。
根据本发明的包含化合物(i)或其盐的注射剂几乎不产生患者依从性的问题,并且可以更好地给药以递送药物。
当生产根据本发明的包含化合物(i)或其盐的注射剂时,特别优选的是全部的生产步骤是无菌的。也就是说,优选地是无菌的化合物(i)或其盐以及无菌载体在无菌条件下混合,以形成无菌的悬浮液。
例如,用于获得化合物(i)或其盐的无菌散装粉末的方法包括下列方法:通过电子束或γ射线的电离照射、无菌结晶、uv照射、高压灭菌等方法灭菌;用环氧乙烷或过氧化氢气体灭菌;悬浮颗粒过滤除菌;和净工作台内的无菌技术。
载体(颗粒粘合剂、分散剂(悬浮剂)、等渗剂、稳定剂、缓冲剂、ph调节剂、溶剂)和水优选通过高压灭菌、过滤等方法在制备后进行灭菌。
根据本发明的包含化合物(i)或其盐的制剂可以优选用于治疗精神分裂症和相关病症(例如双相型障碍和痴呆)的人类患者。例如,本发明的注射剂的优选剂量为单次注射或多次注射的包含化合物(ⅰ)或其盐的浓度为每毫升制剂中约50至150mg的制剂,可以每月一次。虽然注射剂优选肌肉给药,但是皮下注射也是可以接受的。
由于将化合物(ⅰ)或其盐被释放到身体内的持续释放的期间长,本发明的注射剂用作长效药物(持续释放注射剂)。此外,本发明的注射剂是刺激性较小,并且还在稳定性方面是优异的。由于缺乏注射性导致增加的刺激,良好的注射性是优选的。
根据本发明的注射剂,可以施用治疗量的上述的持续释放注射剂给需要治疗的患者,可以治疗中枢神经系统疾病。
由包含苯并噻吩化合物的二水合物的本发明的注射剂治疗的中枢神经系统疾病的具体实例包括精神分裂症(例如难治性、顽固性和慢性精神分裂症)、情绪障碍、精神障碍、心境障碍、双相型障碍(例如双相i型和双相ii型障碍)、躁狂症、抑郁症、内因性抑郁症、重性抑郁症、忧郁性和难治性抑郁症、心境恶劣障碍、循环型情感障碍、焦虑症(例如,恐慌发作、恐慌障碍、广场恐怖症、社交恐怖症、强迫症、创伤后应激障碍、泛化性焦虑障碍和急性应激障碍)、躯体形式障碍(例如癔症、躯体化障碍、转换障碍、疼痛障碍和疑病症)、造作性障碍、分离性障碍、性功能障碍(例如性机能障碍、性欲障碍、性唤起障碍和勃起功能障碍)、进食障碍(例如神经性厌食症和神经性贪食症)、睡眠障碍、适应障碍、物质相关性障碍(例如酒精滥用、酒精中毒和药物成瘾、安非他明成瘾和麻醉瘾)、快感缺乏(例如医源性快感缺乏、心灵上或精神上原因的快感缺乏、与抑郁症相关的快感缺乏、与精神分裂症有关的快感缺失)、谵妄、认知损害、与阿尔茨海默氏病、帕金森氏症和其他神经变性疾病相关的认知损害、由认知损害引起的bpsd(行为和心理痴呆症)、精神分裂症中的认知损害、难治性、顽固性或慢性精神分裂症引起的认知损害、呕吐、晕动病、肥胖、偏头痛、疼痛、精神发育迟缓、孤独性障碍(自闭症)、杜尔雷特综合症(tourette'ssyndrome)、抽动障碍、注意缺陷多动障碍、行为紊乱、唐氏综合征等;以及各种其它中枢神经系统疾病。本发明的药物制剂是用于这些中枢神经系统疾病的改善非常有效。特别地,本发明的药物制剂可有效地治疗或预防精神分裂症、双相型障碍或抑郁症的复发。
本发明的注射剂的特别优选的颗粒粘合剂的一种实例包括:(i)氯化钠,和(ⅱ)选自聚氧乙烯脱水山梨醇脂肪酸酯、环氧乙烷和环氧丙烷的嵌段共聚物和聚乙二醇中的至少一种。其中,组分(ii)优选选自聚氧乙烯脱水山梨醇脂肪酸酯和聚乙二醇中的至少一种。特别地,在使用化合物(i)的二水合物的注射剂中,优选使用颗粒粘合剂。
通过包含化合物(ⅰ)或其盐,或化合物(ⅰ)或其盐和氯化钠,化合物(ⅰ)或其盐可以理想地形成次级颗粒;然而,注射性不是优异的。如上所述化合物(ii)提高了注射性;因此,优选(ⅰ)氯化钠和组分(ii)组合使用作为颗粒粘合剂。
如上所述,本发明的注射剂是这样的:当放置很长一段时间时,化合物(ⅰ)或其盐的次级颗粒析出,但该沉淀物不固结;通过简单的操作(例如轻轻搅拌或用手轻微晃动),次级颗粒很容易悬浮,并恢复到悬浮液。因此,特别是在临床实践中,预先填充本发明的注射剂的预充式注射器是可用的。换言之,因为甚至当预充式注射器由于放置一段时间出现沉淀时,通过用手摇动等很容易地恢复为悬浮液,因此预充有注射剂的注射器具有优良的贮存稳定性且简便。本发明的范围包括这样的预充式注射器和包含该预充式注射器的试剂盒。
有益效果
本发明提供化合物(ⅰ)或其盐的长效药物给药形式,其可作为持续释放注射剂在至少一周的期间内释放治疗有效量的化合物(i)或其盐。与包含初级颗粒形式的化合物(ⅰ)或其盐的注射剂相比,本发明的注射剂给药后显示出优良的持续释放性能。(更具体地,没有观察到血液浓度过度增加,药物疗效的持续性是同等的或更好的)。此外,即使当化合物(i)或其盐的次级颗粒放置很长一段时间后已经析出,该沉淀物不固结,由于次级颗粒通过如轻轻搅拌或用手摇动的简单操作很容易地悬浮,其很容易恢复为悬浮液。因此,本发明的注射剂可以很容易地从经过长期储存(即,五天或更多)后形成的沉淀物恢复为悬浮液,且恢复的悬浮液可以按原样更好地给患者注射。
附图说明
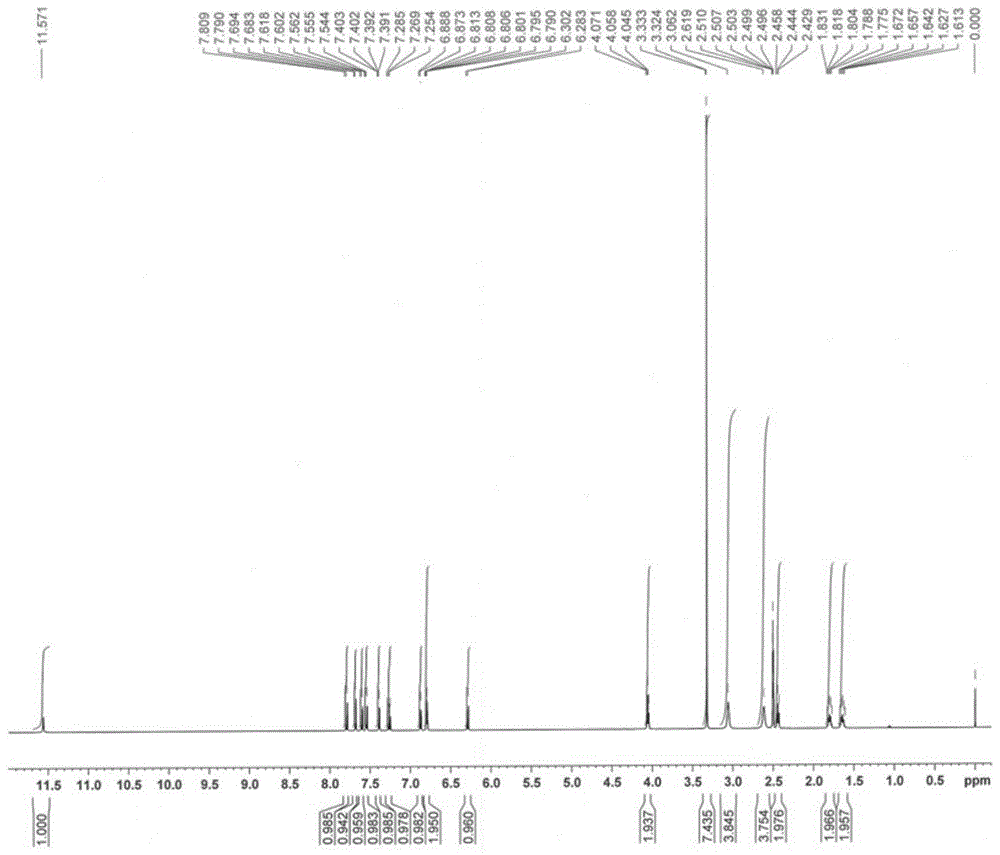
图1示出在制备实施例1中合成的由式(i)表示的苯并噻吩化合物的1h-nmr谱。
图2示出在制备实施例1中合成的由式(i)表示的苯并噻吩化合物的二水合物的x射线粉末衍射图案。
图3示出在制备实施例1中合成的由式(i)表示的苯并噻吩化合物的二水合物的红外吸收光谱。
图4示出在制备实施例1中合成的由式(i)表示的苯并噻吩化合物的二水合物的拉曼光谱。
图5示出在制备实施例2中合成的由式(i)表示的苯并噻吩化合物的1h-nmr谱。
图6示出在制备实施例2中合成的由式(i)表示的苯并噻吩化合物的二水合物的x射线粉末衍射图案。
图7示出在制备实施例2中合成的由式(i)表示的苯并噻吩化合物的二水合物的红外吸收光谱。
图8示出在制备实施例2中合成的由式(i)表示的苯并噻吩化合物的二水合物的拉曼光谱。
图9示出在制备实施例3中合成的由式(i)表示的苯并噻吩化合物的二水合物的拉曼光谱。
图10示出在制备实施例4中合成的由式(i)表示的苯并噻吩化合物的脱水物的1h-nmr谱。
图11示出在制备实施例4中合成的苯并噻吩化合物的脱水物的x射线粉末衍射图案。
图12示出在制备实施例4中合成的苯并噻吩化合物的脱水物的红外吸收光谱。
图13是表示在试验实施例1中将包含实施例1和2的化合物(i)作为活性成分的注射剂施加给大鼠而得到的平均血药浓度-时间曲线的图。
图14是表示在试验实施例2中将包含实施例3和4的化合物(i)作为活性成分的注射剂施加给大鼠而得到的平均血药浓度-时间曲线的图。
图15是表示在试验实施例3中将实施例a、实施例b、比较例a和比较例b的注射剂施加给大鼠而得到的平均血药浓度-时间曲线的图。
图16是表示在试验实施例4中将实施例c至f的注射剂施加给大鼠而得到的平均血药浓度-时间曲线的图。
图17为表示在试验例5中测量的每个实施例的注射剂的rf值的图。
具体实施方式
实施例
参照实施例和试验实施例对本发明进行进一步的详细说明。然而,本发明的范围并不限于这些实施例。
制备实施例1:化合物(i)的二水合物的合成
将甲醇(149l)、7-羟基-1h-喹啉-2-酮(14.87kg)和氢氧化钾(6.21kg)混合于反应容器中,搅拌所得的混合物。溶解后,向其中加入1-溴-4-氯丁烷(47.46kg),将所得混合物回流搅拌7小时。此后,将混合物在10℃下搅拌1小时。将析出的晶体离心分离,并用甲醇(15l)洗涤。收集湿晶体并置于罐中。向其中加入水(149l),随后在室温下搅拌。离心后,将用水(30l)洗涤产物。收集湿晶体并置于罐中。加入甲醇(74l)后,将该混合物回流搅拌1小时,冷却至10℃,然后搅拌。将析出的晶体离心分离,并用甲醇(15l)洗涤。在60℃下干燥分离出的晶体以得到7-(4-氯丁氧基)-1h-喹啉-2-酮(15.07kg)。
此后,将水(20l)、碳酸钾(1.84kg)、1-苯并[b]噻吩-4-基-哌嗪盐酸盐(3.12kg)和乙醇(8l)混合于反应容器中,然后在50℃下搅拌。将7-(4-氯丁氧基)-1h-喹啉-2-酮(2.80kg)加入到混合物中,并回流搅拌9小时。在常压下将溶剂浓缩至8l后,在90℃下搅拌混合物1小时,然后冷却至9℃。将析出的晶体离心分离,然后依次用水(8l)和乙醇(6l)洗涤。在60℃下干燥分离出的晶体,以得到粗产物。将粗产物(4.82kg)和乙醇(96l)混合于反应容器中,并将乙酸(4.8l)加入到反应容器中。回流搅拌混合物1小时以溶解粗产物。放入盐酸(1.29kg)后,将混合物冷却至10℃。将混合物再次加热,回流1小时,冷却至7℃。将析出的晶体离心分离,用乙醇(4.8l)洗涤。在60℃下干燥分离出的晶体以得到7-[4-(4-苯并[b]噻吩-4-基-哌嗪-1-基)丁氧基]-1h-喹啉-2-酮盐酸盐(5.09kg)。将所得的7-(4-(4-苯并[b]噻吩-4-基-哌嗪-1-基)丁氧基]-1h-喹啉-2-酮盐酸盐(5.00kg)、乙醇(45l)和水(30l)混合于反应容器中。回流搅拌该混合物以溶解7-(4-(4-苯并[b]噻吩-4-基-哌嗪-1-基)丁氧基]-1h-喹啉-2-酮盐酸盐。向其中加入活性炭(500g)和水(5l),在回流条件下进行30分钟活性炭处理。热过滤后,包含溶解在水(1.5l)中的氢氧化钠(511g)的溶液流入反应容器中,同时在回流条件下搅拌滤液。回流搅拌30分钟后,向其中加入水(10l),将混合物冷却至约40℃。将析出的晶体离心分离,用水(125l)洗涤。在80℃下干燥分离出的晶体,得到7-[4-(4-苯并[b]噻吩-4-基-哌嗪-1-基)丁氧基]-1h-喹啉-2-酮(3.76kg)。
将以上得到的7-(4-(4-苯并[b]噻吩-4-基-哌嗪-1-基)丁氧基]-1h-喹啉-2-酮(3.2kg)、乙醇(64l)、水(74l)和乙酸(1.77kg)混合于反应容器中,以制备一种酸性液体混合物。回流搅拌所述液体混合物以溶解7-(4-(4-苯并[b]噻吩-4-基-哌嗪-1-基)丁氧基]-1h-喹啉-2-酮(回流温度:84℃)。冷却至-5℃后,在30分钟的时间内将以上得到的溶液引入到包含25%的氢氧化钠(5.9kg)和水(54l)的冷却至0℃的溶液中,以制备ph为10的液体混合物。在5℃以下搅拌1小时后,将混合物加热到20至30℃,并进一步搅拌7小时,以进行固-液分离。用水(320l)进行洗涤,直至固体成分中的碱消失(即,直至滤液的ph值达到7)。然后空气干燥固体成分,直至其重量达到恒定(即,直到不再观察到有任何重量的变化),以得到白色固体7-[4-(4-苯并[b]噻吩-4-基-哌嗪-1-基)丁氧基]-1h-喹啉-2-酮二水合物(未磨制,3.21kg)。
图1示出了由上述方法合成的二水合物的1h-nmr谱(dmso-d6,tms)。如图1所示,在1h-nmr谱(dmso-d6,tms)中,观察到峰1.64ppm(tt,j=7.4hz,j=7.4hz,2h),1.80ppm(tt,j=7.0hz,j=7.0hz,2h),2.44ppm(t,j=7.5hz,2h),2.62ppm(br,4h),3.06ppm(br,4h),3.32ppm(s,4h+h2o),4.06ppm(t,j=6.5hz,2h),6.29ppm(d,j=9.5hz,1h),6.80ppm(d,j=2.5hz,1h),6.80ppm(dd,j=2.5hz,j=9.0hz,1h),6.88ppm(d,j=7.5hz,1h),7.27ppm(dd,j=7.8hz,j=7.8hz,1h),7.40ppm(dd,j=0.5hz,j=5.5hz,1h),7.55ppm(d,j=9.0hz,1h),7.61ppm(d,j=8.0hz,1h),7.69ppm(d,j=5.5hz,1h),7.80ppm(d,j=9.5hz,1h),和11.57ppm(s,1h)。
使用x射线衍射仪(d8advance,brukeraxs生产)测定由上述方法合成的二水合物的x射线粉末衍射光谱。图2示出了x射线粉末衍射光谱。如图2所示,在x射线粉末衍射光谱中,在2θ=8.1°、8.9°、15.1°、15.6°、和24.4°观察到衍射峰。除了上面提到的那些,在2θ=11.6°、12.2°、14.0°、16.3°、18.1°、18.4°、18.9°、19.5°、20.5°、21.5°、22.6°、23.3°、25.0°、26.1°、26.4°、27.1°、28.1°、28.5°、28.9°、29.8°、30.4°、30.7°、31.6°、32.9°、33.9°、34.4°、35.2°、36.0°、36.7°、37.4°和38.3°也观察到衍射峰。
测定由上述方法合成的二水合物的ir(kbr)光谱。图3示出ir(kbr)光谱。如图3所示,在ir(kbr)光谱中,在波数3509cm-1、2934cm-1、2812cm-1、1651cm-1、1626cm-1、1447cm-1、1223cm-1和839cm-1附近观察到吸收带。
测定由上述方法合成的二水合物的拉曼光谱。图4示出了拉曼光谱。如图4所示,在拉曼光谱中,在波数1497cm-1、1376cm-1、1323cm-1、1311cm-1、1287cm-1、1223cm-1和781cm-1附近观察到吸收带。
除了上面提到的那些,在波数1656cm-1、1613cm-1、1563cm-1、1512cm-1、1468cm-1、1446cm-1、1241cm-1、1203cm-1、1145cm-1、1096cm-1、1070cm-1、971cm-1和822cm-1附近也观察到吸收。
此外,使用水分测定仪(ca-100,由mitsubishichemicalanalytech株式会社制造)用费歇尔法测定由上述方法合成的二水合物的水含量。结果表明,二水合物具有7.79重量%的水含量。
制备实施例2:精细研磨的二水合物的合成
使用喷射式研磨机研磨在制备实施例1中得到的二水合物晶体(2.73kg)。其中,空气压力设定在5kgf/cm2,并且进料器的旋转速度设定在20rpm。结果,得到精细研磨的7-[4-(4-苯并[b]噻吩-4-基-哌嗪-1-基)丁氧基]-1h-喹啉-2-酮二水合物(2.61kg,95.6%)。
由此得到的二水合物(精细研磨产物)具有5.5μm的平均粒径。使用日机装株式会社(nikkisoco.,ltd.)制造的microtrackhra测定平均粒径。
图5示出了由上述方法合成的二水合物的1h-nmr谱(dmso-d6,tms)。如图5所示,在1h-nmr谱(dmso-d6,tms)中,观察到峰:1.64ppm(tt,j=7.3hz,j=7.3hz,2h),1.80ppm(tt,j=6.9hz,j=6.9hz,2h),2.44ppm(t,j=7.3hz,2h),2.62ppm(br,4h),3.06ppm(br,4h),3.32ppm(s,4h+h2o),4.06ppm(t,j=6.5hz,2h),6.29ppm(d,j=9.5hz,1h),6.80ppm(d,j=2.5hz,1h),6.80ppm(dd,j=2.3hz,j=9.3hz,1h),6.88ppm(d,j=7.5hz,1h),7.27ppm(dd,j=8.0hz,j=8.0hz,1h),7.40ppm(d,j=5.5hz,1h),7.55ppm(d,j=9.5hz,1h),7.61ppm(d,j=8.0hz,1h),7.69ppm(d,j=5.5hz,1h),7.80ppm(d,j=9.5hz,1h),和11.57ppm(s,1h)。
以与在制备实施例1中相同的方式测定由上述方法合成的二水合物的x射线粉末衍射光谱。图6示出了x射线粉末衍射光谱。如图6所示,在x射线粉末衍射光谱中,在2θ=8.2°、8.9°、15.2°、15.7°和24.4°观察到衍射峰。
除了上面提到的那些,在2θ=6.8°、12.2°、14.0°、14.5°、17.4°、18.1°、18.5°、19.0°、19.2°、19.6°、20.3°、20.6°、21.5°、22.7°、23.4°、25.0°、26.1°、27.1°、28.6°、29.0°、30.4°、34.0°、34.5°、35.3°和36.7°也观察到衍射峰。
以与在制备实施例1中相同的方式测定由上述方法合成的二水合物的ir(kbr)光谱。图7示出ir(kbr)光谱。如图7所示,在ir(kbr)光谱中,在波数3507cm-1,2936cm-1,2812cm-1,1651cm-1,1626cm-1,1447cm-1,1223cm-1和839cm-1附近观察到吸收带。
测定由上述方法合成的二水合物的拉曼光谱。图8示出了拉曼光谱。如图8所示,在拉曼光谱中,在波数1496cm-1、1376cm-1、1323cm-1、1311cm-1、1286cm-1、1223cm-1和781cm-1附近观察到吸收带。
除了上面提到的那些,在波数1656cm-1、1614cm-1、1563cm-1、1512cm-1、1467cm-1、1446cm-1、1241cm-1、1203cm-1、1145cm-1、1095cm-1、1069cm-1、971cm-1和822cm-1附近也观察到吸收。
此外,使用水分测定仪(ca-100,由mitsubishichemicalanalytech株式会社制造)用费歇尔法测定由上述方法合成的二水合物的水含量。结果表明,二水合物具有6.74重量%的水含量。
制备实施例3:7-[4-(4-苯并[b]噻吩-4-基-哌嗪-1-基)丁氧基]-1h-喹啉-2-酮水合物的合成
将7-[4-(4-苯并[b]噻吩-4-基-哌嗪-1-基)丁氧基]-1h-喹啉-2-酮(5.0kg)、乙醇(100l)、水(115l)和dl-乳酸(2.29kg)混合,以制备一种酸性液体混合物。回流搅拌所述液体混合物以溶解该7-[4-(4-苯并[b]噻吩-4-基-哌嗪-1-基)丁氧基]-1h-喹啉-2-酮(回流温度:82℃)。冷却至-5℃后,在约15分钟的时间内将上面得到的溶液导入到冷却至1℃的包含氢氧化钠(1.48kg)和水(135l)的溶液中,以制备ph为11的液体混合物。在约2至5℃搅拌3小时后,将混合物加热至45℃,并进一步在45至50℃搅拌2小时,以进行固-液分离。用水(200l)进行洗涤,直至固体成分中的碱消失(即,直至滤液的ph值达到7)。进一步用乙醇(15l)和水(20l)的液体混合物洗涤固体成分。然后在室温下干燥固体成分,直至其重量达到恒定,得到白色固体7-[4-(4-苯并[b]噻吩-4-基-哌嗪-1-基)丁氧基]-1h-喹啉-2-酮二水合物(未磨制,5.11kg)。
由此获得的水合物与制备实施例1中得到相同。
测定由上述方法合成的水合物的拉曼光谱。图9示出了拉曼光谱。如图9所示,在拉曼光谱中,在波数1497cm-1、1376cm-1、1323cm-1、1311cm-1、1287cm-1、1223cm-1和782cm-1附近观察到吸收带。
除了上面提到的那些,在波数1656cm-1、1614cm-1、1563cm-1、1512cm-1、1468cm-1、1446cm-1、1241cm-1、1203cm-1、1145cm-1、1126cm-1、1096cm-1、1070cm-1、972cm-1和822cm-1附近也观察到吸收。
制备实施例4:化合物(i)的脱水物的合成
将制备实施例1中合成的7-(4-(4-苯并[b]噻吩-4-基-哌嗪-1-基)丁氧基]-1h-喹啉-2-酮(700g)、乙醇(14l)和乙酸(1.4l)混合于反应容器中。加热混合物至回流温度(76℃)以溶解7-(4-(4-苯并[b]噻吩-4-基-哌嗪-1-基)丁氧基]-1h-喹啉-2-酮。向其中加入浓盐酸(158ml),然后冷却至10℃,同时搅拌。此后,将混合物再次加热,回流搅拌1小时,然后冷却至10℃以下。抽滤析出的固体,并用乙醇(0.7l)洗涤。然后在60℃空气干燥固体成分,直至其重量达到恒定,以得到白色固体7-[4-(4-苯并[b]噻吩-4-基-哌嗪-1-基)丁氧基]-1h--喹啉-2-酮盐酸盐(814g)。将7-[4-(4-苯并[b]噻吩-4-基-哌嗪-1-基)丁氧基]-1h--喹啉-2-酮盐酸盐(800g)、乙醇(7.2l)和水(4.8l)混合在反应容器中,并且将混合物加热至回流温度(80℃),同时搅拌。进行热过滤后,溶解7-[4-(4-苯并[b]噻吩-4-基-哌嗪-1-基)丁氧基]-1h-喹啉-2-酮盐酸盐。将包含溶解在水(240ml)中的氢氧化钠(81.6g)的溶液引入上面得到的溶液中,并将该混合物回流搅拌30分钟。向混合物中加入水(2.4l),接着冷却至40℃,同时搅拌。将沉淀的固体滤出并用水(16l)洗涤。在80℃下干燥该固体,以得到白色固体7-[4-(4-苯并[b]噻吩-4-基-哌嗪-1-基)丁氧基]-1h-喹啉-2-酮脱水物(637g)。
以与在制备实施例1中相同的方式测定上面得到的脱水物的1h-nmr谱。图10示出了1h-nmr谱(dmso-d6,tms)。如图10所示,在1h-nmr谱(dmso-d6,tms)中,观察到峰:1.63ppm(tt,j=7.3hz,j=7.1hz,2h),1.80ppm(tt,j=7.3hz,j=6.3hz,2h),2.44ppm(t,j=7.1hz,2h),2.61ppm(m,4h),3.05ppm(m,4h),4.05ppm(t,j=6.3hz,2h),6.29ppm(d,j=9.5hz,1h),6.80ppm(d,j=2.5hz,1h),6.80(dd,j=9.4hz,j=2.5hz,1h),6.88ppm(dd,j=7.8hz,0.8hz,1h),7.27ppm(dd,j=7.8hz,j=7.8hz,1h),7.39ppm(dd,j=5.6hz,0.8hz,1h),7.55ppm(d,j=9.4hz,1h),7.61ppm(d,j=7.8hz,1h),7.69ppm(d,j=5.6hz,1h),7.80ppm(d,j=9.5hz,1h)和11.60(s,1h)。
以与在制备实施例1中相同的方式测定上面得到的脱水物的x射线粉末衍射光谱。图11示出了x射线粉末衍射光谱。如图11所示,在x射线粉末衍射光谱中,在2θ=14.4°、19.1°、20.2°、21.3°和23.2°观察到衍射峰。
以与在制备实施例2中相同的方式测定上面得到的脱水物的的ir(kbr)光谱。图12示出ir(kbr)光谱。如图12所示,在ir(kbr)光谱中,7-(4-(4-苯并[b]噻吩-4-基-哌嗪-1-基)丁氧基]-1h-喹啉-2-酮在波数2941cm-1、2818cm-1、1655cm-1、1624cm-1、1449cm-1、1221cm-1和833cm-1附近具有吸收带。
以与在制备实施例2中相同的方式测定由上述方法合成的脱水物的水含量。结果表明,上述得到的脱水物具有0.04重量%的水含量。
注射剂
如下所述的注射剂是通过使用均由上述方法制备的化合物(i)的二水合物(在制备实施例1中得到的二水合物磨成希望的粒径)或化合物(i)的脱水物和以下成分制备而成的。除非另有定义,化合物(i)的二水合物和化合物(i)的脱水物研磨成2-6μm之后使用。使用激光衍射粒度分析仪(sald-3000j或sald-3100,由shimadzucorporation生产)测定粒度。当注射剂包含每1ml制剂108mg化合物(i)的二水合物时,注射剂中包含100mg的化合物(i)。
·聚乙二醇400(macrogol400,由wakopurechemicalindustries生产)
·氯化钠(由nacalaitesque公司生产)
·磷酸二氢钠二水合物(由nacalaitesque公司生产)
·磷酸氢二钠十二水合物(由wakopurechemicalindustries生产)
·聚氧乙烯脱水山梨糖醇单脂肪酸酯(聚山梨醇酯80,由nofcorporation生产)
·dl-甲硫氨酸(由wakopurechemicalindustries生产)
·聚氧乙烯(160)聚氧丙烯(30)甘醇(pluronicf68,由basfjapanltd.生产)
·氢氧化钠(由wakopurechemicalindustries生产)
·山梨糖醇(d(-)-山梨糖醇,由wakopurechemicalindustries生产)
·羧甲基纤维素钠(羧甲基纤维素钠,由herculeschemicalco.,ltd.生产)
·苯甲酸苄酯(由nacalaitesque公司生产)
实施例1:包含含有水性颗粒粘合剂的化合物(i)的脱水物作为活性成分的注射剂的合成
聚乙二醇400(8640mg)、聚氧乙烯(160)聚氧丙烯(30)甘醇(300mg)、氯化钠(12000mg)、dl-甲硫氨酸(750mg)、磷酸二氢钠二水合物(226mg)、磷酸氢二钠十二水合物(176mg)和聚山梨酯80(90mg)作为载体,称重并混合在500ml烧杯中。加入注射用水(240ml)以溶解载体。确认载体完全溶解于注射用水后,在净化工作台(生物净化工作台,mcv-b161f,由biomedix生产)使所得溶液通过聚醚砜(pes)过滤器(milliporeexpressplus高流速,73mm/0.22μm,scgpu11re,由nihonmilliporek.k.生产)。将化合物(i)(30000mg)的脱水物加入到已通过在净化工作台中的过滤器的溶液中,以制成悬浮液。使用已通过pes过滤器的1n或5n氢氧化钠将混合物的ph值调节至大约7。用量筒测量所得溶液的体积,并吸取其一部分(0.5ml)。通过hplc法测量化合物(i)的含量后,向其中加入注射用水以调节化合物(i)的浓度为100mg/ml。
此后,将各配方单独放置在管形瓶(φ23×35,13mm开口,由iwataglassindustrialco.,ltd.生产),然后在高压灭菌锅(121℃,20分钟)内处理以获得注射剂。所得的注射剂具有6.54的ph值。
使用激光衍射粒度分析仪(sald-3000j或sald-3100,由shimadzucorporation生产)测定所得到的注射剂中包含的化合物(i)的脱水物的粒径。具体而言,次级平均颗粒直径定义为通过使用循环单元并使用水作为测定介质测得的粒径。平均次级颗粒直径定义为除了测量的同时测量介质进行超声波照射之外,在如上述相同的条件下测定的颗粒直径。(这也适用于下面描述的实施例。)化合物(i)的脱水物具有10.480μm的次级平均颗粒直径。可以确认,化合物(i)的脱水物的颗粒聚集形成次级颗粒。
实施例2:包含含有水性颗粒粘合剂的化合物(i)的二水合物作为活性成分的注射剂的合成
除了以化合物(i)的二水合物代替化合物(i)的脱水物以及不进行高压灭菌处理之外,以与实施例1中相同的方法制备注射剂。所得的注射剂具有7.08的ph值。
以与实施例1中相同的方式测量所得注射剂中所包含的化合物(i)的二水合物的粒径。所述的化合物(i)的二水合物具有9.819μm的平均粒径。可以确认,化合物(i)的二水合物的颗粒聚集形成次级颗粒。
在实施例1和2中得到的注射剂的成分,以及其中各成分的量(即,注射剂的配方)示于下表1中。
表1
以相同的方式(实施例2b)重新制备实施例2的注射剂。同时,使用10mg/ml的氯化钠替代5mg/ml的氯化钠制备注射剂(实施例2c),不包括实施例2c的聚乙二醇制备注射剂(实施例2a)。具体地,如表2中所示,制备注射剂(实施例2a、2b和2c)。此外,实施例2a、2b和2c的注射剂在60℃下静置一个月,然后分析其分散性和再分散性。放置之前和之后测定平均初级颗粒直径及平均次级颗粒直径。表2还示出了结果。
表2
在该表中,在“分散性(60℃/1m,rf)”列所示的值显示生产后在60℃下放置一个月各注射剂相对于液面高度形成多个沉淀高度。具体地,数字显示当液面高度定义为1时沉淀高度的比例(60℃/1m指样品在60℃下放置1个月)。
此外,在“再分散性(60℃/1m)”列中的“a”符号表示当因在60℃下放置1个月产生沉淀后,通过用手轻轻摇动时,该注射剂容易恢复为悬浮液。
实施例3:包含含有油性颗粒粘合剂的化合物(i)的脱水物作为活性成分的注射剂的合成
羧甲基纤维素(15000mg)称重并放入300ml烧杯中。向其中加入注射用水(120ml),并在50℃下使用均化器(omnith,由omniinternationalco.,ltd.生产)使羧甲基纤维素溶解。接着,山梨糖醇(75000mg)、磷酸二氢钠二水合物(117mg)和聚山梨醇酯80(150mg)称重,并加入到300ml烧杯中。然后将混合物充分搅拌。在净化工作台(生物净化工作台,mcv-b161f,由biomedix生产)将溶解后得到的溶液通过聚醚砜(pes)过滤器(milliporeexpressplus高流速,73mm/0.22μm,scgpu11re,nihonmilliporek.k.生产)。在净化工作台中,将已通过聚四氟乙烯(ptfe)过滤器(
以与实施例1中相同的方式测量所得注射剂中所含的化合物(i)的脱水物的粒径。所述的化合物(i)的脱水物具有13.237μm的平均粒径。可以确认,化合物(i)的脱水物的颗粒聚集形成次级颗粒。
实施例4:包含含有油性颗粒粘合剂的化合物(i)的二水合物作为活性成分的注射剂的合成
除了使用化合物(i)的二水合物代替化合物(i)的脱水物,以与实施例3中相同的方法制备注射剂。所得的注射剂具有7.06的ph值。
以与实施例1中相同的方式测量所得注射剂中所含的化合物(i)的二水合物的粒径。所述的化合物(i)的二水合物具有8.025μm的平均粒径。可以确认,化合物(i)的二水合物的颗粒聚集形成次级颗粒。
在实施例3和4中所获得的注射剂的成分和其中每种成分的量列于下表3中。
表3
然后以相同的方式(实施例4b)重新制备实施例4的注射剂。同时,除了使用0.6mg/ml(实施例4a)或1.0mg/ml(实施例4c)苯甲酸苄酯替代0.8mg/ml的苯甲酸苄酯之外,以相同的方式制备注射剂。具体地,如表4中所示,制备注射剂(实施例4a、4b和4c)。此外,实施例4a、4b和4c的注射剂在60℃下静置一个月,然后分析其分散性和再分散性。放置之前和之后测定平均初级颗粒直径及平均次级颗粒直径。表4还示出了结果。
表4
上表中各栏的详细说明与表2相同。
重新制备实施例1和3的注射剂(实施例1a和3a),测定其平均粒径。结果表明,实施例1a的注射剂具有5.0μm的平均初级颗粒直径和10.3μm的平均次级颗粒直径,实施例3a的注射剂具有3.9μm的平均初级颗粒直径和15.1μm的平均次级颗粒直径。
实施例5
除了使用化合物(i)的二水合物替代化合物(i)的脱水物,使用苯甲醇(10mg/ml)替代苯甲酸苄酯(0.3mg/ml)之外,以与实施例3相同的方法制备注射剂。注射剂中的化合物(i)的二水合物的次级平均颗粒直径为6.9μm,其平均初级颗粒直径为2.3μm。从该结果可以确认,化合物(i)的二水合物的颗粒聚集形成次级颗粒。当注射剂在室温下静置四天,发生沉淀,但用手轻轻摇动时很容易恢复为悬浮液。
试验实施例1和2
在实施例1至4中制备的包含化合物(i)的脱水物或化合物(i)的二水合物作为活性成分的注射剂以25mg/kg的剂量分别注射到雄性大鼠的小腿肌肉中。为了评价给药后化合物(i)进入血液中的转移,收集给药后第0.25、1、3、6、9、14、21和28天的血样,测定各样品的化合物(i)在血液中的浓度。
图13示出了施用实施例1和2中制备的注射剂得到的平均血药浓度-时间图。图14示出了施用实施例3和4制备的注射剂得到的平均血药浓度-时间图。从图13和14可以清楚看到,在施用包含化合物(i)的脱水物或二水合物的注射剂情况下,化合物(i)的有效的血药浓度持续至少28天。尤其是,试验实施例2的结果(图14)显示,当施用包含实施例4制备的化合物(ⅰ)的二水合物的注射剂时,没有观察到血药浓度过度增加,获得了稳定的血药浓度。
试验实施例3
分别以与实施例3和4相同的方式制备在表5中所示的注射剂(实施例a和实施例b)。
表5
使用与在jp2012-232958a的实施例中公开的同样的方法制备下表6中所示的冻干的注射剂(比较实施例a和比较实施例b)。(jp2012-232958a的内容通过引用并入本发明的说明书中。)在100ml的标度制备注射剂。
表6
实施例a、实施例b、比较实施例a和比较实施例b的注射剂以25mg/kg的化合物(i)剂量分别注射到雄性大鼠的小腿肌肉中。为了评价给药后化合物(i)进入血液中的转移,收集给药后第0.25、1、3、6、9、14、21和28天的血样,测定各样品的化合物(i)在血液中的浓度。比较实施例a和b的冻干注射剂是这样的:化合物(ⅰ)或其盐不形成次级颗粒。
图15以曲线图的形式示出了所得到的结果。从图15可以确认,与没有形成次级颗粒的情况相比,本发明的其中化合物(ⅰ)或其盐形成具有特定粒径的次级颗粒的注射剂,产生抑制开始给药后的爆发现象,并呈现出优异的药效持续性。
试验实施例4
以与实施例2相同的方式制备具有表7中所示的组成的注射剂(实施例c至f)。
表7
实施例c至f的注射剂以25mg/kg的化合物(i)剂量分别注射到雄性大鼠的小腿肌肉中。为了评价给药后化合物(i)进入血液中的转移,收集给药后第0.25、1、3、6、9、14、21和28天的血样,测定各样品的化合物(i)在血液中的浓度。
图16以曲线图的形式示出了所得到的结果。表8示出了各实施例的注射剂给药后的cmax和auc28天。
表8
从以上所示的结果可以确认,对于实施例c至f的所有的注射剂,化合物(i)的血药浓度从给药时维持1个月。
试验实施例5
以与实施例2中相同的方式,各载体成分溶解于注射用水中。化合物(i)的二水合物悬浮于所得的注射溶液中,以得到具有表9-12所示的配方的注射剂(实施例g-1至g-6、实施例h-1至h-6、实施例i-1至i-6和实施例j-1至j-6)。
表9
实施例g系列
表10
实施例h系列
表11
实施例i系列
表12
实施例j系列
表13显示了各实施例的rf值(当液体表面的高度定义为1时的沉淀高度)。
每个实施例在室温下放置五天后,同时施加振动测定rf值。用于测量的试管和振动测试仪如下。
试管,将每个实施例填充其中,
装有螺杆顶盖的试管(nr-10,maruemucorporation制造),
材料(管体):硼硅酸盐玻璃,
长度:105mm,
形状:圆形底,
容量:12ml,
外径
·振动测试仪,将每个试管中放在其上,
空气处理单元dh-14,由sinkoindustriesltd.制造
(空气处理单元用作振动测试仪,将含有注射剂的各试管置于其上。)
使用振动能级计(vm-53a,由rion公司制)测定空气处理单元的振动水平,并观察以下振动水平:
x轴方向:68db,y轴方向:76db以及z轴方向:90db。
振动的应用被认为是使沉淀更致密,促进硬饼形成。因此,对于上述的rf值的测定条件比静置还更严格。
图17是表示表13的结果的图。在表13和图17中,ps80代表聚山梨醇酯80,peg代表聚乙二醇400,以及f68代表聚氧乙烯(160)聚氧丙烯(30)甘醇(pluronicf68)。在某些成分后出现符号(+)意味着该成分包含在其中,符号(-)表示该成分没有包含在其中。这也适用于以下所示的表14。
表13
试验实施例6
实施例g-1至g-6、实施例h-1至h-6、实施例i-1至i-6以及实施例j-1至j-6的注射剂的注射性评价如下。
制备后,实施例g-1至g-6、实施例h-1至h-6、实施例i-1至i-6以及实施例j-1至j-6的注射剂放置五天同时施加振动。此后,将实施例g-1至g-6、实施例h-1至h-6、实施例i-1至i-6以及实施例j-1至j-6的注射剂倒置,以使其中的沉淀物再分散。仅通过倒置一次,所有的注射剂中的沉淀物更好地再分散。
然后,将500μl每种注射剂填充在装有针头的注射器(27g×1.5英寸,terumocorporation制造)内,然后确认每种注射剂进入选取肌(鸡大腿)的注入性。表14显示了结果。在表14中,“a”表示全部量的该注射剂可以被注入(即注射性是令人满意的);“b”表示注射器针头发生堵塞,该注射剂的量不能全部被注入。
表14
- 还没有人留言评论。精彩留言会获得点赞!