V-ATPase活性抑制剂、抗菌剂、药物以及抗菌方法和筛选方法与流程
本发明涉及一种v-atpase活性抑制剂、抗菌剂、药物以及抗菌方法和筛选方法,特别地,涉及一种能够对导致疾病等的微生物中存在的v-atpase有效地进行抑制的v-atpase活性抑制剂、抗菌剂、药物和抗菌方法以及筛选方法。
背景技术:
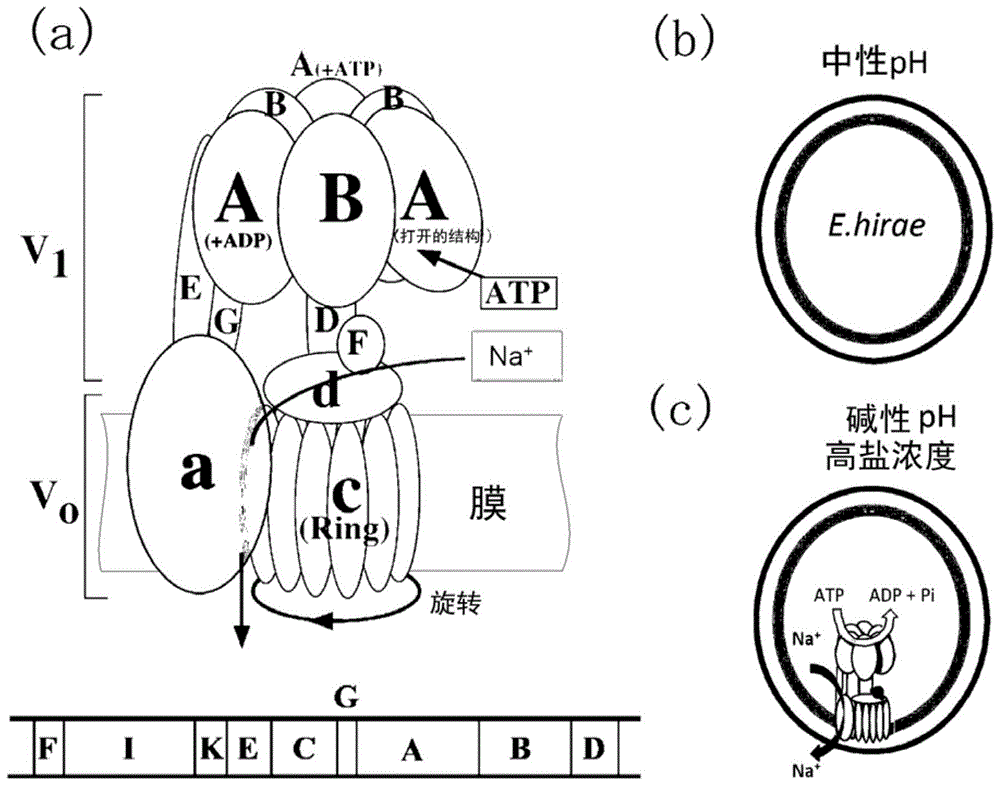
:v-atpase(v型atp酶),存在于真核生物的细胞器膜中,是由复杂的亚基结构构成的超分子复合物。v-atpase,具有离子运输性的分子马达的功能,atp的水解能量导致特定的微小亚基一边在膜内进行旋转一边在膜内与膜外之间运输离子。v-atpase,已知也存在于原核生物(细菌)中,有时会被称作a-atpase。v-atpase,是特定的环境下细胞为了进行生育所必需的。例如,在肠球菌中,v-atpase具有对atp进行水解并将细胞内的钠离子(na+)输送到细胞外的功能,因此在高盐浓度以及高ph条件下肠球菌也能够进行生育。另外,在多种病原性微生物中存在与肠球菌类似的v-atpase,在碱性条件下,对其生育起着重要的作用。因此,对v-atpase的离子运输功能进行抑制的化合物,可用作引起疾病的病原菌的抗菌剂,作为新的治疗药而备受期待。以往,作为抗菌剂,已知各种各样的化合物。例如,专利文献1中公开了具有特定的结构的2-取代苯并咪唑用作抗菌剂。现有技术文献专利文献专利文献1:美国专利第5942532号公报(权利要求1等)技术实现要素:发明要解决的技术问题然而,专利文献1的抗菌剂,是一种以作为微生物的组氨酸蛋白质激酶抑制剂而发挥抗菌作用的抗菌剂,不同于对v-atpase进行抑制的抗菌剂。本发明的目的在于,提供一种能够对引起疾病等的细菌的繁殖选择性地且有效地进行抑制的v-atpase活性抑制剂,包含该v-atpase活性抑制剂的抗菌剂、药物以及抗菌方法。另外,本发明的另一目的在于,提供一种用于高效地进行筛选出这类v-atpase活性抑制剂的筛选方法。解决技术问题的方法本发明人,为了解决上述问题进行了深入研究。结果发现特定的化合物示出了抑制v-atpase活性的效果,并完成了本发明,其中,该特定的化合物具有:芳香环、与芳香环结合的电子提供性基、与芳香环结合且具有双键的任意的取代基。即,本发明是一种na+运输性的v-atpase活性抑制剂,其特征在于,包含用式(1)表示的化合物:(其中,r1表示:通过氧与相邻的苯基进行结合的从羟基、碳数为1~10的烷氧基以及碳数为1~3的卤代烷氧基中选择的任一种,或者通过氮与相邻的苯基进行结合的从各个烷基的碳数为1~10的二烷基氨基、碳数为2~6的杂环胺以及可具有与碳原子进行结合的取代基的羧酸酰胺基中选择的任一种,或者溴、碘,或者碳数为2~5的直链的烃基。r2表示氢或者碳数为1~3的卤代烷氧基。z1是:碳数为5~20的脂肪族烃基、碳数为3~20的脂环式烃基、碳数为6~20的芳香族烃基、或碳数为2~20的杂环基,以上任一者均可具有任意的取代基,其中,在与相邻的苯基之间,具有从下式(1-1)~(1-3)中选择的包含双键的结构。*表示与相邻的苯基结合的键。)在这种情况下,所述用式(1)表示的化合物优选为用下式(2)表示的2-苯基苯并咪唑衍生物:(其中,r1和r2如式(1)中所定义,r3和r4表示:氢原子,碳数为1~4的烷基,或者从氟、氯、溴和碘中选择的卤素原子,r3与r4彼此可以相同也可以不同)。另外,在上述的情况下,是特征在于所述用式(1)表示的化合物是用下式(7)表示的(1,2,4-恶二唑-3-基)苯基衍生物的如权利要求1所示的v-atpase活性抑制剂:(其中,r7~r14表示:氢原子,碳数为1~4的烷基,氨基,醚基,磺酰基,硼基,或者从氟、氯、溴和碘中选择的卤素原子,r7~r14彼此可以相同也可以不同)。另外,在上述的情况下,优选特征在于,与v-atpase的膜内转子环(c环)进行结合对活性进行抑制。所述式(1)的化合物,优选为:(z)-5-(2,4-二(二氟甲氧基)亚苄基)-2-(环戊基氨基)噻唑-4(5h)-酮、(2e,4e,6e,8e)-n-(4-羟基苯基)-3,7-二甲基-9-(2,6,6-三甲基环己基-1-烯-1-基)壬-2,4,6,8-四烯酰胺、5-(4-(壬氧基)亚苄基)嘧啶-2,4,6(1h,3h,5h)-三酮、n,n-二甲基-4-(6-甲基-1h-苯并[d]咪唑-2-基)苯胺)、或者n-(4-(5-((邻甲苯氧基)甲基)-1,2,4-恶二唑-3-基)苯基)噻吩-2-羧基酰胺。本发明是一种针对具有v-atpase的细菌的抗菌剂,其特征在于,包含上述任一项所述的v-atpase活性抑制剂。另外,本发明是一种药物,其特征在于,包含上述的抗菌剂。本发明是一种细菌群调节剂,该细菌群调节剂在包含具有v-atpase的细菌和不具有v-atpase的细菌的细菌群中选择地使得具有v-atpase的细菌减少,其特征在于,包含如权利要求1~5中任一项所述的v-atpase活性抑制剂。另外,本发明是一种药物,其特征在于,包含上述的细菌群调节剂。另外,本发明是一种抗菌方法,是使用上述的抗菌剂对细菌的繁殖进行抑制的抗菌方法,其特征在于,包括:在具有v-atpase的细菌中投放所述v-atpase活性抑制剂的步骤;使得所述v-atpase活性抑制剂与所述细菌的所述v-atpase的膜内转子环(c环)进行结合以对所述v-atpase的活性进行抑制的步骤。另外,本发明是一种筛选方法,所述筛选方法用于从试验化合物中选出na+运输性的v-atpase活性抑制剂的候选化合物,其特征在于,包括:未处理评价步骤,对于具有v-atpase的细菌,在试验化合物没有接触所述细菌状态下,在第一ph和比所述第一ph更加碱性侧的第二ph下,评价所述细菌的生存状态;已处理评价步骤,在将试验化合物与所述细菌接触之后,在所述第一ph和所述第二ph下,评价所述细菌的生存状态;候选化合物确定步骤,将所述未处理评价步骤与所述已处理评价步骤的生存状态进行比较,并且将产生了差异的试验化合物确定为所述细菌的抗菌剂的候选化合物。另外,本发明是一种抗菌药物,其有效成分是具有v-atpase抑制活性的化合物。另外,本发明是一种抗菌方法,其特征在于,包括:对具有v-atpase的细菌投放具有v-atpase抑制活性的化合物的步骤;使得所述v-atpase活性抑制剂与所述细菌的所述v-atpase进行结合以对所述v-atpase的活性进行抑制的步骤。发明的效果根据本发明,能够提供一种能够对引起疾病等的细菌的繁殖选择性地且高效地进行抑制的v-atpase活性抑制剂、含有该v-atpase活性抑制剂的抗菌剂、药物以及抗菌方法。另外,根据本发明,能够提供一种用于高效地筛选这样的v-atpase活性抑制剂的筛选方法。附图说明图1是示出v-atpase的整体结构以及特定环境下的表达的示意图。图2是示出候选化合物的v-atpase活性的抑制率和化合物浓度的图表。图3是示出候选化合物的肠球菌的生育实验的结果的图表。图4是示出v-atpase活性抑制剂与v-atpase的c环进行结合的状态的立体结构图。图5是示出实施例4的化合物与v-atpase的c环的x射线晶体结构分析的结果的图。图6是示出使用实施例4的化合物进行病原菌的繁殖抑制试验的结果的图表。图7是示出使用实施例4的化合物进行病原菌的繁殖抑制试验的结果的图表。图8是示出对使用实施例4的化合物对肠内环境产生的影响进行评价的结果的图表。图9是示出对投喂了高蛋白质饲料、抗生物质的小鼠的肠内的ph进行测量的结果的图表。图10是示出对投喂了实施例4的化合物后的vre感染小鼠的vre菌数进行计测的结果的图表。具体实施方式1.v-atpase活性抑制剂本发明的v-atpase活性抑制剂,是na+运输性的v-atpase活性抑制剂,包含用下式(1)表示的化合物:(其中,r1表示:通过氧与相邻的苯基进行结合的、从羟基、碳数为1~10的烷氧基以及碳数为1~3的卤代烷氧基中选择的任一种,或者通过氮与相邻的苯基进行结合的、从各个烷基的碳数为1~10的二烷基氨基、碳数为2~6的杂环胺以及可具有与碳原子进行结合的取代基的羧酸酰胺基中选择的任一种,或者溴(br)、碘(i),或者碳数为2~5的直链的烃基。r2表示氢或者碳数为1~3的卤代烷氧基。z1是:碳数为5~20的脂肪族烃基,碳数为3~20的脂环式烃基,碳数为6~20的芳香族烃基,或者碳数为2~20的杂环基,以上任一者可以具有任意的取代基,其中,在与相邻的苯基之间,具有从下式(1-1)~(1-3)中选择的包含双键的结构。*表示与相邻的苯基结合的键。)在r1中,羟基是用「-oh」表示的取代基。碳数为1~10的烷氧基,是用「-o-r1a」(r1a表示碳数为1~10的烷基)表示的取代基。另外,r1的碳数为1~3的卤代烷氧基,是用「-o-r1b-xn1」(r1b表示碳数为1~3的烷基,x表示从氟、氯、溴、碘中选择的卤素原子。并且n1=1~3。)表示的取代基。各个的烷基的碳数为1~10的二烷基氨基,是用「-n(r1c)(r1d)」(r1c表示碳数为1~10的烷基,r1d表示碳数为1~10的烷基,r1c与r1d可以相同也可以不同。)表示的取代基。碳数为2~6的杂环胺,是用「-n-(ch2)n2-」(n2=2~6)表示的取代基。羧酸酰胺基,是用「-nh-c(=o)-」表示的取代基。溴是用「-br」表示的取代基,碘是用「-i」表示的取代基。碳数为2~5的直链的烃基,是用「-(ch2)n3-ch3」(n3=1~4)表示的取代基。在r2中,氢是用「-h」表示的取代基。碳数为1~3的卤代烷氧基,是用「-o-r2a-xn4」(r2a表示碳数为1~3的烷基,x表示从氟、氯、溴、碘中选择的卤素原子。并且n4=1~3。)表示的取代基。r2,在苯基中,可以位于z1的邻位,也可以位于z1的间位。在z1中,碳数为5~20的脂肪族烃基,是从烷烃、烯烃、炔烃、二烯烃、共轭二烯等中选择的取代基。作为碳数为5~20的烷烃,可列举戊烷、己烷、庚烷、辛烷、壬烷、癸烷、十一烷、十二烷、十三烷、十四烷、十五烷、十六烷、十七烷、十八烷、十九烷、二十烷等。作为碳数为5~20的烯,可列举1-戊烯、2-戊烯、1-己烯、2-己烯、3-己烯、1-庚烯、2-庚烯、3-庚烯、4-庚烯、1-辛烯、2-辛烯、3-辛烯、4-辛烯、5-辛烯、1-壬烯、2-壬烯、3-壬烯、4-壬烯、5-壬烯、1-癸烯、2-癸烯、3-癸烯、4-癸烯、5-癸烯、6-癸烯等。作为碳数为5~20的炔烃,可列举1-戊炔、2-戊炔、1-己炔、2-己炔、3-己炔、1-庚炔、2-庚炔、3-庚炔、4-庚炔、1-辛炔、2-辛炔、3-辛炔、4-辛炔、5-辛炔、1-壬炔、2-壬炔、3-壬炔、4-壬炔、5-壬炔、1-癸烯、2-癸烯、3-癸烯、4-癸烯、5-癸烯、6-癸烯等。作为碳数为5~20的二烯烃,可列举1,3-戊二烯、2,4-庚二烯、1,4-戊二烯、1,7-辛二烯、2,5-辛二烯、2,6-辛二烯等。作为碳数为5~20的共轭烯烃,可列举1,3,5-庚三烯、1,3,7-辛三烯、2,4,6-辛三烯、1,2,7,8-壬四烯、1,3,6,8-壬四烯、2,4,6,8-壬四烯、1,2,8,9-十碳四烯、2,4,6,8-十碳四烯等。作为碳数为3~20的脂环式烃基,可列举从环烷烃、环烯烃、环炔烃等中选择的取代基。作为碳数为3~20的脂环式烃基,可列举环丙烷、环丁烷、环戊烷、环己烷、环庚烷、环辛烷、环丙烯、环丁烯、环丙烯、环己烯、环庚烯、环辛烯、环辛炔等。作为碳数为6~20的芳香族烃基,可列举苯、萘、蒽等。碳数为2~20的杂环基,是碳数为2~20并且环结构内含有从氮、氧以及硫中选择的1种以上的元素的取代基。作为碳数为2~20的杂环基,能够列举:氮丙啶、环氧乙烷(oxirane)、环硫乙烷(thiirane)、1h-氮丙啶、2h-氮丙啶、环氧乙烷、硫杂环丙烯(thiirene)、氮杂环丁烷、氧杂环丁烷、硫杂环丁烷、氮杂环丁二烯、氮杂环戊烷(azolidine)、氧杂环戊烷、硫杂环戊烷(thiolane)、唑、氧杂环戊二烯(oxole)、硫醇、氮杂环己烷(azinane)、恶烷(oxane)、噻烷(thiane)、吡啶、氮杂环庚烷(azepane)、氧杂环庚烷(oxepane)、噻庚环(thiepane)、氮杂环庚烷(azepine)、氧杂环庚三烯(oxepin)、噻呯(thiepine)、咪唑、吡唑、恶唑、噻唑、咪唑啉、二恶烷、吗啉、噻嗪(thiazine)、三唑、四唑、二氧戊环、哒嗪、嘧啶、吡嗪、吲哚、异吲哚、苯并咪唑、嘌呤、苯并三唑、喹啉、异喹啉、喹唑啉、喹喔啉、噌啉、蝶啶、色烯、异色烯、蒽、吖啶、呫吨、咔唑、恶二唑、苯并-c-肉啉(en)、并四苯等。作为z1,除了上述的取代基以外,在这些取代基上,还可以结合1个或2个以上的烷基、烯基、炔基、芳基、氧基、卤素原子、羟基、硝基、砜基、醚基、巯基、酯基、碳酸基、羰基、酰胺基、氨基、叠氮基、氨基甲酸酯基、氰基、羟基、羧基、磺酸酯基、磺内酯基、内酯环、内酰胺环等。z1,优选分子内含有环结构。作为环结构,优选是从上述的碳数为3~20的脂环式烃基、碳数为6~20的芳香族烃基、以及碳数为2~20的杂环基中选择的基。在z1中,环结构可以仅有1个,也可以包含2个以上。环结构,更优选地在分子内含有包括上述的式(1-1)~(1-3)的双键的结构。特别地,作为上述用式(1)表示的化合物,优选为下述用式(2)表示的2-苯基苯并咪唑衍生物:(其中,r1和r2如式(1)中所定义,r3和r4表示:氢原子,碳数为1~4的烷基,或者从氟、氯、溴和碘中选择的卤素原子,r3与r4彼此可以相同也可以不同。)。作为上述的式(2)的2-苯基苯并咪唑衍生物,能够示例出下述的用式(v-161、v-161-01~v-161-04、v-161-10)表示的化合物:其中,基于v-atpase活性抑制的效果好,优选式v-161(n,n-二甲基-4-(6-甲基-1h-苯并[d]咪唑-2-基)苯胺)。作为上述的用式(1)表示的化合物,能够列举下述式(6)表示的(1,2,4-恶二唑-3-基)苯基衍生物:(其中,r1、r2如式(1)中所定义。r6表示碳数为6~20的芳香族烃基,该芳香族烃基可以被碳数为1~4的烷基取代。)。特别地,式(6)表示的化合物,优选为下述式(7)表示的(1,2,4-恶二唑-3-基)苯基衍生物:(其中,r7~r14表示:氢原子,碳数为1~4的烷基,氨基,醚基,磺酰基,硼基,或者从氟、氯、溴和碘中选择的卤素原子,r7~r14彼此可以相同也可以不同。)。作为上述式(7)表示的化合物的具体例,能够示例出以下的式(v-234)、(v-234-01)~(v-234-03)表示的化合物:作为上述的式(1)表示的化合物,能够列举下述式(3)表示的化合物:(其中,r1以及r2如式(1)中所定义。)。另外,作为上述的式(1)表示的化合物,能够列举下述式(4)表示的化合物:(其中,r1以及r2如式(1)中所定义。)。另外,作为上述的式(1)表示的化合物,能够列举下述式(5)表示的化合物:(其中,r1以及r2如式(1)中所定义。r5表示碳数为3~20的脂环式烃基。)。作为上述式(1)的化合物,能够示例出如下所示的化合物:这些化合物名称如下所述。·v-6:(z)-5-(2,4-二(二氟甲氧基)亚苄基)-2-(环戊基氨基)噻唑-4(5h)-酮·v-84:(2e,4e,6e,8e)-n-(4-羟基苯基)-3,7-二甲基-9-(2,6,6-三甲基环己基-1-烯-1-基)壬-2,4,6,8-四烯酰胺·v-130:5-(4-(壬氧基)亚苄基)嘧啶-2,4,6(1h,3h,5h)-三酮·v-161:n,n-二甲基-4-(6-甲基-1h-苯并[d]咪唑-2-基)苯胺)·v-234:n-(4-(5-((邻甲苯氧基)甲基)-1,2,4-恶二唑-3-基)苯基)噻吩-2-羧基酰胺其中,基于除了对v-atpase结合以外的非特异的结合少的观点,特别优选v-6、v-161、v-234。2.v-atpase活性抑制原理接着,对v-atpase进行说明。图1是作为肠内链球菌的海氏肠球菌(enterococcushirae(e.hirae))的v-atpase的示意图,示出了na+运输性的v-atpase。如图1(a)所示,v-atpase是有多个亚基构成的复合物,具备亲水性的催化剂头部部分(v1部分)和担任钠离子(na+)运输的膜内在性部分(vo部分)。v1部分,是atp驱动性的马达部,在a3b3亚基的作用下atp被水解从而使得v1部分进行旋转。vo部分,使用旋转运动运输离子,包含由c亚基的十聚体构成的膜内在性转子环(c环)。c环,具有离子结合位点,与离子的膜内膜外的运输相关。v-atpase,通过v1部分对atp进行水解,并通过该能量使得vo部分的c环旋转,从而将膜内的钠离子排向膜外。图1(b)、图1(c)的示意图,示出在e.hirae中,外部环境的ph导致v-atpase的活性发生变化的状态。如图1(b)所示,在中性ph(ph≤7.0)附近,v-atpase没有表达。另一方面,如图1(c)所示,在碱性侧的ph(ph>7.0)和高盐浓度下,v-atpase表达,膜内的钠离子被排到膜外。由此,e.hirae,细胞内的na+可保持为较低,在碱性和高盐浓度的环境下也能够生育。本发明的v-atpase活性抑制剂,具有与v-atpase结合并对其活性进行抑制的作用。特别地,本发明的v-atpase活性抑制剂,具有通过与v-atpase的c环进行结合并抑制其旋转从而抑制离子的运输的功能。以下,对v-atpase活性抑制剂的活性抑制原理进行说明。本发明的v-atpase活性抑制剂,是用式(1)表示的化合物。该化合物,如下式所示,具备苯基和任意的取代基,并且在苯基的相对于与任意的取代基结合的位置为对位的位置具有电子提供性基。另外,对于如上述所示例的v-atpase活性抑制剂,示出了对其结构进行说明的图。如这些图所示,任意的取代基z1与苯基之间,通过式(1-1)~(1-3)的包含双键的结构进行连接。另外,z1均具有环结构。具有电子供与性基的苯基,与任意的取代基一起与v-atpase的c环的外周部的特定的位点进行结合并且夹在c环与a亚基之间,从而具有抑制c环的旋转的作用。苯基和任意的取代基具有疏水性,通过与c环外周部中的具有疏水性侧链的氨基酸残基的疏水性相互作用,从而结合于c环。另外可认为,由于结合于苯基的对位的电子提供性基导致苯环的π电子的电子密度增大,因此苯环活性化,有助于v-atpase活性抑制剂对c环的结合亲和性。例如,在下文所述的实施例中记载的化合物「v-161」中,与包括c环的第52个苯丙氨酸的其周围的氨基酸残基进行相互作用,以确保抑制剂的结合能力。可推测,任意的取代基和/或电子提供性基的nh基等提供的氢原子成为供体,另外n原子·o原子·s原子成为受体,与c环的受体和供体之间形成了多个氢键。因此,任意的取代基以及电子提供性基,有助于提高v-atpase与c环的结合亲和性。任意的取代基,只要分子量适当地大并且具有疏水性即可,可以是比较任意的结构。该取代基,优选具有环结构。通过具有疏水性的环结构,并且增加任意的取代基的体积,能够提高v-atpase活性抑制剂的c环的旋转抑制效果。首先,为了与v-atpase的c环进行结合,包括苯基和存在于苯基的特定的方向的双键的结构,是最低限度的必需的基本结构。特别地,在式(1-2)、式(1-3)这样的双键与苯基进行邻接的情况下,可认为双键与苯基进行共振导致结构被固定,该共振的π电子对于v-atpase结合于c环发挥了重要的作用。需要说明的是,包含双键的结构,可以包含在任意的取代基中的连接苯基与环结构的连接体中(例如,v-84等),在苯基与环结构之间不存在连接体的情况下,也可以包含在环结构中(例如,v-161)。由于具备这样的结构,v-atpase活性抑制剂,与v-atpase的c环进行结合并抑制其旋转,从而发挥对v-atpase活性进行抑制的效果。3.抗菌剂·抗菌方法·药物本发明的v-atpase活性抑制剂,由于如上文所述对v-atpase的活性进行抑制,因此可用作表达v-atpase的微生物的抗菌剂。表达v-atpase的微生物的列表如下表所示。这些微生物,可被本发明的v-atpase活性抑制剂抑制v-atpase的活性,可期待其繁殖被抑制。另外,相关病名表示可期待通过抑制微生物的繁殖而得到治疗或预防的疾病。【表1】表中的「bacteria(细菌)」表示微生物名称,「相关病名」表示与该微生物相关的疾病的例子。另外,表中的「v-atpase环标识(%)」,表示该微生物的v-atpase的c环与肠球菌的v-atpase的c环的相同性的百分比。本发明人,对于肠球菌v-atpase,在下文所述的实施例中,确认了v-atpase活性抑制剂与v-atpase的c环进行结合并且示出了肠球菌的生育抑制效果。因此,与肠球菌的v-atpase的c环的相同性高的具有v-atpase的微生物,可期待与肠球菌同样地通过本发明的v-atpase活性抑制剂发挥微生物的生育抑制效果。另一方面,虽然如上文所述,v-atpase活性抑制剂与c环的外周面进行相互作用,但是发明人发现,在v-atpase的c环的外周面,在多种微生物中氨基酸序列比较高度保守。因此可认为,即使是与肠球菌的v-atpase的c环的相同性较低的微生物,v-atpase活性抑制剂也并非肯定没有效果,v-atpase活性抑制剂也有可能发挥微生物的生育抑制效果。本发明的v-atpase活性抑制剂,由于是新颖的抗菌剂,因此可以期待在对现有的抗菌剂具有耐性的耐药性菌中发挥效果。例如,在对万古霉素等有耐药性的肠球菌(vre)的e.faecalis(粪肠球菌)、e.faecium(屎肠球菌)等的情况下,是有用的。本发明的v-atpase活性抑制剂,能够用作在包含具有v-atpase的细菌和不具有v-atpase的细菌的细菌群中,使得具有v-atpase的细菌选择性地减少的细菌群调节剂。例如,韦氏菌(clostridiumperfringens(产气荚膜梭菌))等,被称作坏菌的在肠内使得蛋白质腐败并产生有害的胺类、致癌性物质的病原性细菌。这些与肠内环境的恶化相关的微生物通常具有v-atpase,并且在碱性的环境下有优势地进行生育。另一方面,双歧杆菌(bifidobacterium属)、乳酸菌(lactobacillus属)等,被称为益生菌,在肠内使得食物纤维发酵并产生丁酸、醋酸等对维持宿主健康很重要的短链脂肪酸,并且可抑制坏菌的繁殖和与其相关的疾病。这些具有改善肠内环境的作用的微生物通常不具有v-atpase。因此,本发明的v-atpase活性抑制剂,不对上述的益生菌发挥效果而仅仅对坏菌发生效果,因而选择性地仅仅对具有v-atpase的坏菌进行生育抑制,所以可将肠内改善成益生菌容易生育的环境。需要说明的是,vre感染症、clostridiumdifficile(难辨梭菌)导致的肠炎等,通常其起因是使用抗生物质导致的肠内细菌群紊乱。肠道中的免疫系统、肠内细菌群的异常,可能会诱发自身免疫疾病。肠内环境的恶化,与肠癌、肝癌相关,并且肥胖、糖尿病等生活习惯病也与肠内细菌群密切相关。因此,本发明的v-atpase活性抑制剂,能够用作对肠内细菌的细菌群中的益生菌·坏菌的平衡进行调节,并且对各种疾病进行予防·治疗的药物。本发明的v-atpase活性抑制剂(抗菌剂、细菌群调节剂),能够用作药物、农药等药剂中的有效成分,特别地,优选用于药物用途。作为药物的种类,可列举:片剂、胶囊、丸剂、散剂、颗粒剂、细粒剂、凝胶剂、液剂等。药物中含有的v-atpase活性抑制剂的浓度,能够适当地进行决定,例如可以在1μm~100mm的范围内,优选在100μm~10mm的范围内。v-atpase活性抑制剂,可溶解在水等溶剂中进行使用,或者也能够在粉末的状态下使用。上述的药物,除了本发明的v-atpase活性抑制剂(抗菌剂、细菌群调节剂)之外,在不损害本发明的效果的范围内,可以包含溶剂、赋形剂、粘合剂、崩解剂、润滑剂、稳定剂、悬浮剂等添加物。作为制剂用溶剂,例如可列举:水、乙醇、甘油等。作为赋形剂,例如可列举:乳糖,白糖,葡萄糖,甘露醇,山梨糖醇,玉米淀粉,土豆淀粉,α-淀粉,糊精,羧甲基淀粉,结晶纤维素,羟丙基甲基纤维素,羧基甲基纤维素,羧基甲基纤维素钙,阿拉伯树胶,葡聚糖,普鲁兰多糖,硅酸盐类,磷酸钙,碳酸钙,硫酸钙等。作为硅酸盐类,例如可列举:轻质硅酸酐,合成硅酸铝,偏硅酸铝酸镁等。作为粘合剂,例如可列举:明胶,聚乙烯吡咯烷酮,聚乙二醇等。作为崩解剂,例如可列举:交联羧甲基纤维素钠,羧基甲基淀粉钠,交联聚乙烯吡咯烷酮等。作为润滑剂,例如可列举:滑石,硬脂酸,硬脂酸钙,硬脂酸镁,胶体二氧化硅,蜂胶,珠蜡,鲸蜡,硼酸,乙二醇,富马酸,己二酸,苯甲酸钠,硫酸钠,亮氨酸,月桂硫酸钠,月桂硫酸镁,硅酸酐,硅酸水合物等。作为稳定剂,例如可列举:对羟基苯甲酸甲酯,对羟基苯甲酸丙酯,氯丁醇,苯甲醇,苯乙醇,苯扎氯铵,苯酚,甲酚,硫柳汞,醋酸酐,山梨酸等。作为悬浮剂,例如可列举:聚山梨醇酯80,羧基甲基纤维素钠等。4.筛选方法接着,对从试验化合物中选出na+运输性的v-atpase活性抑制剂的候选化合物的筛选方法进行说明。本发明的筛选方法,具备以下的(a)一次筛选步骤和(b)二次筛选步骤。(a)一次筛选步骤在一次筛选步骤中,从大量的化合物中仅仅选出示出atpase抑制活性的化合物。首先,从化合物库中选择具有v-atpase抑制活性的试验化合物。作为化合物库,能够利用大学等保存的化合物数据库。接着,对所选择的各个化合物,通过将v-atpase与化合物进行反应,并且测量atpase活性,从而对化合物是否对atpase产生抑制进行评价。atpase活性,能够使用钼蓝法进行测量,钼蓝法中对atp的水解产生的无机磷酸进行吸光度测量。反应条件,能够采用用于测量atpase活性的条件。作为在反应中使用的缓冲液,能够使用tris-hcl缓冲液。反应时间,虽然通常为10~60分钟,但是能够根据气温等进行适当调节。通过添加sds等表面活性剂使得v-atpase的反应停止,并添加显色液(ferroussulfate(硫酸亚铁)等)进行显色后,对650nm的吸光度进行测量,从而能够算出无机磷酸的浓度。根据上述算出的无机磷酸的浓度,能够算出v-atpase反应的抑制率。即,制作出纵轴为抑制率且横轴为化合物的浓度而绘制的图表,并求出抑制率为50%的浓度(ic50)。达到ic50的化合物的浓度越小,越以少量得到了高的v-atpase抑制效果,因此成为v-atpase活性抑制剂的候选化合物。在下文所述的实施例中,将在一次筛选步骤中选择出的ic50小于10μm的化合物(以下,记做「ic50<10μm」。)用作候选化合物。(b)二次筛选步骤二次筛选步骤,是确认在一次筛选步骤中筛选出的化合物是否可抑制微生物的生育的步骤。二次筛选步骤,至少包括(b-1)未处理评价步骤、(b-2)已处理评价步骤和(b-3)候选化合物特定步骤。(b-1)未处理评价步骤在未处理评价步骤中,对于具有v-atpase的细菌,在化合物不接触细菌的状态下,在第一ph和比所述第一ph更加碱性侧的第二ph下,对细菌的生存状态进行评价。v-atpase,通常在碱性的环境下繁殖的微生物中表达。因此,在本步骤中,在特定的ph(第一ph)和更加碱性侧的ph(第二ph)这2个环境下使微生物进行生育并观察其生育状況。在以肠球菌为对象的情况下,优选地,第一ph在ph≤7.0的范围内进行适当选择,第二ph在ph>7.0的范围内进行适当选择。例如,第一ph为ph7.0,第二ph为ph8.0等。未处理评价步骤中的微生物的培养条件(培养基、培养温度),能够根据微生物的种类适当地进行决定。例如,在微生物为肠球菌的情况下,优选在含有胰蛋白胨·酵母提取物的液体培养基中进行培养,可以根据需要添加葡萄糖等。在第一ph与第二ph下使用不同ph的培养基。另外,肠球菌的培养温度优选为30~37℃。微生物的生育状态,能够通过观察微生物的数量进行评价。微生物的数量的观察,能够使用对培养微生物的培养基的吸光度进行测量的方法、在盘等中培养微生物并对微生物的数量进行计数的方法等。在肠球菌的情况下,通过测量对波长600nm的吸光度(od600),能够评价生育状态。(b-2)已处理评价步骤:接着,在将试验化合物与细菌接触之后,与上述(b-1)同样地,在特定的ph(第一ph)和碱性侧的ph(第二ph)下对细菌的生存状态进行评价。微生物的培养、生育状态的评价,使用与(b-1)相同的条件、方法进行。(b-3)候选化合物特定步骤:接着,将(a)未处理评价步骤与(b)已处理评价步骤中的微生物的生存状态进行比较,将产生差异的试验化合物特定为细菌的抗菌剂的候选化合物。在比特定的ph更加碱性侧的ph下,如果(b)已处理的比(a)未处理的更加抑制了微生物的繁殖,那么将该试验化合物判断为具有抑制v-atpase活性的可能性,并将其选为v-atpase活性抑制剂的候选化合物。另一方面,如果在特定的ph下繁殖也被抑制,或者在比特定的ph更加碱性侧的ph下,将(a)未处理与(b)已处理进行比较,已处理的情况繁殖更多,又或者两者的繁殖程度大致相同,那么可将该试验化合物判断为不会影响v-atpase活性,并将其从v-atpase活性抑制剂的候选化合物中排除。实施例以下,基于实施例对本发明进行具体说明,但这些实施例不对本发明的内容进行任何限定。另外,在以下的实施例中,只要没有特别说明,则「%」表示质量基准(质量百分比)。(1)准备化合物、v-atpase(a)获取化合物从东京大学创药机构的的化合物库中获取成为atpase活性抑制剂的候选的化合物。获得的化合物为约70000种,对全部的化合物通过下文所述的atpase活性测量进行一次筛选。(b)v-atpase的调配v-atpase按照以下的论文中记载的方法进行调配。论文1:takeshimurata,et.al,“purificationandreconstitutionofna+-translocatingvacuolaratpasefromenterococcushirae”,j.biol.chem.272,24885-24890(1997)论文2:takeshimurata,et.al,“torquegenerationofenterococcushiraev-atpase”,j.biol.chem.289,31212-31223(2014)(2)atpase活性测量(一次筛选)atpase活性测量通过钼蓝法进行,钼蓝法中通过吸光度测量对atp的水解所产生的无机磷酸进行定量。使用96孔板进行测量,在缓冲剂(100mm的tris-hclph8.5,100mm的nacl,5mm的mgso4,10%丙三醇(glycerol))中加入0.05%ddm(n-十二烷基-β-d-麦芽糖苷(n-dodecyl-β-d-maltoside))和10μg/ml的v-atpase(从肠球菌或重组大肠菌中纯化)和20μm的化合物。添加atp至5mm,使总量为100μl并且一边使用搅拌器进行搅拌一边开始反应,反应时间为30分钟。atpase活性会根据反应温度而大幅变化,因此根据实验日的气温在10分钟~60分钟的范围内对反应时间进行调节。通过添加50μl的20%sds使得v-atpase改性而停止反应,添加75μl的显色液(5%硫酸亚铁(ferroussulfate)、1.6%钼酸铵(ammoniummolybdate)、1m硫酸(sulfuricacid))使其显色。然后立刻使用读板机测量650nm的吸光度。使用在相同的实验系统中使得0.2mm、0.5mm、1.0mm、1.5mm的4种kh2po4水溶液与mq(超纯水)进行反应而制作的标准曲线,求出无机磷酸的浓度,由此对v-atpase的活性进行测量。这里,对于抑制了50%以上的活性的化合物,阶段性地将浓度稀释为10μm、5μm、2μm、1μm、500nm、200nm、100nm、50nm,与上述同样地进行测量。(3)一次筛选结果根据上述的atpase活性测量的结果,将没有添加化合物的条件下的活性记做100,并根据与100比较得出的活性的降低,计算出抑制率。即,制作出纵轴为抑制率且横轴为化合物的浓度而绘制的图表(图2)。根据图表,求出抑制率为50%的化合物的浓度(ic50)。其结果是,ic50低于10μm(ic50<10μm)的化合物有280种,ic50低于100nm(ic50<100nm)的化合物有12种。对于ic50<10μm的280种化合物,验证其对人源hela细胞的影响,结果24种示出了毒性,因此将除此之外的256种选为候选抑制剂。从这256种之中,考虑活性较高的化合物和多样性,选出了24种化合物。这24种化合物的结构式如下所示。对于上述24种化合物,通过下文的肠球菌的生育实验进行二次筛选。(4)肠球菌的生育实验(二次筛选)肠球菌(enterococcushirae)的培养,使用在2%胰蛋白胨(tryptone)、1%酵母提取物(yeastextract)基础上添加缓冲液并调节了na+浓度的培养基。在添加葡萄糖的情况下,添加调制成50%的葡萄糖溶液,在使用培养基时添加到1%的葡萄糖。使用96孔板进行总量为200μl的培养,每隔1小时使用读板器测量od600。使用ph7.0和ph8.5的培养基,观察ph对生育产生的影响。在细菌的培养中,繁殖所必须的糖分的分解通常会导致ph大幅地变动,在该实验中维持ph恒定非常重要,因此通过添加适于各种ph的缓冲液将ph保持恒定。由于v-atpase仅仅在碱性条件下表达,因此添加抑制剂所导致的可观察到的生育抑制很大程度依赖于ph。另外,抑制剂对不具有v-atpase的细菌的生育不会产生影响。(5)二次筛选结果在下表中,记载了上述24种化合物的ic5o等。需要说明的是,下表中的「特异性」的栏的「+」表示在ph7.0下没有生育抑制且在ph8.5下有生育抑制,「-」表示在任一情况下均没有生育抑制,「n.a.」表示在任一情况下均有生育抑制。具体地,对于「+」,将ph7.0下的生育抑制率为20%以下的情况,判断为没有生育抑制。另外,对于「-」,将ph7.0和ph8.5的任一ph下的生育抑制率为20%以下的情况,判断为没有生育抑制。另外,对于「n.a.」,将在ph7.0下的生育抑制率为60%以上的情况,判断为有生育抑制。另外,对于没有观察到明确的抑制的化合物,也记入了生育抑制率作为参考。【表2】实施例等化合物分子量(mw)ic50(nm)生育抑制率(%)特异性实施例1v-6404.3798077.9+参考例1v-27319.852300064.0+实施例2v-84391.54578090.6-参考例2v-85875.09281000066.4+参考例3v-91234.33485090.9n.a.参考例4v-99311.40125006.7-参考例5v-103289.39310045.3+参考例6v-105368.4726100090.8n.a.参考例7v-115302.36494000.3-参考例8v-124340.412930049.2+实施例3v-130358.43142088.2-参考例9v-149304.3808450090.5n.a.参考例10v-150399.50850070.4n.a.参考例11v-153336.4275100013.3-参考例12v-157405.4464200084.2n.a.实施例4v-161251.32638588.7+参考例13v-170253.29911000049.7+参考例14v-171281.2877250085.6+参考例15v-189278.3501450091.2+参考例16v-201350.411400019.6-参考例17v-207437.664500012.0-实施例5v-234391.454075.5+参考例18v-278327.248525044.4+参考例19v-289352.430260055.0+另外,对于其中的「特异性」为「+」的14种,示出其生育结果的图表(图3)。横轴表示候选化合物,纵轴表示通过吸光度测量的菌的数量(%)。左端的图表是对照组,各化合物的左侧的图表表示ph7.0的培养条件下的结果,右侧的图表表示ph8.5的培养条件下的结果。如该图表所示,可知任一种候选化合物,与ph7.0相比在ph8.5下更加抑制肠球菌的生育。将上述14种化合物中的、与v-atpase的亲和性高(ic50<=400)、生育抑制效果高(生育抑制率(%)>=70%)并且没有非特异的抑制的3种化合物,特定为表示抑制效率高的v-atpase活性抑制剂的化合物。具体地,是实施例1(v-6)、实施例4(v-161)、实施例5(v-234)。特别地,根据ic50和生育抑制的结果,可认为实施例4(v-161)的化合物(2-苯基苯并咪唑衍生物)是最有用的候选化合物。另外,将虽然与v-atpase的亲和性高(ic50<=400)且生育抑制效果高(生育抑制率(%)>=70%),但是具有非特异的抑制的2种化合物(实施例2(v-84)、实施例3(v-130))也特定为候选化合物。(6)共晶化·x射线晶体结构分析将实施例4(v-161)的化合物和v-atpase的c环进行共晶化、并进行x射线晶体结构分析。使用上述的论文1以及论文2的方法,将来源于肠球菌的v-atpase在重组大肠菌中表达,并纯化为复合物后,分离出c环。将c环调配成2mg/ml,并添加v-161至500μm。在100mm的tris-hclph8.0、220mm硝酸钠(sodiumcitrate)、32%peg400的条件下,在23℃下进行结晶化。对于得到的晶体,使用作为同步放射光设备的光子工厂(photonfactory)(pf)的光束线进行x射线衍射实验。对该衍射像进行解析,以2.3□的分辨率确定结构。其结果在图4以及图5中示出。需要说明的是,关于x射线晶体结构分析的详细的方法,能够参照与肠球菌v-atpase的c环的x射线晶体结构分析相关的以下的论文。论文3:takeshimurata,et.al,“structureoftherotorofthev-typena+-atpasefromenterococcushirae”science308,654-659(2005)如图4(a)所示,飘带状表示c环的螺旋线,周围的棒状表示脂质分子和表面活性剂分子,中央部的粒表示钠离子。图4(b)是放大显示图4(a)中用方框包围的部位的图。另外,图5是电子密度图,左侧表示c环的整体结构,中央和右侧表示将v-161的结合位置逐渐放大的结构。根据这些结构可知,v-161与包括c环的第52个苯丙氨酸的其周围的氨基酸残基进行相互作用而结合于其外周面。(7)2-苯基苯并咪唑衍生物的化合物展开对于具有与v-161共同的骨架的其他的2-苯基苯并咪唑衍生物,进行合成展开。化合物是以下(v-161-01)~(v-161-10)的10种。化合物的结构式如下所示。对于这些化合物,使用与「(2)atpase活性测量」相同的方法,评价atpase活性的抑制效果。其结果在下表中示出。需要说明的是,参考例4-02(v-161-06)没有ph导致的活性的特异性(ph7.0和ph8.5双方均有高活性),参考例4-05(v-161-09)没有观察到活性。【表3】实施例等化合物分子量(mw)ic50(nm)生育抑制率(%)特异性实施例4v-161251.338588.7+实施例4-01v-161-01277.375089.7+实施例4-02v-161-02236.3212088.5+实施例4-03v-161-03287.1612089.8+实施例4-04v-161-04334.1612090.3+参考例401v-161-05364.1950087.5+参考例4-02v-161-06362.2160085.5n.a.参考例4-03v-161-07208.26100076.2+参考例4-04v-161-08194.24200018.5+参考例4-05v-161-09330.23没有活性--实施例4-05v-161-10238.2912086.8+将这些结果中的、与v-atpase的亲和性高(ic50<=400)、生育抑制效果高(生育抑制率(%)>=70%)并且没有非特异的结合的实施例4-01(v-161-01)~实施例4-04(v-161-04)、实施例4-05(v-161-10)这5种化合物,特定为抑制効率高的v-atpase活性抑制剂。另一方面,参考例4-04(v-161-08)和参考例4-05(v-161-09),均没有观察到atpase活性的抑制效果。(8)对病原性细菌的抗菌作用的确认对于具有与肠球菌(enterococcushirae)类似的v-atpase的病原性细菌,与上述「(4)肠球菌的生育实验」同样地,确认v161是否示出生育抑制。作为病原性细菌,准备万古霉素耐性肠球菌(vre)的粪肠球菌(enterococcusfaecalis),屎肠球菌(enterococcusfaecium)、与肠内环境的恶化相关的多耐药性的难辨梭菌(clostridiumdifficile)。vre使用ph7.0、ph7.5、ph8.0的培养基进行培养,c.difficile使用ph6.5、ph7.0,ph7.5的培养基进行培养,测量od600确认菌数量之差。其结果在图6、图7中示出。图6是万古霉素耐性肠球菌(vre)的结果,左侧是e.faecalis的数据,右侧是e.faecium的数据。该图中从上往下依次为ph7.0、ph7.5、ph8.0的数据。根据该图可知,任一种病原菌的生育均依赖于ph地受到抑制,v-161具有v-atpase的活性抑制的碱性条件下的特异的生育抑制活性。另外能够确认,与e.faecalis相比e.faecium受到的v-161的影响更强。图7是病原性clostridium属细菌的数据。该图中从上往下依次为ph6.5、ph7.0、ph7.5的数据。该图给出如下启示:c.difficile在中性·酸性条件下生育也被抑制,在病原性clostridium属细菌中v-atpase表达的ph范围较广,在中性·酸性条件下v-161也起作用。(9)肠内环境的作用条件的确认使用小鼠(c57bl/6,♀,6周龄,体重约15g),调查v-161对肠内环境的影响。使用soybeanpc和碳酸氢钠(メイロン)使得v-161悬浊并且使其成为20mm。对4只小鼠分别每天1次口服投喂0.5ml的悬浊液,在5天后解剖并采集粪便、肠道内容物,对肠内ph和钠离子浓度进行测量。其结果在图8中示出。图的上半部表示肠内ph,下半部表示钠离子浓度。根据该结果可知,特别是在小肠中,是v-atpase表达且适合v-161起作用的ph环境。另外,就算是大量投喂v-161,也没观察到对小鼠的毒性。(10)小鼠肠内环境(高蛋白饲料·抗生物质投喂)的确认在高蛋白的饮食下,通常所谓的坏菌会增加并且肠内环境会紊乱,抗生物质的投喂通常会引起肠内细菌的显著减少并且与病原菌的固着·感染相关,因此在这2个模型下进行验证。首先,分别制作出对于3只小鼠分别给予高蛋白饲料(蛋白质65%)的模型和给予通常的饲料(蛋白质25%)的模型。另外,制作出通过饮水给小鼠投喂抗生物质(氨苄青霉素1g/l)的模型,和投喂通常的饮水的模型。均在一周后解剖,采集肠管内容物并测量ph。其结果在图9中示出。图的上半部示出投喂高蛋白饲料的小鼠的结果,下半部示出投喂抗生物质的小鼠的结果。在任意模型中可观察到,在小肠中ph稍微上升,在盲肠·大肠中ph大幅上升,通常呈酸性的肠内环境变成碱性。根据这些结果可以推测,在恶化的肠内环境中,ph有升高的倾向,与通常的情况相比v-atpase抑制剂更容易起作用。(11)vre感染小鼠的试验使利用抗生物质进行处理后的小鼠感染vre的e.faecium,并投喂v-161。抗生物质以及v-161的投喂量等试验条件,与「(9)肠内环境的作用条件的确认」,「(10)小鼠肠内环境(高蛋白饲料·抗生物质投喂)的确认」是相同条件。其结果在图10中示出。该图的上半部示出小肠的结果,下半部示出盲肠·大肠·粪便的结果。另外,该图的纵轴表示vre的活菌数量。由该图可知,与对照组相比,添加了v-161的情况下小肠中的vre显著减少(减少97%)。另外,与对照组相比,盲肠·大肠·粪便中的vre,在添加了v-161的情况下均明显地减少(减少约50%)。即,可知v-161在小鼠肠内示出了vre的繁殖抑制效果。(12)(1,2,4-恶二唑-3-基)苯基衍生物对于具有与v-234共同的骨架的其他(1,2,4-恶二唑-3-基)苯基衍生物,进行合成展开。化合物是以下(v-234-01)~(v-161-03)的3种。包含v-234的各化合物的结构式如下所示。对于这些化合物,使用与「(2)atpase活性测量」相同的方法,对atpase活性的抑制效果进行评价。其结果在下表中示出。【表4】实施例等化合物分子量ic50(nm)生育抑制率(%)实施例5v-234391.454075.5实施例5-01v-234-01419.505076.9实施例5-02v-234-02405.484074.8实施例5-03v-234-03419.50672.0实施例5-01~5-03的化合物中的任一者,与v-atpase的亲和性高(ic50<=400),生育抑制效果高(生育抑制率(%)>=70%),并且没有非特异的结合。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1