重构脂质体安那霉素的方法与流程
重构脂质体安那霉素的方法
1.本技术要求于2019年6月28日提交的美国临时申请号62/868,190的优先权权益,其披露内容通过引用特此并入,如同本文以其全文书写一样。
2.安那霉素(annamycin)是蒽结构家族的癌症化学治疗剂。由于其物理和药理学特性,已经描述了安那霉素组合物的剂型,其中将药物配制成脂质体(参见us 7,238,366)。已针对患有复发性难治性急性淋巴母细胞性白血病的成人患者(m.wetzler等人,clinical lymphoma,myeloma and leukemia[临床淋巴瘤、骨髓瘤和白血病],13(4),430-434 2013年8月)和在多柔比星抗性乳腺癌的治疗中(d.j.booser等人,cancer chemother.pharmacol[癌症化疗与药理学].50;6-8,2002)描述了脂质体安那霉素的临床试验。
[0003]
在药物递送系统中,期望能够产生具有一致纯度和质量的药物配制品,以确保施用正确的剂量,从而提供最有效的治疗,同时避免由杂质引起的不期望的副作用。此外,维护不良或配制不当的药物材料可能在施用前被分解,导致其无效,从而浪费昂贵的活性药物成分。监管标准还必须按照标签上指定的程序提供一致水平的药物纯度和药物量。
[0004]
安那霉素由于其固有的物理特性以及母体药物和脂质体配制品两者在某些条件下固有的不稳定性,给配制带来特别困难的挑战。因此,找到能确保纯度并避免分解的用于制备脂质体安那霉素剂型的一致方法将是有利的。
技术实现要素:
[0005]
提供了重构安那霉素脂质体前体冻干物以形成脂质体安那霉素悬浮液的方法。
[0006]
还提供了重构安那霉素的方法,该方法包括:将预温热的盐水添加至有安那霉素脂质体前体冻干物的一个或多个容器中,以形成浓度为约0.5-1.5mg/ml的悬浮的脂质体安那霉素;将所述一个或多个容器维持在24℃-45℃;用预温热的盐水稀释所述悬浮的脂质体安那霉素,以提供盐水中浓度为约0.5-1.5mg/ml的脂质体安那霉素;以及在稀释期间和稀释后,将有悬浮的脂质体安那霉素的所述一个或多个容器和所述稀释的脂质体安那霉素维持在24℃-45℃。
[0007]
还提供了制备有效剂量的安那霉素的重构的脂质体配制品的方法,该方法包括:在烘箱或袋式加温器(bag warmer)中,在37℃
±
4℃,将各自含有盐水(约)0.9%水性注射usp氯化钠的注射器和非pvc iv袋温热至少约3个小时,其中注射器中盐水的体积等于待重构的安那霉素脂质体前体冻干物的重量,该体积以ml计,该重量以mg计,并且所述iv袋中盐水的体积等于所有注射器中盐水的总量,并且所述iv袋的容积足够容纳用于稀释脂质体安那霉素的总剂量的盐水和脂质体安那霉素的总体积;从冰箱中取出足够数量的含有安那霉素脂质体前体冻干物的小瓶以提供所需的
安那霉素总剂量,并使这些小瓶在室温静置30分钟至2小时;剧烈摇动每个有安那霉素脂质体前体冻干物的小瓶以打碎任何干饼;从充气注射器(air filled syringe)向每个小瓶中注入空气,直到每个小瓶中的压力均衡为止;将在烘箱内保持在37℃
±
4℃的注射器中的37℃
±
4℃盐水体积添加到小瓶中,该小瓶含有重量当量小瓶的安那霉素脂质体前体冻干物,使得最终的安那霉素浓度为约1mg/ml,并且在整个添加盐水过程中保持负压;立即用手剧烈来回摇动该小瓶15秒,然后将该小瓶放入可重新密封的聚乙烯储存袋中;重复以下项:添加盐水,摇动小瓶,并且将该小瓶放入储存袋中,直到将安那霉素总剂量所需的所有小瓶都同样制备好为止;第二次摇动所有小瓶,每次摇动2-4个,持续1-2分钟;将有重构的脂质体安那霉素的所有小瓶储存在37℃
±
4℃直至准备稀释,其持续30分钟至1小时;从37℃
±
4℃的储存中取出有重构的脂质体安那霉素的小瓶,一次取出不超过两个,然后将每个小瓶轻轻颠倒一次,从小瓶中取出无泡沫的悬浮液,同时在整个悬浮液取出过程中维持负压;将取出的重构的脂质体安那霉素的无泡沫的悬浮液缓慢引入有盐水的预温热的非pvc iv袋中,其如上所述进行制备,并对第二个小瓶重复此过程;重复以下步骤:取出小瓶,取出悬浮液,并且将该悬浮液引入预温热的iv袋中直到将安那霉素总剂量所需的有重构的脂质体安那霉素的所有小瓶都引入非pvc iv袋中,提供含有浓度为约0.5mg/ml的最终重构的脂质体安那霉素的iv袋;以及通过轻轻颠倒容器数次且不产生泡沫,搅动该iv袋中的盐水和重构的脂质体安那霉素。
[0008]
还提供了治疗癌症的方法,该方法包括向有需要的患者施用有效剂量的稀释的脂质体安那霉素,其通过以下制备:将预温热的盐水添加至有安那霉素脂质体前体冻干物的一个或多个容器中,以形成浓度为约0.5-1.5mg/ml的脂质体安那霉素悬浮液;将所述一个或多个容器维持在24℃-45℃;用预温热的盐水稀释所述悬浮的脂质体安那霉素,以提供盐水中浓度为约0.3-0.7mg/ml的脂质体安那霉素;以及在稀释期间和稀释后,将有悬浮的脂质体安那霉素的所述一个或多个容器和所述稀释的脂质体安那霉素维持在24℃-45℃。
[0009]
还提供了根据上述方法制备的稀释的重构的脂质体安那霉素在制造用于治疗癌症的药物中的用途。
[0010]
还提供了根据上述方法制备的稀释的重构的脂质体安那霉素,用于在治疗癌症中使用。
附图说明
[0011]
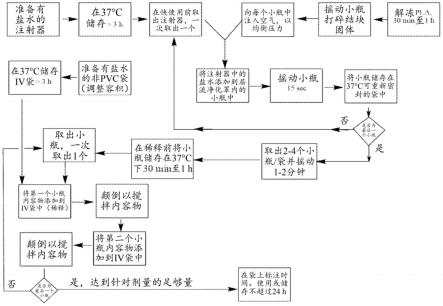
图1.举例说明从安那霉素脂质体前体冻干物重构脂质体安那霉素的方法的示意图。
[0012]
图2.20℃-25℃样品的直方图结果覆盖图。
[0013]
图3.28℃-42℃样品的直方图结果覆盖图。
[0014]
图4.20℃-42℃样品的直方图结果覆盖图。
具体实施方式
[0016]
提供了制备具有改善的稳定性和高纯度的脂质体安那霉素的配制品的方法。定义
[0017]
除非另外定义,否则本文使用的所有技术和科学术语均具有本发明所属领域的技术人员通常所理解的相同的含义。
[0018]
如本文所用,以下术语具有如下定义的含义。
[0019]
术语“安那霉素”意指化合物(7s,9s)-7-(((2r,3r,4r,5r,6s)-4,5-二羟基-3-碘-6-甲基四氢-2h-吡喃-2-基)氧基)-6,9,11-三羟基-9-(2-羟基乙酰基)-7,8,9,10-四氢并四苯-5,12-二酮,其具有以下结构:
[0020]
术语“脂质体(liposomes、liposomal)”等意指通常为球形的结构,其包含脂质、脂肪酸、脂质双层类型的结构、单层囊泡和无定形脂质囊泡。经典地,脂质体是完全封闭的脂质双层膜,其含有截留的水体积。脂质体包括非经典形式,其中安那霉素可以在双层内部、作为双层的一部分、和吸附到双层上。脂质体可以是单层囊泡(具有单个的双层膜)或多层囊泡(特征为多个膜双层的洋葱状结构,每个膜双层与下一个膜双层都由水层隔开)。双层由具有疏水“尾”区和亲水“头”区的两个脂质单层组成。膜双层的结构使得脂质单层的疏水(非极性)“尾”朝向双层的中心,而亲水“头”朝向水相。
[0021]
术语“脂质体前体冻干物(preliposome-lyophilizate和preliposomal lyophilizate)”意指在添加水溶液时将形成脂质体的非水性材料。在一些实施例中,非水性材料为干燥的(如在非液体、非凝胶中的)材料。冻干物广泛用于包括来自非挥发性物质的冷冻液体升华的干燥残余物、旋转蒸发和类似程序的残余物、以及在添加水相时(伴随或不伴随搅拌)将产生脂质体的干燥组合物。特别要理解的是,“脂质体前体冻干物”不是冻干后的脂质体形式。
[0022]
术语“安那霉素脂质体前体冻干物”是一种脂质体前体冻干物,其中药物是安那霉素。在一些实施例中,根据美国专利公开2005/0238707(出于所有目的通过引用并入本文)
中示出的程序制备冻干物。
[0023]
术语“预温热的”意指将制品或溶液或悬浮液温热至约24℃-45℃(例如30℃-45℃,例如37℃
±
4℃或37℃
±
2℃、37℃
±
1℃)的温度。
[0024]
术语“高纯度安那霉素脂质体前体冻干物”意指使用经验证的标准样品通过hplc分析的材料纯度不低于95%安那霉素。在一些实施例中,安那霉素为至少96%纯的、或至少97%纯的、或至少98%纯的、或至少99%纯的。
[0025]
在前面的部分中,使用了许多缩写词和首字母缩写词,其完整说明提供如下:dmpc 二肉豆蔻酰磷脂酰胆碱dmpg 1,2-二肉豆蔻酰基-sn-甘油-3-磷酸-(1
’‑
外消旋甘油)(钠盐)dmso 二甲亚砜iv 静脉内dehp 双(2-乙基己基)邻苯二甲酸酯pla 安那霉素脂质体前体冻干物pvc 聚氯乙烯wfi 注射用水;符合美国药典(usp)
[0026]
贯穿本说明书和以下的权利要求书,除非上下文另有要求,“包含”一词或变型如“包括”或“含有”应当被理解为暗示包含一个所陈述的整体或步骤、或多个整体或步骤的组,但不排除任何其他整体或步骤、或多个整体或步骤的组。本文旨在通过列举此类指定范围,所列举的范围还包括所引用范围之间的所有那些特定的整数量。例如,约24℃-45℃的范围也旨在涵盖24℃、30℃、33℃、34℃、35℃、36℃、37℃、38℃、39℃、40℃和45℃。
[0027]
在本专利说明书中提到的每个美国专利和国际专利申请的全部披露内容出于所用目的通过引用完全并入本文。
[0028]
还提供了制备具有优越均匀性和稳定性的脂质体安那霉素的方法。提供了制备具有优越均匀性和稳定性的脂质体安那霉素的新颖方法。特别地,提供了重构安那霉素的方法,此方法包括:将预温热的盐水添加至有安那霉素脂质体前体冻干物的一个或多个容器中,以形成浓度为约0.5-1.5mg/ml的悬浮的脂质体安那霉素;将所述一个或多个容器维持在24℃-45℃;用预温热的盐水稀释所述悬浮的脂质体安那霉素,以提供盐水中浓度为约0.5-1.5mg/ml的脂质体安那霉素;以及在稀释期间和稀释后,将有悬浮的脂质体安那霉素的所述一个或多个容器和所述稀释的脂质体安那霉素维持在24℃-45℃。
[0029]
在一些实施例中,脂质体安那霉素悬浮液的浓度为0.5-1.5mg/ml。在一些实施例中,脂质体安那霉素悬浮液的浓度为0.8-1.2mg/ml。在一些实施例中,脂质体安那霉素悬浮液的浓度为约1mg/ml。
[0030]
在一些实施例中,在添加到含预温热盐水的iv袋中的稀释悬浮液中,安那霉素的总重量等于所需的有效剂量。
[0031]
在一些实施例中,悬浮的脂质体安那霉素通过将其添加到预温热的含盐水的iv袋中进行稀释。在一些实施例中,含盐水的iv袋的温度为30℃-45℃。在一些实施例中,含盐水
的iv袋的温度为37℃
±
4℃。
[0032]
在一些实施例中,重构的脂质体安那霉素在24℃或高于24℃形成。在一些实施例中,重构的脂质体安那霉素在稀释前和稀释期间、以及在输注前和输注期间维持在24℃或高于24℃。出人意料地发现脂质体安那霉素在24℃以下是不稳定的。
[0033]
在一些实施例中,重构的脂质体安那霉素维持在30℃-45℃的温度下。在一些实施例中,重构的脂质体安那霉素维持在30℃-42℃的温度下。在一些实施例中,重构的脂质体安那霉素维持在37℃
±
4℃的温度下。在一些实施例中,脂质体安那霉素的悬浮液维持在37℃或接近37℃,并且稀释的脂质体安那霉素维持在37℃或接近37℃。
[0034]
在一些实施例中,稀释的脂质体安那霉素的浓度为约0.5mg/ml。
[0035]
在一些实施例中,在iv滴线上使用保护套,以确保在37℃
±
4℃或高于37℃
±
4℃的温度下递送稀释的脂质体安那霉素。在一些实施例中,该套是加热的。在一些实施例中,该套是绝缘的。
[0036]
在一些实施例中,重构安那霉素的方法包括:将37℃
±
4℃的盐水添加至有安那霉素脂质体前体冻干物的一个或多个容器中,以形成浓度为约1mg/ml的悬浮的脂质体安那霉素;将所述一个或多个容器维持在37℃
±
4℃;用37℃
±
4℃的盐水稀释所述悬浮的脂质体安那霉素,以提供盐水中浓度为约0.5mg/ml的脂质体安那霉素;以及在稀释期间和稀释后,将有悬浮的脂质体安那霉素的所述一个或多个容器和所述稀释的脂质体安那霉素维持在37℃
±
4℃。
[0037]
在一些实施例中,在施用前和施用期间,将稀释的脂质体安那霉素维持在37℃
±
4℃。
[0038]
在一些实施例中,有冻干的安那霉素的容器是在添加预温热的盐水以允许充分混合以形成脂质体之后顶部空间为至少4ml的小瓶。在一些实施例中,小瓶的大小为50ml。
[0039]
在一些实施例中,制备有效剂量的安那霉素的重构的脂质体配制品的方法包括:在烘箱或袋式加温器中,在37℃
±
4℃,将各自含有盐水(约)0.9%水性注射usp氯化钠的注射器和非pvc iv袋温热至少约3个小时,其中注射器中盐水的体积等于待重构的安那霉素脂质体前体冻干物的重量,该体积以ml计,该重量以mg计,并且所述iv袋中盐水的体积等于所有注射器中盐水的总量,并且所述iv袋的容积足够容纳用于稀释脂质体安那霉素的总剂量的盐水和脂质体安那霉素的总体积;从冰箱中取出足够数量的含有安那霉素脂质体前体冻干物的小瓶以提供所需的安那霉素总剂量,并使这些小瓶在室温静置30分钟至2小时;剧烈摇动每个有安那霉素脂质体前体冻干物的小瓶以打碎任何干饼;从充气注射器向每个小瓶中注入空气,直到每个小瓶中的压力均衡为止;将在烘箱内保持在37℃
±
4℃的注射器中的37℃
±
4℃盐水体积添加到小瓶中,该小瓶含有重量当量小瓶的安那霉素脂质体前体冻干物,使得最终的安那霉素浓度为约1mg/ml,并且在整个添加盐水过程中保持负压;
立即用手剧烈来回摇动该小瓶15秒,然后将该小瓶放入可重新密封的聚乙烯储存袋中;重复以下步骤:添加盐水,摇动小瓶,并且将该小瓶放入储存袋中,直到将安那霉素总剂量所需的所有小瓶都同样制备好为止;第二次摇动所有小瓶,每次摇动2-4个,持续1-2分钟;将有重构的脂质体安那霉素的所有小瓶储存在37℃
±
4℃直至准备稀释,其持续30分钟至1小时;从37℃
±
4℃的储存中取出有重构的脂质体安那霉素的小瓶,一次取出不超过两个,然后将每个小瓶轻轻颠倒一次,从小瓶中取出无泡沫的悬浮液,同时在整个悬浮液取出过程中维持负压;将取出的重构的脂质体安那霉素的无泡沫的悬浮液缓慢引入有盐水的预温热的非pvc iv袋中,其如上所述进行制备,并对第二个小瓶重复此过程;重复以下步骤:取出小瓶,取出悬浮液,并且将该悬浮液引入预温热的iv袋中直到将安那霉素总剂量所需的有重构的脂质体安那霉素的所有小瓶都引入非pvc iv袋中,提供含有浓度为约0.5mg/ml的最终重构的脂质体安那霉素的iv袋;以及通过轻轻颠倒容器数次且不产生泡沫,搅动该iv袋中的盐水和重构的脂质体安那霉素。
[0040]
在一些实施例中,安那霉素脂质体前体冻干物由安那霉素、一种或多种脂质和一种或多种非离子型表面活性剂组成。在一些实施例中,脂质包含dmpc和dmpg,并且非离子型表面活性剂包含聚山梨酯型表面活性剂,其由乙氧基化山梨聚糖然后添加羧酸而形成。在一些实施例中,非离子型表面活性剂包含聚氧化乙烯脱水山梨聚糖单月桂酸酯。在一些实施例中,安那霉素脂质体前体冻干物包含1.8-2.2wt%安那霉素、3.0-3.4wt.%聚山梨酯20、以及94.4-95.2wt.%选自dmpc和dmpg的脂质。在一些实施例中,dmpc为65.3-67.3wt.%并且dmpg为27.1-29.9wt.%。
[0041]
还提供了向有需要的患者输注有效剂量的重构的脂质体安那霉素的方法,该重构的脂质体安那霉素是通过上述方法由安那霉素脂质体前体冻干物制备,其中在整个重构和施用过程中脂质体配制品的温度维持在37℃
±
4℃,并在24小时内使用。
[0042]
还提供了上述重构的脂质体安那霉素在癌症治疗中的用途,包括向有需要的患者施用有效剂量的如上所述制备的稀释的脂质体安那霉素。在一些实施例中,癌症选自乳腺癌、白血病、急性髓细胞性白血病、急性淋巴母细胞性白血病、胃癌、霍奇金淋巴瘤和非霍奇金淋巴瘤、卵巢癌、甲状腺癌、结肠癌、传统细胞膀胱癌和维尔姆斯瘤。
[0043]
如本文所述制备的重构的脂质体安那霉素对特定人类癌症(如乳腺癌、白血病(包括急性髓细胞性白血病(aml)和急性淋巴母细胞性白血病)、胃癌、霍奇金淋巴瘤和非霍奇金淋巴瘤、卵巢癌、甲状腺癌、结肠癌、传统细胞膀胱癌、和维尔姆斯瘤)的治疗是有用的。剂量和施用途径。
[0044]
通常,将重构的脂质体配制品在重构后24小时内用于治疗患有将受益于其治疗的病症的患者。静脉内施用药物通过标准方式实现,并取决于剂量而在110至130min内完成。
[0045]
将脂质体安那霉素用于治疗哺乳动物(特别是人)的癌症的方法中和抑制哺乳动物(特别是人)的肿瘤生长的方法中。可以治疗的癌症包括白血病和淋巴瘤。特别地,安那霉
素可用于治疗白血病,包括急性髓细胞性白血病(aml)、慢性髓细胞性白血病(cml)、急性淋巴细胞性白血病(all)和慢性淋巴细胞性白血病(cll)。脂质体安那霉素可用于治疗淋巴瘤,包括霍奇金淋巴瘤和非霍奇金淋巴瘤。方法包括向哺乳动物施用有效量的药物组合物。
[0046]
施用步骤可以适当地是胃肠外的,并且可以通过静脉内注射、动脉内注射、肌内注射、淋巴管内注射、腹膜内注射、皮下注射、胸膜内注射、鞘内注射,或通过局部应用剂量进行。在一些实施例中,通过静脉内施用安那霉素。在一些实施例中,这样的施用是重复剂量方案直至达到肿瘤消退或消失,并且可以与肿瘤疗法(如手术或用不同药剂的化疗)的形式结合使用。在一些实施例中,针对施用组合物的哺乳动物受试者,组合物的施用剂量在约120至250mg/m2之间。
[0047]
本发明通过以下实例进一步说明,这些实例决不以任何方式解释为限制本发明的范围。相反,应该清楚地理解的是,在不脱离本发明的精神和/或所附权利要求的范围的情况下,可以采用各种其他实施例、修改及其等效物,并且本领域技术人员在阅读本文的说明后可以想到这些实施例、修改及等同物。实例1通用方法a.材料
[0048]
将安那霉素脂质体前体冻干物制备成粉末,其包含dmpc、dmpg和聚山梨酯20以及安那霉素。
[0049]
二肉豆蔻酰磷脂酰胆碱(dmpc)和1,2-二肉豆蔻酰基-sn-甘油-3-[磷酸-外消旋-(1甘油)]钠盐(dmpg)可作为干粉获得自日本大阪的日本精细化工公司(nippon fine chemicals,inc.)。
[0050]
如前所述并稍作修改而合成安那霉素,其作为thf溶剂化物(纯度》95%)(mw=640.39)(horton,d.,priebe,w.4-demethoxy-3'-desamino-2'-halo-anthracyclines and pharmaceutical compositions containing same[4-脱甲氧基-3'-脱氨基-2'-卤代蒽环类及含有其的药物组合物.]美国专利号4,537,882,1985)。
[0051]
生理盐水获得自伊利诺伊州北芝加哥的雅培实验室(abbott laboratories)。
[0052]
在以下实例中,安那霉素脂质体前体的重构根据以下方法进行:步骤1:制备盐水注射器和iv袋
[0053]
所有程序均在层流净化罩或绝对无尘室中使用无菌技术进行。
[0054]
制备盐水(0.9%氯化钠,注射usp)的注射器(45ml),每个注射器对应一个待使用的有脂质体安那霉素的45mg小瓶。这些盐水注射器用于重构安那霉素脂质体前体。例如,对于360mg总剂量的脂质体安那霉素,制备了八个注射器。
[0055]
将注射器放入37℃的烘箱或iv袋式加温器中至少2-3小时。
[0056]
制备容纳另外体积盐水的非pvc iv袋,该体积等于用于重构安那霉素脂质体前体的注射器中盐水的总体积。iv袋的大小足以容纳两倍的注射器中盐水的体积。例如,如果研究药物的总剂量为360mg,则需要八(8)个安那霉素脂质体前体的45-mg小瓶,每个需要装45ml盐水或总共需要装360ml盐水。因此,制备了还容纳360ml盐水的非pvc iv袋。这通过从标准的1,000ml盐水非pvc iv袋中除去640ml盐水来完成。1000ml iv袋的尺寸足以容纳袋中剩余盐水的两倍体积,即2x 360ml=720ml。
[0057]
在可商购的iv袋式加温器(根据制造商的说明已预热至约37℃)或烘箱(已加热至37℃)中将制得的盐水iv袋进行温热。将iv袋在用于随后步骤之前放入袋式加温器或烘箱中约2-3h,以使该iv袋达到约37℃的温度。步骤2:重构安那霉素脂质体前体冻干物
[0058]
从冰箱中取出安那霉素脂质体前体冻干物的小瓶(每个有45mg安那霉素,不包括thf溶剂化物重量),其组合重量足以提供药物总所需剂量,并将这些小瓶在室温静置约30分钟至约2小时。剧烈摇动小瓶以打碎安那霉素脂质体前体冻干物可能形成的任何干饼。
[0059]
将小瓶移至层流净化罩,并通过充气注射器将空气注入每个小瓶中,直到压力均衡为止。从37℃烘箱或预热至37℃的iv袋式加温器中取出(一次一个)有45ml盐水的注射器,并立即用于重构。将袋式加温器或烘箱放置在重构安那霉素脂质体前体冻干物的罩中或靠近罩的地方,以最小化可能的冷却。当与冻干的药物产品在小瓶中混合时,用于重构的盐水为37℃(
±
4℃)。
[0060]
从袋式加温器或烘箱中取出(一次一个)注射器,然后立即与安那霉素脂质体前体冻干物混合。例如,从37℃ iv袋式加温器或烘箱中取出有45ml盐水的注射器,然后将45ml的37℃盐水添加到有安那霉素脂质体前体冻干物的第一个45-mg小瓶中,最终安那霉素的浓度约为1mg/ml),添加后使用刚好刺穿隔片的针头使得小瓶内的压力达到常压。取下针头,并立即用手将小瓶剧烈摇晃2分钟,置于拉链密封的塑料袋中,然后放回37℃的烘箱或袋式加温器中。
[0061]
然后以类似的方式,从37℃ iv袋式加温器或烘箱中取出(一次一个)另外的45ml盐水注射器,并将45ml的37℃盐水添加到安那霉素脂质体前体冻干物的每个另外的45-mg小瓶中、摇动并置于密封的塑料袋中。将每个小瓶置于其各自的塑料袋中,然后放入烘箱或袋式加温器中,直到重构安那霉素脂质体前体的总剂量所需的所有小瓶。
[0062]
当所有小瓶都已被重构并放入烘箱或袋式加温器中后,取出两到四个小瓶,再摇动1-2分钟,然后放回烘箱或袋式加温器中。直到第二次摇动所有小瓶为止。使小瓶在37℃静置30分钟至1小时,然后如下面的步骤2中所述稀释到最终的iv袋中。
[0063]
对重构的安那霉素样品进行粒度分析,并确定其平均粒度始终为约8μm,50%分布在约5-10μm的范围内,而90%分布在约2-20μm的范围内。
[0064]
步骤3:脂质体安那霉素稀释到iv袋中
[0065]
在重构脂质体安那霉素的约一小时内完成对脂质体安那霉素的稀释。在转移到iv袋中进行稀释之前,如步骤2所述制备的重构的脂质体安那霉素小瓶应维持在约37℃,并且直到稀释前才立即将其从37℃的烘箱中取出。
[0066]
将如上述步骤2中所述制备的重构的脂质体安那霉素小瓶(45mg于45ml盐水中,含有在约37℃的测量数量的盐水用于稀释)从37℃的烘箱中取出(一次一个),该小瓶)。将小瓶轻轻颠倒,并经由注射器取出脂质体悬浮液。如果需要使压力均衡,则将隔片刺穿1秒,取下针头,然后继续取出药物。立即将悬浮液缓慢转移(以免产生泡沫)到如步骤1制备的预温热的非pvc iv袋中。注意避免转移任何泡沫。
[0067]
以类似的方式,从烘箱中取出(一次一个)足以提供所需总剂量的安那霉素脂质体前体的另外的小瓶,轻轻颠倒,通过注射器取出脂质体安那霉素悬浮液,并立即缓慢转移至预温热的非pvc iv袋的内容物中,直到将所有小瓶转移到含有用于稀释的盐水的非pvc iv
袋中。通过轻轻颠倒容器数次(避免产生泡沫),将iv袋中的盐水和脂质体安那霉素混合。时间记录到iv袋上。最终的脂质体安那霉素浓度为约0.5mg/ml。
[0068]
在整个步骤中,通过立即将iv袋转移到预温热的iv袋式加温器中,将有稀释的重构的脂质体安那霉素的iv袋维持在约37℃。
[0069]
准备好将iv袋式加温器转移到患者输液室时,拔掉其电源插头,在30分钟至60分钟内将其转移患者附近并立即插电用于输注。在输注至患者之前和输注期间,将稀释的脂质体安那霉素悬浮液维持在约37℃。
[0070]
当维持在约37℃时,用盐水稀释的重构脂质体安那霉素在24小时内是稳定的,此后该药物不适合施用于受试者。仅将非pvc管和非dehp管用于药物施用。
[0071]
注意记录从重构开始直到2小时输注完成为止的时间。从重构时间到完成输注的时间相隔不得超过24小时。实例2温度研究
[0072]
对每个样品进行外观测试。在每个温度下重构样品材料后,立即进行另外的外观观察。还记录了在粒度测试期间出现的任何外观变化。
[0073]
重构样品材料之前和之后立即获得的外观结果以及粒度测试后的外观如下所示。所有样品的重构结果之前的外观均与目标限值相同。但是,重构后的外观取决于温度。随着样品温度的升高,未分散颗粒的可能性降低。在20℃-25℃之间的温度下观察到未分散颗粒的簇,而在28℃-42℃之间的温度下则没有这些簇的迹象。另外,该表显示在粒度测试结束后重构后的外观变化仅限于较低温度下的变化。这些较低温度样品趋向于分散重构后立即存在的颗粒簇,尽管并不总是完全分散。不出所料,较高温度样品的外观保持不变,这是因为重构后不会立即存在未分散的颗粒簇。
*这些观察是在样本分析时(在重构后的外观后约1-2小时之间)进行的
[0074]
使用激光衍射粒度分析仪进行粒度研究。制备单个样品并针对37℃(标称)、20℃、23℃、25℃、28℃、30℃和42℃中的每个温度进行分析。样品制备(即,孵育温度等)和分析(即,仪器分散剂温度等)的每个步骤均在指定的温度下进行。
[0075]
从粒度分析温度研究获得的结果如下所示。直方图结果覆盖图在图2-图4中示出。总体而言,在20℃-25℃之间的样品粒度结果与目标限值显著不同,而在28℃-42℃之间的样品结果相似。20℃样品的极大粒度结果表明,样品材料在重构时未形成脂质体。在23℃-25℃之间的样品结果明显小于目标限值,这表明脂质体正在形成过程中。在28℃-42℃之间的样品结果要稳定的多,并且与目标限值相似。这指示脂质体已经完全形成并且在该温度范围内相当稳定。但是,应注意的是,28℃的样品结果不在目标限值范围内。这突显出,尽管在25℃-28℃的温度范围内发生了粒度转变,但直到达到约30℃的温度后脂质体才可能完全形成。最后,应注意的是,当查看28℃-42℃样品的结果时,dv90结果随温度升高而增加。
*标称注意:为改善数据解释,全精度值显示为3位有效数字
[0076]
外观和粒度结果均表明温度对重构的药物产品脂质体的粒度分布有影响。在20℃-25℃之间的温度下进行重构会使颗粒簇不分散,而这些温度下的粒度结果差异很大。在28℃-42℃之间的温度下时,外观和粒度结果要稳定得多,这指示过渡温度范围为约25℃-28℃。所有这些数据指示,药物产品应被重构且维持在温度在约30℃-42℃之间。
[0077]
尽管已经参考特定实施例和实例描述了本发明,但是本领域技术人员认识到可以在不脱离本发明的精神和范围的情况下对本发明进行各种修改。
[0078]
本文引用的所有参考文献,包括专利、专利申请和出版物,通过引用以其全文并入本文。无论先前是否特别并入。
[0079]
在上面的各个部分中提及的本发明的各种特征和实施例适当地在进行必要的变更后适用于其他部分。因此,一个部分中指定的特征可以与其他部分中指定的特征进行适当组合。
[0080]
对一些特定实施例的以上描述提供了足够的信息,使得其他人可以在不偏离一般概念的情况下,通过应用现有知识将此类实施例容易地针对各种应用而修改和/或调整,因此,此类调整和修改应当并且旨在涵盖于所披露的实施例的等同物的含义和范围内。应当理解,本文采用的措辞或术语是出于描述而非限制的目的。在附图和说明书中,已经披露了示例性实施例,并且尽管可以采用特定的术语,但是除非另有说明,这些术语仅以一般性和描述性的意义使用,而并非出于限制权利要求的范围的目的。此外,本领域的技术人员将理解,本文讨论的方法的某些步骤能以可替代的顺序来排序,或者可以将步骤进行组合。因此,意图是所附权利要求不限于本文披露的特定实施例。本领域的普通技术人员只使用常
规实验就将认识到或能够确定本文描述的本发明的实施例的许多等同物。此类等同物由以下权利要求所涵盖。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1