使用了干细胞迁移剂的糖尿病治疗的制作方法
1.本发明涉及组合了干细胞的迁移和异常干细胞的抑制的糖尿病和/或其关联疾病的治疗、以及以干细胞的迁移和/或残留为指标的糖尿病和/或其关联疾病的诊断。更特定地,本发明涉及通过使异常造血干细胞迁移并加以抑制而进行的糖尿病和/或其关联疾病的治疗、以及通过检测异常造血干细胞从特定龛(niche)中的迁移和/或在特定龛中的残留而进行的糖尿病和/或其关联疾病的诊断。
背景技术:
2.糖尿病通常分为1型和2型(非专利文献1)。但是,由于两者发病的详情均不明,因此不得不说1型及2型的分类本身以病因为基准的认定妥当性欠佳。另外,现在,为了治疗糖尿病而开发了各种药物,但大多以控制血糖为目的,虽然可能对于防止糖尿病的发展有效,但是对于糖尿病的治愈而言可能还不充分。而且,神经障碍、肾病、肝障碍、视网膜病、脂肪肝、胃肠障碍、骨折延迟愈合、摄食障碍及皮肤障碍等的糖尿病并发症也在分类为1型及2型的糖尿病中作为共通的并发症而发病,一旦发病则很难治愈。
3.现有技术文献
4.非专利文献
5.非专利文献1:糖尿病诊疗指南2016、日本糖尿病学会、南江堂
技术实现要素:
6.用于解决课题的技术手段
7.本发明人们发现:通过抑制异常干细胞进行的糖尿病和/或其关联疾病的治疗战略在与干细胞的迁移组合的情况下更有效。基于该新的见解,本发明提供用于治疗及诊断糖尿病和/或其关联疾病的技术手段。
8.因此,本发明提供以下技术手段。
9.(项目1)一种组合物,其特征在于,其用于治疗和/或预防糖尿病以及/或者与糖尿病相关联的疾病、障碍和/或症状,所述组合物包含异常造血干细胞(hsc)的抑制剂,该抑制剂与干细胞迁移剂组合来施用。
10.(项目2)根据上述任意项目所述的组合物,其中,上述异常hcs中选自cd106、及其功能等同物中的基因或蛋白质不以通常的水平表达和/或不发挥功能。
11.(项目3)根据上述任意项目所述的组合物,其中,上述不以通常的水平表达是指过表达。
12.(项目4)根据上述任意项目所述的组合物,其中,上述抑制剂包含选自抗cd106抗体或其功能变体中的至少一者。
13.(项目5)根据上述任意项目所述的组合物,其中,上述异常hcs中,进一步地选自肿瘤坏死因子α(tnf-α)及胰岛素原中的基因或蛋白质不以通常的水平表达。
14.(项目6)根据上述任意项目所述的组合物,其中,上述抑制剂包含选自抗tnf-α抗
体或其功能变体中的至少一者。
15.(项目7)根据上述任意项目所述的组合物,其中,上述疾病、障碍和/或症状包括糖尿病并发症。
16.(项目8)根据上述任意项目所述的组合物,其中,上述疾病、障碍和/或症状选自神经障碍、肾病、肝障碍、视网膜病、脂肪肝、胃肠障碍、骨折延迟愈合、摄食障碍及皮肤障碍。
17.(项目9)根据上述任意项目所述的组合物,其中,上述干细胞迁移剂具有使上述异常hsc从龛迁移的能力。
18.(项目10)根据上述任意项目所述的组合物,其中,上述干细胞迁移剂包含选自cxcr4拮抗剂、cxcr2刺激剂、上皮生长因子受体(egfr)抑制剂、粒细胞集落刺激因子(g-csf)剂中的至少1种药剂。
19.(项目11)根据上述任意项目所述的组合物,其中,上述干细胞迁移剂包含选自普乐沙福(plerixafor)、groβ2(mip2)、吉非替尼(gefitinib)、埃罗替尼(erlotinib)、阿法替尼(afatinib)、奥希替尼(osimertinib)、非格司亭(filgrastim)、那托司亭(nartograstim)、来格司亭(lenograstim)、培非格司亭(pegfilgrastim)中的至少一者。
20.(项目12)一种用于治疗和/或预防糖尿病以及/或者与糖尿病相关联的疾病、障碍和/或症状的药物,所述药物包含异常造血干细胞(hsc)的抑制剂和干细胞迁移剂的组合。
21.(项目13)一种组合物,其特征在于,其用于治疗和/或预防糖尿病以及/或者与糖尿病相关联的疾病、障碍和/或症状,所述组合物包含干细胞迁移剂,该干细胞迁移剂与异常造血干细胞(hsc)的抑制剂组合来施用。
22.(项目14)一种用于选择为了治疗和/或预防糖尿病以及/或者与糖尿病相关联的疾病、障碍和/或症状的处置的组合物,所述组合物包含对异常造血干细胞(hsc)的迁移和/或残留进行检测的药剂。
23.(项目15)根据上述任意项目所述的组合物,其中,上述迁移和/或残留为从骨髓龛的迁移和/或骨髓龛中的残留。
24.(项目16)根据上述任意项目所述的组合物,其中,上述迁移检测剂包括cd106或功能等同物的检测剂。
25.(项目17)一种方法,其是在受试体中治疗和/或预防糖尿病或与糖尿病相关联的疾病、障碍和/或症状的方法,所述方法包括对该受试体施用有效量的使异常造血干细胞(hsc)减少或消失的药剂及干细胞迁移剂的工序。
26.(项目18)一种方法,其是以异常造血干细胞(hsc)的迁移和/或残留作为处置的指标的方法,所述处置用于在受试体中治疗和/或预防糖尿病或糖尿病以及/或者与糖尿病相关联的疾病、障碍和/或症状,所述方法包括对该受试体中的异常造血干细胞(hsc)的迁移和/或残留进行检测的工序。
27.(项目19)根据上述任意项目所述的组合物,其中,上述组合物为药学的组合物。
28.(项目20)根据上述任意项目所述的组合物,其中,所述组合物还包含药学上可接受的赋形剂。
29.(项目a1)一种方法,其是治疗和/或预防受试体的糖尿病以及/或者与糖尿病相关联的疾病、障碍和/或症状的方法,所述方法包括对该受试体施用有效量的异常造血干细胞(hsc)的抑制剂及干细胞迁移剂的工序。
30.(项目a2)根据上述任意项目所述的方法,其中,上述异常hcs中选自cd106及其功能等同物中的基因或蛋白质不以通常的水平表达和/或不发挥功能。
31.(项目a3)根据项目a2所述的方法,其中,上述不以通常的水平表达是指过表达。
32.(项目a4)根据上述任意项目所述的方法,其中,上述抑制剂包含选自抗cd106抗体或其功能变体中的至少一者。
33.(项目a5)根据上述任意项目所述的方法,其中,上述异常hcs中,进一步地选自肿瘤坏死因子α(tnf-α)及胰岛素原中的基因或蛋白质不以通常的水平表达。
34.(项目a6)根据上述任意项目所述的方法,其中,上述抑制剂包含选自抗tnf-α抗体或其功能变体中的至少一者。
35.(项目a7)根据上述任意项目所述的方法,其中,上述疾病、障碍和/或症状包含糖尿病并发症。
36.(项目a8)根据上述任意项目所述的方法,其中,上述疾病、障碍和/或症状选自神经障碍、肾病、肝障碍、视网膜病、脂肪肝、胃肠障碍、骨折延迟愈合、摄食障碍及皮肤障碍。
37.(项目a9)根据上述任意项目所述的方法,其中,上述干细胞迁移剂具有使上述异常hsc从龛迁移的能力。
38.(项目a10)根据上述任意项目所述的方法,其中,上述干细胞迁移剂包含选自cxcr4拮抗剂、cxcr2刺激剂、上皮生长因子受体(egfr)抑制剂、粒细胞集落刺激因子(g-csf)剂中的至少1种药剂。
39.(项目a11)根据上述任意项目所述的方法,其中,上述干细胞迁移剂包含选自普乐沙福、groβ2(mip2)、吉非替尼、埃罗替尼、阿法替尼、奥希替尼、非格司亭、那托司亭、来格司亭、培非格司亭中的至少1种。
40.(项目a12)一种方法,其是选择用于治疗和/或预防受试体的糖尿病以及/或者与糖尿病相关联的疾病、障碍和/或症状的处置的方法,所述方法包括对该受试体施用药剂的工序,所述药剂用于检测有效量的异常造血干细胞(hsc)的迁移和/或残留。
41.(项目a13)根据上述任意项目所述的方法,其中,上述迁移和/或残留为从骨髓龛的迁移和/或骨髓龛中的残留。
42.(项目a14)根据上述任意项目所述的方法,其中,上述迁移检测剂包括cd106或功能等同物的检测剂。
43.(项目a15)一种方法,其是以异常造血干细胞(hsc)的迁移和/或残留来诊断受试体中糖尿病或糖尿病以及/或者与糖尿病相关联的疾病、障碍和/或症状的方法,所述方法包括对该受试体的异常造血干细胞(hsc)的迁移和/或残留进行检测的工序。
44.(项目b1)一种用于抑制异常造血干细胞(hsc)的组合物,所述组合物用于治疗和/或预防糖尿病以及/或者与糖尿病相关联的疾病、障碍和/或症状,并且所述组合物与干细胞迁移剂组合来使用。
45.(项目b2)根据上述任意项目所述的组合物,其中,上述异常hcs中选自cd106及其功能等同物中的基因或蛋白质不以通常的水平表达和/或不发挥功能。
46.(项目b3)根据上述任意项目所述的组合物,其中,上述不以通常的水平表达是指过表达。
47.(项目b4)根据上述任意项目所述的抑制剂,其中,包含选自抗cd106抗体或其功能
变体中的至少一者。
48.(项目b5)根据上述任意项目所述的组合物,其中,上述异常hcs中,进一步地选自肿瘤坏死因子α(tnf-α)及胰岛素原中的基因或蛋白质不以通常的水平表达。
49.(项目b6)根据上述任意项目所述的组合物,其中,所述组合物包含选自抗tnf-α抗体或其功能变体中的至少一者。
50.(项目b7)根据上述任意项目所述的组合物,其中,上述疾病、障碍和/或症状包括糖尿病并发症。
51.(项目b8)根据上述任意项目所述的组合物,其中,上述疾病、障碍和/或症状选自神经障碍、肾病、肝障碍、视网膜病、脂肪肝、胃肠障碍、骨折延迟愈合、摄食障碍及皮肤障碍。
52.(项目b9)根据上述任意项目所述的组合物,其中,上述干细胞迁移剂具有使上述异常hsc从龛迁移的能力。
53.(项目b10)根据上述任意项目所述的组合物,其中,上述干细胞迁移剂包含选自cxcr4拮抗剂、cxcr2刺激剂、上皮生长因子受体(egfr)抑制剂、粒细胞集落刺激因子(g-csf)剂中的至少1种药剂。
54.(项目b11)根据上述任意项目所述的组合物,其中,上述干细胞迁移剂包含选自普乐沙福、groβ2(mip2)、吉非替尼、埃罗替尼、阿法替尼、奥希替尼、非格司亭、那托司亭、来格司亭、培非格司亭中的至少一者。
55.(项目b13)一种用于干细胞迁移的组合物,所述组合物用于治疗和/或预防糖尿病以及/或者与糖尿病相关联的疾病、障碍和/或症状,并且所述组合物用于与异常造血干细胞(hsc)的抑制剂组合使用。
56.(项目b14)一种用于对异常造血干细胞(hsc)的迁移和/或残留进行检测的组合物,所述组合物用于选择为了治疗和/或预防糖尿病以及/或者与糖尿病相关联的疾病、障碍和/或症状的处置。
57.(项目b15)根据上述任意项目所述的组合物,其中,上述迁移和/或残留为从骨髓龛的迁移和/或骨髓龛中的残留。
58.(项目b16)根据上述任意项目所述的组合物,其中,所述组合物包含cd106或功能等同物的检测剂。
59.(项目b17)根据上述任意项目所述的组合物,其中,上述组合物为药学的组合物。
60.(项目b18)根据上述任意项目所述的组合物,其中,所述组合物还包含在药学上可接受的赋形剂。
61.(项目c1)异常造血干细胞(hsc)的抑制剂及干细胞迁移剂在制造用于治疗和/或预防糖尿病以及/或者与糖尿病相关联的疾病、障碍和/或症状的药物中的用途。
62.(项目c2)根据上述任意项目所述的用途,其中,上述异常hcs中选自cd106、及其功能等同物中的基因或蛋白质不以通常的水平表达和/或不发挥功能。
63.(项目c3)根据上述任意项目所述的用途,其中,上述不以通常的水平表达是指过表达。
64.(项目c4)根据上述任意项目所述的用途,其中,上述抑制剂包含选自抗cd106抗体或其功能变体中的至少一者。
65.(项目c5)根据上述任意项目所述的用途,其中,上述异常hcs中,进一步地选自肿瘤坏死因子α(tnf-α)及胰岛素原中的基因或蛋白质不以通常的水平表达。
66.(项目c6)根据上述任意项目所述的用途,其中,上述抑制剂包含选自抗tnf-α抗体或其功能变体中的至少一者。
67.(项目c7)根据上述任意项目所述的用途,其中,上述疾病、障碍和/或症状包括糖尿病并发症。
68.(项目c8)根据上述任意项目所述的用途,其中,上述疾病、障碍和/或症状选自神经障碍、肾病、肝障碍、视网膜病、脂肪肝、胃肠障碍、骨折延迟愈合、摄食障碍及皮肤障碍。
69.(项目c9)根据上述任意项目所述的用途,其中,上述干细胞迁移剂具有使上述异常hsc从龛迁移的能力。
70.(项目c10)根据上述任意项目所述的用途,其中,上述干细胞迁移剂包含选自cxcr4拮抗剂、cxcr2刺激剂、上皮生长因子受体(egfr)抑制剂、粒细胞集落刺激因子(g-csf)剂中的至少1种药剂。
71.(项目c11)根据上述任意项目所述的用途,其中,上述干细胞迁移剂包含选自普乐沙福、groβ2(mip2)、吉非替尼、埃罗替尼、阿法替尼、奥希替尼、非格司亭、那托司亭、来格司亭、培非格司亭中的至少一者。
72.(项目c14)对异常造血干细胞(hsc)的迁移和/或残留进行检测的药剂在制造用于选择为了治疗和/或预防糖尿病以及/或者与糖尿病相关联的疾病、障碍和/或症状的处置的药物中的用途。
73.(项目c15)根据上述任意项目所述的用途,其中,上述迁移和/或残留为从骨髓龛的迁移和/或骨髓龛中的残留。
74.(项目c16)根据上述任意项目所述的用途,其中,上述迁移检测剂包含cd106或功能等同物的检测剂。
75.(项目d1)一种组合物,其特征在于,其用于治疗和/或预防糖尿病以及/或者与糖尿病相关联的疾病、障碍和/或症状,所述组合物包含异常造血干细胞(hsc)的抑制剂,该抑制剂与干细胞迁移剂组合来施用。
76.(项目d2)根据上述任意项目所述的组合物,其中,上述异常hcs中选自cd106及其功能等同物中的基因或蛋白质不以通常的水平表达和/或不发挥功能。
77.(项目d3)根据上述任意项目所述的组合物,其中,上述不以通常的水平表达是指过表达。
78.(项目d4)根据上述任意项目所述的组合物,其中,上述抑制剂包含选自抗cd106抗体或其功能变体中的至少一者。
79.(项目d5)根据上述任意项目所述的组合物,其中,上述异常hcs中,进一步地选自肿瘤坏死因子α(tnf-α)、组蛋白去乙酰化酶(hdac)及胰岛素原中的基因或蛋白质不以通常的水平表达。
80.(项目d6)根据上述任意项目所述的组合物,其中,上述抑制剂包含选自抗tnf-α抗体或其功能变体及hdac抑制剂(例如曲古抑菌素a)中的至少一者。
81.(项目d7)根据上述任意项目所述的组合物,其中,上述疾病、障碍和/或症状包括糖尿病并发症。
82.(项目d8)根据上述任意项目所述的组合物,其中,上述疾病、障碍和/或症状选自神经障碍、肾病、肝障碍、视网膜病、脂肪肝、胃肠障碍、骨折延迟愈合、摄食障碍及皮肤障碍。
83.(项目d9)根据上述任意项目所述的组合物,其中,上述干细胞迁移剂具有使上述异常hsc从龛迁移的能力。
84.(项目d10)根据上述任意项目所述的组合物,其中,上述干细胞迁移剂包含选自cxcr4拮抗剂、cxcr2刺激剂、上皮生长因子受体(egfr)抑制剂、粒细胞集落刺激因子(g-csf)剂中的至少1种药剂。
85.(项目d11)根据上述任意项目所述的组合物,其中,上述干细胞迁移剂包含选自普乐沙福、groβ2(mip2)、吉非替尼、埃罗替尼、阿法替尼、奥希替尼、非格司亭、那托司亭、来格司亭、培非格司亭中的至少一者。
86.(项目d12)一种用于治疗和/或预防糖尿病以及/或者与糖尿病相关联的疾病、障碍和/或症状的药物,所述药物包含异常造血干细胞(hsc)的抑制剂和干细胞迁移剂的组合。
87.(项目d13)一种组合物,其特征在于,其用于治疗和/或预防糖尿病以及/或者与糖尿病相关联的疾病、障碍和/或症状,所述组合物包含干细胞迁移剂,该干细胞迁移剂与异常造血干细胞(hsc)的抑制剂组合来施用。
88.(项目d14)一种用于选择为了治疗和/或预防糖尿病以及/或者与糖尿病相关联的疾病、障碍和/或症状的处置的组合物,所述组合物包含对异常造血干细胞(hsc)的迁移和/或残留进行检测的药剂。
89.(项目d15)根据上述任意项目所述的组合物,其中,上述迁移和/或残留为从骨髓龛的迁移和/或骨髓龛中的残留。
90.(项目d16)根据上述任意项目所述的组合物,其中,上述迁移检测剂包含cd106或功能等同物的检测剂。
91.(项目d17)一种方法,其是用于在受试体中治疗和/或预防糖尿病或与糖尿病相关联的疾病、障碍和/或症状的方法,所述方法包括对该受试体施用有效量的使异常造血干细胞(hsc)减少或消失的药剂及干细胞迁移剂的工序。
92.(项目d18)一种方法,其是以异常造血干细胞(hsc)的迁移和/或残留作为处置的指标的方法,所述处置用于在受试体中治疗和/或预防糖尿病或糖尿病以及/或者与糖尿病相关联的疾病、障碍和/或症状,所述方法包括对该受试体的异常造血干细胞(hsc)的迁移和/或残留进行检测的工序。
93.(项目d19)根据上述任意项目所述的组合物,其中,上述组合物为药学的组合物。
94.(项目d20)根据上述任意项目所述的组合物,其中,所述组合物还包含药学上可接受的赋形剂。
95.(项目e1)一种方法,其是治疗和/或预防受试体的糖尿病以及/或者与糖尿病相关联的疾病、障碍和/或症状的方法,所述方法包括对该受试体施用有效量的异常造血干细胞(hsc)的抑制剂及干细胞迁移剂的工序。
96.(项目e2)根据上述任意项目所述的方法,其中,上述异常hcs中选自cd106及其功能等同物中的基因或蛋白质不以通常的水平表达和/或不发挥功能。
97.(项目e3)根据上述任意项目所述的方法,其中,上述不以通常的水平表达是指过表达。
98.(项目e4)根据上述任意项目所述的方法,其中,上述抑制剂包含选自抗cd106抗体或其功能变体中的至少一者。
99.(项目e5)根据上述任意项目所述的方法,其中,上述异常hcs中,进一步地选自肿瘤坏死因子α(tnf-α)、组蛋白去乙酰化酶(hdac)及胰岛素原中的基因或蛋白质不以通常的水平表达。
100.(项目e6)根据上述任意项目所述的方法,其中,上述抑制剂包含选自抗tnf-α抗体或其功能变体及hdac抑制剂(例如曲古抑菌素a)中的至少一者。
101.(项目e7)根据上述任意项目所述的方法,其中,上述疾病、障碍和/或症状包括糖尿病并发症。
102.(项目e8)根据上述任意项目所述的方法,其中,上述疾病、障碍和/或症状选自神经障碍、肾病、肝障碍、视网膜病、脂肪肝、胃肠障碍、骨折延迟愈合、摄食障碍及皮肤障碍。
103.(项目e9)根据上述任意项目所述的方法,其中,上述干细胞迁移剂具有使上述异常hsc从龛迁移的能力。
104.(项目e10)根据上述任意项目所述的方法,其中,上述干细胞迁移剂包含选自cxcr4拮抗剂、cxcr2刺激剂、上皮生长因子受体(egfr)抑制剂、粒细胞集落刺激因子(g-csf)剂中的至少1种药剂。
105.(项目e11)根据上述任意项目所述的方法,其中,上述干细胞迁移剂包含选自普乐沙福、groβ2(mip2)、吉非替尼、埃罗替尼、阿法替尼、奥希替尼、非格司亭、那托司亭、来格司亭、培非格司亭中的至少一者。
106.(项目e12)一种方法,其是选择用于治疗和/或预防受试体的糖尿病以及/或者与糖尿病相关联的疾病、障碍和/或症状的处置的方法,所述方法包括对该受试体施用有效量的对异常造血干细胞(hsc)的迁移和/或残留进行检测的药剂的工序。
107.(项目e13)根据上述任意项目所述的方法,其中,上述迁移和/或残留为从骨髓龛的迁移和/或骨髓龛中的残留。
108.(项目e14)根据上述任意项目所述的方法,其中,上述迁移检测剂包含cd106或功能等同物的检测剂。
109.(项目e15)一种方法,其是以异常造血干细胞(hsc)的迁移和/或残留来诊断受试体的糖尿病或糖尿病以及/或者与糖尿病相关联的疾病、障碍和/或症状的方法,所述方法包括对该受试体的异常造血干细胞(hsc)的迁移和/或残留进行检测的工序。
110.(项目f1)一种干细胞迁移剂或异常hsc抑制剂,其用于治疗和/或预防糖尿病以及/或者与糖尿病相关联的疾病、障碍和/或症状,并且在干细胞迁移剂与异常造血干细胞(hsc)抑制剂的组合中使用。
111.(项目f2)根据上述任意项目所述的干胞迁移剂或异常hsc抑制剂,其中,上述异常hcs中选自cd106及其功能等同物中的基因或蛋白质不以通常的水平表达和/或不发挥功能。
112.(项目f3)根据上述任意项目所述的干细胞迁移剂或异常hsc抑制剂,其中,上述不以通常的水平表达是指过表达。
113.(项目f4)根据上述任意项目所述的抑制剂,其包含选自抗cd106抗体或其功能变体中的至少一者。
114.(项目f5)根据上述任意项目所述的干细胞迁移剂或异常hsc抑制剂,其中,上述异常hcs中,进一步地选自肿瘤坏死因子α(tnf-α)、组蛋白去乙酰化酶(hdac)及胰岛素原中的基因或蛋白质不以通常的水平表达。
115.(项目f6)根据上述任意项目所述的干细胞迁移剂或异常hsc抑制剂,其包含选自抗tnf-α抗体或其功能变体及hdac抑制剂(例如曲古抑菌素a)中的至少一者。
116.(项目f7)根据上述任意项目所述的干细胞迁移剂或异常hsc抑制剂,其中,上述疾病、障碍和/或症状包含糖尿病并发症。
117.(项目f8)根据上述任意项目所述的干细胞迁移剂或异常hsc抑制剂,其中,上述疾病、障碍和/或症状选自神经障碍、肾病、肝障碍、视网膜病、脂肪肝、胃肠障碍、骨折延迟愈合、摄食障碍及皮肤障碍。
118.(项目f9)根据上述任意项目所述的干细胞迁移剂或异常hsc抑制剂,其中,上述干细胞迁移剂具有使上述异常hsc从龛迁移的能力。
119.(项目f10)根据上述任意项目所述的干细胞迁移剂或异常hsc抑制剂,其中,上述干细胞迁移剂包含选自cxcr4拮抗剂、cxcr2刺激剂、上皮生长因子受体(egfr)抑制剂、粒细胞集落刺激因子(g-csf)剂中的至少1种药剂。
120.(项目f11)根据上述任意项目所述的干细胞迁移剂或异常hsc抑制剂,其中,上述干细胞迁移剂包含选自普乐沙福、groβ2(mip2)、吉非替尼、埃罗替尼、阿法替尼、奥希替尼、非格司亭、那托司亭、来格司亭、培非格司亭中的至少一者。
121.(项目f13)一种用于干细胞迁移的干细胞迁移剂或异常hsc抑制剂,其用于治疗和/或预防糖尿病以及/或者与糖尿病相关联的疾病、障碍和/或症状,并且与异常造血干细胞(hsc)的抑制剂组合来使用。
122.(项目f14)一种药剂,其用于选择为了治疗和/或预防糖尿病以及/或者与糖尿病相关联的疾病、障碍和/或症状的处置,并且用于对异常造血干细胞(hsc)的迁移和/或残留进行检测。
123.(项目f15)根据上述任意项目所述的药剂,其中,上述迁移和/或残留为从骨髓龛的迁移和/或骨髓龛中的残留。
124.(项目f16)根据上述任意项目所述的药剂,其中,所述药剂包含cd106或功能等同物的检测剂。
125.(项目g1)异常hsc抑制剂或干细胞迁移剂中的至少一者以异常造血干细胞(hsc)抑制剂及干细胞迁移剂的组合在制造用于治疗和/或预防糖尿病以及/或者与糖尿病相关联的疾病、障碍和/或症状的药物中的用途。
126.(项目g2)根据上述任意项目所述的用途,其中,上述异常hcs中选自cd106及其功能等同物中的基因或蛋白质不以通常的水平表达和/或不发挥功能。
127.(项目g3)根据上述任意项目所述的用途,其中,上述不以通常的水平表达是指过表达。
128.(项目g4)根据上述任意项目所述的用途,其中,上述抑制剂包含选自抗cd106抗体或其功能变体中的至少一者。
129.(项目g5)根据上述任意项目所述的用途,其中,上述异常hcs中,进一步地选自肿瘤坏死因子α(tnf-α)、组蛋白去乙酰化酶(hdac)及胰岛素原中的基因或蛋白质不以通常的水平表达。
130.(项目g6)根据上述任意项目所述的用途,其中,上述抑制剂包含选自抗tnf-α抗体或其功能变体及hdac抑制剂(例如曲古抑菌素a)中的至少一者。
131.(项目g7)根据上述任意项目所述的用途,其中,上述疾病、障碍和/或症状包括糖尿病并发症。
132.(项目g8)根据上述任意项目所述的用途,其中,上述疾病、障碍和/或症状选自神经障碍、肾病、肝障碍、视网膜病、脂肪肝、胃肠障碍、骨折延迟愈合、摄食障碍及皮肤障碍。
133.(项目g9)根据上述任意项目所述的用途,其中,上述干细胞迁移剂具有使上述异常hsc从龛迁移的能力。
134.(项目g10)根据上述任意项目所述的用途,其中,上述干细胞迁移剂包含选自cxcr4拮抗剂、cxcr2刺激剂、上皮生长因子受体(egfr)抑制剂、粒细胞集落刺激因子(g-csf)剂中的至少1种药剂。
135.(项目g11)根据上述任意项目所述的用途,其中,上述干细胞迁移剂包含选自普乐沙福、groβ2(mip2)、吉非替尼、埃罗替尼、阿法替尼、奥希替尼、非格司亭、那托司亭、来格司亭、培非格司亭中的至少一者。
136.(项目g14)对异常造血干细胞(hsc)的迁移和/或残留进行检测的药剂在制造用于选择为了治疗和/或预防糖尿病以及/或者与糖尿病相关联的疾病、障碍和/或症状的处置的药物中的用途。
137.(项目g15)根据上述任意项目所述的用途,其中,上述迁移和/或残留为从骨髓龛的迁移和/或骨髓龛中的残留。
138.(项目g16)根据上述任意项目所述的用途,其中,上述迁移检测剂包括cd106或功能等同物的检测剂。
139.在本发明中旨在表明上述的1个或多个特征除了所明示的组合以外还可进一步组合来提供。对于本发明的进一步其他的实施方式及优点,只要根据需要阅读以下的详细说明并加以理解,就能被本领域技术人员所认识。
140.发明的效果
141.本发明提供糖尿病和/或其关联疾病的新型的治疗及诊断。不需要以往在使糖尿病患者恢复胰岛素分泌的方法即胰腺移植、胰岛移植等中所需的供体,能克服对受体数量的供给能力限制。另外,还能回避受体所承受的手术等患者负荷。这样,本发明的治疗可通过药剂施用来实现,因此可简便得多且低负荷。另外,由于能够根本治疗,因此还可期待预后良好。
附图说明
142.图1是非糖尿病(非dm)及链脲霉素诱导糖尿病(stz-dm)的单核细胞中的c-kit阳性sca-1阳性谱系标志阴性细胞(ksl)级分中的胰岛素原阳性细胞的荧光活化细胞分选(facs)分析。左上的2个图示(左:非dm,右:stz-dm)表示谱系阴性细胞中的ksl细胞(被四方形包围),纵轴表示c-kit的荧光强度,横轴表示sca-1的荧光强度。左下的2个图示(左:非
dm,右:stz-dm)表示胰岛素原阳性细胞(被四方形包围)的分布,纵轴表示ksl细胞数,横轴表示胰岛素原的荧光强度。右侧的图表(左:非dm,右:stz-dm)表示ksl细胞中的胰岛素原阳性细胞的比例(每组为n=3)。**:p<0.01。
143.图2是非dm及stz-dm的单核细胞中的ksl细胞中的肿瘤坏死因子α(tnf-α)阳性细胞的facs分析。左上的2个图示(左:非dm,右:stz-dm)表示谱系阴性细胞中的ksl细胞(被四方形包围),纵轴表示c-kit的荧光强度,横轴表示sca-1的荧光强度。左下的2个图示(左:非dm,右:stz-dm)表示tnf-α阳性细胞(被四方形包围)的分布,纵轴表示ksl细胞数,横轴表示tnf-α的荧光强度。右侧的图表表示ksl细胞中的tnf-α阳性细胞的比例(每组为n=5)。数据以平均
±
标准误差来表示。**:p<0.01。
144.图3是针对非dm及stz-dm的单核细胞中的ksl细胞的cd106表达的facs分析。左侧的2个图示(上:非dm,下:stz-dm)表示谱系阴性细胞中的ksl细胞(被四方形包围),纵轴表示c-kit的荧光强度,横轴表示sca-1的荧光强度。右侧的2个图示(上:非dm,下:stz-dm)表示cd106阳性细胞(被四方形包围)的分布,纵轴表示侧方散射光(ssc)的强度,横轴表示cd106的荧光强度。右侧的图表(左:非dm,右:stz-dm)表示ksl细胞中的cd106阳性细胞的比例(1个刻度为1%)(每组为n=4)。**:p<0.01。
145.图4是icr小鼠及nod小鼠的单核细胞的facs分析。2个图示(左:icr,右:nod)表示谱系阴性细胞中的ksl细胞(被四方形包围),纵轴表示c-kit的荧光强度,横轴表示sca-1的荧光强度。
146.图5是icr小鼠及nod小鼠的单核细胞中的ksl细胞中的肿瘤坏死因子α(tnf-α)阳性细胞及cd106阳性细胞的facs分析。上侧的2个图示(左:icr,右:nod)表示tnf-α阳性细胞(被四方形包围)的分布,纵轴表示前方散射光(fsc)的强度,横轴表示tnf-α的荧光强度。下侧的2个图示(左:icr,右:nod)表示cd106阳性细胞(被四方形包围)的分布,纵轴表示前方散射光(fsc)的强度,横轴表示cd106的荧光强度。
147.图6是非dm及stz-dm的ksl细胞中的侧群细胞(side population,sp)级分及非sp级分的facs分析。左侧的2个图示(上:非dm,下:stz-dm)表示ksl细胞中的sp级分(左下的圆圈)及非sp级分(右上的圆圈),纵轴表示hoechst blue的荧光强度,横轴表示hoechst red的荧光强度。右侧的图表(左:sp,右:非sp)表示非dm(左棒图)及stz-dm(右棒图)的ksl细胞中的sp级分及非sp级分的比例(n=3)。数据以平均值
±
标准误差来表示。**:p<0.01。
148.图7中,a)是非dm及stz-dm的ksl-非sp细胞中的cd106阳性细胞的facs分析。2个图示(上:非dm,下:stz-dm)表示cd106阳性细胞(被四方形包围)的分布,纵轴表示侧方散射光(ssc)的强度,横轴表示cd106的荧光强度。图表(左:非dm,右:stz-dm)表示ksl-非sp细胞中的cd106阳性细胞的比例(每组为n=3)。b)是非dm及stz-dm的ksl-sp细胞中的cd106阳性细胞的facs分析。2个图示(上:非dm,下:stz-dm)表示cd106阳性细胞(被四方形包围且为0%)的分布,纵轴表示侧方散射光(ssc)的强度,横轴表示cd106的荧光强度。图表(左:非dm,右:stz-dm)表示ksl-sp细胞中的cd106阳性细胞的比例(每组为n=3)。c)是非dm及stz-dm的ksl-非sp细胞中的tnf-α阳性细胞的facs分析。2个图示(上:非dm,下:stz-dm)表示tnf-α阳性细胞(被四方形包围)的分布,纵轴表示侧方散射光(ssc)的强度,横轴表示tnf-α的荧光强度。图表(左:非dm,右:stz-dm)表示ksl-非sp细胞中的tnf-α阳性细胞的比例(每组为n=3)。d)是非dm及stz-dm的ksl-sp细胞中的tnf-α阳性细胞的facs分析。2个图示(上:非dm,
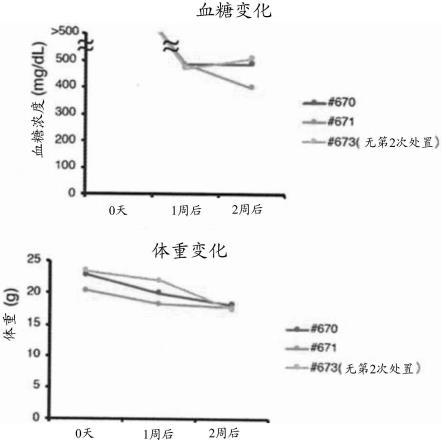
下:stz-dm)表示tnf-α阳性细胞(被四方形包围且为0%)的分布,纵轴表示侧方散射光(ssc)的强度,横轴表示tnf-α的荧光强度。图表(左:非dm,右:stz-dm)表示ksl-sp细胞中的tnf-α阳性细胞的比例(每组为n=3)。数据以平均值
±
标准误差来表示。*:p<0.05。
149.图8表示非dm及stz-dm小鼠的ksl细胞中的组蛋白去乙酰化酶基因群(hdacs)的基因表达比较。自左侧起示出hdac3、hdac4、hdac8及hdac9的表达量,在各棒图中,左侧是非dm小鼠的结果,右侧是stz-dm小鼠的结果。纵轴表示将非dm小鼠中的mrna表达量设为1时的两小鼠中的mrna表达量的相对量。*:p<0.05。
150.图9是表示用于将源自非dm或stz-dm小鼠的ksl细胞向正常血糖小鼠移植的实验的概况。准备了将导入有绿荧光蛋白质基因的转基因小鼠(gfp-tg小鼠)用stz进行处置而诱发糖尿病的小鼠(stz-dm gfp)、以及实施了静脉内柠檬酸缓冲液注射的对照处置的非dm小鼠(非dm gfp)。3个月后,将分别从非dm小鼠及stz-dm小鼠得到的ksl细胞移植至9gy的致死量照射正常血糖野生型小鼠(源自非dm的ksl-t、源自stz-dm的ksl-t)。
151.图10表示源自非dm的ksl-t(n=9)及源自stz-dm的ksl-t(n=10)中的血糖浓度(mg/gl)(左)及将源自非dm的ksl-t中的测定值设为1时的坐骨神经中的感觉神经传导速度(sncv)的相对比(右)。n.s表示没有显著差异,**表示p<0.01。
152.图11是后根神经节(drg)中的map2、胰岛素原及tnf-α的免疫荧光染色像。自左侧起的4列是源自stz-dm的ksl-t的结果,自左侧起为核(蓝)、gfp(绿)、靶标分子(上段:map2,中段:胰岛素原,下段:tnf-α)(红)、合并(merge)的影像。右列是源自非dm的ksl-t的结果,且是核(蓝)、gfp(绿)及靶标分子(上段:map2、中段:胰岛素原、下段:tnf-α)(红)的合并影像。箭头表示融合细胞。比例尺=10μm。
153.图12是源自非dm的ksl-t及源自stz-dm的ksl-t的单核细胞中的ksl级分中的胰岛素原阳性细胞的facs分析。左上的2个图示(左:源自非dm的ksl-t,右:源自stz-dm的ksl-t)表示谱系阴性细胞中的ksl细胞(被四方形包围),纵轴表示c-kit的荧光强度,横轴表示sca-1的荧光强度。左下的2个图示(左:源自非dm的ksl-t,右:源自stz-dm的ksl-t)表示胰岛素原阳性细胞(被四方形包围)的分布,纵轴表示ksl细胞数,横轴表示胰岛素原的荧光强度。右侧的图表(左:源自非dm的ksl-t,右:源自stz-dm的ksl-t)表示ksl细胞中的胰岛素原阳性细胞的比例(每组为n=3)。*:p<0.05。
154.图13是源自非dm的ksl-t及源自stz-dm的ksl-t的单核细胞中的ksl级分中的tnf-α阳性细胞的facs分析。左上的2个图示(左:源自非dm的ksl-t,右:源自stz-dm的ksl-t)表示谱系阴性细胞中的ksl细胞(被四方形包围),纵轴表示c-kit的荧光强度,横轴表示sca-1的荧光强度。左下的2个图示(左:源自非dm的ksl-t,右:源自stz-dm的ksl-t)表示tnf-α阳性细胞(被四方形包围)的分布,纵轴表示ksl细胞数,横轴表示tnf-α的荧光强度。右侧的图表(左:源自非dm的ksl-t,右:源自stz-dm的ksl-t)表示ksl细胞中的tnf-α阳性细胞的比例(每组为n=3)。**:p<0.01。
155.图14是人糖尿病患者(dm)及健康人受试者(non-dm)的血液试样中的各基因的表达量的比较。图示分别表示胰岛素(左上)、cd34(右上)、tnf-α(左下)、cd106(右下)。在各图示中,左棒图表示健康人受试者的结果,右棒图表示人糖尿病患者的结果。纵轴表示将健康人受试者的平均结果设为1时的mrna的相对表达量。
156.图15表示将链脲霉素诱导糖尿病小鼠用干细胞迁移剂和抗cd106抗体进行处置时
(250ug/小鼠的用量,每周尾静脉施用)的血糖值及体重的变化。上侧的图表表示第0天及第18天的血糖值(纵轴,mg/dl)。下侧的图表表示第0天及第18天的体重(纵轴,g)。蓝色的线表示对照处置的结果,橙色的线表示干细胞迁移剂和抗cd106抗体的结果,灰色的线表示抗cd106抗体处置的结果。
157.图16是小鼠冻结切片的胰岛素及核的染色像。左上为非dm小鼠,右上为stz-dm小鼠,下侧的两幅表示用干细胞迁移剂及抗cd106抗体处置后的2只stz-dm小鼠的结果。
158.图17是在各小鼠中随机地选择8~10个左右胰岛、并将胰岛素阳性面积相对于胰岛的大小的比例用image j软件进行计算得到的结果。从左侧起表示非dm小鼠、stz-dm小鼠、用干细胞迁移剂及抗cd106抗体处置后的2只stz-dm小鼠(#1及#2)的结果。**p<0.01。
159.图18表示在将nod小鼠用干细胞迁移剂及抗cd106抗体处置时(250μg/小鼠的用量,每周尾静脉施用)的血糖值及体重的变化。上侧的图表表示第7天及第14天的血糖值(纵轴,mg/dl)。下侧的图表表示第7天及第14天的体重(纵轴,g)。蓝色的线(#670)及橙色的线(#671)分别表示每周实施2次迁移剂及抗cd106抗体处置的2个个体的结果,灰色的线(#673)表示仅实施1次迁移剂及抗cd106抗体处置的个体的结果。
160.图19是小鼠冻结切片的胰岛素及核的染色像。从左侧起表示非dm小鼠、糖尿病发病前的nod小鼠、糖尿病发病后的nod小鼠的结果。上段为20倍放大像,下段为40倍放大像。箭头表示胰岛。
161.图20是无dm的患者(dm(-))和有dm的患者(dm(+))的骨髓的胰岛素原染色。在dm(+)例中能够观察到经胰岛素原抗体染色的骨髓细胞(箭头),但是,在dm(-)例中不能观察到经胰岛素原抗体染色的骨髓细胞(箭头)。比例尺表示50μm。
具体实施方式
162.以下,示出最佳方式来说明本发明。在整个说明书中,只要没有特别说明,单数形式的表达应理解为也包括其复数形式的概念。因此,只要没有特别说明,单数形式的冠词(例如,在英语的情况下为"a"、"an"、"the"等)应理解为也包括其复数形式的概念。另外,只要没有特别说明,本说明书中所使用的术语应理解为以该领域中通常所用的含义使用。因此,只要没有其他定义,本说明书中所使用的所有专业术语和科技术语具有与本发明所属领域的普通技术人员通常所理解的含义相同的含义。在矛盾的情况下,以本说明书(包括定义)为准。
163.以下,对本说明书中特别使用的术语的定义和/或基本的技术内容进行适当说明。
164.(定义)
165.在本说明书中,“糖尿病”以该领域中所使用的通常含义来使用,除与妊娠相伴的糖尿病、由特异的基因异常引起的糖尿病以外,通常分为1型糖尿病和2型糖尿病,1型糖尿病是因胰腺的β细胞的破坏使胰岛素枯竭而产生的糖尿病,2型糖尿病是因肥胖等原因使由胰腺胰岛(pancreatic islet)的β细胞分泌的胰岛素分泌量减少且葡萄糖在肌肉、脂肪组织中的摄取能力降低而产生的糖尿病。需要说明的是,根据本研究的结果,推测1型糖尿病及2型糖尿病两者是因免疫异常介导的共通的细胞成因而引起的,这与迄今被认为的成因完全不同。糖尿病例如可通过在2次以上的检查中空腹时血糖≥126mg/dl、hba1c≥6.5%、
经口葡萄糖负荷试验(75gogtt)中2小时值为200mg/dl以上等来诊断。本说明书中的“糖尿病”也包括青年发病成人型糖尿病、边界型糖尿病。
166.在本说明书中“糖尿病的关联疾病”或“与糖尿病相关联的疾病、障碍和/或症状”可包括与糖尿病相关联的任意的疾病、障碍及症状,作为这些例子,可列举:糖尿病性神经障碍、糖尿病性视网膜病、糖尿病性肾病、继发性糖尿病、糖尿病性昏睡、意识障碍、腹痛、腿痉挛、神经障碍、高渗透压高血糖症候群、白蛋白尿、浮肿、肾衰竭、失明、阿尔茨海默氏痴呆症、心肌梗塞、闭塞性动脉硬化症、脑梗塞、脂肪肝、皮肤症状(糖尿病性脂性渐进性坏死等)、创伤治愈能力的降低、易感染性(败血症等)、癌(肝癌、肾癌、胰腺癌、结肠癌、胃癌、肝癌、卵巢癌、大肠癌、结肠癌等)、糖尿病性酮酸中毒、心脏病、脑血管障碍、类固醇糖尿病、便秘、站起式眩晕(起立性低血压)、勃起功能障碍、心肌梗塞、胸痛、重症阑尾炎、腹膜刺激症状、低温烫伤、妊娠糖尿病、口渴、多饮、多尿等。
167.只要没有特别说明,在本说明书中,“非糖尿病受试体”是指没有糖尿病及其关联疾病的受试体。
168.在本说明书中,“治疗”是指针对某疾病或障碍而言在已成为此种状态的情况下,防止此种疾病或障碍的恶化,优选维持现状,更优选使其减轻,进一步优选使其消退,包括可发挥患者的疾病或者与疾病相伴的1个以上的症状的症状改善效果或预防效果。通过事先诊断来进行适当治疗是指“伴随式治疗”,有时将用于其的诊断药称作“伴随式诊断药”。
169.在本说明书中,“预防”是指针对某疾病或障碍而言在成为此种状态之前使其不至成为此种状态。可以使用本发明的药剂进行诊断,根据需要使用本发明的药剂进行例如糖尿病等的预防或者采取用于预防的对策。
170.在本说明书中,“诊断”是指鉴定与受试体的状态(例如疾病、障碍)等相关联的各种参数、并判定此种状态的现状或未来。通过使用本发明的方法、组合物、系统,从而能够对体内的状态进行研究,使用这样的信息,能够选定受试体的状态、应施用的处置或用于预防的处方物或方法等各种参数。在本说明书中,狭义而言,“诊断”是指对现状进行诊断,广义而言,包括“早期诊断”、“预测诊断”、“事前诊断”等。本发明的诊断方法原则上可以利用从身体出来的物质,能够脱离医生等医护人员的手来实施,因此在产业上有用。在本说明书中,为了明确能够脱离医生等医护人员的手来实施,有时尤其将“预测诊断、事前诊断或诊断”称作“支援”。本发明的技术能够应用于这样的诊断技术。
171.在本说明书中靶标细胞的“抑制”是指引起靶标细胞的增殖速度的降低、靶标细胞的伤害、靶标细胞的减少和/或靶标细胞的死亡。靶标细胞的抑制可通过直接的作用和/或间接的作用来实现。例如,抑制靶标细胞的直接作用是通过以该细胞所具有的任意特征(例如表达分子)作为靶标、引起靶标细胞的伤害、靶标细胞的减少和/或靶标细胞的死亡来实现,可列举例如放射线照射、细胞凋亡(apoptosis)的诱导、基于免疫细胞的攻击的诱导等的机构,但并不限定此。对于抑制靶标细胞的间接作用,可列举以识别该靶标细胞并加以抑制的方式使免疫系统进行学习的方法等,但是并不限定于此。
172.在本说明书中,靶标细胞的“抑制剂”是指以任意的手段抑制靶标细胞的药剂。在本说明书记载的抑制剂中,抑制靶标细胞的手段可以是任意的,可列举例如因靶标细胞与靶标化分子(例如抗体)结合而引起的基于免疫细胞的攻击、放射线产生分子的使用等,但是并不限定于此。
173.在本说明书中,细胞的“迁移”是指细胞在末梢血液和/或循环血液中移动。典型地,迁移是指细胞从骨髓(或其中的特定部位)向末梢血液和/或循环血液中移动。这样的骨髓中的特定部位有时称作龛(niche)或特定龛,特定龛是指在生物体内干细胞维持其性质所需的微小环境。因此,在本说明书中,在特定的实施方式中是指使干细胞从龛中迁移,但并不限定于此。
174.在本说明书中,细胞的“迁移剂”是指利用任意的手段使靶标细胞迁移的药剂。
175.在本说明书中,“造血干细胞”或“hsc”是指能够分化为血球系细胞的干细胞。在人成体中主要存在于骨髓,产生白血球(嗜中性白细胞、嗜酸性细胞、嗜碱性细胞、淋巴细胞、单核细胞、巨噬细胞)、红血球、血小板、肥胖细胞、树状细胞。人造血干细胞例如可通过cd34阳性thy-1阳性来表征,另外,还可通过谱系(lineage)阴性cd34阳性cd38阴性cd90阳性cd45ra阴性(即lin-cd34
+
cd38-cd90
+
cd45ra-)来表征(例如参照proc natl acad sci usa.2011 dec 13;108(50):20012-20017)。小鼠造血干细胞可作为c-kit阳性sca-1阳性谱系标志阴性(ksl)细胞来表征。另外,造血干细胞也可通过以下方式来表征,即,利用紫外光(350nm)来激发经hoechest 33342色素染色后的骨髓细胞,并且在hoechst blue及hoechst red两种光学过滤器中展开时,两者均为阴性。造血干细胞可细分为长期造血干细胞(lt-hsc)、短期造血干细胞(st-hsc)等。例如造血干细胞的特征可以参照cytometry research 19(2):25-32,2009。
176.在本说明书中,“长期造血干细胞(lt-hsc)”是指具有长期骨髓细胞再建能力的造血干细胞。lt-hsc通常通过表面抗原标志来特定,(例如在小鼠中)可表现为cd34阴性、cd150阳性、cd48阴性、lin阴性、sca1阳性、c-kit阳性(或lineage-c-kit
+
sca-1
+
cd34-/low
cd150
+
细胞)。另外,lt-hsc可表现为(例如在人中)cd34阴性、cd38阴性(或cd34-cd38-细胞)(例如nat immunol.2010 jul;11(7):585-93;blood 108,2446-2454,2006)。
177.在本说明书中,“短期造血干细胞(st-hsc)”是指具有短期骨髓再建能力的造血干细胞。st-hsc通常通过表面抗原标志来特定,(例如在小鼠中)可表现为cd34阳性、cd150阳性、cd48阴性、lin阴性、sca-1阳性、c-kit阳性。另外,st-hsc(例如对于人而言)可表现cd34阳性、cd38阴性(或cd34
+
cd38-细胞)(例如nat immunol.2010 jul;11(7):585-93;blood 108,2446-2454,2006)。
178.在本说明书中,“异常造血干细胞”或“异常hsc”是指表达异常功能和/或正常功能至少部分缺失的造血干细胞。代表性而言,异常hsc是指cd106或其功能等同物的基因或蛋白质不以通常水平表达和/或不发挥功能的细胞。
179.在本说明书中,基因或蛋白质“不以通常的水平表达”是指以不是在具有正常功能的细胞中观察到的表达量的量或水平表达该基因或蛋白质。例如,对于cd106而言,在cd106脱离通常表达(正常细胞中观察到的通常的值)时可判断为异常,优选在cd106比通常更多表达时可判定为异常。例如用facs从非糖尿病及糖尿病的小鼠中分取ksl细胞,提取rna后,使用qt-pcr进行基因表达量的比较解析,由此可以检验基因的非通常水平的表达(例如过表达)。例如,实施facs解析,检测出异常的造血干细胞的表面抗原,将糖尿病受试体与非糖尿病受试体进行比较,由此可以检验蛋白质的非通常水平的表达。
180.在本说明书中,基因或蛋白质“不以通常的水平发挥功能”是指针对该基因或蛋白质没有观察到在具有正常功能的细胞中观察到的水平的功能。例如,对于cd106而言,在
cd106脱离通常发挥功能的水平(在正常细胞中观察到的通常的水平或值)时可判断为异常,优选在cd106被观察到以比通常高的水平发挥功能时可判定为异常。例如,实施facs解析,检测出异常的造血干细胞的表面抗原,将糖尿病受试体和非糖尿病受试体进行比较,观察蛋白质的活化,由此能够检验蛋白质没有以通常的水平发挥功能。
181.在本说明书中,“cxcr4”是也作为cd184或融合素(fusin)已知的7次跨膜型g蛋白偶联受体(gpcr)。cxcr4的生理性配体为cxc趋化因子之一,其是强力地诱导单核细胞及淋巴细胞的迁移的基质细胞衍生因子(stromal cell-derived factor-1,sdf-1)。可通过抑制cxcr4而发生造血干细胞的迁移(future oncol.2007 feb;3(1):19-27)。
182.在本说明书中,已知:“cd106”为表面抗原的一种,也是作为粘附分子vcam-1(vascular cell adhesion molecule-1,血管细胞粘附分子-1)或incam-100而已知的、ig超家族的成员的i型膜蛋白质,是通过细胞因子活化内皮来表达的细胞表面唾液糖蛋白质,以白血球-内皮细胞粘附及信号传导为媒介。对于人而言,vcam-1同种型a前体(核酸序列:nm_001078.4、氨基酸序列:np_001069.1)、vcam-1同种型b前体(核酸序列:nm_080682.2、氨基酸序列:np_542413.1)、vcam-1同种型c前体(核酸序列:nm_001199834.1、氨基酸序列:np_001186763.1)具代表性。
183.在本说明书中,已知:“cd34”是表面蛋白质(认为其与干细胞向骨髓细胞外基质或间质细胞的附着有关),被高度地糖基化,并且被蛋白激酶c(protein kinase)磷酸化。对于人而言,cd34转录变异体1(核酸序列:nm_001025109.2、氨基酸序列:np_001020280.1)、cd34转录变异体2(核酸序列:nm_001773.3、氨基酸序列:np_001764.1)具代表性。
184.在本说明书中,“肿瘤坏死因子α”或其缩写形式即“tnf-α”是也作为tnf、dif、tnfa、tnfsf2、tnlg1f已知的属于肿瘤坏死因子(tnf)超家族的多功能炎症诱发性细胞因子,主要是指由巨噬细胞分泌的蛋白质。tnf-α可由受体tnfrsf1a/tnfr1及tnfrsf1b/tnfbr介导而发挥功能,参与调节细胞增殖、分化、细胞凋亡、脂质代谢及凝血等广泛的生物学过程。对于人而言,核酸序列:nm_000594.4、氨基酸序列:np_000585.2具代表性。
185.在本说明书中,“胰岛素原”是指胰岛素的前体蛋白质。对于胰岛素原,在胰β细胞的小胞体中进行加工,在未成熟的分泌颗粒内除去c肽区域,从而生成由a链及b链构成的胰岛素。对于人而言,胰岛素原转录变异体1(核酸序列:nm_000207.3、氨基酸序列:np_000198.1)、胰岛素原转录变异体2(核酸序列:nm_001185097.2、氨基酸序列:np_001172026.1)、胰岛素原转录变异体3(核酸序列:nm_001185098.1、氨基酸序列:np_001172027.1)、胰岛素原转录变异体4(核酸序列:nm_001291897.2、氨基酸序列:np_001278826.1)具代表性。
186.在本说明书中,“c-kit”是指作为pbt、scfr、kit、cd117或mastc已知的mgf(已知其也作为肥胖细胞增殖因子、干细胞因子)的3型膜贯穿受体。对于人而言,kit同种型1前体(核酸序列:nm_000222.2、氨基酸序列:np_000213.1)、kit同种型2前体(核酸序列:nm_001093772.1、氨基酸序列:np_001087241.1)具代表性。
187.在本说明书中,“cd20”是也作为ms4a1、b1、s7、bp35、cd20、cvid5、ms4a2或leu-16已知的跨膜型4a基因家族的成员,是指在b细胞向浆细胞(plasma cell)的发展及分化中发挥作用的b淋巴细胞表面分子。对于人而言,cd20转录变异体1(核酸序列:nm_152866.2、氨基酸序列:np_690605.1)、cd20转录变异体3(核酸序列:nm_021950.3、氨基酸序列:np_
068769.2)具代表性。
188.只要没有特别说明,可理解为在本说明书中提及的有关各蛋白质不仅为具有特定的登录号记载的氨基酸序列的蛋白质(或编码其的核酸),而且还包括其功能等同物。
189.在本说明书中,对于某分子的“功能等同物”,可以理解为是该分子的突变体或变体(例如氨基酸序列变体等),包括具有作为本说明书记载的特征(例如标志)的功能的功能等同物、发挥与该分子的生物学功能同样的功能(也可以不为相同程度)的功能等同物以及在作用的时刻能够变化为该分子本身的功能等同物。
190.在本说明书中,对于某分子的“功能变体”,包括在维持该分子的功能(程度也可以发生变更)的状态下改变该分子而得到的物质。例如,抗体等结合分子的功能变体包括为了维持与靶标分子的结合功能而与其他部分(标志、其他功能性分子(蛋白质等)等)缀合化而成的功能变体、片段化而成的功能变体等。这样,在使用于本说明书的情况下,功能变体维持改变前的基本功能。
191.作为本发明的功能等同物,可以使用在氨基酸序列中插入、置换或缺失1个或多个氨基酸、或者在其一末端或两末端添加1个或多个氨基酸而成的功能等同物。在本说明书中,“在氨基酸序列中插入、置换或缺失1个或多个氨基酸、或者在其一末端或两末端添加1个或多个氨基酸”是指:通过部位特异的突变诱发法等公知技术的方法进行改变,或者通过可利用天然的变异而天然产生的程度的多个数量的氨基酸的置换等来进行改变。
192.在本说明书中,“生物学功能”是指:在提及某基因或与其相关的核酸分子或多肽时,该基因、核酸分子或多肽在生物体内所能具有的特定功能,其中,可列举例如特异性抗体的生成、酶活性、抵抗性的赋予等,但并不限定于这些功能。这样的生物学活性可以参照在上述的表中所提及的登录号、entrez号等所引用的文献等,在本说明书中,这样的文献等也作为参考加以援引。在本说明书中,生物学功能可以通过“生物学活性”来发挥。在本说明书中,“生物学活性”是指某因子(例如多核苷酸、蛋白质等)在生物体内所能具有的活性,包括发挥各种功能(例如转录促进活性)的活性,例如也包括通过与某分子的相互作用而使其他分子活化或失活的活性。在2个因子相互作用的情况下,其生物学活性认为是其二分子之间的结合及由此产生的生物学变化,例如在使用抗体使一个分子沉降时其他分子也共沉淀,此时2分子结合。因此,观察此种共沉淀可被列举为一个判断方法。例如,在某因子为酶的情况下,其生物学活性包括其酶活性。在其他的例子中,在某因子为配体的情况下,包括该配体与相应的受体的结合。这样的生物学活性可以在该领域中利用公知技术来测定。
193.本说明书中所使用的蛋白质或核酸的“衍生物”或“类似体”或“突变体”并无特别限定,但是含有包含蛋白质或核酸实质相同的区域的分子,在各种实施方式中,对于这样的分子,在相同大小的氨基酸序列或核酸序列中、或者利用该领域中公知的计算机同源性程序进行比对而与所比对的序列相比时至少30%、40%、50%、60%、70%、80%、90%、95%、98%或99%同源,或者这样的核酸的“衍生物”或“类似体”或“突变体”在严格的条件、中等程度严格的条件或不严格的条件下能够与原来的核酸杂交。代表性地,蛋白质的“衍生物”或“类似体”或“突变体”是在天然存在蛋白质中发生氨基酸置换、缺失及添加等修饰而得到的产物,需要说明的是,是指显示天然存在蛋白质的生物学功能但程度并不一定相同的蛋白质。例如,通过在本说明书中记载或该领域中公知的能够适当利用的体外(in vitro)测定,也能对这样的蛋白质的生物学功能进行研究。在本发明中,主要针对人进行了论述,但
是可理解为其他物种例如包括灵长类在内的其他物种或除此以外所属动物的种类也适用,针对这些哺乳动物,可理解为落入本发明的范围内。
194.本说明书中所使用的术语“活性”是指最广意义上的分子的功能。活性并无特别限定,但一般而言包括分子生物学的功能、生化学的功能、物理功能或化学功能。活性包括例如酶活性、与其他分子相互作用的能力以及是否能活化、促进、稳定化、阻碍、抑制其他分子的功能、或者不稳定化的能力、稳定性、局部化在特定的细胞内位置的能力。在能应用的情况下,该术语还与最广意义上的蛋白质复合体的功能有关。
195.本说明书中所使用的“具有功能活性的”蛋白质、多肽、片段或衍生物具有生物学活性等蛋白质的结构功能、控制功能或生化学功能。
196.在本说明书中,“基因”是指规定遗传性状的因子。通常在染色体上以一定的顺序排列。将规定蛋白质的一级结构的基因称作结构基因,将支配其表达的基因称作调节基因。在本说明书中,“基因”有时是指“多核苷酸”、“寡核苷酸”及“核酸”(在此,包括dna、rna等)。“基因产物”是指基于基因而产生的物质,是指蛋白质、mrna等。因此,mrna也可以落入基因的概念,也属于基因产物。另外,提及“基因表达”的情况大多是指mrna等的转录水平。
197.在本说明书中,“蛋白质”、“多肽”、“寡肽”及“肽”是指在本说明书中以相同的含义使用且任意长度的氨基酸的聚合物。该聚合物可以是直链,也可以是支链,还可以是环状。氨基酸可以是天然的氨基酸,也可以是非天然的氨基酸,还可以是经改变的氨基酸。该术语还可包括装配成多个多肽链的复合体。该术语还包括天然或经人工改变的氨基酸聚合物。作为这样的改变,包括例如二硫醚键形成、糖基化、脂质化、乙酰基化、磷酸化或任意的其他操作或改变(例如与标记成分的结合体化)。该定义还包括例如包含氨基酸的1个或2个以上类似物的多肽(例如包括非天然氨基酸等)、肽样化合物(例如类肽)及该领域中公知的其他改变。
198.在本说明书中,“多核苷酸”、“寡核苷酸”及“核酸”在本说明书中以相同含义使用,是指任意长度的核苷酸的聚合物。该术语还包含“寡核苷酸衍生物”或“多核苷酸衍生物”。“寡核苷酸衍生物”或“多核苷酸衍生物”包括核苷酸的衍生物、或者是指核苷酸间的键与通常不同的寡核苷酸或多核苷酸,可互换使用。作为这样的寡核苷酸,具体而言,可例示例如:2
’‑
o-甲基-核糖核苷酸、寡核苷酸中的磷酸二酯键被转化为硫代磷酸酯键(phosphorothioate)的寡核苷酸衍生物、寡核苷酸中的磷酸二酯键被转化为n3
’‑
p5’氨基磷酸酯键的寡核苷酸衍生物、寡核苷酸中的核糖和磷酸二酯键被转化为肽核酸键的寡核苷酸衍生物、寡核苷酸中的尿嘧啶被c-5丙炔基尿嘧啶置换的寡核苷酸衍生物、寡核苷酸中的尿嘧啶被c-5噻唑尿嘧啶置换的寡核苷酸衍生物、寡核苷酸中的胞嘧啶被c-5丙炔基胞嘧啶置换的寡核苷酸衍生物、寡核苷酸中的胞嘧啶被吩噁嗪修饰胞嘧啶(phenoxazine-modified cytosine)置换的寡核苷酸衍生物、dna中的核糖被2
’‑
o-丙基核糖置换的寡核苷酸衍生物及寡核苷酸中的核糖被2
’‑
甲氧基乙氧基核糖置换的寡核苷酸衍生物等。除非另有说明,特定的核酸序列还意图与公开的序列同样包括其保守性改变的变体(例如简并密码子置换体)及互补序列。具体而言,简并密码子置换体可通过制作1个或1个以上的所选择的(或所有的)密码子的第3位被混合碱基和/或脱氧肌苷残基置换的序列来实现(batzer et al.,nucleic acid res.19:5081(1991);ohtsuka et al.,j.biol.chem.260:2605-2608(1985);rossolini et al.,mol.cell.probes 8:91-98(1994))。在本说明书中,“核
酸”还能与基因、cdna、mrna、寡核苷酸及多核苷酸互换使用。在本说明书中,“核苷酸”可以是天然的核苷酸,也可以是非天然的核苷酸。
199.在本说明书中,基因的“同源性”是指2个以上的基因序列的相互间的一致性的程度,通常具有“同源性”是指一致性或相似性的程度高。因此,某2个基因的同源性越高,这些序列的一致性或相似性越高。2种基因是否具有同源性可通过序列的直接比较来研究,或者对于核酸的情况而言,可以通过在严格条件下的杂交法来研究。在直接比较2个基因序列的情况下,当在该基因序列间dna序列具代表性为至少50%一致的情况、优选至少70%一致的情况、更优选至少80%、90%、95%、96%、97%、98%或99%一致的情况下,这些基因具有同源性。因此,在本说明书中,“同源体”或“同源基因产物”是指发挥与在本说明书中进一步记载的复合体的蛋白质构成要素相同的生物学功能的、其他物种优选哺乳动物的蛋白质。这样的同源体有时也称作“直系同源基因产物”。
200.在本说明书中,氨基酸可以通过其通常所公知的三字母符号或者由iupac-iub生物化学命名委员会(biochemical nomenclature commission)所推荐的单字母符号来表示。同样地,核苷酸也可以通过通常所知晓的单字母符号来表示。在本说明书中,对于氨基酸序列及碱基序列的相似性、一致性及同源性的比较,使用作为序列分析用工具的blast并采用默认参数来计算。一致性的检索例如可以使用ncbi的blast 2.2.9(2004.5.12发行)来进行。本说明书中的一致性的值通常是指使用上述blast在默认的条件下进行比对时的值。但是,在通过变更参数来给出较高值的情况下,以最高值作为一致性的值。当在多个区域中评价一致性的情况下,以其中的最高值作为一致性的值。相似性是除一致性外还对相似的氨基酸也计算在内的数值。
201.在本说明书中,在“严格(的)条件下杂交的多核苷酸”是指在该领域中惯用的公知的条件。以从本发明的多核苷酸中选择的多核苷酸作为探针,使用菌落杂交法、噬菌斑杂交法或southern印迹杂交法等,由此可以得到这样的多核苷酸。具体而言,是指能够通过以下方式进行鉴定的多核苷酸,即,使用固定有源自菌落或噬菌斑的dna的滤器,在0.7~1.0m的nacl存在下且在65℃下进行杂交后,使用0.1~2倍浓度的ssc(saline-sodium citrate)溶液(1倍浓度的ssc溶液的组成为150mm氯化钠、15mm柠檬酸钠),在65℃条件下清洗滤器,由此能够鉴定的多核苷酸。杂交可以按照molecular cloning 2nd ed.,current protocols in molecular biology,supplement 1~38、dna cloning 1:core techniques,a prac1tical approach,second edition,oxford university press(1995)等实验书中记载的方法来进行。低严格条件包括:在由35%甲酰胺、5
×
ssc、50mm tris-hcl(ph7.5)、5mm edta、0.02%聚乙烯基吡咯烷酮(pvp)、0.02%bsa、100μg/ml变性鲑鱼精dna及10%(重量/体积)葡聚糖硫酸构成的缓冲液中,在40℃下杂交18~20小时,在由2
×
ssc、25mm tris-hcl(ph7.4)、5mm edta及0.1%sds构成的缓冲液中,在55℃下清洗1~5小时,然后,在由2
×
ssc、25mm tris-hcl(ph7.4)、5mm edta及0.1%sds构成的缓冲液中,在60℃下清洗1.5小时。
202.在本说明书中,“经纯化的”物质或生物学因子(例如核酸或蛋白质等)是指除去了与该生物学因子天然伴随的因子的至少一部分而得到的产物。因此,通常经纯化的生物学因子中的该生物学因子的纯度相比于该生物学因子通常存在的状态更高(即被浓缩)。本说明书中所使用的术语“经纯化”是指存在优选至少75重量%、更优选至少85重量%、更进一
步优选至少95重量%、而且最优选至少98重量%的同型的生物学因子。本发明中所使用的物质优选为“经纯化的”物质。
203.在本说明书中,“相应”氨基酸或核酸是指:在某多肽分子或多核苷酸分子中,具有或预测具有与成为比较基准的多肽或多核苷酸中的规定的氨基酸或核苷酸同样的作用的氨基酸或核苷酸,尤其对于酶分子而言,是指存在于活性部位中的同样位置且对催化剂活性具有同样贡献的氨基酸。例如,如果是反义分子,则可以是与该反义分子的特定部分相应的直系同源物中的同样部分。相应氨基酸例如可以为进行了半胱氨酸化、谷胱甘肽化、s-s键形成、氧化(例如蛋氨酸侧链的氧化)、甲酰化、乙酰化、磷酸化、糖链附加、肉豆蔻基化等的特定氨基酸。或者,相应氨基酸可以是担负二聚体化的氨基酸。这样的“相应”氨基酸或核酸可以是一定范围内的区域或结构域(domain)。因此,在这样的情况下,在本说明书中称作“相应”区域或结构域。
204.在本说明书中,“相应”基因(例如多核苷酸序列或分子)是指在某物种中具有或预测具有与成为比较基准的物种中的规定的基因同样的作用的基因(例如多核苷酸序列或分子),当存在多个具有这样的作用的基因的情况下,是指具有进化学上相同的起源的基因。因此,与某基因相应的基因可以是该基因的直系同源物。这样的相应基因可以使用在该领域中公知的技术来鉴定。因此,例如某动物(例如小鼠、大鼠)中的相应基因可以通过使用以成为相应基因(例如人的基因)基准的基因序列作为查询序列(query sequence)并检索该动物的序列数据库来查出。
205.在本说明书中,“片段(fragment)”是指相对于全长的多肽或多核苷酸(长度为n)而言具有1~n-1的序列长度的多肽或多核苷酸。片段的长度可以根据其目的进行适当变更,例如,作为其长度的下限,在多肽的情况下,可列举3、4、5、6、7、8、9、10、15、20、25、30、40、50及更多个氨基酸,此处未具体列举的整数所示的长度(例如11等)也可适当作为下限。另外,在多核苷酸的情况下,可列举5、6、7、8、9、10、15、20、25、30、40、50、75、100及更多个核苷酸,此处未具体列举的整数所示的长度(例如11等)也可适当作为下限。在本说明书中,对于这样的片段,例如,在全长作为标志发挥功能的情况下,只要该片段本身也具有作为标志的功能,则可理解为落入本发明的范围内。在本发明中,分子的片段是指包含该分子的任意区域的物质(具代表性为多肽),只要可以用于本发明的目的(例如治疗、检测、诊断等),则也可以具有天然的分子生物学的功能。
206.在本说明书中,基因、多核苷酸、多肽等的“表达”是指该基因等在体内受到一定的作用而变成其他形态。优选是指基因、多核苷酸等被转录和翻译而变成多肽的形态,对于被转录而制作mrna的情况,也可以是表达的一个方式。更优选使这样的多肽的形态为经过翻译后加工的多肽(本说明书中提及的衍生物)。例如,分子的表达水平可以利用任意的方法来确定。具体而言,可以通过评价该分子的mrna的量、蛋白质的量或蛋白质的生物学活性来获知表达水平。
207.在本说明书中,“表达量”是指在目标细胞、组织等中表达多肽或mrna等的量。作为这样的表达量,可列举:使用本发明的抗体,利用包括免疫学测定方法(elisa法、ria法、荧光抗体法、western印迹法、免疫组织染色法等)的任意适当的方法进行评价的本发明多肽的基于蛋白质水平的表达量;或者利用包括分子生物学的测定方法(northern印迹法、斑点印迹法、pcr法等)的任意适当方法进行评价的本发明中所使用的多肽的基于mrna水平的表
达量。“表达量的变化”是指利用包括上述免疫学测定方法或分子生物学的测定方法的任意适当方法进行评价的本发明中所使用的多肽的基于蛋白质水平或mrna水平的表达量增加或减少。通过测定某标志的表达量,从而可以基于标志进行各种的检测或诊断。
208.在本说明书中,“标志(物质、蛋白质或基因(核酸))”是指成为标示的物质,该标示追踪是否处于某状态(例如细胞的种类、正常细胞状态、疾病状态、障碍状态或增殖能力、分化状态的水平等)或是否具有其危险性。作为这样的标志,可列举基因(核酸=dna水平)、基因产物(mrna、蛋白质等)、代谢物质、酶等。在本发明中,对某状态(糖尿病等)的检测、诊断、预备性检测、预测或事前诊断可以使用对于与该状态相关联的标志呈特异性的药剂、剂、因子或手段、或包含它们的组合物、试剂盒或系统等来实现。
209.在本说明书中,“抗体”在广义上包括多克隆抗体、单克隆抗体、多重特异性抗体、嵌合抗体及抗独特型抗体、以及它们的片段例如fv片段、fab’片段、f(ab’)2及fab片段、以及其他通过重组生产的结合体或功能等同物(例如嵌合抗体、人化抗体、多功能抗体、双特异性或寡特异性(oligospecific)抗体、单链抗体、scfv、双体、sc(fv)2(single chain(fv)2)、scfv-fc)。进而可以使这样的抗体与酶、例如碱性磷酸酯酶、辣根过氧化物酶、α半乳糖苷酶等共价键合或通过重组而融合。对于本发明中所使用的抗体,其来源、种类、形状等不限。具体而言,可以使用非人动物的抗体(例如小鼠抗体、大鼠抗体、骆驼抗体)、人抗体、嵌合抗体、人化抗体等公知的抗体。在本发明中可以利用单克隆或多克隆的抗体,但有些为单克隆抗体。抗体对靶标蛋白质的结合优选为特异性的结合。
210.在本说明书中,“手段”是指可以成为实现某目的(例如检测、诊断、治疗、预防)的任意道具的手段,尤其,在本说明书中,“选择性识别(检测)的手段”是指能够识别(检测)某对象不同于其他对象的手段。
211.在本说明书中,多核苷酸或多肽表达的“检测”或“定量”例如可以使用包括mrna的测定及免疫学的测定方法(包括与标志检测剂的结合或相互作用)的适当的方法来实现。作为分子生物学的测定方法,可例示例如northern印迹法、斑点印迹法或pcr法等。作为免疫学的测定方法,可例示例如作为方法而言的使用微量滴定板的elisa法、ria法、荧光抗体法、发光免疫测定(lia)、免疫沉降法(ip)、免疫扩散法(srid)、免疫比浊法(tia)、western印迹法、免疫组织染色法等。另外,作为定量方法,可例示elisa法或ria法等。也可通过使用了阵列(例如dna阵列、蛋白酶抑制剂阵列)的基因解析方法来进行。关于dna阵列,在(秀润社编、细胞工学增刊“dna微阵列和最新pcr法”)中得以广泛地概述。关于蛋白酶抑制剂阵列,在nat genet.2002 dec;32 suppl:526-32中得以详细叙述。作为基因表达的分析法,除上述以外,还可列举rt-pcr、race法、sscp法、免疫沉降法、two-hybrid系统、in vitro翻译等,但并不限定于此。这样的进一步的分析方法已经记载在例如基因组解析实验法
·
中村祐辅实验规程(laboratory manual)、编集
·
中村祐辅羊土社(2002)等中,在本说明书中将这些记载全部作为参考援引于此。
212.本发明的检测剂或检测手段可以是使其他物质(例如标志等)与能够检测的部分(例如抗体等)结合而成的复合体或复合分子。在使用于本说明书的情况下,“复合体”或“复合分子”是指包含2个以上部分的任意构成体。例如,在一部分为多肽的情况下,其他部分可以是多肽,也可以是除此以外的物质(例如基材、糖、脂质、核酸、其他烃等)。在本说明书中构成复合体的2个以上的部分可以以共价键结合,也可以以除此以外的键(例如氢键、离子
键、疏水性相互作用、范德华力等)结合。在2个以上的部分为多肽的情况下,也可称作嵌合多肽。因此,在本说明书中,“复合体”包括多肽、多核苷酸、脂质、糖、低分子等分子多种连结而成的分子。
213.本发明的检测剂或其他药物可以采用探针及引物的形态。本发明的探针及引物可以与靶标的核酸分子特异性地杂交。本发明的探针及引物只要能够检测靶标核酸分子的表达即可,可以是由多个脱氧核糖核酸(dna)或核糖核酸(rna)等的碱基或碱基对构成的聚合物。已知双链cdna也能够在组织原位(in situ)杂交中利用,本发明的探针及引物也包含这样的双链cdna。作为在组织中的rna的检测中特别优选的探针及引物,可列举rna探针(核糖探针)。
214.本发明的引物及引物对(primer set)可以在利用pcr法、rt-pcr法、实时pcr法、in situ pcr法、lamp法等核酸放大法来检测目标基因的公知方法中按照常规方法作为引物及引物对加以利用。
215.在本说明书中,“探针”是指在体外和/或体内等的筛选等生物学实验中所使用的作为检索手段的物质,可列举例如包含特定的碱基序列的核酸分子或包含特定的氨基酸序列的肽、特异的抗体或其片段等,但是并不限定于此。在本说明书中,探针被用作标志检测手段。
216.作为通常被用作探针的核酸分子,可列举具有与目标基因的核酸序列相同或互补的至少8个连续的核苷酸长的核酸序列的核酸分子。这样的核酸序列可以为优选至少9个连续的核苷酸长、更优选至少10个连续的核苷酸长、进一步优选至少11个连续的核苷酸长、至少12个连续的核苷酸长、至少13个连续的核苷酸长、至少14个连续的核苷酸长、至少15个连续的核苷酸长、至少20个连续的核苷酸长、至少25个连续的核苷酸长、至少30个连续的核苷酸长、至少40个连续的核苷酸长、至少50个连续的核苷酸长的核酸序列。在作为探针使用的核酸序列中包含相对于上述序列为至少约70%同源、更优选至少约80%同源、进一步优选至少约90%同源、至少约95%同源的核酸序列。
217.在一个实施方式中,本发明的检测剂可以是被标记的检测剂。或者,本发明的检测剂也可以为结合有标签(tag)的检测剂。
218.在本说明书中,“标记”是指用于将目标分子或物质从其他中识别的存在(例如物质、能量、电磁波等)。作为这样的标记方法,可列举ri(放射性同位素)法、荧光法、生物素法、化学发光法等。在利用荧光法对多个本发明的标志或捕捉标志的因子或手段进行标记的情况下,利用荧光发光极大波长互不相同的荧光物质进行标记。荧光发光极大波长之差优选为10nm以上。在对配体进行标记的情况下,只要不对功能造成影响,则任意方法均可使用,但是,作为荧光物质,理想的是alexa tm
fluor。alexa tm
fluor是将香豆素、罗丹明、荧光素、花青等修饰而得到的水溶性的荧光色素,是与广范围的荧光波长对应的系列,与其他的适合波长的荧光色素相比,非常稳定、明亮、并且ph敏感性低。作为荧光极大波长为10nm以上的荧光色素的组合,可列举alexa tm
555与alexa tm
633的组合、alexa tm
488与alexa tm
555的组合等。在对核酸进行标记的情况下,只要能够与其碱基部分结合,则任意标记均可使用,优选使用花青色素(例如cydye tm
系列的cy3、cy5等)、罗丹明6g试药、n-乙酰氧基-n2-乙酰基氨基芴(aaf)、aaif(aaf的碘衍生物)等。作为荧光发光极大波长之差为10nm以上的荧光物质,可列举例如cy5与罗丹明6g试药的组合、cy3与荧光素的组合、罗丹明6g试药与荧光
素的组合等。在本发明中,可以利用这样的标记改变目标对象以便能够使其被所使用的检测手段检出。这样的改变在该领域中是公知的,本领域技术人员可以根据标记以及目标对象来适当地实施这样的方法。
219.当在本说明书中使用的情况下,“标签”是指用于通过如受体-配体那样的特异性识别机构来挑选分子的物质,更具体而言,是指发挥用于结合特定物质的结合配偶体的作用的物质(例如具有如生物素-抗生物素蛋白(avidin)、生物素-链霉抗生物素蛋白那样的关系),可包含在“标记”的范畴。因此,例如,对于标签结合的特定物质,可以通过与结合有标签序列的结合配偶体的基材接触,来挑选该特定的物质。这样的标签或标记在该领域中是公知的。作为具代表性的标签序列,可列举myc标签、his标签、ha、avi标签等,但是并不限定于此。可以使这样的标签与本发明的标志或标志检测剂结合。
220.在本说明书中,“药剂”、“剂”或“因子”(均相当于英文agent)在广义上可交换使用,只要能够实现想要的目的,则可以是任意的物质或其他要素(例如光、放射能、热、电等的能量)。作为这样的物质,可列举例如细胞(例如t细胞)、蛋白质、多肽、寡肽、肽、多核苷酸、寡核苷酸、核苷酸、核酸(例如包括如cdna、基因组dna那样的dna、如mrna那样的rna)、多糖、寡糖、脂质、有机低分子(例如激素、配体、信息传导物质、有机低分子、在组合化学中合成的分子、可作为药品利用的低分子(例如低分子配体等)等)、它们的复合分子,但是并不限定于此。
221.在本说明书中,“试剂盒”是指通常分为两个以上的分区来提供所应提供的部分(例如检查药、诊断药、治疗药、抗体、标记、说明书等)的单元。在目的为提供一种为了稳定性等不应该以混合的形式提供而优选在即将使用之前将之混合使用的组合物时,该试剂盒的形态是优选的。这样的试剂盒优选具备记载如何使用所提供的部分(例如检查药、诊断药、治疗药)或者应如何处理试药的指示书或说明书是有利的。在本说明书中,当试剂盒作为试药试剂盒使用的情况下,在试剂盒中通常包含记载有检查药、诊断药、治疗药、抗体等的使用方法等的指示书等。
222.在本说明书中,“指示书”记载有针对医生或其他使用者的使用本发明的方法的说明。该指示书记载有指示本发明的检测方法、诊断药的使用方法或施用药物等的文字。另外,在指示书中可以记载有指示口服、向食管施用(例如采用注射等)作为施用部位的文字。该指示书按照实施本发明的国家监管机构(例如日本的厚生劳动省、美国的食品药品监督管理局(fda)等)规定的方式来制作,并且明确记载了已经获得该监管局的批准。指示书是所谓的添附文书(package insert),通常以纸介质来提供,但是并不限定于此,例如也能以电子介质(例如由互联网提供的主页、电子邮件)的形态来提供。
223.在本说明书中使用时,试样中的分析物等的“量”通常是指反映能够在试样的体积中检测到的分析物的质量的绝对值。但是,量还意图表示与其他分析物量进行比较得到的相对量。例如,试样中的分析物的量可以是比在试样中通常存在的分析物的对照值或正常值更大的量。
224.在本说明书中使用时,对于试样中的分析物等的“水平”,通常在分析物为酶等的发挥功能的对象的情况下,是指反映该分析物的活性等的值的绝对值。但是,水平还意图表示与其他分析物水平进行比较得到的相对水平。例如,试样中的分析物的水平可以是比通常存在于试样中的分析物的对照值或正常值更大的水平。
225.术语“约”在本说明书中使用时是指所示的值加或减10%。需要说明的是,即使在没有明确表示“约”的情况下,也可同义地解释成存在“约”。
226.(本发明的概要)
227.本发明人等发现了一新局面,即,对于以异常干细胞(通过cd106等的异常表达来表征)为靶标的糖尿病治疗的效果,通过与干细胞的迁移组合能够得到改善。本发明基于该新糖尿病治疗策略而提供针对糖尿病和/或其关联疾病的新的治疗策略及诊断。
228.(优选的实施方式)
229.以下,对本发明的优选实施方式进行说明。以下提供的实施方式是为了更好地理解本发明而提供的,可理解为本发明的范围不应受到以下记载限定。因此,表明本领域技术人员可以参酌本说明书中的记载而在本发明的范围内进行适宜改变。另外,可理解为本发明的以下的实施方式可以单独使用或将它们组合使用。
230.(糖尿病和/或其关联疾病的异常干细胞的特征)
231.在一个实施方式中,本发明的作为对象的异常干细胞可以是造血干细胞。在一个实施方式中,本发明的异常干细胞通过cd106、cd34、tnf-α、胰岛素原及组蛋白去乙酰化酶(hdacs)中的至少一者不以通常的水平表达和/或不发挥功能来表征,根据需要可以通过具有本说明书记载的异常干细胞的其他特征(例如c-kit阳性、sca-1阳性、造血干细胞的谱系标志阴性、上述短期造血干细胞的特征(cd38阴性等))来进一步表征。在一个实施方式中,本发明的异常干细胞可通过使cd106不以通常的水平表达来表征。在一个实施方式中,本发明的异常干细胞通过(a)使cd106不以通常的水平表达、(b)使cd34异常表达、tnf-α异常表达、胰岛素原异常表达及组蛋白去乙酰化酶(hdacs)异常表达中的至少一者不以通常的水平表达来表征,根据需要,可以通过具有本说明书记载的异常干细胞的其他特征(例如c-kit阳性、sca-1阳性、造血干细胞的系统标志阴性、上述短期造血干细胞的特征(cd38阴性等))来进一步表征。
232.在一个代表性的实施方式中,本发明的作为对象的异常干细胞(例如造血干细胞)可通过cd106的异常表达来表征。在一个实施方式中,本发明的异常干细胞可通过比非糖尿病受试体群的全骨髓细胞或造血干细胞(例如cd34阳性thy-1阳性细胞)中的cd106表达量更高的cd106表达量来表征。在一个实施方式中,本发明的异常干细胞可通过使每个细胞中1
×
102以上、2
×
102以上、5
×
102以上、1
×
103以上、2
×
103以上、5
×
103以上、1
×
104以上、2
×
104以上、5
×
104以上、1
×
105以上、2
×
105以上、5
×
105以上、1
×
106以上、2
×
106以上、5
×
106以上或1
×
107以上的cd106分子在细胞表面表达来表征。在具体的实施方式中,本发明的异常干细胞可通过使每个细胞中约1
×
104以上的cd106分子在细胞表面表达来表征。在一个实施方式中,本发明的异常干细胞可通过如下的表达量来表示,即,在将正常的受试体(例如人)的全骨髓细胞或造血干细胞(例如cd34阳性thy-1阳性细胞)用针对cd106的荧光色素缀合化抗体进行标记并利用facs进行分析的情况下,该表达量呈现对全骨髓细胞或造血干细胞观察到的源自该荧光色素的荧光强度的中央值的1倍以上、2倍以上、5倍以上、10倍以上、20倍以上、50倍以上、100倍以上、200倍以上、500倍以上或1000倍以上的荧光强度。在一个实施方式中,本发明的异常干细胞可通过比源自非糖尿病受试体群的造血干细胞(例如cd34阳性细胞)高10%以上、20%以上、30%以上、40%以上、50%以上、60%以上、70%以上、80%以上、90%以上、100%以上、150%以上或200%以上的cd106的mrna表达量
来表征。
233.在一个实施方式中,本发明的作为对象的异常干细胞可通过tnf-α的表达来表征。在一个实施方式中,本发明的异常干细胞可通过使tnf-α的表达为阳性来表征。在一个实施方式中,使tnf-α的表达为阳性可通过如下的表达量来表示,即,在将正常的受试体(例如人)的全骨髓细胞或造血干细胞(例如cd34阳性thy-1阳性细胞)用针对tnf-α的荧光色素缀合化抗体进行标记并利用facs进行分析的情况下,该表达量呈现对全骨髓细胞或造血干细胞观察到的源自该荧光色素的荧光强度的中央值的1倍以上、2倍以上、5倍以上、10倍以上、20倍以上、50倍以上、100倍以上、200倍以上、500倍以上或1000倍以上的荧光强度。在一个实施方式中,本发明的异常干细胞可通过比源自非糖尿病受试体群的造血干细胞(例如cd34阳性细胞)高10%以上、20%以上、30%以上、40%以上、50%以上、60%以上、70%以上、80%以上、90%以上、100%以上、150%以上或200%以上的tnf-α的mrna表达量来表征。
234.在一个实施方式中,本发明的作为对象的异常干细胞可通过胰岛素原的异常表达来表征。在一个实施方式中,本发明的异常干细胞可通过使胰岛素原的表达为阳性来表征。在一个实施方式中,胰岛素原的表达为阳性可通过如下的表达量来表示,即,在将非糖尿病受试体(例如人)的全骨髓细胞或造血干细胞(例如cd34阳性thy-1阳性细胞)用针对胰岛素原的荧光色素缀合化抗体进行标记并利用facs进行分析的情况下,该表达量呈现对全骨髓细胞或造血干细胞观察到的源自该荧光色素的荧光强度的中央值的1倍以上、2倍以上、5倍以上、10倍以上、20倍以上、50倍以上、100倍以上、200倍以上、500倍以上或1000倍以上的荧光强度。在一个实施方式中,本发明的异常干细胞可通过比源自非糖尿病受试体群的造血干细胞(例如cd34阳性细胞)高10%以上、20%以上、30%以上、40%以上、50%以上、60%以上、70%以上、80%以上、90%以上、100%以上、150%以上、200%以上、300%以上、400%以上、500%以上、700%以上或1000%以上的胰岛素(或胰岛素原)的mrna表达量来表征。
235.在一个实施方式中,本发明的作为对象的异常干细胞可通过c-kit的表达来表征。在一个实施方式中,本发明的异常干细胞可通过使c-kit的表达为阳性来表征。在一个实施方式中,使c-kit的表达为阳性可通过如下的表达量来表示,即,在将非糖尿病受试体(例如人)的全骨髓细胞或造血干细胞(例如cd34阳性thy-1阳性细胞)用针对c-kit的荧光色素缀合化抗体进行标记并利用facs进行分析的情况下,该表达量呈现对全骨髓细胞或造血干细胞观察到的源自该荧光色素的荧光强度的中央值的0.1倍以上、0.2倍以上、0.5倍以上、1倍以上、2倍以上、5倍以上、10倍以上、20倍以上、50倍以上、100倍以上、200倍以上、500倍以上或1000倍以上的荧光强度、且/或在将细胞按照源自该荧光色素的荧光强度从大到小的顺序排列的情况下呈现属于位居前70%以内、60%以内、50%以内、40%以内、30%以内、20%以内或10%以内的荧光强度。
236.在一个实施方式中,本发明的作为对象的异常干细胞可通过sca-1的表达来表征。在一个实施方式中,本发明的异常干细胞可通过使sca-1的表达为阳性来表征。在一个实施方式中,使sca-1的表达为阳性可以通过如下的表达量来表示,即,在将非糖尿病受试体(例如人)的全骨髓细胞用针对sca-1的荧光色素缀合化抗体进行标记并利用facs进行分析的情况下,该表达量呈现对全骨髓细胞观察到的源自该荧光色素的荧光强度的中央值的0.1倍以上、0.2倍以上、0.5倍以上、1倍以上、2倍以上、5倍以上、10倍以上、20倍以上、50倍以上、100倍以上、200倍以上、500倍以上或1000倍以上的荧光强度、且/或在将全骨髓细胞按
照源自该荧光色素的荧光强度从大到小的顺序排列的情况下呈现属于位居前70%以内、60%以内、50%以内、40%以内、30%以内、20%以内或10%以内的荧光强度。
237.在一个实施方式中,本发明的作为对象的异常干细胞可通过造血干细胞的谱系标志的表达来表征。作为造血干细胞的谱系标志,可列举cd3(t细胞)、cd19(b细胞)、nk1.1(nk细胞)、cd11c(树状细胞)、cd11b(单核细胞)、fcεri(肥大细胞)、gr-1(粒细胞)等。在一个实施方式中,本发明的异常干细胞可以通过使cd3、cd19、nk1.1、cd11c、cd11b、fcεri及gr-1中的一个或多个(例如全部)的表达为阴性来表征。在一个实施方式中,使cd3、cd19、nk1.1、cd11c、cd11b、fcεri及gr-1各自的表达为阴性可通过如下的表达量来表示,即,在将非糖尿病受试体(例如人)的全骨髓细胞用针对cd3、cd19、nk1.1、cd11c、cd11b、fcεri或gr-1的荧光色素缀合化抗体进行标记并利用facs进行分析的情况下,该表达量呈现针对全骨髓细胞观察到的源自该荧光色素的荧光强度的中央值的1000%以下、500%以下、200%以下、100%以下、50%以下、20%以下、10%以下、5%以下、2%以下或1%以下的荧光强度、且/或在将全骨髓细胞按照源自该荧光色素的荧光强度从大到小的顺序进行排列的情况下呈现属于位居前后50%以内、20%以内、10%以内、5%以内、2%以内或1%以内的荧光强度。在一个实施方式中,本发明的异常干细胞可通过比源自非糖尿病受试体群的造血干细胞高10%以上、20%以上、30%以上、40%以上、50%以上、60%以上、70%以上、80%以上、90%以上、100%以上、150%以上或200%以上的cd34的mrna表达量来表征。
238.在一个实施方式中,本发明的作为对象的异常干细胞可通过使其为造血干细胞来表征。在一个实施方式中,使其为人造血干细胞也可通过为cd34阳性thy-1阳性或lineage阴性cd34阳性cd38阴性cd90阳性cd45ra阴性来表征。在一个实施方式中,小鼠造血干细胞可通过使其为c-kit阳性sca-1阳性谱系标志阴性(ksl)来表征。在一个实施方式中,使其为造血干细胞也可通过如下方式来表征,即,在将用hoechest 33342色素染色的骨髓细胞用紫外光(350nm)进行激发并利用hoechst blue及hoechst red两种光学过滤器进行展开的情况下,两者均为阴性。
239.在一个实施方式中,本发明的作为对象的异常干细胞可通过造血干细胞的细胞阶段来表征。在一个实施方式中,本发明的异常干细胞可以为短期造血干细胞。
240.在一个实施方式中,本发明的作为对象的异常干细胞可通过组蛋白去乙酰化酶基因群(hdacs)的表达来表征。在一个实施方式中,本发明的异常干细胞可以通过比源自非糖尿病受试体群的造血干细胞(例如c-kit阳性谱系标志阴性细胞)高10%以上、20%以上、30%以上、40%以上、50%以上、60%以上、70%以上、80%以上、90%以上、100%以上、150%以上、200%以上、300%以上、400%以上或500%以上的组蛋白去乙酰化酶基因群(hdacs)(例如hdac3、hdac4、hdac8、hdac9)中的1个或多个的表达量来表征。
241.在一个实施方式中,胰岛素原和/或tnf-α可以成为显示本发明的作为对象的异常干细胞在骨髓中局部化的标记。
242.(与干细胞的迁移组合的、以异常干细胞作为靶标的糖尿病和/或与糖尿病相关联的疾病、障碍和/或症状的治疗和/或预防)
243.一方面,本发明提供通过具有本说明书中记载的特征的异常干细胞迁移并加以抑制进行的糖尿病和/或与糖尿病相关联的疾病、障碍和/或症状的治疗和/或预防。该治疗和/或预防可通过方法的实施、用于该目的的组合物、组合、试剂盒或系统的提供等任意的
手段来实现。例如,在使用抗体等抑制剂的情况下,针对存在于骨髓中的细胞的抑制效果可以是限定性的(例如参照实施例)。因此,如本发明那样在抑制异常干细胞之前使异常干细胞迁移,从而可提高异常干细胞的抑制效果。
244.在一个实施方式中,本发明的治疗和/或预防可通过使具有本说明书中记载的异常干细胞的至少1个特征的全细胞迁移并加以抑制来实施。即,在该实施方式中,迁移并加以抑制的细胞并不限定于本说明书中记载的异常干细胞。在技术上很难仅使本说明书中记载的异常干细胞迁移并加以抑制,考虑到通过异常干细胞的迁移并加以抑制而得到的利益和由其他细胞的迁移并加以抑制带来的影响来选择治疗和/或预防。另一方面,在本说明书记载的异常干细胞中的一部分细胞迁移并加以抑制时,可能使糖尿病和/或与糖尿病相关联的疾病、障碍和/或症状的治疗和/或预防变得不充分,因此,可优选使全部的本说明书中记载的异常干细胞迁移并加以抑制。在本发明的治疗和/或预防中,为了迁移而利用的异常干细胞的特征和为了抑制而利用的异常干细胞的特征可以相同,也可以不同。例如,在一个实施方式中,本发明的治疗和/或预防可以为了迁移而利用异常干细胞为造血干细胞这一特征(例如使用cxcr4拮抗药和/或cxcr2刺激药)、并且为了抑制而利用异常干细胞使特定的细胞表面蛋白质(cd106等)异常表达这一特征(例如使用抗cd106抗体)。
245.在一个实施方式中,本发明的治疗和/或预防中的迁移可通过使具有本说明书中记载的任意特征的异常干细胞迁移来实施。在一个实施方式中,本说明书中记载的异常干细胞的迁移可通过使造血干细胞迁移的处置来实施。在一个实施方式中,使造血干细胞迁移的处置可列举的是抑制cxcr4(future oncol.2007 feb;3(1):19-27)、抑制上皮生长因子受体(egfr)(nature medicine volume 16,pages 1141-1146(2010))、激发粒细胞集落刺激因子(g-csf)刺激(blood.1995 dec 15;86(12):4437-45)及激发cxcr2刺激(cell.2018 jan 11;172(1-2):191-204.e10)等,但是并不限定于此。
246.在一个实施方式中,本发明的治疗和/或预防中的迁移可通过使用具有本说明书中记载的任意特征的异常干细胞的迁移剂来实施。本领域技术人员可适当选择能够在本发明的治疗和/或预防的迁移中使用的迁移剂,例如,在施用迁移剂前后,实际测定骨髓内和/或血液中的干细胞(例如具有本说明书记载的特征的异常干细胞)的比率,并对迁移效果进行研究,由此能够选择可利用于本发明的治疗和/或预防的迁移剂。在一个实施方式中,本发明的治疗和/或预防的迁移可使用造血干细胞的迁移剂来实施。在一个实施方式中,造血干细胞的迁移剂可具有抑制cxcr4(例如普乐沙福(plerixafor)(amd3100))、抑制上皮生长因子受体(egfr)(例如吉非替尼、埃罗替尼、阿法替尼、奥希替尼等)、激发粒细胞集落刺激因子(g-csf)刺激(例如非格司亭、那托司亭、来格司亭、培非格司亭等)及激发cxcr2刺激(例如groβ(mip2))等功能,但是并不限定于此。在一个实施方式中,造血干细胞的迁移剂能够以任意的组合来使用,例如可以为cxcr4的抑制剂(例如普乐沙福(amd3100))及cxcr2刺激惹起剂(例如groβ(mip2))的组合。
247.在一个实施方式中,本说明书中记载的异常干细胞的抑制可以通过以本说明书中记载的异常干细胞的任意特征作为靶标、使成为靶标的细胞迁移并加以抑制来实施。例如,在本说明书中记载的异常干细胞以在细胞表面表达的分子(cd106、cd34、tnf-α、胰岛素原、c-kit、sca-1等)作为靶标的情况下,可以使用与细胞表面表达分子特异性结合的分子(抗体、t细胞受体、低分子化合物等)。另外,在以同时表达多种分子的细胞作为靶标的情况下,
例如可以使用多特异性抗体等与多种分子结合的分子来将目标细胞靶标化。
248.在一个实施方式中,本发明的治疗和/或预防中的抑制可通过使下述异常干细胞迁移并加以抑制来实施,该异常干细胞以cd106异常表达、cd34异常表达、tnf-α异常表达、胰岛素原异常表达及组蛋白去乙酰化酶(hdacs)异常表达中的至少一者为特征。在一个实施方式中,本发明的治疗和/或预防中的抑制可以通过使以cd106异常表达为特征的异常干细胞迁移并加以抑制来实施。在一个实施方式中,本发明的治疗和/或预防中的抑制可通过使下述异常干细胞迁移并加以抑制来实施,该异常干细胞以(a)cd106异常表达和(b)cd34异常表达、tnf-α异常表达、胰岛素原异常表达及组蛋白去乙酰化酶(hdacs)异常表达中的至少一者为特征。
249.在一个实施方式中,本发明的治疗和/或预防中的抑制可通过使用以cd106、cd34、tnf-α、胰岛素原及组蛋白去乙酰化酶(hdacs)中的至少一者作为靶标的1个或多个抑制剂来实施。在一个实施方式中,本发明的治疗和/或预防中的抑制可使用以cd106作为靶标的抑制剂来实施。在一个实施方式中,本发明的治疗和/或预防中的抑制可使用以(a)cd106和(b)cd34、tnf-α、胰岛素原及组蛋白去乙酰化酶(hdacs)中的至少一者作为靶标的1个或多个抑制剂来实施。抑制剂可以使用本说明书中记载的任意抑制剂,例如为与上述分子结合的抗体。在一个实施方式中,以组蛋白去乙酰化酶(hdacs)作为靶标的抑制剂可以为hdac抑制剂,可列举例如tsa(曲古抑菌素a)、vpa(丙戊酸)、丁酸钠(nabu)、saha(辛二酰苯胺异羟肟酸(suberoylanilide hydroxamic acid)或伏立诺他(vorinostat))、苯丁酸钠、缩酚肽(fr901228、fk228)、曲霉毒素(tpx)、含环氧肟酸的肽1(chap1)、ms-275、lbh589及pxd101等,但是并不限定于此。
250.在一个实施方式中,本发明的治疗和/或预防可以为糖尿病的治疗和/或预防。在一个实施方式中,本发明的治疗和/或预防可以为神经障碍、肾病、肝障碍、视网膜病、脂肪肝、胃肠障碍、骨折延迟愈合、摄食障碍或皮肤障碍的治疗和/或预防。
251.本发明的治疗和/或预防可以与任意的公知的治疗和/或预防处置或手段(例如糖尿病和/或与糖尿病相关联的疾病、障碍和/或症状的治疗和/或预防处置或手段)组合。
252.(基于异常干细胞的迁移和/或残留进行的糖尿病和/或与糖尿病相关联的疾病、障碍和/或症状、或者其风险的诊断)
253.一方面,本发明提供基于本说明书记载的异常干细胞的迁移和/或残留进行的糖尿病和/或与糖尿病相关联的疾病、障碍和/或症状、或者其风险的诊断。该诊断可通过方法的实施、用于该目的的组合物、组合、试剂盒、或者系统的提供等任意的手段来实现。
254.在一个实施方式中,本发明的诊断可通过对具有本说明书记载的异常干细胞的至少1个特征的至少一部分细胞在特定部位中的存在和/或存在量进行检测来实施。在本说明书中,只要没有特别说明,细胞的“存在量”不仅可以是细胞的数量(或显示细胞数量的任意指标),而且还可以是细胞群中的特定细胞的比例(或显示特定细胞的比例的任意指标)。在一个实施方式中,本发明的诊断可通过对本说明书记载的异常干细胞在骨髓和/或骨髓龛中的存在和/或存在量进行检测来实施。在一个实施方式中,本发明的诊断可通过对本说明书中记载的异常干细胞在循环血中的存在和/或存在量进行检测来实施。在一个实施方式中,本发明的诊断可通过在施用本说明书记载的迁移剂的受试体中异常干细胞在特定部位中的存在和/或存在量进行检测来实施,例如,可通过基于在施用迁移剂前后异常干细胞在
特定部位(例如骨髓)中的存在和/或存在量的变化来实施。在该实施方式中,例如在施用迁移剂后异常干细胞在受试体的骨髓中的存在量降低的情况下,受试体可以诊断为具有糖尿病和/或与糖尿病相关联的疾病、障碍和/或症状、或者其风险,在一个实施方式中,可将该受试体供于使用了该迁移剂的本发明的治疗和/或预防处置。
255.在一个实施方式中,本发明的诊断可基于本说明书中记载的异常干细胞的至少1个特征的定量的指标(例如细胞表面蛋白质表达量、mrna表达量)来实施。在一个实施方式中,在源自受试体的试样(例如血液试样、骨髓试样)或其中所包含的造血干细胞(例如cd34阳性细胞)显示比非糖尿病受试体群所对应的试样或其中所包含的造血干细胞(例如cd34阳性细胞)高10%以上、20%以上、30%以上、40%以上、50%以上、60%以上、70%以上、80%以上、90%以上、100%以上、150%以上或200%以上的cd106的mrna表达量的情况下,可判断为受试体具有糖尿病和/或与糖尿病相关联的疾病、障碍和/或症状、或者其风险,或者可判断为适合于本发明的异常细胞迁移处置。
256.在一个实施方式中,本发明的诊断可基于显示本说明书中记载的异常干细胞的至少1个特征(包含定量的指标)的细胞的比例来实施。在一个实施方式中,本发明的诊断可基于受试体的造血干细胞中的显示不正常水平的cd106表达的细胞的比例来实施,可根据需要与非糖尿病受试体群或糖尿病受试体群的造血干细胞中的显示不正常水平的cd106表达的细胞的比例进行比较来实施。在一个实施方式中,对于特定的部位(例如骨髓),在受试体的造血干细胞中的显示不正常水平的cd106表达的细胞的比例为非糖尿病受试体群的造血干细胞中的显示不正常水平的cd106表达的细胞的比例的1.1倍以上、1.2倍以上、1.3倍以上、1.4倍以上、1.5倍以上、1.6倍以上、1.7倍以上、1.8倍以上、1.9倍以上、2倍以上、2.1倍以上、2.2倍以上、2.3倍以上、2.4倍以上、2.5倍以上、2.6倍以上、2.7倍以上、2.8倍以上、2.9倍以上、3倍以上、3.5倍以上、4倍以上、4.5倍以上或5倍以上的情况下,可判断为受试体具有糖尿病和/或与糖尿病相关联的疾病、障碍和/或症状、或者其风险,或者可判断为适合于本发明的异常细胞迁移处置。
257.在一个实施方式中,本发明的诊断可以通过检测本说明书中记载的异常干细胞的任意特征来实施。在一个实施方式中,本发明的诊断可通过检测下述细胞来实施,该细胞具有cd106异常表达、cd34异常表达、tnf-α异常表达、胰岛素原异常表达及组蛋白去乙酰化酶(hdacs)异常表达中的至少1个特征、并且根据需要还具有本说明书中记载的异常干细胞的其他特征(例如c-kit阳性、sca-1阳性、造血干细胞的谱系标记阴性、上述短期造血干细胞的特征(cd38阴性等))。在一个实施方式中,本发明的诊断可通过检测以cd106异常表达为特征的细胞来实施。在一个实施方式中,本发明的诊断可通过检测下述细胞来实施,该细胞以(a)cd106异常表达和(b)cd34异常表达、tnf-α异常表达、胰岛素原异常表达及组蛋白去乙酰化酶(hdacs)异常表达中的至少一者为特征、并且根据需要还具有本说明书中记载的异常干细胞的其他特征(例如c-kit阳性、sca-1阳性、造血干细胞的谱系标记阴性、上述短期造血干细胞的特征(cd38阴性等))。
258.在一个实施方式中,本发明的诊断可通过使用以cd106、cd34、tnf-α、胰岛素原及组蛋白去乙酰化酶(hdacs)中的至少一者作为靶标的1个或多个检测剂来实施。在一个实施方式中,本发明的诊断可通过使用以cd106作为靶标的检测剂来实施。在一个实施方式中,本发明的诊断可通过使用以(a)cd106和(b)cd34、tnf-α、胰岛素原及组蛋白去乙酰化酶
(hdacs)中的至少一者作为靶标的1个或多个检测剂来实施。检测剂可以使用本说明书中记载的任意的检测剂,例如包括与上述分子结合的抗体。
259.在一个实施方式中,本发明的诊断可以通过施用针对受试体的检测剂来实施,也可以通过检验源自受试体的试样来实施。例如、本发明的诊断可以通过对受试体施用本发明的检测器并对骨髓(或其特定的龛)中的本发明的异常干细胞的存在和/或存在量进行检测来实施。例如,本发明的诊断可以通过取得包含受试体的细胞的试样(例如血液试样、骨髓试样)并确认是否存在具有本发明的异常干细胞的至少1个特征和/或标记(显示骨髓(或其特定的龛)的存在)的细胞来实施。
260.在一个实施方式中,本发明的诊断可以为糖尿病的诊断。在一个实施方式中,本发明的诊断可以为神经障碍、肾病、肝障碍、视网膜病、脂肪肝、胃肠障碍、骨折延迟愈合、摄食障碍或皮肤障碍、或者其风险的诊断。
261.本发明的诊断可以与任意的公知诊断(例如糖尿病和/或与糖尿病相关联的疾病、障碍和/或症状的诊断)组合。
262.在一个实施方式中,本发明的治疗和/或预防可基于本发明的诊断(例如针对本发明的诊断的结果为预测到异常干细胞存在于骨髓的受试体)来实施。
263.本发明的治疗、预防和/或诊断可以在任意的受试体中实施。在一个实施方式中,受试体为哺乳动物、例如人、小鼠、豚鼠、仓鼠、大鼠、老鼠、兔子、猪、绵羊、山羊、牛、马、猫、狗、绒猴、猴或黑猩猩等。在具体的实施方式中,受试体为人。
264.(药品、剂型等)
265.本说明书中所记载的异常干细胞的抑制剂、迁移剂及异常干细胞的检测剂可以以各种形态的组合物或药物来提供。
266.对于本说明书中记载的异常干细胞的抑制剂、迁移剂及异常干细胞的检测剂的施用路径,优选使用在糖尿病和/或与糖尿病相关联的疾病、障碍和/或症状的治疗、预防或检测时有效果的施用路径,例如可以为静脉内、皮下、肌肉内、腹腔内或经口施用等。作为施用形态,例如可以为注射剂、胶囊剂、片剂、颗粒剂等。注射用的水溶液例如可以保存在管形瓶(vial)或不锈钢容器中。另外,注射用的水溶液可以配合例如生理食盐水、糖(例如海藻糖)、nacl或naoh等。另外,治疗药可以配合例如缓冲剂(例如磷酸盐缓冲液)、稳定剂等。
267.通常,本发明的组合物、药物、抑制剂、迁移剂检测剂等包括治疗有效量的有效成分或可检测量的检测手段、以及药学上可接受的载体或赋形剂。在本说明书中“药学上可接受”是指:为了在动物中使用,而且更具体而言为了在人中使用,而得到政府的监管局批准、或者被列举在药典或其他受到广泛认可的药典中。在本说明书中所使用的“载体”是指将治疗剂或检测剂一起施用的稀释剂、佐剂(adjuvant)、赋形剂或媒介物(vehicle)。这样的载体也可为无菌液体、例如水及油,包括石油、动物、植物或合成起源的油,并无限定,但包括花生油、大豆油、矿物油、芝麻油等。在经口施用药物的情况下,水是优选的载体。当在静脉内施用药物组合物的情况下,生理食盐水及水性葡萄糖(dextrose)是优选的载体。优选将生理食盐水溶液以及水性葡萄糖及甘油溶液用作能注射的溶液的液体载体。适当的赋形剂包括轻质无水硅酸、结晶纤维素、甘露糖醇、淀粉、葡萄糖、乳糖、蔗糖、明胶、麦芽、米、小麦粉、白垩(chalk)、硅胶、硬脂酸钠、单硬脂酸甘油、滑石、氯化钠、脱脂粉乳、甘油、丙烯、甘醇、水、乙醇、羧甲纤维素钙、羧甲纤维素钠、羟基丙基纤维素、羟丙基甲基纤维素、聚乙烯醇
缩醛二乙基氨基乙酸酯、聚乙烯基吡咯烷酮、明胶、中链脂肪酸三甘油酯、聚氧乙烯氢化蓖麻油60、白糖、羧甲基纤维素、玉米淀粉、无机盐等。组合物在理想的情况下还能含有少量的湿润剂或乳化剂、或者ph缓冲剂。这些组合物还能以溶液、悬浊物、乳液、片剂、药丸(pill)、胶囊、粉末、缓释配合物等的形式获得。使用传统的粘合剂及载体、例如三甘油酯,还能配合组合物作为栓剂。经口配合物也能包括药物等级的甘露糖醇、乳糖、淀粉、硬脂酸镁、糖精钠、纤维素、碳酸镁等标准的载体。适当的载体的例子记载于e.w.martin,remington’s pharmaceutical sciences(mark publishing company,easton,u.s.a)中。这样的组合物同时含有适量的载体和治疗有效量的疗法剂、优选纯化型的疗法剂以便能够以适合施用于患者的形式提供。配合物必须适合于施用方式。除此以外,可以包含例如表面活性剂、赋形剂、着色料、着香料、保存料、稳定剂、缓冲剂、悬浊剂、等渗剂、粘合剂、崩解剂、润滑剂、流动性促进剂、矫味剂等。
268.在本发明的一个实施方式中,“盐”包含例如由任意的酸性(例如羧基)基形成的阴离子盐或由任意的碱性(例如氨基)基形成的阳离子盐。盐类包含无机盐或有机盐,例如包含berge et al.,j.pharm.sci.,1977,66,1-19中记载的盐。另外,可列举例如金属盐、铵盐、与有机碱的盐、与无机酸的盐、与有机酸的盐等。在本发明的一个实施方式中,“溶剂合物”是由溶质及溶剂形成的化合物。关于溶剂合物,例如可参照j.honig et al.,the van nostrand chemist’s dictionary p650(1953)。如果溶剂为水,则所形成的溶剂合物为水合物。该溶剂优选不妨碍溶质的生物活性。作为这样的优选的溶剂的例子,并无特别限定,但可列举水或各种缓冲液。
269.在本发明中,在施用药物的情况下,各种递送(delivery)系统均可使用,而且,通过使用这样的系统,还能对适当的部位施用本发明的抑制剂和/或迁移剂。这样的系统包括例如:脂质体、微小粒子及微小囊中的包囊:受体介导的胞吞作用(endocytosis)的使用;作为逆转录病毒载体或其他载体的一部分的疗法核酸的构建等。引入法并无限定,但包括皮内、肌内、腹腔内、静脉内、皮下、鼻内、硬膜外及经口路径。通过任意的适合路径,例如通过注入、通过弹丸(bolus)注射、通过经由上皮或皮肤粘膜衬里(例如口腔、直肠及肠粘膜等)的吸收,也能施用药物,可根据需要使用气溶胶化剂来使用吸入器或喷雾器,而且,还能与其他生物学的活性剂一起施用。施用也能为全身性或局部。
270.在优选的实施方式中,按照公知的方法,作为适于对人施用的药物组合物,可以配合组合物。这样的组合物可以通过注射来施用。具代表性地,用于注射施用的组合物为无菌等渗水性缓冲剂中的溶液。在必要的情况下,组合物还能包含可溶化剂及减缓在注射部位上的疼痛的利多卡因等局部麻醉剂。通常,将成分单独供给或在单位投药模中一起混合来供给,例如在显示活性剂的量的安瓶或小药囊(sachet)等密封容器中,可以以冻结干燥粉末或不含水的浓缩物的形式供给。在想要通过注入来施用组合物的情况下,也能使用含有无菌药剂等级的水或生理食盐水的注入瓶来进行分配。在想要通过注射施用组合物的情况下,也可按照在施用前能混合成分的方式提供注射用的无菌水或生理食盐水的安瓶。
271.本发明的组合物、药物、迁移剂、抑制剂也能以中性型或盐型或其他前药(例如酯等)的形式来配合。在药学上可接受的盐包括:与源自盐酸、磷酸、乙酸、草酸、酒石酸等的游离型的羧基一起形成的盐;与源自异丙基胺、三乙基胺、2-乙基氨基乙醇、组氨酸、普鲁卡因等的游离型的胺基一起形成的盐;以及源自钠、钾、铵、钙及氢氧化铁等的盐。
272.本发明的抑制剂和/或迁移剂的量可根据障碍或状态的性质来变动,本领域技术人员能够基于本说明书的记载而根据标准的临床技术来决定。进而,根据情况还能使用体外测定来辅助鉴定最佳投药量范围。想要使用于配合物的准确用量还可根据施用路径及疾病或障碍的重大性来变动,因此应按照责任医生的判断及各患者的状况来决定。但是,施用量并无特别限定,例如可以是每次0.001、1、5、10、15、100或1000mg/kg体重,也可以是上述任意2个值的范围内。施用间隔并无特别限定,例如可以是每1、7、14、21或28天施用1或2次,也可以是每上述任意2个值的范围施用1或2次。施用量、施用间隔、施用方法可以根据患者的年龄、体重、症状、对象脏器等来适当选择。另外,治疗药优选包含治疗有效量或发挥所期望作用的有效量的有效成分。有效用量能够根据由体外或动物模型试验体系得到的用量-反应曲线来推定。
273.本发明的药物组合物或治疗剂或预防剂可以以试剂盒的形式来提供。
274.在特定的实施方式中,本发明提供药剂袋或试剂盒,其包含填充有本发明的组合物或药物的1种以上成分的1个以上容器。根据情况,还可随附这样的容器而示出如下信息:为政府机关(规制药物或生物学制品的制造、使用或销售)所规定的形式,显示政府机关批准用于人施用的制造、使用或销售的信息。
275.对于作为本发明的治疗药、预防药等药物等的制剂化步骤,在该领域中是公知的,例如记载于日本药典、美国药典、其他国家的药典等。因此,本领域技术人员只要获知本说明书的记载,便能决定所应使用的量等的实施方式而无需进行过度的实验。
276.在本说明书中,“或”在能够采用文章中所列举的事项的“至少1个以上”时使用。“或者”也同样。在本说明书中,在明确记载为“2个值”的“范围内”的情况下,该范围也包括2个值本身。
277.在本说明书中所引用的科学文献、专利、专利申请等参考文献其全部内容作为参考以与各自具体记载的情况相同的程度援用于本说明书中。
278.以上,为了便于理解而示出优选的实施方式来说明本发明。以下,基于实施例来说明本发明,但是,上述的说明及以下的实施例仅以例示的目的来提供,并不以限定本发明的目的来提供。因此,本发明的范围并不限定于本说明书中具体记载的实施方式和实施例,而仅受到权利要求书的限定。
279.实施例
280.在需要的情况下,以下的实施例中使用的动物的处理按照滋贺医科大学的动物实验指南来实施。试药类具体使用实施例中记载的制品,但是,也可用其他制造商(sigma-aldrich、和光纯药、nacalai、r&d systems、uscn life science inc等)的同等品来代用。
281.在以下的实施例中,各个缩写表示以下的含义。
282.dm
ꢀꢀꢀꢀꢀꢀ
糖尿病
283.stz-dm
ꢀꢀ
链脲霉素诱导性糖尿病
284.ksl细胞
ꢀꢀ
c-kit阳性sca-1阳性lineage(谱系标志)阴性细胞
285.sncv
ꢀꢀꢀꢀ
感觉神经传导速度
286.(实施例1:与糖尿病有关的异常干细胞的特定)
287.为了特定与糖尿病有关的异常细胞,对从糖尿病模型小鼠取得的干细胞进行了分析。
288.方法
289.小鼠及骨髓细胞的取得
290.在试验中使用了c57bl/6j小鼠(野生型,日本clea,大阪)。通过静脉内注射链脲霉素(stz)(150mg/kg)(nakalai tesque,京都)来诱导糖尿病,制作2型糖尿病模型(stz小鼠)。从8周龄的小鼠分离骨髓细胞。
291.facs
292.使用ficoll-paque plus(ge healthcare bio-sciences ab、uppsala、sweden),从全骨髓分离单核细胞。
293.为了评价tnf-α及cd106的表达,使单核细胞与pe-cy7缀合化链霉抗生物素蛋白抗体(bd biosciences、san jose、ca)、生物素小鼠谱系panel染色(bd biosciences)、apc缀合化抗c-kit抗体(bd biosciences)、apc-cy7缀合化抗ly6a/e抗体(sca-1)(bd biosciences)、荧光素异硫氰酸酯(fitc)缀合化抗cd106抗体(bd biosciences)及藻红蛋白(pe)缀合化抗tnf-α抗体(ebiosciences)进行免疫反应。
294.为了评价胰岛素原表达,使单核细胞与pe-cy7缀合化链霉抗生物素蛋白抗体、apc缀合化抗c-kit抗体、apc-cy7缀合化抗ly6a/e抗体(sca-1)及生物素小鼠谱系panel反应后,用bd cytofix/cytoperm(bd biosciences)进行固定。接着,将兔子抗胰岛素单克隆抗体(cell signaling technology)及pe缀合化抗兔子igg抗体(cell signaling technology)应用于单核细胞。在其染色之前,为了使死细胞枯竭,使用了能固定live/dead的死细胞蓝染色试剂盒(thermofisher scientific inc.、美国马萨诸塞州瓦尔珊)。
295.在染色4小时后,用facs diva软件(bd biosciences),使用facs canto ii对细胞进行了分析。
296.结果
297.在源自stz-dm小鼠的单核细胞的ksl级分中发现了胰岛素原阳性细胞,但是在非dm小鼠的ksl级分中未观察到胰岛素原阳性细胞(图1)。同样,在源自stz-dm小鼠的单核细胞的ksl级分中也发现了tnf-α阳性细胞,但是在非dm小鼠的ksl级分中未观察到tnf-α阳性细胞(图2)。在stz-dm小鼠及非dm小鼠两者的单核细胞的ksl级分中发现了cd106阳性细胞,但是在stz-dm小鼠中更多地表达了cd106阳性细胞(图3)。
298.在糖尿病小鼠中,在ksl细胞中存在tnf-α阳性细胞及胰岛素原阳性细胞,cd106表达细胞增大,认为具有这些特征的造血干细胞成为出现作为糖尿病的慢性疾病的特征的原因。
299.(实施例2:与1型糖尿病有关的异常干细胞的特定)
300.与实施例1同样,针对从1型糖尿病模型小鼠取得的干细胞,也对与糖尿病有关的异常细胞进行了表征。
301.方法
302.小鼠及骨髓细胞的取得
303.试验使用了icr小鼠(日本clea,大阪)及nod小鼠(日本clea,大阪)。与实施例1同样地分离了单核细胞。
304.与实施例1同样,对于单核细胞,针对tnf-α、cd106、c-kit、sca-1及小鼠谱系(lineage)进行了染色,并且进行了facs分析。
305.结果
306.与icr小鼠相比,在nod小鼠中,ksl细胞的比例减少至约25%(图4)。对于ksl细胞群中所包含的tnf-α阳性细胞及cd106表达细胞的比例,与icr小鼠相比,在nod小鼠中显著地增大(图5)。
307.在1型糖尿病小鼠的ksl细胞中,tnf-α阳性细胞及cd106表达细胞也增大,认为具有这些特征的造血干细胞成为出现作为糖尿病的慢性疾病的特征的原因。
308.(实施例3:与糖尿病有关的异常干细胞的细胞阶段)
309.对异常干细胞为造血干细胞的哪个阶段的细胞进行检验。
310.方法
311.按照由goodell报道的方法,通过facs对ksl细胞的侧群细胞(sp)进行了分析(参照j exp med.1996apr 1;183(4):1797-806;nat med.1997dec;3(12):1337-45)。hoechest 33342色素具有细胞透过性,并且与dna结合,但是,在造血干细胞中,该色素可有效地排出至细胞外。据报道,使用该性质,利用紫外光(350nm)来激发经该色素染色后的骨髓细胞,并且在hoechst blue及hoechst red两种光学滤波器中展开时,造血干细胞级分包含在未染色的细胞群(sp细胞)中。使用hoechest 33342(sigma-aldrich japan k.k.,东京,日本)作为色素,将全骨髓细胞在37℃下准确染色90分钟。为了设定门控,将hoechest 33342阳性细胞与盐酸维拉帕米(tocris bioscience、bristol、uk)一起培养,通过ficoll-paque plus分离单核细胞。接着,经生物素小鼠谱系panel染色后,将这些细胞与pe-cy7缀合化链霉抗生物素蛋白、apc缀合化抗c-kit、apc-cy7缀合化抗ly6a/e(sca-1)及pe缀合化抗tnf-α或fitc缀合化抗cd106进行培养。为了使死细胞枯竭,将碘化丙啶(sigma-aldrich)添加到试样中,除去死细胞,利用使用了facs diva软件(bd biosciences)的facs aria fusion进行了分析。利用350nm的紫外光来激发经hoechest 33342染色的细胞,使用了450bp20(450/20nm带通滤波器)(hoechst blue)及675eflp(675nm长通边缘滤波器)(hoechst red)两种光学滤波器。
312.结果
313.与非dm小鼠相比,在stz-dm小鼠中,ksl细胞中的sp细胞的比例增大,非sp细胞的比例减少(图6)。在非dm及stz-dm的任意小鼠的sp细胞中,均未检测到cd106阳性细胞和tnf-α阳性细胞(图7b、d)。另一方面,在非sp细胞中,未检测到源自非dm的tnf-α阳性细胞,但检测到源自stz-dm的tnf-α阳性细胞,与非dm小鼠相比,在stz-dm小鼠中观察到更多的cd106阳性细胞(图7a、c)。因此,cd106阳性细胞及tnf-α阳性细胞存在于stz-dm中的ksl细胞的非sp级分中。
314.表征造血干细胞的异常的cd106阳性细胞及tnf-α阳性细胞包含在ksl细胞中的非sp细胞(短期造血干细胞:st-hsc),但是不包含在处于更早期的分化阶段的ksl细胞中的sp细胞(长期造血干细胞:lt-hsc)。这可以揭示:糖尿病中的hsc的异常即使在干细胞中也停留在前体细胞的阶段,所谓的“干细胞中的干细胞”未产生异常,通过除去前体细胞,能够治疗糖尿病及其关联疾病。在以“干细胞中的干细胞”为治疗对象时,可能需要骨髓移植,但是如果通过除去前体细胞能够治疗,则能够进行药物治疗。
315.由此表明,在糖尿病中发现的异常干细胞可能存在于st-hsc中。
316.(实施例3:异常干细胞的进一步的表征)
317.对与糖尿病有关的异常干细胞进行了进一步的表征。
318.方法
319.从与实施例1同样的由非dm及stz-dm小鼠的facs sort得到的ksl细胞中提取rna,使用qt-pcr法,对组蛋白去乙酰化酶基因群(hdacs)的基因表达进行了解析。
320.结果
321.将结果示于图8中。表明:与非dm小鼠相比,在stz-dm小鼠中,hdac3、hdac4、hdac8及hdac9的mrna表达显著地增加。
322.在糖尿病的ksl细胞中,对于通过组蛋白修饰等来调节基因表达而言重要的表观基因组关联基因(hdacs)的表达增加,因此认为高血糖对干细胞授予基因水平上异常的性质。据报道,暴露于一过性高血糖的细胞即使恢复到正常血糖值的环境下,也会维持在高血糖下产生的细胞的异常(el-osta et.al.j exp med.2008sep 29;205(10):2409-17),由此还认为:在ksl细胞中产生的组蛋白去乙酰化酶基因的表达增加可能与出现cd106、tnf-α、胰岛素原阳性细胞有关。为了明确该情况,考虑研究是否能够通过hdac抑制剂(例如曲古抑菌素a)来进行治疗。
323.(实施例5:由异常干细胞所致的糖尿病发病)
324.对上述发现的异常干细胞是否成为引起糖尿病的原因进行了检验。
325.方法
326.将非dm或stz-dm ksl细胞移植于正常血糖小鼠的试验的概略示于图9中。对gfp-tg小鼠(the jackson laboratory,bar harbor,me),与实施例1同样地实施了stz处置(stz-dm gfp)或静脉内柠檬酸缓冲液注射的对照处置(非dm gfp)。3个月后,将分别从非dm小鼠或stz-dm小鼠得到的ksl细胞移植至照射了9gy的致死量的放射线的正常血糖野生型c57bl/6j小鼠(clea、大阪)(分别为源自非dm的ksl-t或源自stz-dm的ksl-t)(图10,左)。观察了自移植起3个月后的血糖值(源自非dm的ksl-t(n=9),源自stz-dm的ksl-t(n=10))。在自移植起3个月后测定坐骨神经中的sncv((源自非dm的ksl-t(n=5)、源自stz-dm的ksl-t(n=6))(图10,右)。在自移植起3个月后从各个小鼠取得后根神经节(drg),针对核、gfp、map2、胰岛素原及tnf-α(pe缀合化)进行了免疫荧光染色(图11、图12、图13)。
327.上述的sncv测定按照以下的步骤进行。在30℃~32℃、且麻醉下(戊巴比妥钠、5mg/kg i.p.)使用了medelec sapphire emg(medelec、woking、uk),进行了小鼠的感觉神经传导试验。从大腿部的左背面表面切取皮肤,使坐骨神经露出。记录感觉神经活动电位(snap),从刺激部位到记录部位的距离除以snap的初始潜伏期由此来计算感觉神经传导速度(sncv)。
328.结果
329.在源自stz-dm的ksl-t小鼠的ksl细胞级分中发现了tnf-α、胰岛素原等异常干细胞的特征,但是,源自非dm的ksl-t小鼠的ksl细胞级分未发现异常干细胞的特征。
330.将在糖尿病小鼠中发现的异常的ksl细胞移植至正常小鼠,结果,无论血糖值是否正常,均呈现出糖尿病性神经障碍类似症状。由此表明,即使在使糖尿病小鼠的血糖值正常化的情况下,异常干细胞也不会消失。由此表示异常细胞以异常的状态固定在骨髓内、即固定为病态的干细胞。另外,可理解的是从该异常干细胞派生的细胞向神经组织迁移而使神经障碍发病,因此表明只要残留该干细胞,即使进行血糖控制,也不能治疗糖尿病。进而,将
包含该糖尿病小鼠的异常干细胞的骨髓移植至正常小鼠,结果观察到耐糖能力障碍,并且因骨髓移植还会重现作为糖尿病的本质的糖代谢异常。
331.这与即使改善高血糖也不能治疗糖尿病及糖尿病并发症这样的临床症状一致,揭示了糖尿病的最终的治疗靶标为异常的造血干细胞。这样,通过将糖尿病的造血干细胞移植至正常小鼠,从而能够使正常小鼠中重现糖代谢异常以及糖尿病神经障碍。
332.(实施例6:人糖尿病患者中的异常干细胞的特征)
333.对进入到滋贺医科大学附属医院重病监护室的患者进行了调查。取得了试样的受试者是诊断为糖尿病的患者(3名)(男性3/女性0,平均年龄72.0
±
14.2)和健康的受试者(4名)(男性3/女性1,平均年龄76.5
±
8.5)。
334.从这些受试者取得血液试样,从血液试样提取rna。具体而言,采取1.5ml血液,用dnase(qiagen,hilden,德国)对dna进行分解后,使用qiaamp rna blood mini kit(qiagen,hilden,德国),提取了rna。使用superscript(注册商标)iii first-strand synthesis system(invitrogen/thermofisher scientific,ma,美国)从所得的rna制作cdna。使用power sybr green pcr master mix in a real-time pcr system(applied biosystems/thermofisher scientific,ma,美国)进行定量的pcr,并且对表达的mrna进行了定量。2组间的比较采用t检验进行。将结果示于图14中。
335.与小鼠的结果同样,对于人,也在糖尿病患者中确认到胰岛素、tnf-α、及cd106的表达的上升倾向。另外,在糖尿病患者中确认到cd34的表达的上升倾向,但是由于在人中cd34显示干细胞的特征,因此揭示:与小鼠的结果同样,对于人而言也在糖尿病患者中存在异常干细胞。
336.(实施例7:以异常干细胞作为靶标的1型糖尿病治疗)
337.对于确认到血糖值上升的nod小鼠,将胰岛素颗粒埋入背部皮下,使血糖值正常后,每周尾静脉施用250μg/小鼠的用量的抗cd106抗体,在该情况下,对是否能维持正常血糖值而不依赖于胰岛素颗粒进行了研究。
338.针对埋入胰岛素颗粒而使血糖值大致正常的糖尿病小鼠,照射放射线,使骨髓干细胞(lt-hsc以及st-hsc两者)死亡,代替其而仅骨髓移植从正常小鼠采集的lt-hsc。通过该操作,在所移植的小鼠的骨髓内由lt-hsc新制作出st-hsc。在此认为:由于在糖尿病小鼠中原本存在的异常st-hsc、由此分化的t细胞系前体细胞(在stz小鼠及糖尿病发病nod小鼠中观察到异常)及b细胞系前体细胞(在糖尿病发病前的nod小鼠中观察到异常)死亡,因此不会因这些细胞而损伤脏器。另外,准备同样的糖尿病小鼠,不埋入胰岛素颗粒而在维持高血糖值的状态下进行同样的lt-hsc骨髓移植。在该小鼠中,由于是存在高血糖的状态,因此由lt-hsc产生异常的st-hsc,预测其会损伤各种脏器,因此预测不会治愈糖尿病及其并发症。
339.除去通过胰岛素颗粒+lt-hsc处置而产生的异常st-hsc,受损的胰岛变得正常,并发症可消失。
340.(实施例8:干细胞的抑制剂及迁移剂在链脲霉素诱导性糖尿病小鼠中的组合处置)
341.在链脲霉素诱导性糖尿病小鼠中,检验了由组合异常干细胞的抑制剂和迁移剂带来的治疗效果。
342.方法
343.针对与上述同样制作的链脲霉素诱导糖尿病小鼠(糖尿病发病后3个月),将amd3100(5mg/kg:abcam)+groβ(0.1mg/kg:peprotech)与生理食盐水一起进行皮下注射,经过15分钟后,将抗cd106抗体(250μg/小鼠)进行尾静脉注射(ga-cd106组)。每周进行该处置。同样,针对不施用amd3100及groβ而施用抗cd106抗体的组(cd106组)、amd3100、groβ及抗cd106抗体均不施用的组(非处置群)也进行了检验。测定每日血糖值和体重(图15),在从治疗开始经过20天后,实施了小鼠的灌流固定。
344.在固定24小时后,将所固定的小鼠移换至15%蔗糖、0.1m pb液中,之后,从小鼠中采集胰腺,制作胰腺的冻结块作后,利用恒冷切片机(cryostat)制作8μm的冻结切片。
345.之后,对所制作的冻结切片进行以下的步骤,并进行了免疫染色(图16)。
346.·
用pbs(-)清洗3次10分钟。
347.·
在室温下于0.3%h2o2的pbs(-)液中浸渍30分钟,使内因性过氧化物酶失活。
348.·
用pbs(-)清洗3次5分钟。
349.·
与封闭缓冲液(pbs中5%正常山羊血清+0.3%triton-x100)一起在室温下培养1小时。
350.·
添加一次抗体(抗胰岛素抗体:cst公司),在4℃培养一夜。
351.·
用pbs(-)清洗3次5分钟。
352.·
添加immpress reagent(抗兔子:vector laboratories),在室温下培养30分钟。
353.·
用pbs(-)清洗3次5分钟。
354.·
添加immpact dab基质(vector laboratories),在室温下使其反应30秒。
355.·
添加dh2o,使dab反应停止。
356.·
用苏木精对比染色30秒。
357.·
用自来水进行清洗。
358.·
进行脱水并使其渗透。
359.在显微镜下观察所制作的切片试样,随机选择8~10个左右的胰岛,用image j软件计算相对于胰岛的大小而言的胰岛素阳性的比例(图17)。
360.结果
361.在使干细胞迁移并且用抗cd106抗体进行了治疗的组中,确认到血糖值的减少(图15),在免疫染色中,与非治疗组相比,胰岛素阳性区域增加(图17)。
362.在干细胞迁移后,实施异常干细胞抑制处置,由此通过施用stz,从而使仅残留1成左右的胰腺的胰岛的胰岛素阳性区域恢复至3~4成左右。由此表示如下可能性,即,因抗cd106抗体而使通过施用干细胞迁移剂而从骨髓龛释放至末梢的异常干细胞受损,另一方面,正常发挥功能的干细胞使胰岛再生。
363.(实施例9:干细胞的抑制剂及迁移剂在nod小鼠中的组合处置)
364.在自然发病1型糖尿病模型小鼠(nod小鼠)中,检验了由组合异常干细胞的抑制剂和迁移剂带来的治疗效果。
365.方法
366.从日本clea(大阪府)购入作为自然发病1型糖尿病模型的nod小鼠,每2周测定血
糖值和体重。针对确认到血糖值上升的动物,将amd3100(5mg/kg:abcam)+groβ(0.1mg/kg:peprotech)用生理食盐水调制后进行皮下注射,经过15分钟后,经由尾静脉施用(施用间隔是每周)抗cd106抗体(250μg/小鼠)。治疗开始后,每天测定血糖值及体重(图18)。
367.另外,为了在治疗开始前确认icr小鼠、糖尿病未发病的nod小鼠和糖尿病已发病的nod小鼠(所有小鼠均使用了同一周龄)的胰岛的状态,实施灌流固定,按照下述的要领实施了免疫染色(图19)。
368.·
用pbs(-)清洗3次10分钟。
369.·
在室温下于0.3%h2o2的pbs(-)液中浸渍30分钟,使内因性过氧化物酶失活。
370.·
用pbs(-)清洗3次5分钟。
371.·
与封闭缓冲液(pbs中5%正常山羊血清+0.3%triton-x100)一起在室温下培养1小时。
372.·
添加一次抗体(抗胰岛素抗体:cst公司),在4℃培养一夜。
373.·
用pbs(-)清洗3次5分钟。
374.·
添加immpress reagent(抗兔子:vector laboratories),在室温下培养30分钟。
375.·
用pbs(-)清洗3次5分钟。
376.·
添加immpact dab基质(vector laboratories),在室温下使其反应30秒。
377.·
添加dh2o,使dab反应停止。
378.·
用苏木精对比染色30秒。
379.·
用自来水进行清洗。
380.·
进行脱水并使其渗透。
381.从所制作的各切片取得图像。
382.结果
383.在nod小鼠中,胰岛的炎症反应自糖尿病发病前起非常强,胰岛素的染色程度非常低(图19)。另外,确认到由上述处置所致的糖尿病小鼠的血糖值降低(图18)。
384.迁移剂与抗体的并用疗法显示出明显的血糖降低作用。认为该效果是由因抗体使胰岛功能恢复带来的效果。
385.揭示了在1型糖尿病中异常的造血干细胞的除去也是有用的治疗法。
386.(实施例10:人糖尿病患者骨髓中的异常细胞)
387.在人糖尿病患者中也确认到骨髓中存在异常细胞。
388.在进入滋贺医科大学的2型糖尿病(dm)患者中,针对在2000年1月1日~2010年12月31日的期间进行过病理解剖的例子,研究了有无出现骨髓中的胰岛素原阳性细胞。对于组织,由滋贺医科大学解剖学中心包埋于石蜡中。使用抗生物素蛋白-生物素过氧化物酶复合体(abc)法及二氨基联苯胺(dab)-镍反应,将石蜡包埋试样的5μm厚的切片进行了用于免疫组织化学的处理。在二甲苯及乙醇中进行脱石蜡后,将切片用微波(10mmol/l柠檬酸缓冲液中,在ph6.0、0.5kw下10分钟)进行处理,之后,将针对胰岛素原的抗体(小鼠单克隆、abcam、uk)在包含0.3%triton x-100(pbst)的0.1%pbs中稀释1:1,000,培养一夜后,在4℃下进行用于免疫组织化学的处理。dab-镍反应后,将切片用核固红染色液进行了对比染色(counterstained)。
389.将结果示于图20。在源自无dm的患者的骨髓细胞中未观察到胰岛素原表达,但是,在源自有dm的患者的骨髓细胞中观察到胰岛素原表达。认为在小鼠中观察到的异常干细胞的见解也在人中也适用。
390.(实施例11:对人的应用)
391.在人糖尿病患者中鉴定源自骨髓的异常造血干细胞,将其作为靶标来治疗糖尿病。
392.研究计划1.糖尿病患者中的源自骨髓的异常造血干细胞的鉴定
393.(对象)
394.针对非糖尿病组,在滋贺医科大学及附属病院职员中招募无耐糖能力障碍的既往史且现在也没有接受糖尿病治疗的志愿者,测定实时血糖值及hba1c,将满足实时血糖值<140mg/dl且hba1c<6.0%的人定义为非糖尿病,作为对照组,注册20名。关于糖尿病组,定义成hba1c为6.5%以上或糖尿病治疗中,从滋贺医科大学附属病院糖尿病内分泌内科外来到院患者中,根据电子病历制作使性别和年龄与非糖尿病组相匹配的列表(list),并随机录入80名(1型糖尿病40名,2型糖尿病40名)。
395.(研究方法)
396.进行受试者的问诊,测定身高、体重,进行血液检查、尿检查,判定有无糖尿病。从所采集的血液中提取单核细胞,采集cd34标记骨髓前体细胞进行固定,利用免疫染色来鉴定形态、表达蛋白质。另外,提取mrna后,制备cdna,通过定量的pcr,对mrna的表达量进行定量。具体而言,在末梢血中的cd34阳性且cd106阳性(cd34/cd106)骨髓前体细胞中,测定tnf-αmrna及胰岛素mrna的表达量等。还测定这些细胞中有无蛋白质的表达。另外,对糖尿病患者有无糖尿病并发症与血糖控制的关联性进行分析。为了获悉有无代表性并发症即糖尿病性神经障碍、视网膜病、肾病、脂肪肝、脂质异常症以及大血管障碍,进行神经传导速度检查、心电图r-r间隔检查、眼底视网膜检查、尿中白蛋白排出率、使用腹部ct的腹腔内脂肪量的定量、血液脂质检查、心电图、颈动脉回声检查、下肢动脉回声检查。
397.(结果的预测)
398.(1)在非糖尿病组和2型糖尿病组中,在末梢血中的cd34/cd106骨髓前体细胞中观察到tnf-αmrna及胰岛素mrna的表达,但是2型糖尿病组中的表达量增加。另一方面,在1型糖尿病组中,在cd34/cd106骨髓前体细胞中,tnf-αmrna的表达与非糖尿病相比增加,但胰岛素mrna完全没有表达。
399.(2)在非糖尿病组中,在末梢血中的cd34/cd106骨髓前体细胞中几乎没有表达tnf-α及胰岛素原的蛋白质的细胞。与此相比,在2型糖尿病中两者均表达的细胞增加。另一方面,在1型糖尿病中表达tnf-α蛋白质的细胞增加,但是完全没有表达胰岛素原的细胞。
400.(3)在1型糖尿病患者中,代表性的并发症即糖尿病性神经障碍、视网膜病、肾病、脂肪肝、脂质异常症的发病与末梢血中的cd34/cd106骨髓前体细胞中的tnf-α蛋白质阳性细胞的增加相关联。另一方面,在2型糖尿病患者中,糖尿病性神经障碍、视网膜病、肾病、脂肪肝、脂质异常症的发病与末梢血中的cd3/cd106骨髓前体细胞中的tnf-α蛋白质阳性细胞的增加以及胰岛素原阳性细胞的增加相关联。
401.(讨论和结论的预测)
402.1)在非糖尿病中存在微量的在血中表达胰岛素mrna及tnf-αmrna的cd34/cd106骨
髓前体细胞。设想该细胞在归巢至胰岛时作为提示自身抗原的内皮细胞发挥功能。
403.2)在2型糖尿病中,因高血糖而使该细胞(表达胰岛素mrna及tnf-αmrna的cd34/cd106骨髓前体细胞)为存在于骨髓内及血中的状态,可预测:因为已经表达胰岛素原和tnf-α蛋白质,同时分化为具有异常功能的血管内皮或具有异常的细胞融合能力,故而成为胰岛素抵抗性、各种并发症的原因。
404.研究计划2.以源自骨髓的异常造血干细胞作为靶标的糖尿病的治疗
405.(对象)
406.按照研究计划1,在滋贺医科大学以及共同研究设施中,录入糖尿病患者280名(1型糖尿病140名、2型糖尿病140名)。在1型、2型的任一者中,糖尿病一旦发病,则不能治愈。但是,已知在1型糖尿病中会出现因使用胰岛素的严格的血糖管理而显示暂时缓解的蜜月期(honeymoon phase)。据报道该期间多种多样,通常为1个月到13年(wallensteen m,dahlquist g,persson b,landin-olssonm,lernmark a,sundkvist g,thalme b(1988)factors influencing the magnitude,duration,and rate off all of β-cell function in type 1 (insulin-dependent)diabetic children followed for two years from their clinical diagnosis.diabetologia 31:664-669)。因此认为:通过施行本治疗计划,难以区分是蜜月期的到来还是疾病本身的治愈。另外,据报道,在2型糖尿病中,通过严格的控制而使胰岛素抵抗性变成轻度(h.e.lebovitz(2001)insulin resistance:definition and consequences.clin endocrinol diabetes 109 suppl 2:s135-s148)。由此,有可能观察到胰岛素、经口剂等的治疗药量以及内因性的胰岛素分泌能力的改善。因此,在1型及2型两者中,在此次的治疗研究中均需要制作通过单独的胰岛素进行治疗的组和进行新型治疗法的组并进行比较研究。
407.(研究方法)
408.进行受试者的问诊,测定身高、体重,并且进行血液检查、尿检查,判定有无糖尿病。从所采集的血液中提取单核细胞,采集cd34标记骨髓前体细胞进行固定,利用免疫染色来鉴定形态、表达蛋白质。另外,提取mrna后,制备cdna,通过定量的pcr,对mrna的表达量进行定量。具体而言,在末梢血中的cd34阳性且cd106阳性骨髓前体细胞中测定tnf-α mrna及胰岛素mrna的表达量等。还测定这些细胞中有无蛋白质的表达。另外,对糖尿病患者有无糖尿病并发症以及与血糖控制的关联性进行分析。为了获悉有无代表性并发症即糖尿病性神经障碍、视网膜病、肾病、脂肪肝、脂质异常症的有无以及大血管障碍,进行神经传导速度检查、心电图r-r间隔检查、眼底视网膜检查、尿中白蛋白排出率、使用腹部ct的腹腔内脂肪量的定量、血液脂质检查、颈动脉回声检查、下肢动脉回声检查。
409.将1型例随机分成7组,每组20例,将2型例分成7组,每组20例。在1型及2型中,分别对20例仅用胰岛素治疗控制3个月间(对照组),其余的120例中,60例在开始胰岛素治疗的同时,对各个20例开始以下三种治疗(无迁移剂的治疗组)。每周静脉内施用1次1)抗tnf-α抗体(阿达木单抗(adalimumab)40mg或英夫利昔单抗(infliximab)3mg/kg)、2)抗cd106抗体(0.8mg/kg)、3)曲古抑菌素(0.5mg/kg),将上述操作持续12周。其余的60例在开始胰岛素治疗的同时,对各个20例开始以下三种治疗(有迁移剂的治疗组)。每周静脉内施用1次作为细胞迁移剂的groβ(100μg/kg)+普乐沙福(0.24mg/kg)与1)抗tnf-α抗体(阿达木单抗40mg或英夫利昔单抗3mg/kg)、2)抗cd106抗体(0.8mg/kg)、3)曲古抑菌素(0.5mg/kg),将上述操
作持续12周。
410.(治疗效果的判定方法)
411.对患者进行每天6次的自身血糖测定。血糖控制的目标为:通过胰岛素治疗而使餐前血糖值为140mg/dl以下、餐后2小时血糖值为200mg/dl以下。积极地实现胰岛素量的增减以满足控制基准,最终以第12周的用于血糖控制的胰岛素所需量结束治疗研究期。
412.对于治疗效果的判定,在治疗前、治疗结束时、治疗结束后第3、6、9、12个月,追踪判定下述的判定项目作为治疗效果。
413.(判定项目)
414.(a)使异常造血干细胞消失的效果
415.对在末梢血液中的cd34/cd10骨髓前体细胞中的表达蛋白质(cd34、胰岛素原、tnf-α、cd106等)及表达基因(cd34 mrna、胰岛素mrna、tnf-α mrna、cd106 mrna等)进行定量。
416.(b)使糖尿病治愈的效果
417.在治疗前后对血糖值、hba1c、尿中cpr、脂质、使用高血糖素负荷试验的胰岛素分泌能力进行测定。测定胰岛关联抗体并明确了其有无消失。
418.(c)对并发症的治疗效果
419.作为代表性的并发症,对糖尿病性神经障碍、视网膜病、肾病、脂肪肝、脂质异常症、大血管障碍的有无以及变化在治疗前后进行了比较研究。
420.(结果的预测)
421.1)通过以单独的胰岛素进行治疗,从而明确以下内容。
422.(a)在1型糖尿病、2型糖尿病中,异常造血干细胞均未消失。
423.(b)未观察到使糖尿病治愈的效果。
424.(c)观察到些许对并发症的治疗效果,但是并未治愈。
425.2)无论有无细胞迁移剂通过新型治疗,从而明确以下内容。
426.(a)在1型糖尿病、2型糖尿病中,异常造血干细胞均消失。
427.(b)1型糖尿病、2型糖尿病均暂时治愈。
428.(c)在1型糖尿病、2型糖尿病中,并发症均停止发展,观察到明显的治疗效果。
429.3)通过添加了细胞迁移剂的新型治疗,从而明确以下内容。
430.(a)与无迁移剂相比,通过添加了迁移剂的新型治疗,从而1型糖尿病、2型糖尿病的异常造血干细胞均更早地消失。
431.(b)与无迁移剂相比,通过添加了迁移剂的新型治疗,从而1型糖尿病、2型糖尿病均观察到治愈率的提高。
432.(c)与无迁移剂相比,通过添加了迁移剂的新型治疗,从而1型糖尿病、2型糖尿病均观察到并发症的治愈率的提高。
433.(讨论和结论的预想)
434.1)在1型中,即使是胰岛素单独治疗,也可能因血糖控制效果而到来蜜月期。但是,在该情况下,均使得再度缓解结束,胰岛素分泌能力再度欠缺。
435.2)在2型糖尿病中,通过胰岛素单独治疗,从而血糖控制变得良好,有可能不需要胰岛素治疗,但是异常造血干细胞没有消失,因此糖尿病没有治愈。
436.3)通过添加了细胞迁移剂的新型治疗,即使1型糖尿病治愈,在成为产生自身抗体的原因的自身免疫再发作时,仍然残留患病可能性。但是,只要再度进行添加了细胞迁移剂的新型治疗即可。
437.4)在2型糖尿病中,即使通过添加了细胞迁移剂的新型治疗而完全治愈,也会因能量的过度摄取或运动不足而再度引起高血糖,此时有可能出现异常造血干细胞。在该情况下,只要再度进行添加了细胞迁移剂的新型治疗,也可进行治疗。
438.(注释)
439.综上所述,使用本发明的优选实施方式来例示了本发明,但是可理解为本发明应当仅通过权利要求书来解释其范围。在本说明书中引用的专利、专利申请及其他文献可理解为与其内容本身具体记载于本说明书的情况同样地援引该内容作为针对本说明书的参考。
440.本技术对在2019年10月18日向日本专利局申请的日本特愿2019-191369号主张优先权的利益,其全部内容援引于本说明书中。
441.产业上的可利用性
442.本发明提供以干细胞为靶标的糖尿病治疗的改善,基于该见解,可提供用于进行糖尿病和/或与糖尿病相关联的疾病、障碍和/或症状的治疗或预防、以及糖尿病和/或与糖尿病相关联的疾病、障碍和/或症状、或者其风险的诊断的新手段。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1